2. 青岛蔚蓝福邦生物科技有限公司山东 青岛 266600;
3. 中国水产科学研究院黄海水产研究所 山东 青岛 266071;
4. 济南市农业技术推广服务中心 山东 济南 250004
2. Qingdao Vland Fubang Biotech Co., Ltd., Qingdao 266600, China;
3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
4. Jinan Agro-Tech Extension and Service Center, Jinan 250004, China
α-生育酚转移蛋白(α-tocopherol transfer protein, α-TTP)是一种可以结合维生素E的蛋白,在机体转运和吸收维生素E方面起到关键的调控作用(Arai et al, 2021)。α-TTP促进α-生育酚从细胞向外周介质转运的现象最早在鼠肝癌细胞中发现(Arita et al, 1997),随后,Qian (2005)在人肝癌细胞中也发现了同样的现象。α-TTP在哺乳动物中主要分布在肝脏组织,除此之外,在中枢神经系统、脾脏、肺、肾、子宫以及胎盘中也均检测到了α-TTP (刘昆, 2014)。α-TTP对于小鼠胎盘滋养层的发育是必需的(Jishage et al, 2001),而且在抵抗药物毒性方面也起到非常重要的作用(Shichiri et al, 2012),α-TTP的缺失或变异会导致维生素E缺乏性共济失调症(Gohil et al, 2008)。α-TTP在维持机体维生素E水平、提高繁殖性能等方面起到重要作用。在斑马鱼(Danio rerio)胚胎发育过程中,α-TTP可以将维生素E从蛋黄转移到发育中的胚胎,同时促进维生素E从胎盘到胚胎的运输,并调节胚胎发育中的神经系统细胞内的维生素E运输(Head et al, 2021)。目前,关于维生素E对α-TTP表达的影响成为研究热点,但仍没有明确一致的结论。
半滑舌鳎(Cynoglossus semilaevis)属于近海大型底栖暖温性动物,其味道鲜美、肉质嫩滑、营养丰富,广受群众喜爱,是我国重要的名贵海水养殖鱼类。目前,关于维生素E对半滑舌鳎的生长、繁殖性能方面的研究已有相关报道(肖登元等, 2015; 王蔚芳等, 2020),且相关研究已证实维生素E能够影响鱼类垂体中生长激素和促性腺激素的基因表达(Huang et al, 2019; 王蔚芳等, 2020),这是否与α-TTP有关?目前未见维生素E对鱼类垂体中α-TTP的影响研究。因此,本研究拟通过养殖和细胞培养实验,在克隆α-TTP基因的基础上,探究α-TTP基因在半滑舌鳎各组织分布情况以及维生素E浓度与垂体α-TTP基因表达量之间的关联性,初步探讨α-TTP在介导维生素E影响鱼类生长与繁殖方面的潜在机制。
1 材料与方法 1.1 实验用鱼实验用鱼购自莱州明波水产有限公司(山东),为当年的同一批孵化培育的成鱼,大小为(464.0±2.6) g。
1.2 养殖实验 1.2.1 饲料制备与养殖管理养殖实验饲料中维生素E (DL-α-生育酚乙酸酯, Sigma)添加量分别为0、200、400、800和1 600 mg/kg,设置5组,每组3个重复。在基础饲料中,以鱼粉、酪蛋白为主要蛋白源,以鱼油、豆油为主要脂肪源,维生素E以逐级混匀方式添加到高筋粉中。饲料配方及营养组成见表 1。所有原料过60目筛后充分混合均匀,并经机械挤压形成颗粒饲料,直径为4 mm,在60 ℃的烘箱中干燥至湿度为10%,然后密封于塑料袋内并保存在–20 ℃的冰柜中以待使用。
|
|
表 1 实验基础饲料配方及营养组成 Tab.1 Formulation and proximate composition of the experimental diet |
养殖实验在山东莱州明波水产有限公司养殖场进行。正式实验开始前,对所有鱼投喂7 d的基础饲料(表 1),以适应实验条件。在测量鱼体长和称重后随机分成15组,在15个15 m3的圆形聚乙烯养殖桶中(直径为150 cm,高度为60 cm)进行流水养殖实验,每个桶里放养10尾半滑舌鳎,养殖用水为过滤海水,流速为50 L/min。每3个养殖桶随机分成一组,每天早晚2次投喂相同的饲料,投喂率为鱼体质量的2%,进行为期60 d的养殖实验。实验期间,水温为24~ 27 ℃,盐度为30~31,pH为7.8~8.1。溶解氧 > 5.65 mg/L。每天早上清除粪便和多余的饲料以保持良好的水质条件。
1.2.2 实验取样养殖结束后,所有鱼饥饿24 h,丁香油(10 mg/L)麻醉后准确称重,记录终末体重;每个养殖桶随机取3尾鱼,无菌取出垂体用于后续实验。
1.3 垂体原代细胞培养 1.3.1 细胞培养基配制称取4.76 g HEPES和9.6 g L-15培养基,充分混溶于水,4 h后用NaOH将pH调至7.4,抽滤(除菌),分装,即制成L-15基础培养基。在L-15基础培养中加入胎牛血清(终体积为5%)、青霉素(终浓度为100 U/mL)、链霉素(终质量浓度为100 μg/mL),即制成完全培养基,4 ℃保存。所有操作在细胞培养室进行,有专用橱柜和冰箱放置物品,所有解剖工具、器皿等均经高压消毒后使用,实验用水、磷酸缓冲液(PBS)等为无菌型商品。
1.3.2 细胞分离在细胞培养室的准备室内,用75%酒精浸泡鱼头后,无菌条件下,取20条成鱼垂体组织,移入超净工作台内后更换培养液和培养皿,保证无菌操作。随后垂体组织剪成1 mm3小块,用PBS冲洗,加入0.25%的胰蛋白酶,用量约为组织块的10倍,放入18 ℃水浴锅中45 min。水浴后用2 mL PBS吹打组织块,倒入200目的尼龙网过滤,取滤液以100 ×g速度离心10 min,除去上清液,并重悬沉淀,分装至六孔板,1 mL/孔,置于24 ℃培养箱中进行培养。参考王蔚芳等(2020)的方法进行操作。
1.3.3 细胞培养细胞培养液中维生素E (DL-α-生育酚乙酸酯, Sigma)浓度参照大菱鲆(Scophthalmus maximus)的相关研究设置(Huang et al, 2019),实验分为3组,每组3个重复,维生素E添加量分别为0、18和54 μmol/L。将维生素E预先溶解在无水乙醇中,然后加入到L-15完全培养基中(无水乙醇的终浓度为0.1%,v/v),于24 ℃培养箱中培养3 d (黄滨等, 2017)。
1.4 RNA的提取与cDNA文库的构建养殖实验结束后,分别在每个养殖桶随机取3尾鱼,无菌取出垂体组织并置于无菌1.5 mL离心管中;细胞实验结束后,将每孔垂体细胞转移至15 mL离心管中,以100 ×g转速离心10 min之后取细胞沉淀,并置于1.5 mL无菌离心管中。加入1 mL TRIzol (Invitrogen, 美国),按照程序提取总RNA,使用NanoDrop 2000定量并调整至相同浓度备用,并取适量RNA进行琼脂糖凝胶电泳,检测RNA完整度,取质量较好的RNA作为cDNA文库构建的模板。以总RNA模板构建cDNA文库,选用PrimeScript RT regent kit with gDNA eraser (TaKaRa, 日本)进行反转录实验,操作流程参照该使用说明书进行,制成的cDNA文库保存于–20 ℃冰柜中。
1.5 RACE扩增α-TTP基因根据GenBank半滑舌鳎α-TTP预测基因(XM_008335042.3)编码序列(Coding sequence, CDS)信息设计引物(表 2),使用cDNA末端快速扩增法(Rapid-amplification of cDNA ends, RACE)进行扩增,具体步骤如下:
|
|
表 2 本研究所用引物的序列 Tab.2 The primer sequence used in the present study |
α-TTP基因的3´端序列的获得利用两步法,先利用F1和3´Outer Primer进行首轮扩增,然后使用首轮扩增的PCR产物为模板,F2和3´Inner Primer为引物进行第2轮扩增。反应体系为50 μL,反应条件:94 ℃ 1 min预热,然后98 ℃ 10 s、55 ℃ 15 s、68 ℃ 1 min,30个循环。反应结束后,1%琼脂糖凝胶电泳,使用TaKaRa Mini BEST agarose gel DNA extraction kit V4.0切胶回收纯化;将纯化产物使用DNA A-Tailing kit处理后,使用TaKaRa DNA ligation kit V2.1中的连接酶,将产物与T-Vector pMDTM 20连接后,热转化至E. coli感受态细胞JM109中,涂布平板,37 ℃过夜培养。挑选阳性单克隆,使用通用引物M13-47、RV-M进行测序。
1.5.2 5´端扩增α-TTP基因的5´端序列的获得同样利用两步法,先用R3和5´Outer Primer进行首轮扩增,然后利用首轮扩增的PCR产物为模板,以R4和5´Inner Primer为引物进行第2轮扩增。反应体系为50 μL,反应条件:94 ℃ 2 min预热,然后98 ℃ 10 s、55 ℃ 30 s、72 ℃ 1 min,30个循环,反应结束后,1%琼脂糖凝胶电泳,切胶回收纯化,连接转化,挑选阳性单克隆测序。
1.5.3 基因验证最后,将扩增的序列组合在一起并设计引物F-TTTTCCATCAGTGGTGTAGCCGGGT C,R-GTGCCCCCTGATGGACATGACAAG对产物进行验证。反应体系为50 μL,反应条件:94 ℃ 1 min预热,然后,98 ℃ 10 s、55 ℃ 15s、68 ℃ 1 min,30个循环,反应结束后,1%琼脂糖凝胶电泳并测序。
1.6 定量PCR分析根据半滑舌鳎α-TTP基因序列,通过Primer Premier 5软件进行引物设计,由生工生物工程(上海)股份有限公司进行合成,引物浓度为10 µmol/L。应用实时荧光定量PCR (qRT-PCR)分析不同水平维生素E处理下垂体α-TTP基因的表达情况。以20×cDNA稀释液为模板进行qRT-PCR扩增,参照TB Green® Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)(RR820A)试剂盒说明书,扩增体系为20 μL,包括10 μL TB Green®试剂、0.8 μL PCR正向引物、0.8 μL PCR反向引物、1 μL cDNA模板和7.4 μL RNase-free dH2O。为减小实验误差,每个样品均设置3个重复,18S核糖体RNA基因作为内参引物,与目的基因在相同条件下进行扩增,引物序列见表 2。反应按95 ℃ 10 min,95 ℃ 10 s,58.4 ℃ 15 s,72 ℃ 20 s, 再依次按照95 ℃15 s、60℃ 15 s、95 ℃ 15 s绘制熔解曲线。实验中,PCR产物通过溶解曲线确定扩增准确性及特异性,使用2–∆∆Ct法计算mRNA相对表达水平。
1.7 生物学信息与数据统计分析扩增全长序列在NCBI数据库中进行BLAST比对和同源性分析,利用SignalP (http://www.cbs.dtu.dk/services/SignalP-4.1/)推断其开放阅读框和编码氨基酸序列;利用ClastalX结合MEGA 4.0软件构建系统进化树;利用ProtParam工具(https://web.expasy.org/protparam/)分析a-TTP蛋白质的基本理化性质。
所有实验均设置3个平行处理,所得数据均以平均值±标准误(Mean±SE)表示,并通过SPSS 19软件进行单因素方差分析(one-way ANOVA)分析及基于LSD最小显著差异法的多重比较。当P < 0.05时,认为具有显著差异。
2 结果与分析 2.1 半滑舌鳎α-TTP基因的获得经过RACE扩增,拼接后获得一个全长为3 964 bp的序列(图 1),经NCBI比对发现,其与半滑舌鳎α-TTP预测基因(XM_008335042.3)有99%的相似性。半滑舌鳎α-TTP基因编码293个氨基酸,大小约为33 kDa,等电点为6.21,为不稳定蛋白(稳定系数为63.56),具有亲水性(总平均亲水性为–0.263)。进一步进化树比对显示,所扩基因(标记为sequence)与半滑舌鳎聚为一支,与其他鱼类相距较远,再次说明所扩基因为半滑舌鳎α-TTP基因(图 2)。

|
图 1 半滑舌鳎α-TTP基因序列 Fig.1 The sequence of C. semilaevis α-TTP gene 划横线部分为CDS区,大写字母为对应的编码氨基酸,*为终止密码子。 The underlined part is the CDS region, the capital letter is the corresponding coded amino acid, and an asterisk represents the termination codon. |

|
图 2 半滑舌鳎α-TTP基因进化树 Fig.2 The α-TTP gene evolutionary tree of C. semilaevis |
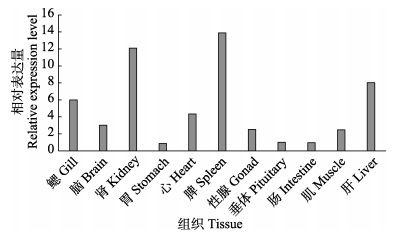
经qRT-PCR检测发现,α-TTP基因在半滑舌鳎11个不同组织中均有表达,但表达量存在很大差异,在脾脏中相对表达量最高,其次是肾脏,在胃中相对表达量最低,具体表达情况见图 3。
|
图 3 α-TTP基因在半滑舌鳎各组织中的相对表达情况 Fig.3 Relative expression of α-TTP gene in tissues of C. semilaevis |
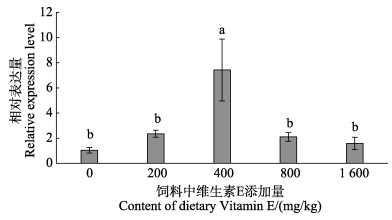
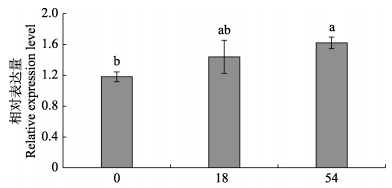
在养殖实验中,垂体中α-TTP的表达量随饲料中维生素E含量的增加而呈先升高后降低的趋势,并在维生素E达到400 mg/kg时,其表达量显著高于其他4组(P < 0.05),比对照组高7.11倍,比其他组高3~4倍,而其他4组之间α-TTP表达量无显著差异(图 4);在体外细胞实验中,α-TTP表达量随维生素E含量的持续升高而升高,并在54 μmol/L组达到最高,显著高于对照组,是对照组的1.37倍(P < 0.05)(图 5)。
|
图 4 饲料中维生素E含量对半滑舌鳎垂体组织α-TTP基因表达的影响 Fig.4 Effects of dietary vitamin E content on α-TTP expression in pituitary tissue of C. semilaevis 不同字母表示差异显著(P < 0.05), 下同 Different letters indicate significant difference (P < 0.05), the same below. |
|
图 5 维生素E浓度对半滑舌鳎垂体原代细胞α-TTP基因表达的影响 Fig.5 Effects of vitamin E concentration on α-TTP expression in pituitary cells of C. semilaevis |
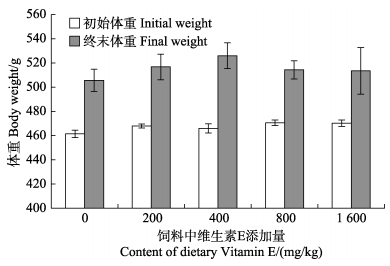
经过60 d的养殖实验,生长数据表明饲料中维生素E含量对半滑舌鳎的生长影响不显著(P > 0.05),但其终末体重随着维生素E的添加呈先升高后降低的趋势,并在维生素E添加400 mg/kg时最高(图 6)。
|
图 6 饲料中维生素E含量对半滑舌鳎生长的影响 Fig.6 Effects of dietary vitamin E content on growth of C. semilaevis |
维生素E是具有保护细胞膜免受过氧化损害的抗氧化剂,α-生育酚转移蛋白(α-TTP)是调控机体维生素E含量的重要因子。目前,关于α-TTP的研究主要集中在哺乳动物上,有关鱼类α-TTP的研究还较少。本研究通过RACE法克隆了半滑舌鳎的α-TTP基因,其编码293个氨基酸,分子质量约为33 kDa,这与哺乳动物中α-生育酚转移蛋白的大小几乎相一致,但其3 964 bp的基因全长远大于绵羊的1 098 bp (左兆云, 2014)。半滑舌鳎α-TTP基因在全身各组织广泛表达,这与哺乳动物α-TTP表达情况类似(Hosomi et al, 1998; Kaempf-Rotzoll et al, 2002; Shichiri et al, 2012),但哺乳动物α-TTP主要在肝脏组织中表达(Yoshida et al, 1992; Sato et al, 1993; Arita et al, 1995),而半滑舌鳎α-TTP在脾脏和肾脏中表达量最高,这可能是由种属差异导致的。
α-TTP能够特异识别α-生育酚(维生素E)侧链结构(Chow et al, 2015),因此,α-TTP的突变也会相应引发维生素E缺乏症,但α-TTP的表达量是否受维生素E摄入水平的影响尚不明确。近年来,研究人员针对维生素E对α-TTP表达水平的影响进行了广泛的研究,但研究结果并不尽一致,有的甚至相互矛盾。Thakur等(2010)在人肝癌细胞的研究中发现,添加维生素E后显著提高了α-TTP的表达水平;刘昆等(2014)在滩羊饲料中添加高水平的维生素E显著提高了滩羊肝脏中α-TTP的蛋白含量。本研究中,无论是养殖实验还是体外细胞实验,添加维生素E均可以显著提高垂体α-TTP基因的表达水平。然而,在小鼠(Chen et al, 2012)、猪(Lauridsen et al, 2013)和斑马鱼(Watt et al, 2021)的研究中发现,饲料中添加维生素E对其肝脏α-TTP基因表达水平均未产生显著影响。据此,有学者认为,由于肝脏中α-TTP的含量充足,因此,不会随着维生素E含量的变化而发生明显的改变(Bella et al, 2006)。但Thakur等(2010)研究发现,维生素E可以同α-TTP结合并改变其构象,然后降低其降解速率,提高α-TTP的表达水平。维生素E对α-TTP表达的调节机制十分复杂,研究结果存在差异,其分子机制尚有待进一步的研究。
垂体在鱼类的生长和繁殖过程中发挥重要的作用(林浩然, 2011)。垂体在接收脑部传来的信号后合成生长激素、促性腺激素等,并通过轴突将激素释放到血液中,进而通过血液运送到靶细胞(组织或器官),发挥激素的生理功能。由于垂体组织很小,其大小接近半个米粒,因此,很难检测组织中营养素(如维生素E)的含量,限制了营养素对垂体影响的评估,因此,有必要寻找一个可替代评价的敏感指标。鉴于α-TTP与维生素E的密切关系,以及维生素E与生长激素、促性腺激素等之间的关联已被证实(Huang et al, 2019; 王蔚芳等, 2020),本研究也试图探讨α-TTP成为评价维生素E影响鱼类生长和繁殖的一个潜在指标的可行性。本研究结果表明,维生素E参与了垂体α-TTP基因的表达,其表达量受维生素E剂量影响。在养殖实验中,垂体α-TTP基因表达量随着饲料中维生素E添加量的增加呈先升高后下降的趋势,并在添加量为400 mg/kg时表达量最高,且显著高于其他各组(P < 0.05),其结果也与本研究中半滑舌鳎的生长趋势吻合,生长指标也在添加400 mg/kg维生素E时表现最优异。张志强等(2017)和覃希等(2014)的研究也指出,饲料中维生素E的缺乏或过量能够影响鱼的生长,其影响模式与本研究中α-TTP基因变化趋势相符。然而,高剂量的维生素E (1 200 mg/kg)却有效提升了半滑舌鳎亲鱼的繁殖性能(肖登元等, 2015)。在亲鱼垂体中α-TTP基因表达量是如何响应饲料中维生素E含量的变化,值得进一步探索。另一方面,体外细胞实验结果显示,没有出现α-TTP基因表达量下调的现象,今后可进一步增加其浓度梯度开展实验;但体外实验进一步证实了垂体中α-TTP基因受到维生素E浓度的影响。本研究结果表明,垂体α-TTP基因的表达响应了饲料中维生素E含量的变化,可成为指示垂体中评价维生素E影响鱼类生长和繁殖的潜在评价指标,在日后的相关研究中可以进一步考虑二者之间的关联性并加以验证。
4 结论本研究克隆了半滑舌鳎α-生育酚转移蛋白基因α-TTP,其在半滑舌鳎各组织均有表达,并在脾脏中表达最高,其次是肾脏,在胃中表达量最低。饲料中添加400 mg/kg的维生素E时,其垂体中α-TTP基因表达量最高,饲料中维生素E含量不足或过量都会降低其表达。
ARAI H, KONO N. α-Tocopherol transfer protein (α-TTP). Free Radical Biology and Medicine, 2021, 176: 162-175 DOI:10.1016/j.freeradbiomed.2021.09.021 |
ARITA M Y, SATO Y, MIYATA A, et al. Human alpha-tocopherol transfer protein: cDNA cloning, expression and chromosomal localization. Biochemical Journal, 1995, 306(Pt2): 437-443 |
ARITA M, NOMURA K, ARAI H. α-Tocopherol transfer protein stimulates the secretion of α-tocopherol from a cultured liver cell line through a brefeld in A-insensitive pathway. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(23): 12437-12441 |
BELLA D L, SCHOCK B C, LIM Y, et al. Regulation of the alpha-tocopherol transfer protein in mice: Lack of response to dietary vitamin E or oxidative stress. Lipids, 2006, 41(2): 105-112 DOI:10.1007/s11745-006-5077-7 |
CHEN W H, LI Y J, WANG M S, et al. Elevation of tissue α-tocopherol levels by conjugated linoleic acid in C57BL/6J mice is not associated with changes in vitamin E absorption or α-carboxyethyl hydroxychroman production. Nutrition, 2012, 28(1): 59-66 DOI:10.1016/j.nut.2011.04.006 |
CHOW C K. Biological functions and metabolic fate of vitamin E revisited. Journal of Biomedical Science, 2004, 11(3): 295-302 DOI:10.1007/BF02254433 |
GOHIL K, OOMMEN S, QUACH H T, et al. Mice lacking α-tocopherol transfer protein gene have severe α-tocopherol deficiency in multiple regions of the central nervous system. Brain Research, 2008, 1201: 167-176 DOI:10.1016/j.brainres.2008.01.044 |
HEAD B, DU J L, BARTON C, et al. RedEfish: Generation of the polycistronic mScarlet: GSG-T2A: Ttpa Zebrafish Line. Antioxidants, 2021, 10: 965 DOI:10.3390/antiox10060965 |
HOSOMI A, GOTO K, KONDO H, et al. Localization of α-tocopherol transfer protein in rat brain. Neuroscience Letters, 1998, 256(3): 159-162 DOI:10.1016/S0304-3940(98)00785-X |
HUANG B, WANG N, SHI B, et al. Primary culture of pituitary cells in Cynoglossus semilaevis. Open Journal of Fisheries Research, 2017, 4(3): 71-78 [黄滨, 王娜, 史宝, 等. 半滑舌鳎垂体细胞体外原代培养方法研究. 水产研究, 2017, 4(3): 71-78] |
HUANG B, WANG N, SHI B, et al. Vitamin E stimulates the expression of gonadotropin hormones in primary pituitary cells of turbot (Scophthalmus maximus). Aquaculture, 2019, 509: 47-51 DOI:10.1016/j.aquaculture.2019.05.023 |
JISHAGE K I, ARITA M, IGARASHI K, et al. α-Tocopherol transfer protein is important for the normal development of placental labyrinthine trophoblasts in mice. Journal of Biological Chemistry, 2001, 276(3): 1669-1672 DOI:10.1074/jbc.C000676200 |
KAEMPF-ROTZOLL D E, IGARASHI K, AOKI J, et al. Alpha-tocopherol transfer protein is specifically localized at the implantation site of pregnant mouse uterus. Biology of Reproduction, 2002(2): 599-604 |
LAURIDSEN C, THEIL P K, SOREN K J. Composition of α-tocopherol and fatty acids in porcine tissues after dietary supplementation with vitamin E and different fat sources. Animal Feed Science and Technology, 2013, 179(1/2/3/4): 93-102 |
LIN H R. Fish physiology. Guangzhou: Sun Yat-sen University Press, 2011: 240-249 [林浩然. 鱼类生理学. 广州: 中山大学出版社, 2011: 240-249]
|
LIU K, LUO H L. Effect of vitamin E on α-tocopherol transfer protein (α-TTP) expression and its mechanism. Journal of Agricultural Biotechnology, 2014, 22(5): 615-620 [刘昆, 罗海玲. 维生素E对α-生育酚转移蛋白(α-TTP)表达的影响及其作用机制研究进展. 农业生物技术学报, 2014, 22(5): 615-620] |
LIU K. Effect of vitamin E on α-TTP expression in sheep and its mechanism. Doctoral Dissertation of China Agricultural University, 2014 [刘昆. 维生素E对绵羊α-TTP表达的影响及其作用机制. 中国农业大学博士研究生学位论文, 2014]
|
QIAN J. Intracellular trafficking of vitamin E in hepatocytes: The role of tocopherol transfer protein. Journal of Lipid Research, 2005, 10: 2072-2082 |
QIN X, HUANG K, LIU K, et al. Effects of dietary vitamin E and selenium on the growth and the antioxidant enzyme activity in serum of juvenile Tilapia (Oreochromis niloticus). Advances in Fishery Science, 2014, 35(4): 77-84 [覃希, 黄凯, 刘康, 等. 维生素E和硒对吉富罗非鱼(Oreochromis niloticus)幼鱼生长及血清抗氧化酶活性的影响. 渔业科学进展, 2014, 35(4): 77-84] |
SATO Y, ARAI H, MIYATA A, et al. Primary structure of alpha-tocopherol transfer protein from rat liver: Homology with cellular retinaldehyde-binding protein. Journal of Biological Chemistry, 1993, 268(24): 17705-17710 DOI:10.1016/S0021-9258(17)46761-5 |
SHICHIRI M, KONO N, SHIMANAKA Y, et al. A novel role for α-tocopherol transfer protein (α-TTP) in protecting against chloroquine toxicity. Journal of Biological Chemistry, 2012, 287(4): 2926-2934 DOI:10.1074/jbc.M111.321281 |
THAKUR V, MORLEY S, MANOR D. Hepatic α-tocopherol transfer protein: Ligand-induced protection from proteasomal degradation. Biochemistry, 2010, 49(43): 9339-9344 DOI:10.1021/bi100960b |
WANG W F, XIANG L, WANG L, et al. Optimal concentration of vitamin E promotes the expression of growth hormone gene in tongue sole. Marine Sciences, 2020, 44(2): 113-119 [王蔚芳, 向玲, 王琳, 等. 适宜浓度的维生素E促进半滑舌鳎生长激素基因的表达. 海洋科学, 2020, 44(2): 113-119] |
WATT A T, HEAD B, LEONARD S W, et al. Gene expression of CRAL_TRIO family proteins modulated by vitamin E deficiency in zebrafish (Danio rerio). Journal of Nutritional Biochemistry, 2021, 97: 108801 DOI:10.1016/j.jnutbio.2021.108801 |
XIAO D Y, LIANG M Q, WANG X X, et al. Effects of dietary supplementation of different levels of vitamin E on reproductive performance and offspring quality of Cynoglossus semilaevis. Advances in Fishery Science, 2015, 36(2): 125-132 [肖登元, 梁萌青, 王新星, 等. 饲料中添加不同水平的维生素E对半滑舌鳎(Cynoglossus semilaevis)亲鱼繁殖性能及后代质量的影响. 渔业科学进展, 2015, 36(2): 125-132] |
YOSHIDA H, YUSIN M, REN I, et al. Identification, purification, and immunochemical characterization of a tocopherol-binding protein in rat liver cytosol. Journal of Lipid Research, 1992, 33(3): 343-350 DOI:10.1016/S0022-2275(20)41524-X |
ZHANG Z Q, JIANG M, WEN H, et al. Dietary vitamin E requirement of juvenile Chinese sucker (Myxocyprinus asiatius). Journal of Northwest A & F University (Natural Science), 2017, 45(2): 23–30, 36 [张志强, 蒋明, 文华, 等. 胭脂鱼幼鱼对饲料中维生素E需要量的研究. 西北农林科技大学学报(自然科学版), 2017, 45(2): 23–30, 36] |
ZUO Z Y. Molecular mechanism of dietary vitamin E on testis reproductive function in sheep. Doctoral Dissertation of China Agricultural University, 2014 [左兆云. 日粮维生素E对绵羊睾丸繁殖机能影响的分子机制初探. 中国农业大学博士研究生学位论文, 2014]
|



