2. 中国水产科学研究院黄海水产研究所 山东 青岛 266071;
3. 霞浦县海洋渔业发展中心 福建 宁德 355100
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Xiapu Marine Fishery Development Center, Ningde 355100, China
仿刺参(Apostichopus japonicus)又称刺参,具有重要的食用价值和药用价值(Roggatz et al, 2018; 曹荣等, 2020; 陈士国, 2010),自然分布于西北太平洋沿岸,在我国,刺参主要分布在辽宁、河北和山东等省份。伴随着刺参繁育养殖技术的快速发展,刺参的增养殖得到迅速发展,养殖区域也从刺参的自然分布区往南、往东拓展,形成了一个以山东、辽宁、河北沿海为主产区、并以东参西养、北参南养等形式延伸到黄河三角洲地区和闽浙沿海的增养殖产业群(廖梅杰等, 2021)。渔业统计年鉴表明,到2021年,我国刺参养殖面积达到24.74万hm2,养殖产量达22.27万t。其中,以福建省霞浦县为代表的“北参南养”的刺参产业模式已成为南方水产业中的重要的经济体系,该模式利用冬季南方海域水温优势开展刺参吊笼养殖,以占全国不足1%的养殖面积生产出占全国15%的海参养殖产量,成为近年来中国海参产业增速最快的一股产业力量(胡荣炊等, 2019)。然而,由于该地区海参养殖产业发展时间较短,养殖工艺较为粗放,且对养殖区域的环境调查数据缺乏,随着养殖产业的扩大,近年来,养殖病害频发,养殖成活率和增重率也受到较大影响。
目前,关于海水环境中主要菌群研究发现,海水中主要细菌分为自养和异养、光能和化能、好氧和厌氧、寄生和腐生以及浮游和附着等不同类型。海水中以革兰氏阴性菌占优势,常见的有假单胞菌属(Pseudomonas)、弧菌属(Vibrio)、无色杆菌属(Achromobacter)、黄杆菌属(Flavobacterium)、螺菌属(Lachnospira)、微球菌属(Micrococcus)、八叠球菌属(Sarcina)、芽孢杆菌属(Bacillus)、棒杆菌属(Corynebacterium)、枝动菌属(Mycoplana)、诺卡氏菌属(Nocardia)和链霉菌属(Streptomyces)等10多个属;而在含氧的海底沉积物中,包括α-变形菌、β-变形菌、γ-变形菌在内的变形菌门(Proteobacteria)成员与厚壁菌门(Firmicutes)成员一起占主导地位。相反,缺氧沉积物中普遍存在暗黑菌门(Atribacteria)、绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes)的成员(Hoshino et al, 2020)。感染微生态学研究表明,随着季节的变化,环境理化因子也不断发生变化,导致环境中微生物的组成和数目发生动态变化,最终影响刺参肠道中微生物的组成和数量,进而导致疾病发生(李成华, 2021)。因此,在本养殖区域开展环境因子调查并解析其菌群结构特征,对该地区海参养殖产业的可持续发展具有重要意义。高通量测序技术的开发及运用,不仅为准确地反映自然状态下微生物群落的真实情况提供了强有力的技术支持,而且还可以结合生物信息学的方法,揭示微生物之间、微生物与环境之间的相互作用规律,大大拓展了微生物学的研究思路与方法,为从群落结构水平上全面了解微生物的生态特征和功能特征提供支撑(Youssef et al, 2009; Caporaso et al, 2010)。本研究以福建省霞浦县东吾洋海域东安、雷江、马坑和沙湾4个刺参养殖区域的海水、沉积物为对象,完成了海水关键水质因子的测定,并采用16S rDNA高通量测序技术分析了4个养殖海域的菌群多样性及特异菌群的基因功能,以期全面、客观地反映霞浦刺参养殖环境的菌群现状,为霞浦刺参健康养殖和疾病防控提供重要的理论依据。
1 材料与方法 1.1 采集地点及方法根据福建省刺参吊笼养殖周期特点和主要养殖海域分布的调查结果,本研究选取刺参养殖中期(2022年1月)采样,选取位于海参养殖主要海域——东吾洋海域的东安(26°41′46.2′′N;119°54′24.8′′E,标记为DA)、雷江(26°37′58.0′′N;119°55′50.2′′E,标记为LJ)、马坑(26°41′15.9′′N;119°57′51.8′′E,标记为MK)和沙湾(26°39′40.3′′N;119°49′51.8′′E,标记为SW) 4个刺参养殖区域进行样品采集。采用YSI EXO水质监测仪(美国)现场测定养殖海域水体温度(T)、盐度(S)、酸碱度(pH)、叶绿素a (Chl-a)和溶解氧(DO)。利用击打式采水器收集水深2 m处的海水样品,挖斗式采泥器采集海底沉积物,取表层2~3 cm的沉积物样品装入灭菌离心管中,每个位点的水样和沉积物样品均采集3个平行,低温运送回实验室,所采集各个地点水样标记为W,沉积物样品标记为N。使用NH4-3 TC Reagent HR Set (WTW, 德国)试剂盒测定水样的离子氨含量,参照纳氏试剂分光光度法(HJ 535-2009)测定水样中氨氮的含量,参照分光光度法(GB/T 7493-1987)测定水样中亚硝酸氮含量,参照气相分子吸收光谱法(HJ/T 195-2005)测定水样中无机氮的含量,参照重铬酸盐法(HJ 828-2017-COD)测定样品中的化学需氧量。富营养化评价采用有机污染指数(Q)和富营养化指数(E)相结合的方法(姜太良等, 1991; 邹景忠等, 1983; 刘丽华等, 2021)。使用0.22 μm醋酸纤维素滤膜抽滤水样收集细菌后用于菌群结构分析。
1.2 养殖区环境菌群结构分析首先,提取样品总DNA,然后,根据保守区设计引物,在引物末端加测序接头,进行PCR扩增并对扩增产物进行纯化、定量和均一化,构建测序文库,对质检合格的测序文库用Illumina Novaseq 6000进行测序。对高通量测序获得的原始图像数据文件,经碱基识别(base calling)分析转化为原始测序序列(sequenced reads),结果以FASTQ (简称为fq)文件格式存储,其中,包含测序序列(reads)的信息以及其对应的测序质量信息。利用Trimmomatic v0.33软件对测序得到的raw reads进行过滤,然后,使用cutadapt 1.9.1软件识别并去除引物序列后获得clean reads,使用Usearch v10软件对每个样品的clean reads进行拼接,再根据不同区域的长度范围对拼接后数据进行长度过滤,最后使用UCHIME v4.2软件去除嵌合体,获得最终有效数据(effective reads)。
采用QIIME2软件对样品序列进行多样性分析,其中,Alpha多样性分析包括ACE指数、Chao1指数、Shannon指数和Simpson指数的分析;Beta多样性分析,包括PCoA分析(principal coordinates analysis)、UPGMA (unweighted pairgroup method with arithmetic mean)分析。采用物种分类学分析(包括基于科的构建物种分布图、Venn图等)来比较样品中物种的分类。基于物种分类结果,得到在不同水平上各rank的丰度值,随后进行LEFSe (line discriminant analysis effect size)分析(http://huttenhower.sph.harvard.edu/lefse/),筛选条件为P < 0.05 (Magoč et al, 2011; Bolger et al, 2014; Edgar, 2013)。采用PICRUSt2软件对各组样品微生物群落基因功能进行预测并进行COG (clusters of orthologous groups of proteins)分类分析,统计水体与沉积物样品中微生物群落的功能基因在代谢途径上的差异和变化。
1.3 环境菌群结构与环境因子相关性分析基于操作分类单元(operational taxonomic unit, OTU)聚类和环境因子信息,利用R语言的Vegan package进行环境因子相关性分析,进行冗余分析(redundancy analysis, RDA),根据图中元素点之间距离进行样品组成相近性分析;根据射线间夹角的大小进行环境因子与样品间的相关性分析,图中元素点之间的关系由距离表示,距离越近代表样品组成相近;射线之间的关系由夹角表示,钝角代表负相关,锐角代表正相关。
2 结果与分析 2.1 不同刺参养殖海域环境因子调查对东吾洋海域内4个刺参养殖区域的水质因子测定结果见表 1。结果显示,在1月份东安海域的水温显著低于其他养殖地区(P < 0.05);各海域水体的pH以及盐度无显著性差异(P > 0.05);马坑海域溶解氧显著低于其他3个海域(P < 0.05);4个海域的Chl-a的含量为(0.19±0.02)~(0.41±0.02) μg/L,COD含量为(0.16± 0.02)~(0.60±0.01) mg/L,水体中磷酸盐含量为(0.12±0.01) ~(0.18±0.02) mg/L,各海域的Chl-a的含量、COD含量和磷酸盐含量均存在显著差异(P < 0.05);东安海域的铵根含量和游离氨的含量均显著高于其他3个海域(P < 0.05);各海域pH、亚硝酸盐含量和无机氮含量无显著性差异(P > 0.05)。对照《海水水质标准GB3097-1997》和《渔业水质标准GB11607-89》,4个刺参养殖海域水体温度、溶解氧含量、COD、游离氨含量等均符合《海水水质标准GB3097-1997》第一类海水水质标准,水体pH符合第三类海水水质标准,但水体中的无机氮含量、活性磷酸盐的含量超过了第四类海水水质标准,说明水体中有机物含量过高。根据水质富营养化指数等级(E≤1.0属于贫营养,1.0<E<2.0属于轻度富营养,2.0≤E<5.0属于中度富营养,5.0≤E<15.0属于重度富营养,E≥15.0属于严重富营养)划分,在1月海参养殖高峰期,马坑海域的富营养化指数达到21.60,属于严重富营养化;东安和雷江海域属于重度富营养,只有沙湾海域处于中度富营养的水平。根据水质有机污染指数等级(Q≤0属于良好,0<Q≤1.0属于较好,1.0<Q≤2.0属于开始受到污染,2.0<Q≤3.0属于轻度污染,3.0<Q≤4.0属于中度污染,Q>4.0属于严重污染)划分,东安和沙湾海域属于轻度污染,而马坑和雷江海域属于中度污染。
|
|
表 1 东吾洋海域个刺参养殖区1月份水质测定结果 Tab.1 Water quality monitoring results of the sea cucumber culture areas in Dongwuyang Bay in January |
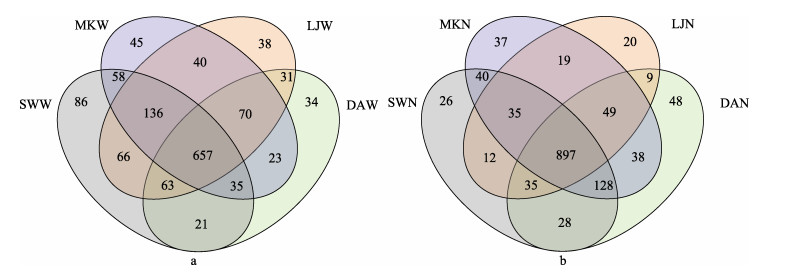
对所采集的24个样品进行高通量测序,获得的有效序列在73 042~77 582之间,对测序获得的有效数据进行聚类分析,以97%相似度以上的序列聚类成OTU,共获得1 520个OTU,并根据样品来源分别绘制4个海域的水体和沉积物样品OTU的Venn图(图 1)。结果显示,东安、雷江、马坑和沙湾4个海域水样中检测到的OTU分别是934、1 101、1 064和1 122个,其中,共有OTU的数目为657个,分别占4个海域水体所检出OTU数的70.34%、59.67%、61.75%和58.56% (图 1a);东安、雷江、马坑和沙湾4个海域沉积物样品中含有的OTU分别是1 232、1 076、1 243和1 201个,其中,共有OTU的数目为897个,分别占4个海域沉积物所检出OTU数的72.81%、83.36%、72.16%和74.69% (图 1b)。以上结果可以看出,沉积物的微生物种类显著高于水体中的微生物种类,4个海域的水体间、沉积物间的微生物种群具有较高的相似性。根据测序分析获得的OTU的分类结果,24个样品检测到的细菌归属于28门、57纲、163目、322科、581属。
|
图 1 东吾洋海域刺参养殖区的水体(a)及沉积物(b)样品Venn图 Fig.1 Venn diagram of seawater (a) and sediment (b) samples collected from sea cucumber culture areas in Dongwuyang Bay SWW、MKW、LJW、DAW分别为沙湾、马坑、雷江和东安水体样品;SWN、MKN、LJN、DAN分别为沙湾、马坑、雷江和东安沉积物样品。下同。 SWW, MKW, LJW, DAW indicate Shawan, Makeng, Leijiang, and Dong´an water samples, respectively; SWN, MKN, LJN, and DAN indicate Shawan, Makeng, Leijiang, and Dong´an sediment samples, respectively. The same below. |
根据测序所获得的OTU分类及其丰度信息,对各样本的Alpha多样性分析结果见表 2。所测定的水体及沉积物ACE指数在906.42~1 098.95之间,Shannon指数在5.68~8.01之间,Simpson指数在0.95~ 0.99之间,Chao1指数在840.30~1 100.71之间。沉积物样本中的OTU数目和多样性均显著高于水体样本。针对不同海域的水体和沉积物样品多样性指数的显著性差异分析结果显示,沙湾海域水体的ACE指数显著高于马坑和雷江海域,表明该区域的微生物种类丰富且分布均匀度高于其他2个海域;东安海域的Chao1指数显著低于雷江和沙湾海域,说明东安海域所检出的物种较少,且东安海域的Shannon指数最低,表明该区域微生物菌群的生物多样性最低。对不同海域沉积物样品多样性差异分析结果显示,马坑海域的沉积物ACE指数显著高于沙湾和雷江海域(P < 0.05),表明该区域沉积物的微生物种类丰富且分布均匀度高于其他2个海域;而Shannon指数计算结果显示,4个海域的沉积物样品微生物多样性的指数依次为沙湾>马坑 > 雷江 > 东安,且各样品间差异显著(P < 0.05),说明沙湾海域环境菌群多样性与丰度最高。
|
|
表 2 东吾洋刺参养殖区水体和沉积物样品Alpha多样性分析 Tab.2 Alpha diversity analysis of seawater and sedimental samples collected from sea cucumber culture areas in Dongwuyang Bay |
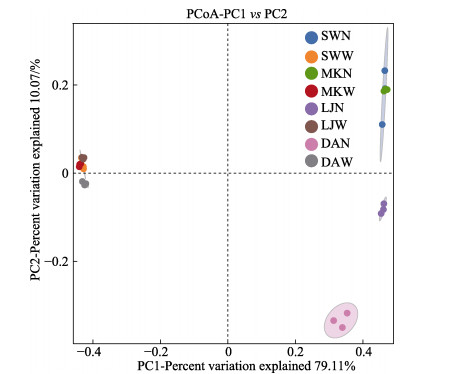
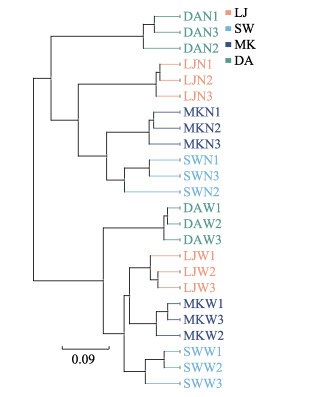
为研究不同养殖地区水体及沉积物样品间的微生物群落的相似性,基于Bray curtis算法在OTU水平上对所有沉积物和海水样品进行PCoA分析,结果见图 2,第一主坐标(PC1)的贡献率为79.11%,第二主坐标(PC2)的贡献率为10.07%,总贡献率为89.18%。各组内的样品均较好的聚集在一起,表明样品具有较好的生物学重复性;水体样本和沉积物样本距离较远,表明沉积物与水体之间的菌群结构差异显著。利用weighted unifrac算法进行UPGMA分析,得到所有样品的聚类图(图 3),也证实水体样本和底泥样本分别聚为单独的一簇,从聚类图中样本所来源的海域位置可以看出,雷江、沙湾和马坑海域的水体菌群聚为一支后再与东安水体样品聚为一支,沉积物样品的聚类也存在相同的特点,说明海域位置对其水体和沉积物菌群结构的影响较大。
|
图 2 东吾洋刺参养殖区水体及沉积物菌群的PCoA分析 Fig.2 The PCoA analysis of seawater and sedimental microbial community collected from sea cucumber culture areas in Dongwuyang Bay |
|
图 3 东吾洋刺参养殖区水体及沉积物菌群的聚类分析 Fig.3 Cluster analysis of of seawater and sedimental microbial community collected from sea cucumber culture areas in Dongwuyang Bay |
依据科水平的菌群分类选取丰度最高的10个种类绘制的相对丰度图(见图 4)。从样品来源可以看出,除了黄杆菌科(Flavobacteriaceae)和红杆菌科(Rhodobacteraceae)为水体和沉积物中共有的优势种类外,水体样品和沉积物样品间的微生物种类差异较大,在水体样本中,Nitrincolaceae、冷单胞菌科(Psychromonadaceae)、微杆菌科(Microbacteriacea)和Clade_Ⅰ这几类微生物丰度较高,但在沉积物样品中丰度很低;而沉积物中丰度较高的Sva1033、Desulfocapsaceae和Woeseiaceae在水体样品中的丰度却很低。从各样品的海域来源可以看出,4个海域水体中科水平的微生物种类相似,但每个种类的相对丰度存在差异,如沙湾海水中优势菌科为Nitrincolaceae (占21.14%),而东安、雷江和马坑水体样品优势菌科为红杆菌科,相对丰度依次为22.90%、20.58%和19.41%,4个海域水体中单细胞科的相对含量差异显著。4个海域的沉积物优势种类的相对丰度亦存在较大差异,东安、雷江、沙湾海域沉积物样品优势菌科为黄杆菌科,相对丰度依次为37.48%、21.87%和10.45%;马坑海域中优势菌科为Sva1033,相对丰度为11.17%。此外,值得注意的是,具有潜在致病性的弧菌科(Vibrionaceae)在所有水体和沉积物样本中均为优势种类之一。

|
图 4 基于科水平对东吾洋不同刺参养殖海域水体及沉积物菌群的相对丰度比较 Fig.4 Comparison of relative abundance of bacterial of seawater and sediments collected from sea cucumber culture areas in Dongwuyang Bay based on family level |
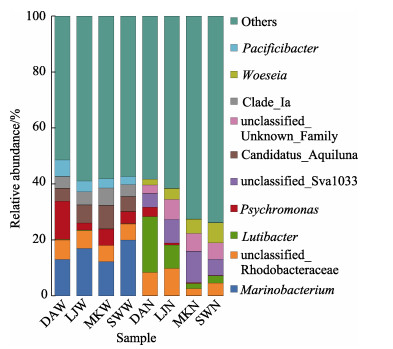
依据属水平的菌群分类选取丰度最高的10个种类绘制相对丰度图(见图 5)。从样品来源可以看出,在水体样品中,海小杆菌属(Marinobacterium)、冷单胞菌属(Psychromonas)、Candidatus_Aquiluna、太平洋杆菌属(Pacificibacter)和Clade_Ⅰa菌属的相对丰度较高,但在沉积物样品中丰度却很低;而沉积物样品中,相对丰度高的淤泥杆菌属(Lutibacter)、Woeseia、Unclassified Rhodobacteraceae和Unclassified_Sva1033菌属在水体中丰度却很低。而从各样品的海域来源可以看出,4个海域水体中科水平的微生物种类相似,但每个种类的相对丰度存在差异,东安海域水体样品优势菌属为冷单胞菌属,相对丰度为13.68%,而雷江、马坑和沙湾水体中优势菌属则为海小杆菌属,相对丰度依次为16.91%、12.22%和19.92%。4个海域的沉积物优势菌属的相对丰度亦存在较大差异,东安海域沉积物优势菌属为淤泥杆菌属,相对丰度为19.98%;雷江海域沉积物优势菌属为Unclassified Rhodobacteraceae,相对丰度为9.68%;马坑海域沉积物样品中优势菌属为unclassified_Sva1033,相对丰度为11.17%;沙湾海域沉积物样品中优势菌属为Woeseia,相对丰度为7.17%。
|
图 5 基于属水平对东吾洋不同刺参养殖海域水体及沉积物菌群的相对丰度比较 Fig.5 Comparison of the relative abundance of bacterial of seawater and sediment collected from sea cucumber culture areas in Dongwuyang Bay based on genus level |
根据样品来源不同,本研究从不同环境(水体和沉积物)和不同海域2个维度进行差异菌群的分组筛选。根据环境来源将全部样本分为水体样品和沉积物样品2个组,进行线性判别LEFSe分析,筛选在水体和沉积物中存在显著差异的菌群,并构建差异菌群物种信息树状图(图 6a),基于LDA判别值大于4.0的判定标准,筛选到不同分类水平的74个菌群在水体和沉积物间存在显著差异(图 6b),其中,在水体样品中存在显著性优势的菌群有35个,主要集中于变形菌门,其中,差异性代表γ-变形菌和α-变形菌;而在沉积物样品中显著性优势菌群有39个,集中于Desulfobacterota以及拟杆菌门,其差异性代表为脱硫菌纲(Desulfobulbia)和拟杆菌纲(Bacteroidia)。
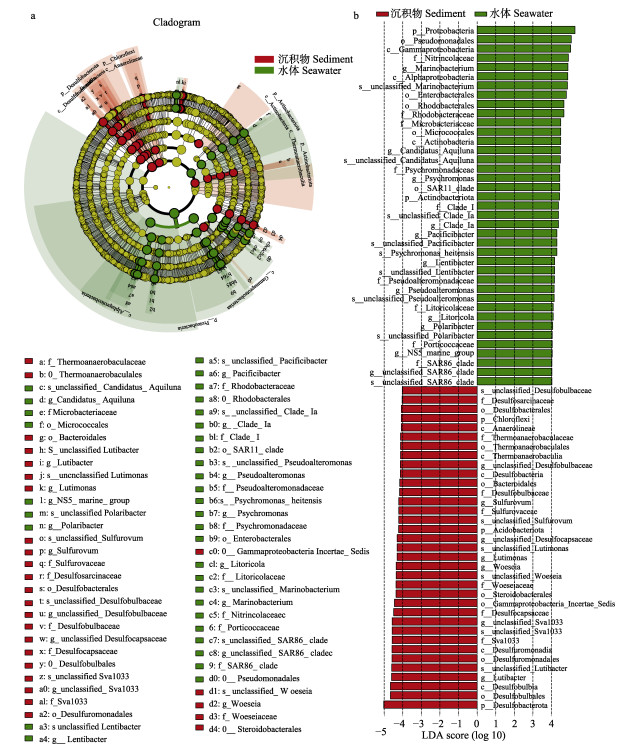
|
图 6 东吾洋刺参养殖区水体菌群和沉积物菌群LEFSe分析环形树状图(a)和优势群落线性判别分析(b) Fig.6 LEFSe analysis annular tree (a) and Linear discrimination analysis (b) of seawater and sedimental Shannon in sea cucumber culture area in Dongwuyang Bay |
将所有样本根据样品的海域来源对4个区水体菌群进行线性判别LEFSe分析,筛选在不同海域中存在显著差异的菌群,并构建差异菌群物种信息树状图(图 7a),水体样品中共有不同分类水平的30个细菌类群在4个地区之间存在显著性差异(图 7b)。其中,东安地区水体样品显著性优势菌群集中于变形菌门,以肠杆菌目(Enterobacterales)和单细胞科为主。雷江地区水体样品显著性优势菌群集中于拟杆菌门,以黄杆菌目(Flavobacterales)和拟杆菌纲为主。马坑地区水体样品显著性优势菌群集中于放线菌门以及弯曲杆菌门,以放线菌纲(Actinobacteria)和微杆菌科为主。沙湾地区水体样品显著性优势菌群集中于γ-变形菌,以假单胞菌目(Pseudomonadales)和海小杆菌属为主。

|
图 7 东吾洋刺参养殖不同地区水体菌群LEFSe分析环形树状图(a)和优势群落线性判别分析(b) Fig.7 LEFSe analysis annular tree (a) and Linear discrimination analysis (b) of microbial community from different sea cucumber culture areas in Dongwuyang Bay |
利用PICRUSt2软件对水体以及沉积物样品微生物群落进行基因功能的预测和COG分类统计,在所有预测到的17个原核生物COG代谢途径中,水体与沉积物样品在12个代谢途径上存在显著差异(P < 0.05) (图 8)。其中,在代谢方面,氨基酸转运和代谢、无机离子转运和代谢、脂质运输和代谢在水体中的相对丰度显著高于沉积物中;而能源生产和转化、辅酶运输和代谢在沉积物中的相对丰度显著高于水体中。在细胞过程和传导过程中,菌群的转录功能在水体中的相对丰度显著高于沉积物中;而在细胞壁/膜/包膜生物发生、防御机制、复制、重组和修复、细胞周期控制、细胞分裂、染色体分配方面,沉积物中的相对丰度显著高于水体中。在信息存储与处理方面,次生代谢物的生物合成、运输和分解代谢在水体中的相对丰度显著高于沉积物中;而在翻译、核糖体结构和生物发生中,沉积物中的相对丰度显著高于水体中。
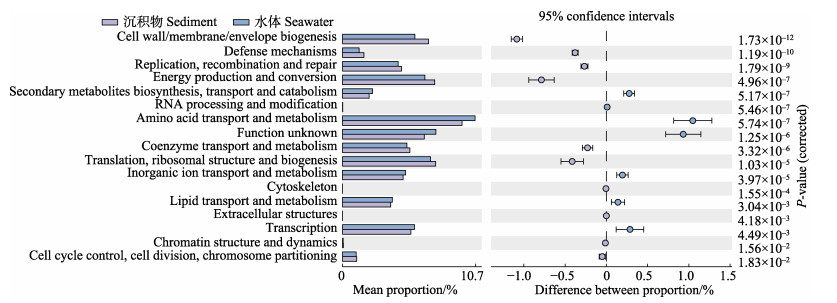
|
图 8 基于COG分类的水体与沉积物菌群的功能分类统计图 Fig.8 The statistical chart of functional categories based on the analysis of the COG between the seawater and sedimental microbial community |
对不同海域所采集水体的菌群与环境因子进行RDA分析,结果显示(图 9a),4个地区样本分别位于第一、二、三、四象限,并且各个样品之间无重叠,温度、溶氧、Chl-a浓度是影响不同海域水体菌群结构的主要环境因子。通过对RDA结果中环境因子与样本优势菌属的分布关系根系表明(图 9b),冷单胞菌属、假交替单胞菌属(Pseudoalteromonas)、太平洋杆菌属、极化杆菌属(Polaribacter)、Unclassified Rhodobacteraceae与Chl-a浓度、溶氧成正相关,与温度成负相关;海小杆菌属,鳞毛蕨属(Litoricola)与溶氧和温度成正相关,与Chl-a浓度成负相关;Candidatus-Aquiluna属、慢杆菌属(Lentibacter)与温度成正相关,与溶氧、Chl-a浓度成负相关;Clade_Ⅰa与温度、Chl-a浓度成正相关,与溶氧成负相关。
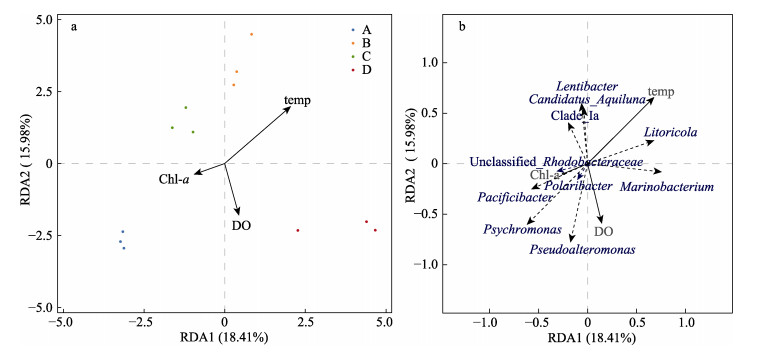
|
图 9 基于RDA分析的水体样品与环境因子(a)以及菌群与环境因子(b)间关系分布图 Fig.9 The distribution diagram of the relationship between seawater samples and environmental factors (a) and between bacterial community and environmental factors (b) based on the RDA A:东安海域;B:雷江海域;C:马坑海域;D:沙湾海域 A: Dong´an costal area; B: Leijiang costal area; C: Makeng costal area; D: Shawan costal area |
东吾洋地处闽东三都湾内,属于封闭性较强的内湾海域,历来是霞浦县的主要水产养殖基地。近年来,该海域刺参吊笼养殖模式异军突起,2021年该海域养殖吊笼数量达到1 100万笼,刺参养殖产量达3.5万t,产值逾50亿元,成为霞浦地区乡村振兴的重要途径。海域环境的好坏对水产养殖至关重要,然而,该海域相关环境因子数据缺乏,对指导该区域合理布局和产业发展支撑不足。本研究对东吾洋海域的水质检测结果发现,刺参养殖区水体中磷酸盐含量在0.12~0.18 mg/L之间,亚硝酸盐的含量在0.038~0.041 mg/L之间,与柯才焕等(1988)对该海域1984年的检测结果相比,水体中磷酸盐和亚硝酸盐含量分别上涨了300和200多倍;与黄标等(2002)检测的三都澳海域的结果相比,磷酸盐含量增长超过2倍,亚硝酸盐的含量提升超过4倍,说明在近40年的养殖过程中,水体的富营养化现象日益加重。刘丽华等(2021)对闽西南海域环境调查评估也发现,内湾海域污染最为严重。本研究所监测的4个区域均存在中度或重度的富营养化并存在轻度或中度的有机污染,尤其是养殖最为集中的沙湾和雷江海域,富营养化和有机污染更为严重,这可能是养殖密度过大、水产结构不合理、饲料投喂量大、日常生活用水大量排入等原因引起。水体的富营养化会进一步导致海区生境衰退、多样性减少,制约沿海地区的可持续发展,因此,后期在该海域的养殖管理过程中可采用多营养层次综合养殖或者大型藻类养殖等策略进行生态修复(汤坤贤等, 2021; 何培民等, 2021)。
3.2 东吾洋海域环境菌群结构分析对于水生生物,其所处水域环境中的致病原的种类和数量是病害发生的重要因素,因此,解析水产养殖环境的菌群结构对于水产养殖动物的病害防控具有重要意义(Schöttner et al, 2013)。本研究对东吾洋海域的4个区域沉积物和水体菌群结构进行多样性分析发现,水体与沉积物样品中共有不同分类水平的74个菌群存在显著差异,其中,水体样品中存在显著性优势的菌群有35个;而沉积物样品中的显著性优势菌群有39个。沉积物的微生物多样性显著高于水体;Nitrincolaceae是水体样品细菌群落优势菌科,而Sva1033、Desulfocapsaceae和Woeseiaceae是沉积物中的优势菌科,沉积物和水体优势菌的种类具有较强的空间异质性。沉积物菌群多样性水平和菌群空间异质性结果与王丹丹等(2023)和张雨晴等(2022)在不同水域研究的沉积物与水体菌群多样性比较结果一致。这可能是由于水体流动性强,菌群结构不断发生变化,从而影响菌群的多样性,沉积物细菌群落多样性高可能与其环境异质性更高有关。造成空间异质性存在的原因可能是环境因子的改变。王泽铭等(2021)在湿度、盐度和pH协同驱动锡林河景观疣微菌群空间异质性研究中发现,各类环境因子都会对环境菌群造成一定的影响。
刺参营底栖生活,在自然环境中,其肠道菌群与养殖水体和沉积物环境均密切相关(丁斯予等, 2019; 谭八梅等, 2021)。福建地区“北参南养”主要采用吊笼养殖模式,即利用鲍鱼笼将海参放于水深约为2~3 m的水层中养殖,因此,养殖海参受水体菌群结构的影响较大,水体菌群结构更值得关注。本研究对不同海域的水体样品差异比较可以看出,位于东吾洋海域外侧的沙湾海域的多样性指数最高,而位于东吾洋内侧的东安海域多样性指数最低,且聚类分析与其他3个区域间隔较远,这可能与东安海域位于内湾最深处,且受东安岛的阻隔,水流交换受限有关。濮鸣锋等(2017)对东吾洋海域的洋流模拟分布调查结果也支撑了本推论。从不同刺参养殖海域水体和沉积物优势菌群的分析结果可以看出,弧菌科在所有水体和沉积物样本中均为优势种类之一。弧菌科是刺参重要的潜在致病菌,目前,常见的有灿烂弧菌(Vibrio splendidus) (王印庚等, 2006)、副溶血弧菌(Vibrio parahaemolyticus) (王印庚等, 2012)、溶藻弧菌(Vibrio algaelyticus)(李晓宇等, 2022)、哈维氏弧菌(Vibrio harveyi)(逄慧娟等, 2017; 杨求华, 2015)、塔式弧菌(Vibrio tubiashii)(杨求华等, 2014)、伯麦氏弧菌(Vibrio pomeroyi)(方旅平等, 2014)等,均被证明为致病菌。因此,后期养殖管理过程中,需要密切关注这类病原菌的丰度和增殖情况,保障海参养殖的顺利开展。
3.3 水体菌群结构与环境因子的相关性分析水域环境菌群结构受环境因素的直接影响(Engering et al, 2013)。本研究对影响水体及沉积物微生物菌群的环境因子进行RDA分析,发现温度、溶氧、Chl-a浓度是影响样品中菌群结构的主要因素。在东安地区的水体菌群中,单细胞科是特有的,其成员与水体中维生素B12的合成有关(Jin et al, 2022)。在沙湾地区水体样品中,假单胞菌和γ-变形菌纲是特有的,γ-变形菌纲在氨氧化过程中起着重要作用(Freitag et al, 2003)。假单胞菌属可以作为刺参的特征菌属用来区分生态系统中的其他菌群(柴英辉等, 2019)。雷江地区水体样品中,主要特异性菌类为拟杆菌门,其与脂肪等代谢有关(Qiao et al, 2020),推测雷江地区饵料及粪便等有机物的分解,导致拟杆菌门的增多。马坑地区水体样品中特异性菌类为放线菌门,其与磷含量密切相关(唐浩琪等, 2020),水体中磷含量的增加会促进放线菌的生长繁殖,因此推测,由于马坑地区水体中的磷含量要高于其他地区,导致菌群存在差异。由此可见,不同地区刺参养殖水域差异菌群相对丰度特征与其主导环境因子的地域性差异相吻合。
本研究完成了福建吊笼养殖主海域——东吾洋海域环境因子调查和评价,并进一步完成了水体和沉积物菌群结构分析,发现东吾洋海域处于较高的富营养化水平,有机污染指数较高,沉积物菌群多样性显著高于水体菌群,在所有检测样品中弧菌科细菌均是其优势种类之一,提示具有一定的养殖风险,温度、溶氧和Chl-a浓度是影响样品中菌群结构的主要因素。本研究为本海域刺参养殖管理提供基础数据和科学参考。
BOLGER A M, LOHSE M, USADEL B. Trimmomatic: A flexible trimmer for Illumina sequence data. Bioinformatics (Oxford, England), 2014, 30(15): 2114-2120 |
CAO R, WANG S Y, ZHAO L, et al. Nutritional analysis and evaluation of Apostichopus japonicus gonads. Chinese Fishery Quality and Standards, 2020, 10(2): 23-30 [曹荣, 王善宇, 赵玲, 等. 仿刺参雄、雌性腺营养组成分析与评价. 中国渔业质量与标准, 2020, 10(2): 23-30] |
CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336 DOI:10.1038/nmeth.f.303 |
CHAI Y H, GAO F, WANG J F, et al. Intestinal microbiota in Apostichopus japonicus: Regional difference and common feature. Oceanologia et Limnologia Sinica, 2019, 50(5): 1127-1137 [柴英辉, 高菲, 王金锋, 等. 仿刺参(Apostichopus japonicus)肠道菌群的地域性差异与共性研究. 海洋与湖沼, 2019, 50(5): 1127-1137] |
CHEN S G. Structure and bioactivity analysis of several acid polysaccharides from sea animal: Searching for alternatives to heparin. Doctoral Dissertation of Ocean University China, 2010 [陈士国. 几种海洋动物酸性多糖的结构和活性研究. 中国海洋大学博士研究生学位论文, 2010]
|
DING S Y, WANG L, XU H C, et al. Bacterial community structure and function in the intestinal tracts and culture environment of sea cucumber (Apostichopus japonicus). Chinese Journal of Ecology, 2019, 38(1): 210-220 [丁斯予, 王荦, 徐瀚晨, 等. 刺参肠道及养殖环境菌群结构与功能. 生态学杂志, 2019, 38(1): 210-220] |
EDGAR R C. UPARSE: Highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 2013, 10(10): 996-998 DOI:10.1038/nmeth.2604 |
ENGERING A, HOGERWERF L, SLINGENBERGH J. Pathogen-host-environment interplay and disease emergence. Emerging Microbes and Infections, 2013, 2(2): e5 |
FANG L P, ZHOU C, HUANG R F, et al. Identification and characterization of Vibrio pomeroyi isolated from Apostichopus japonicus with skin ulcer syndrome during aestivation. Journal of Xiamen University (Natural Science), 2014, 53(2): 273-282 [方旅平, 周宸, 黄瑞芳, 等. 度夏仿刺参病原菌伯麦罗氏弧菌的分离鉴定和特征研究. 厦门大学学报(自然科学版), 2014, 53(2): 273-282] |
FREITAG T E, PROSSER J I. Community structure of ammonia-oxidizing bacteria within anoxic marine sediments. Applied and Environmental Microbiology, 2003, 69(3): 1359-1372 DOI:10.1128/AEM.69.3.1359-1371.2003 |
HE P M, DUAN Y L, LIU Q, et al. Strategy of macroalgae eco-remediation with cases in nearshore China. Journal of Applied Oceanography, 2021, 40(4): 557-563 [何培民, 段元亮, 刘巧, 等. 我国近海大型海藻生态修复策略与典型案例. 应用海洋学学报, 2021, 40(4): 557-563 DOI:10.3969/J.ISSN.2095-4972.2021.04.001] |
HOSHINO T, DOI H, URAMOTO G I, et al. Global diversity of microbial communities in marine sediment. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(44): 27587-27597 |
HU R C, CAI Z J, ZHOU C, et al. Analysis of the development situation of Fujian sea cucumber industry. China Fisheries, 2019(1): 57-59 [胡荣炊, 蔡珠金, 周宸, 等. 福建海参产业发展形势分析. 中国水产, 2019(1): 57-59] |
HUANG B, QIAN L M, LIU J F. Nutrient salts content and eutrophication assessment for Sanduao sea area, Fujian. Journal of Oceanography in Taiwan Strait, 2002(4): 411-415 [黄标, 钱鲁闽, 刘家富. 福建三都澳水产养殖区水体氮磷含量及潜在性富营养化程度分析. 台湾海峡, 2002(4): 411-415] |
JIANG T L, XU H D, PAN H Z, et al. Status quo and evaluation of water environment in southwest Laizhou Bay. Marine Science Bulletin, 1991(2): 17-52 [姜太良, 徐洪达, 潘会周, 等. 莱州湾西南部水环境的现状与评价. 海洋通报, 1991(2): 17-52] |
JIN X K, YANG Y F, CAO H H, et al. Eco-phylogenetic analyses reveal divergent evolution of vitamin B12 metabolism in the marine bacterial family 'Psychromonadaceae'. Environmental Microbiology Reports, 2022, 14(1): 147-163 DOI:10.1111/1758-2229.13036 |
KE C H, XIE J G, GUAN J Z, et al. A preliminary study on nutrient and plankton biomass in the waters of Dongwuyang. Journal of Fujian Fisheries, 1988(2): 24-31 [柯才焕, 谢建国, 关金藏, 等. 东吾洋水域营养盐与浮游生物量初步研究. 福建水产, 1988(2): 24-31] |
LI C H. Research progress on molecular regulation mechanism of skin ulcer syndrome in sea cucumber Apostichopus japonicus: A review. Journal of Dalian Ocean University, 2021, 36(3): 355-373 [李成华. 刺参腐皮综合征发生的分子调控机制研究进展. 大连海洋大学学报, 2021, 36(3): 355-373] |
LI X Y, FENG L J, XU L, et al. Isolation, identification and characteristics of pathogen from sea cucumber Apostichopus japonicus with skin ulceration syndrome. Fisheries Science, 2022, 41(5): 759-768 [李晓宇, 冯丽娟, 徐乐, 等. 刺参腐皮综合征病原菌的分离鉴定及特性分析. 水产科学, 2022, 41(5): 759-768] |
LIAO M J, WANG Y G, LI B, et al. Present status and existing problem for sea cucumber culture industry in China and discussion on its countermeasures. Scientific Fish Farming, 2021(2): 24-25 [廖梅杰, 王印庚, 李彬, 等. 我国海参养殖产业现状、存在问题及对策探讨(上). 科学养鱼, 2021(2): 24-25] |
LIU L H, HE Q, LAN J Q, et al. Distribution characteristics of environmental factors and eutrophication assessment in the Fujian coastal areas. Marine Sciences, 2021, 45(12): 97-107 [刘丽华, 贺琦, 兰景权, 等. 福建省近岸海域环境因子分布特征及富营养化评价. 海洋科学, 2021, 45(12): 97-107] |
MAGOČ T, SALZBERG S L. FLASH: Fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963 DOI:10.1093/bioinformatics/btr507 |
PANG H J, LIAO M J, LI B, et al. Etiology and treatment of enteritis disease in cultured juveniles of Apostichopus japonicus. Progress in Fishery Sciences, 2017, 38(3): 188-197 [逄慧娟, 廖梅杰, 李彬, 等. 刺参(Apostichopus japonicus)保苗期"肠炎病"及其治疗方法. 渔业科学进展, 2017, 38(3): 188-197] |
PU M F, YANG H, ZHANG W. The oil spill simulation around Guanmen fishing port in Dongwu Bay. Marine Environmental Science, 2017, 36(1): 121-128 [濮鸣锋, 杨红, 张午. 东吾洋关门渔港邻近海域溢油模拟分析. 海洋环境科学, 2017, 36(1): 121-128] |
QIAO S S, BAO L, WANG K, et al. Activation of a specific gut Bacteroides-folate-liver axis benefits for the alleviation of nonalcoholic hepatic steatosis. Cell Reports, 2020, 32(6): 108005 DOI:10.1016/j.celrep.2020.108005 |
ROGGATZ C C, GONZÁLEZ-WANGÜEMERT M, PEREIRA H, et al. A first glance into the nutritional properties of the sea cucumber Parastichopus regalis from the Mediterranean Sea (SE Spain). Natural Product Research, 2018, 32(1): 116-120 DOI:10.1080/14786419.2017.1331224 |
SCHÖTTNER S, HOFFMANN F, CÁRDENAS P, et al. Relationships between host phylogeny host type and bacterial community diversity in cold-water coral reef sponges. PLoS One, 2013, 8(2): e55505 DOI:10.1371/journal.pone.0055505 |
TAN B M, WANG L, PEI H L, et al. The seasonal structural and functional characteristics of bacterial community in Apostichopus japonicus culture pond water. Progress in Fishery Sciences, 2021, 42(3): 77-88 [谭八梅, 王荦, 裴泓霖, 等. 不同季节刺参养殖池塘水体菌群结构与功能特征研究. 渔业科学进展, 2021, 42(3): 77-88] |
TANG H Q, ZHANG N, SUN B, et al. Effect of interaction between arbuscular mycorrhizal fungi and rhizosphere bacteria in farmland soils on nutrients utilization. Acta Microbiologica Sinica, 2020, 60(6): 1117-1129 [唐浩琪, 张娜, 孙波, 等. 典型农田土壤中丛枝菌根真菌–根际细菌互作及与氮磷利用的关系. 微生物学报, 2020, 60(6): 1117-1129] |
TANG K X, FAN X, LI H Y, et al. Ecological restoration techniques and strategies for typical eutrophication sea areas in southern China. Journal of Applied Oceanography, 2021, 40(1): 163-169 [汤坤贤, 范祥, 李和阳, 等. 南方典型富营养化海区生态修复技术与策略. 应用海洋学学报, 2021, 40(1): 163-169] |
WANG D D, HUANG Y F, YANG H J. Differences of bacterial community co-occurrence network and assembly processes between sediment and water in lakes on the Qinghai-Tibet Plateau. Journal of Lake Sciences, 2023, 35(3): 959-971 [王丹丹, 黄跃飞, 杨海娇. 青藏高原湖泊沉积物与水体细菌群落共发生网络和群落构建过程差异解析. 湖泊科学, 2023, 35(3): 959-971] |
WANG Y G, GUO W L, RONG X J, et al. lsolation and identification of a pathogenic bacterium associated with off-plate syndrome from Apostichopus japonicus cultured in Liaoning Province. Progress in Fishery Sciences, 2012, 33(6): 81-86 [王印庚, 郭伟丽, 荣小军, 等. 养殖刺参"化板症"病原菌的分离与鉴定. 渔业科学进展, 2012, 33(6): 81-86] |
WANG Y G, SUN S F, RONG X J. Stomach ulcer disease in auricularia of sea cucumber (Apostichopus japonicus) and its etiological identification. Journal of Fishery Sciences of China, 2006, 13(6): 908-916 [王印庚, 孙素凤, 荣小军. 仿刺参幼体烂胃病及其致病原鉴定. 中国水产科学, 2006, 13(6): 908-916] |
WANG Z M, LI C H, MA Q L, et al. Moisture, salinity and pH co-driving spatial heterogeneity of Verrucomicrobial populations in Xilin River landscape. Acta Microbiologica Sinica, 2021, 61(6): 1728-1742 [王泽铭, 李传虹, 马巧丽, 等. 湿度盐度pH协同驱动锡林河景观疣微菌群空间异质性. 微生物学报, 2021, 61(6): 1728-1742] |
YANG Q H, GE H, FANG L P, et al. Identification of Vibrio tubiashii isolated from diseased pond-cultured sea cucumbers (Apostichopus japonicus). South China Fisheries Science, 2014, 10(4): 45-51 [杨求华, 葛辉, 方旅平, 等. 池塘养殖刺参病原菌塔式弧菌的分离与鉴定. 南方水产科学, 2014, 10(4): 45-51] |
YANG Q H. Isolation, identification and antibiotic sensitivity analysis of bacterial pathogen from skin ulcer disease in Apostichopus japonicus cultured in South China. Journal of Fujian Fisheries, 2015, 37(2): 98-106 [杨求华. 南移仿刺参体表溃疡症病原菌的分离鉴定及药敏分析. 福建水产, 2015, 37(2): 98-106] |
YOUSSEF N, SHEIK C S, KRUMHOLZ L R, et al. Comparison of species richness estimates obtained using nearly complete fragments and simulated pyrosequencing-generated fragments in 16S rRNA gene-based environmental surveys. Applied and Environmental Microbiology, 2009, 75(16): 5227-5236 DOI:10.1128/AEM.00592-09 |
ZHANG Y Q, SHAO K Q, HU Y, et al. Bacterial diversity and community composition in lake water and sediment of Lake Daihai. Journal of Lake Sciences, 2022, 34(6): 2070-2082 [张雨晴, 邵克强, 胡洋, 等. 岱海水体及沉积物细菌多样性及群落组成特征. 湖泊科学, 2022, 34(6): 2070-2082] |
ZOU J Z, DONG L P, QIN B P. Preliminary discussion on eutrophication and red tide in Bohai Bay. Marine Environmental Science, 1983, 2(2): 41-54 [邹景忠, 董丽萍, 秦保平. 渤海湾富营养化和赤潮问题的初步探讨. 海洋环境科学, 1983, 2(2): 41-54] |



