2. 中国水产科学研究院黄海水产研究所 海水养殖生物育种与可持续产出全国重点实验室 农业农村部海洋渔业与可持续发展重点实验室 山东 青岛 266071;
3. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 山东 烟台 264006
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, State Key Laboratory of Mariculture Biobreeding and Sustainable Goods, Key Laboratory of Marine Fisheries and Sustainable Development, Ministry of Agriculture and Rural Affairs, Qingdao 266071, China;
3. Shandong Marine Resource and Environment Research Institute, Shandong Key Laboratory of Marine Ecological Restoration, Yantai 264006, China
二甲基巯基丙酸内盐(dimethylsulfoniopropionate, DMSP)是海洋浮游植物产生的一种含硫化合物(Kiene et al, 2000),它构成了海洋藻类细胞内的硫储存库(Stefels et al, 2007; Galí et al, 2015),是浮游植物重要的渗透保护剂、冷冻保护剂和抗氧化剂(Kirst et al, 1991; Wittek et al, 2020; Sunda et al, 2002)。海洋浮游植物每年产生的DMSP高达109 t,这些DMSP被释放到环境中后,在硫的生物地球化学循环及调节气候变化方面发挥着重要作用(Challenger et al, 1948; van Duyl et al, 1998; Stefels et al, 2007)。例如,DMSP被细菌降解为二甲基硫(dimethyl sulfide, DMS),DMS通过海气交换被释放到大气中,有助于形成云凝结核(Lovelock et al, 1972; Hatakeyama et al, 1982),增加对太阳光的反射率,从而减轻温室效应。每年大约有28.1 Tg硫以DMS的形式进入大气,约占全球总硫通量的50% (Lana et al, 2011; Watts, 1999)。
自经典的CLAW假说被报道以来(Charlson et al, 1990),在全球不同海域开展了大量关于DMSP的工作。近几十年来,关于中国近海环境中DMSP的研究也开展了大量工作,研究发现,我国近海DMSP含量较高(Li et al, 2023)。东海虽然仅占全球海洋面积的一小部分,但其海洋表层DMS的释放量高达全球海洋贡献的0.21% (Jian et al, 2018)。其中,长江冲淡水携带了大量NO3–、NH4+和尿素等氮营养盐(Li et al, 2010; Zhou et al, 2003),它们可能是影响东海水体DMSP浓度的关键因素之一(Jian et al, 2019; 孙策策等, 2023)。NO3–等氮营养盐对水体中DMSP的影响是多方面的:一方面,氮营养盐促进浮游植物生长,进而导致浮游植物丰度增加;另一方面,DMSP是含硫的化合物,高浓度的NO3–会抑制藻类单细胞中DMSP的含量。但不同藻类对氮营养盐的响应存在差异(Song et al, 2007; 乔玲等, 2022),此外,目前在不同类型氮营养盐对浮游植物DMSP含量的影响方面认识不充分。
本研究以DMSP生产能力不同的赫氏颗石藻(Emiliania huxleyi) (DMSP含量较高)和三角褐指藻(Phaeodactylum tricornutum) (DMSP含量中等)为对象(Keller et al, 1989; Spielmeyer et al, 2011),在不同氮营养盐浓度和类型条件下进行室内培养实验。首先,分析不同氮营养盐浓度条件下培养液中DMSP的含量变化特征及主要影响因素;其次,分析不同氮营养盐类型条件下培养液中DMSP含量的变化特征。本研究旨在为进一步认识不同氮营养盐浓度/类型对浮游植物合成DMSP的影响提供理论依据。
1 材料与方法 1.1 实验藻种和培养条件实验藻种赫氏颗石藻(有钙板)来源于厦门大学藻种库,三角褐指藻来源于中国水产科学研究院黄海水产研究所细胞生物学实验室。实验用玻璃仪器均在10% (V/V)盐酸中浸泡24 h后用超纯水洗净。
1.1.1 不同氮营养盐浓度条件下赫氏颗石藻和三角褐指藻培养实验赫氏颗石藻正常生长条件下所需的NO3–浓度为100 μmol/L (Sunda et al, 2005)。在本研究中,以NaNO3为氮源,设置5种不同NO3–浓度梯度,分别为0、10、25、100 (正常NO3–浓度培养组)和200 μmol/L (高NO3–浓度培养组)。三角褐指藻正常生长所需的NO3–浓度为882 μmol/L (Guillard et al, 1962)。在本研究中,以NaNO3为氮源,设置5种不同NO3–浓度梯度,0、88、220、882 (正常NO3–浓度培养组)和1 764 μmol/L (高NO3–浓度培养组)。
1.1.2 不同氮营养盐类型条件下赫氏颗石藻和三角褐指藻培养实验分别设置NaNO3、NH4Cl和CH4N2O (尿素)作为氮源供应,赫氏颗石藻利用Aquil培养基浓度(100 μmol/L)配制;三角褐指藻利用f/2培养基浓度(882 μmol/L)配制,只改变其中氮源种类而不改变氮的浓度,其他营养元素不变。
1.1.3 培养方法每个培养组设3个平行,藻种活化、扩培至对数生长期后接种于1 L锥形瓶中,培养体积为700 mL,控制接种密度为6×104 cells/mL,每天定时摇瓶3次。于恒温光照培养箱中进行培养,光照强度为4 500 lx,温度为(20.0±0.2) ℃,光暗周期为12∶12 h。
1.2 藻细胞密度、比生长率的测定培养过程中,隔日取样,用鲁哥试剂进行固定和染色,用血球计数板在光学显微镜下计数,每个样品计数5次,去掉最大值与最小值后取平均值。计数后换算为藻细胞密度值,藻细胞密度=血球计数板上藻细胞数目×104 cells/mL。
藻细胞比生长率μ=(lnNt–lnN0)/(Tt–T0),式中,Nt为藻类在Tt时刻的藻细胞密度,N0为藻类接种时(T0)的藻细胞密度。
1.3 NO3–浓度的测定在培养过程中,隔日取20 mL藻液用于NO3–浓度的检测,每组样品测定3个平行,采用营养盐自动分析仪(QuAAtro,德国)测定。
1.4 DMSPp含量的测定DMSP的保存与测定:取一定体积的培养藻液,在重力作用下通过0.7 μm的GF/F滤膜,收集最初的4 mL滤液,并加入20 μL的50%浓硫酸固定,用作溶解态DMSP (DMSPd)样品分析;另取10 mL的未过滤藻液,直接加入50 μL的50%浓硫酸固定,用作总DMSP (DMSPt)样品分析(Kiene et al, 2006)。取2 mL保存的DMSP样品,加入NaOH (pH≥13)并置于黑暗处24 h,使DMSP完全转化为DMS,并按照DMS测定方法测出其浓度,按1∶1的比例换算得到DMSPd和DMSPt的量,二者之差即为颗粒态DMSP (DMSPp)浓度(Yang et al, 2012)。
藻类培养中DMSP样品在第4、6、9、11、15天采集,即在藻类生长周期中采集样品共5次,包括在指数生长期和稳定生长期各采集样品2次、在衰退期采集样品1次(Keller et al, 1999)。本研究中所有DMSP浓度均为DMSPp浓度。
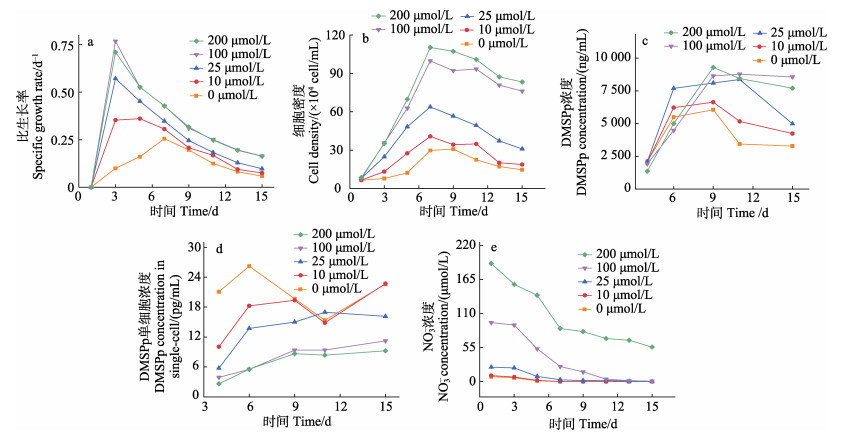
2 结果与分析 2.1 NO3–浓度对赫氏颗石藻和三角褐指藻生长及DMSPp的影响 2.1.1 不同NO3–浓度对赫氏颗石藻生长及DMSPp生产的影响Sunda等(2005)研究发现,赫氏颗石藻正常生长所需的NO3–浓度为100 μmol/L。本研究中,NO3–浓度为100 μmol/L的培养组,藻类比生长率在前3 d迅速增加,并在第3天达到最大值,随后逐渐降低(图 1a)。高NO3–浓度(200 μmol/L)培养组藻类的比生长率与100 μmol/L培养组基本相同(P > 0.05)。在低于100 μmol/L的3个培养组中(25、10和0 μmol/L),赫氏颗石藻的比生长率显著低于100 μmol/L的培养组,但随NO3–浓度升高,赫氏颗石藻比生长率显著增加(P < 0.05)。
|
图 1 不同NO3–浓度赫氏颗石藻的比生长率(a)、细胞密度(b)、培养液DMSPp浓度(c)、单细胞DMSPp浓度(d)和NO3–浓度(e) Fig.1 Specific growth rate (a), cell density (b), DMSPp concentration in culture medium (c), DMSPp concentration in single-cell (d), and NO3– concentration (e) of E. huxleyi under different NO3– concentrations |
藻细胞密度在不同NO3–浓度下的变化趋势与比生长率类似,整体都表现出随NO3–浓度增加而增加的趋势。在NO3–浓度为200 μmol/L的培养组中,藻细胞密度出现的最大值为110.30×104 cells/mL,NO3–浓度为0 μmol/L的培养组,藻细胞密度的最大值仅为30.80×104 cells/mL,是前者的27.9%。而高NO3–浓度组(200 μmol/L)比正常NO3–浓度组(100 μmol/L)的藻细胞密度略高,但并没有通过显著性检验(P > 0.05)(图 1b)。
对比各组培养液中DMSPp的浓度可以发现其整体与藻细胞密度的变化类似,出现先增加后降低的趋势。此外,随着不同培养组中NO3–浓度增加,培养液中的DMSPp浓度增加(图 1c)。
在单细胞DMSPp含量的变化中,大多数培养组出现随培养时间增加而逐渐增加的趋势,这可能是由于随培养时间的增加,NO3–浓度逐渐减少(图 1e、2e)。并且在不同NO3–浓度的培养条件下,随着NO3–浓度升高,单细胞DMSPp含量降低。NO3–浓度为200 μmol/L条件下,藻类生长周期中单细胞DMSPp的平均含量为(6.89±2.78) fmol/cell,NO3–浓度为0 μmol/L条件下,单细胞DMSPp的平均含量为(20.98±3.97) fmol/cell,约是200 μmol/L培养组单细胞平均含量的3倍(图 1d)。
|
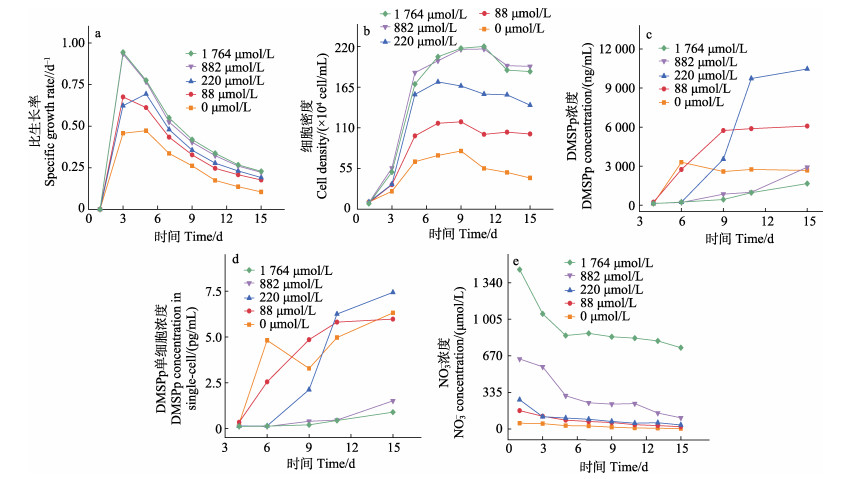
图 2 不同NO3–浓度三角褐指藻的比生长率(a)、细胞密度(b)、培养液DMSPp浓度(c)、单细胞DMSPp浓度(d)和NO3–浓度(e) Fig.2 Specific growth rate (a), cell density (b), DMSPp concentration in culture medium (c), DMSPpconcentration in single-cell (d), and NO3– concentration (e) of P. tricornutum under different NO3– concentrations |
总体来看,赫氏颗石藻培养液中DMSPp的浓度与藻细胞密度变化趋势一致,而与单细胞DMSPp的含量变化趋势不同。
2.1.2 不同NO3–浓度对三角褐指藻生长及DMSPp生产的影响Guillard等(1962)研究发现,三角褐指藻正常生长所需NO3–浓度为882 μmol/L。本研究中,882 μmol/L浓度组的比生长率也出现前3 d迅速增加、随后逐步降低的现象。高NO3–浓度组(1 764 μmol/L)比生长率与882 μmol/L培养组无显著差异。在低于882 mol/L的3个培养组(0、88和220 μmol/L)中,三角褐指藻的比生长率明显低于882 μmol/L培养组,与赫氏颗石藻的结果相似,随着NO3–浓度的增加三角褐指藻的比生长率显著增加(P < 0.05)(图 2a)。
同时,各培养组的藻细胞密度与比生长率类似,随着NO3–浓度升高,藻细胞密度增加。高NO3–浓度组(1 764 μmol/L)藻细胞密度最大值为220.2×104 cells/mL,而低NO3–浓度组(0 μmol/L)藻细胞密度最大值为78.7× 104 cells/mL,仅为高NO3–组的35.7%,这说明2种藻都表现出高NO3–浓度条件促进藻细胞生长的现象。与赫氏颗石藻结果相似,高NO3–浓度培养组(1 764 μmol/L)和正常NO3–浓度培养组(882 μmol/L)的藻细胞密度无显著性差异(P > 0.05) (图 2b)。
在不同NO3–浓度培养组中,三角褐指藻单细胞DMSPp含量也有随着培养时间的增加而增加的趋势,这与赫氏颗石藻的现象一致(图 2c),均由NO3–浓度逐渐降低而导致。同时,各培养组整体与赫氏颗石藻类似,高NO3–浓度对藻单细胞DMSPp含量有明显的抑制作用。在高NO3–浓度组(1 764 μmol/L),藻类生长周期中单细胞DMSPp平均含量为(0.35± 0.33) fmol/cell,而在低NO3–浓度条件下(0 μmol/L),单细胞DMSPp平均含量为(3.93±2.31) fmol/cell,为高NO3–浓度组的11倍,这一比值明显高于赫氏颗石藻的比值(图 2d)。
与赫氏颗石藻不同的是,三角褐指藻培养液中DMSPp的浓度与单细胞DMSPp的变化趋势基本一致,说明三角褐指藻培养液中DMSPp的浓度主要受单细胞DMSPp含量控制,而非藻细胞密度。
2.1.3 不同NO3–浓度对赫氏颗石藻和三角褐指藻生产DMSPp的影响在本研究中,赫氏颗石藻在低NO3–浓度组(0 μmol/L)藻细胞密度的最大值仅为高NO3–浓度组的27.9%;三角褐指藻低NO3–浓度组中(0 μmol/L)藻细胞密度的最大值仅为高NO3–浓度组的35.7%。NO3–浓度对赫氏颗石藻和三角褐指藻的生长促进作用一致,均具有高NO3–浓度下藻细胞比生长率高、藻细胞密度也高的特点。但2种藻的高NO3–浓度组(200 μmol/L)和正常NO3–浓度组(100 μmol/L)的藻细胞密度无显著性差异。这说明氮营养盐增加至完全满足藻类生长时,其浓度不会再大幅度促进藻的生长。
在NO3–浓度差异对藻细胞合成DMSPp影响的实验中,2种藻的结果有一定差异。高NO3–浓度对藻细胞DMSPp的合成均有抑制作用,对赫氏颗石藻来说,低NO3–浓度组(0 μmol/L)单细胞DMSPp平均含量为高NO3–浓度组(200 μmol/L)的3倍;而在三角褐指藻中,低NO3–浓度组(0 μmol/L)单细胞DMSPp平均含量为高NO3–浓度组(1 764 μmol/L)的11倍,表明高NO3–浓度对三角褐指藻单细胞生产DMSPp的抑制作用更加显著。同时,对比2种藻培养液中DMSPp浓度的变化趋势可以发现,赫氏颗石藻培养液中的DMSPp浓度主要与藻细胞密度有关,而三角褐指藻培养液中DMSPp浓度主要受单细胞DMSPp影响。这可能是由于NO3–对赫氏颗石藻单细胞DMSPp的影响相对较小,所以培养液中的DMSPp主要受藻细胞密度的影响;而在三角褐指藻中,NO3–对单细胞中DMSPp的含量抑制较明显,相比藻细胞密度,单细胞中DMSPp的含量对其影响更大。
McParland等(2020)研究表明,由于赫氏颗石藻是高DMSP的生产者,DMSP在细胞内充当“相容性”溶质而存在,氮的浓度对其藻细胞DMSP合成的影响较小。赫氏颗石藻细胞内DMSP的含量对氮营养盐限制的条件没有显著的反应(Keller et al, 1999; McParland et al, 2020; Sunda et al, 2007)。而在DMSP的低生产者中,其可能是作为藻细胞的抗氧化剂应对外界环境胁迫。Gröne等(1992)研究认为,在氮限制的条件下,DMSP类含硫渗透剂会取代含氮渗透剂(如甜菜碱)来维持细胞平衡。Sunda等(2002)研究验证了DMSP及其降解产物在藻细胞中充当抗氧化剂,藻细胞受到某些应激源(如较低的氮)引起的氧化刺激会增加。在以往的报道中,以大洋海链藻(Thalassiosira oceanica)、中肋骨条藻(Skeletonema costatum)、微型海链藻(Thalassiosila pseudonana)作为研究对象(Sunda et al, 2007; Keller et al, 1999),发现在氮不足条件下,藻细胞内DMSP的产量出现大量增加。尽管目前对于三角褐指藻在低氮浓度下的响应机制报道较少,但三角褐指藻与中肋骨条藻和微型海链藻都属于硅藻,因此,我们推测三角褐指藻对氮的响应也是由于DMSP充当藻细胞的抗氧化剂而导致。
2.2 不同氮营养盐类型对赫氏颗石藻和三角褐指藻生长及DMSPp生产的影响 2.2.1 不同氮营养盐类型对赫氏颗石藻生长及DMSPp生产的影响在赫氏颗石藻各培养组中,NaNO3、NH4Cl和CH4N2O的浓度均为100 μmol/L,是藻细胞正常生长所需浓度。培养的前3 d,各培养组中赫氏颗石藻比生长率都表现出迅速增加的趋势,并在第3天达到最大值,随后逐渐减弱。NaNO3和CH4N2O培养组的比生长率变化曲线几乎完全一致,NH4Cl培养组的比生长率略低(图 3a)。

|
图 3 不同氮营养盐类型赫氏颗石藻的比生长率(a)、细胞密度(b)、培养液DMSPp浓度(c)和单细胞DMSPp浓度(d) Fig.3 Specific growth rate (a), cell density (b), DMSPp concentration in culture medium (c), and DMSPp concentration in single-cell (d) of E. huxleyi under different nitrogen nutrients |
3个培养组的藻细胞密度也有随着培养时间先增加后降低的变化趋势。在NaNO3、NH4Cl和CH4N2O三个培养组中,赫氏颗石藻的藻细胞密度最高值分别为104.75×104、94.75×104和172.25×104 cells/mL。CH4N2O作为氮源促进赫氏颗石藻生长最为明显,其藻细胞密度是以NH4Cl为氮源条件下藻细胞密度的2倍。
赫氏颗石藻的单细胞DMSPp含量在各培养组中存在一定差异,整个培养过程中,NaNO3、NH4Cl和CH4N2O培养组赫氏颗石藻单细胞DMSPp平均产量分别为(8.68±0.74)、(7.79±0.88)和(9.45±0.97) fmol/cell,CH4N2O培养组略微高于其他2组,但无显著性差异(P > 0.05)。对比3个培养组赫氏颗石藻培养液中DMSPp的浓度发现,NaNO3、NH4Cl和CH4N2O培养液中的DMSPp平均浓度分别是(7 048.04±1 753.80)、(5 898.16±1 450.73)和(8 689.36±2 667.96) ng/mL,CH4N2O培养液中的DMSPp浓度最高,是NH4Cl培养液中的DMSPp平均浓度的1.5倍。
2.2.2 不同氮营养盐类型对三角褐指藻生长及DMSPp生产的影响在三角褐指藻的NaNO3、NH4Cl和CH4N2O三个培养组中,氮的浓度均为882 μmol/L,是藻细胞正常生长所需浓度。实验前3 d各组比生长率迅速增加,第3天达到最大值,其中,NH4Cl和CH4N2O两个培养组比生长率趋势相似,NaNO3培养组在第3~5天比生长率比其他2组略高,随后3个培养组趋向一致(图 4a)。
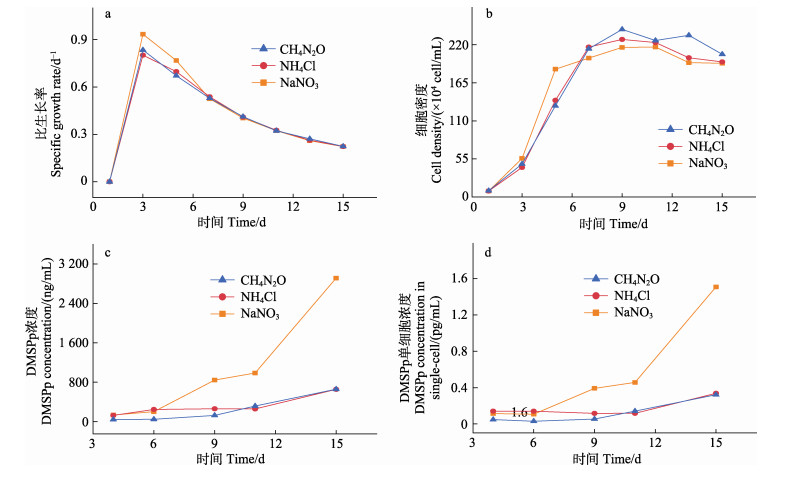
|
图 4 不同氮营养盐类型三角褐指藻的比生长率(a)、细胞密度(b)、培养液DMSPp浓度(c)和单细胞DMSPp浓度(d) Fig.4 Specific growth rate (a), cell density (b), DMSPp concentration in culture medium (c), and DMSPp concentration in single-cell (d) of P. tricornutum under different nitrogen nutrients |
与赫氏颗石藻类似,NaNO3、NH4Cl和CH4N2O三种不同氮营养盐类型条件下,三角褐指藻细胞密度整体呈先增加后逐渐降低的趋势,藻细胞密度最大值分别为216.70×104、227.70×104和242.20×104 cells/mL,CH4N2O培养组略高,但无显著性差异(P > 0.05),与赫氏颗石藻3种氮营养盐类型条件下对藻细胞密度的促进结果相一致,表明CH4N2O作为氮源对2种藻的生长均最为有利(图 3b、4b)。
在单细胞DMSPp含量的变化中,CH4N2O和NH4Cl培养组分别在第9天和第11天有显著升高,第15天单细胞内DMSPp的含量是第4天的2~8倍。NaNO3培养组单细胞DMSPp含量最高,变化最为显著,第15天单细胞内DMSPp的含量是第4天的14倍,培养过程中的平均值是CH4N2O和NH4Cl培养组的3~5倍(图 4d)。
NaNO3、NH4Cl、CH4N2O三组培养液中DMSPp浓度与单细胞DMSPp含量变化趋势基本一致,但培养液中DMSPp的平均浓度分别为(1 016.89±1 126.64)、(309.5±201.41)、(238.04±260.20) ng/mL,其中,在NaNO3作为氮源条件下,三角褐指藻细胞产生DMSPp的含量明显高于其他2个培养组,是NH4Cl和CH4N2O条件下培养液中DMSPp浓度平均值的3~4倍(图 4c)。
2.2.3 不同氮营养盐类型对赫氏颗石藻和三角褐指藻生产DMSPp的影响目前,国内外在不同氮营养盐类型对赫氏颗石藻和三角褐指藻生长影响已有比较充分的研究。Rees等(2002)在北海北部赫氏颗石藻水华期间的现场观测发现,与NH4+和NO3–相比,尿素对藻生长的促进作用最强。张文源等(2016)以NO3–、NH4+和尿素为氮源培养三角褐指藻,发现在以尿素为氮源的培养条件下,三角褐指藻的生物量最高。在本研究中,与NH4+和NO3–相比,CH4N2O对2种藻的细胞密度也表现出更有利的促进作用(图 3a、4a)。
但目前人们对3种不同类型的氮营养盐对藻细胞生产DMSP的影响认识并不充分。培养液中DMSPp的浓度主要与藻细胞密度和单细胞DMSPp含量有关。赫氏颗石藻培养液中DMSPp浓度与藻细胞密度的变化趋势相似(图 3c),说明赫氏颗石藻培养液中DMSPp的浓度主要受藻细胞密度的影响;而三角褐指藻培养液中DMSPp浓度的变化与单细胞DMSPp含量趋势一致(图 4c、4d),NO3–的影响较显著,NaNO3培养液中DMSPp平均浓度分别为NH4Cl和CH4N2O培养组的3~4倍,这进一步说明,对于高产种赫氏颗石藻,不同氮源对其细胞内DMSP的含量影响较小;对于DMSP生产处于中等水平的三角褐指藻,与尿素和NH4+相比,NO3–对藻细胞生产DMSPp的影响更加显著。
在本研究中,CH4N2O对赫氏颗石藻合成DMSPp的影响相对较强(图 3d),但与NH4Cl和NaNO3培养组无显著性差异(P > 0.05);而NaNO3对三角褐指藻合成DMSPp的作用明显大于NH4Cl和CH4N2O (P < 0.05) (图 4d),这可能是因为NO3–对三角褐指藻细胞生产DMSP的影响更加敏感。
3 结论本研究以赫氏颗石藻和三角褐指藻为对象,在不同氮营养盐浓度和不同氮营养盐类型的培养条件下,分析2种藻的藻细胞密度及DMSP含量的变化。结果发现,对赫氏颗石藻这类DMSP的高生产者来说,氮营养盐浓度及类型的改变对藻单细胞生产DMSPp的影响较小,2个实验的各培养组之间无显著性差异(P > 0.05),且培养液中总DMSP浓度主要受藻细胞密度影响;而对于三角褐指藻这类DMSP的中等生产者而言,不同氮营养盐浓度及类型对藻单细胞DMSP生产均有显著影响(P < 0.05),其培养液中总DMSP主要受单细胞DMSP含量影响。在不同NO3–浓度下,低NO3–浓度(0 μmol/L)培养组单细胞DMSPp平均含量为高NO3–浓度(1 764 μmol/L)培养组的11倍;在不同氮营养盐类型条件下,NaNO3培养液中总DMSPp平均浓度分别为NH4Cl和CH4N2O培养组的3~4倍。这可能是由DMSP在赫氏颗石藻和三角褐指藻细胞中的生理机制存在差异造成的。本研究可为认识不同氮营养盐浓度及类型对不同藻中DMSP含量的影响提供科学参考。
CHALLENGER F, SIMPSON M I. Studies on biological methylation. Part Ⅻ. A precursor of the dimethyl sulphide evolved by Polysiphonia fastigiata. Dimethyl-2- carboxyethylsulphonium hydroxide and its salts. Journal of the Chemical Society (Resumed), 1948, 1591-1597 DOI:10.1039/jr9480001591 |
CHARLSON R J, LANGNER J, RODHE H. Sulphate aerosol and climate. Nature, 1990, 348(6296): 22 DOI:10.1038/348022a0 |
GALÍ M, DEVRED E, LEVASSEUR M, et al. A remote sensing algorithm for planktonic dimethylsulfoniopropionate (DMSP) and an analysis of global patterns. Remote Sensing of Environment, 2015, 171: 171-184 DOI:10.1016/j.rse.2015.10.012 |
GRÖNE T, KIRST G O. The effect of nitrogen deficiency, methionine and inhibitors of methionine metabolism on the DMSP contents of Tetraselmis subcordiformis (Stein). Marine Biology, 1992, 112: 497-503 DOI:10.1007/BF00356296 |
GUILLARD R R L, RYTHER J H. Studies of marine planktonic diatoms. Ⅰ. Cyclotella nana Hustedt and Detonula confervacea (Cleve) Gran. Canadian Journal of Microbiology, 1962, 8: 229-239 DOI:10.1139/m62-029 |
HATAKEYAMA S, OKUDA M, AKIMOTO H. Formation of sulfur dioxide and methanesulfonic acid in the photooxidation of dimethyl sulfide in the air. Geophysical Research Letters, 1982, 9(5): 583-586 DOI:10.1029/GL009i005p00583 |
JIAN S, ZHANG H H, YANG G P, et al. Variation of biogenic dimethylated sulfur compounds in the Changjiang River Estuary and the coastal East China Sea during spring and summer. Journal of Marine Systems, 2019, 199: 103222 DOI:10.1016/j.jmarsys.2019.103222 |
JIAN S, ZHANG H H, ZHANG J, et al. Spatiotemporal distribution characteristics and environmental control factors of biogenic dimethylated sulfur compounds in the East China Sea during spring and autumn. Limnology and Oceanography, 2018, 63(S1): S280-S298 |
KELLER M D, BELLOWS W K, GUILLARD R R L. Dimethyl sulfide production in marine phytoplankton. Biogenic Sulfur in the Environment, 1989, 393: 167-182 |
KELLER M D, KIENE R P, MATRAI P A, et al. Production of glycine betaine and dimethylsulfoniopropionate in marine phytoplankton. Ⅱ. N-limited chemostat cultures. Marine Biology, 1999, 135(2): 249-257 DOI:10.1007/s002270050622 |
KIENE R P, LINN L J, BRUTON J A. New and important roles for DMSP in marine microbial communities. Journal of Sea Research, 2000, 43(3/4): 209-224 |
KIENE R P, SLEZAK D. Low dissolved DMSP concentrations in seawater revealed by small-volume gravity filtration and dialysis sampling. Limnology and Oceanography: Methods, 2006, 4(4): 80-95 DOI:10.4319/lom.2006.4.80 |
KIRST G O, THIEL C, WOLFF H, et al. Dimethylsulfoniopropionate (DMSP) in icealgae and its possible biological role. Marine Chemistry, 1991, 35(1/2/3/4): 381-388 |
LANA A, BELL T G, SIMÓ R, et al. An updated climatology of surface dimethlysulfide concentrations and emission fluxes in the global ocean. Global Biogeochemical Cycles, 2011, 25(1): 1-17 |
LI J, GLIBERT P M, ZHOU M J. Temporal and spatial variability in nitrogen uptake kinetics during harmful dinoflagellate blooms in the East China Sea. Harmful Algae, 2010, 9(6): 531-539 DOI:10.1016/j.hal.2010.03.007 |
LI L X, CUI Z G, QU K M, et al. High dimethylsulfoniopropionate concentrations in the surface seawater over the marginal seas of China and the Northwest Pacific Ocean during May–July of 2021 following La Niña. Marine Pollution Bulletin, 2023, 194: 115335 DOI:10.1016/j.marpolbul.2023.115335 |
LOVELOCK J E, MAGGS R J, RASMUSSEN R A. Atmospheric dimethyl sulphide and the natural sulphur cycle. Nature, 1972, 237(5356): 452-453 DOI:10.1038/237452a0 |
MCPARLAND E L, WRIGHT A, ART K, et al. Evidence for contrasting roles of dimethylsulfoniopropionate production in Emiliania huxleyi and Thalassiosira oceanica. New Phytologist, 2020, 226(2): 396-409 DOI:10.1111/nph.16374 |
QIAO L, CHANG Z Q, LI J, et al. Comparison of phytoplankton community diversity in the ecological aquaculture system of a marine pond using morphological analysis and high-throughput sequencing. Progress in Fishery Sciences, 2022, 43(2): 32-43 [乔玲, 常志强, 李健, 等. 基于形态学和高通量测序的海水池塘生态养殖系统中浮游植物多样性比较. 渔业科学进展, 2022, 43(2): 32-43] |
REES A P, WOODWARD E M S, ROBINSON C, et al. Size-fractionated nitrogen uptake and carbon fixation during a developing coccolithophore bloom in the North Sea during June 1999. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2002, 49(15): 2905-2927 DOI:10.1016/S0967-0645(02)00063-2 |
SONG B, WARD B B. Molecular cloning and characterizaion of high-affinity nitrate transporters in marine phytoplankon 1. Journal of Phycology, 2007, 43(3): 542-552 DOI:10.1111/j.1529-8817.2007.00352.x |
SPIELMEYER A, GEBSER B, POHNERT G. Dimethylsulfide sources from microalgae: Improvement and application of a derivatization-based method for the determination of dimethylsulfoniopropionate and other zwitterionic osmolytes in phytoplankton. Marine Chemistry, 2011, 124(1/2/3/4): 48-56 |
STEFELS J, STEINKE M, TURNER S, et al. Environmental constraints on the production and removal of the climatically active gas dimethylsulphide (DMS) and implications for ecosystem modelling. Biogeochemistry, 2007, 83: 245-275 DOI:10.1007/s10533-007-9091-5 |
SUN C C, WU W T, LIU J, et al. Contribution of freshwater aquaculture for nitrogen and phosphorus production in the Changjiang River and its impact on estuarine environment. Progress in Fishery Sciences, 2023, 44(1): 35-46 [孙策策, 吴文涛, 刘军, 等. 淡水养殖对长江氮磷输出的贡献及其河口环境效应. 渔业科学进展, 2023, 44(1): 35-46] |
SUNDA W G, HARDISON R, KIENE R P, et al. The effect of nitrogen limitation on cellular DMSP and DMS release in marine phytoplankton: Climate feedback implications. Aquatic Sciences, 2007, 69: 341-351 DOI:10.1007/s00027-007-0887-0 |
SUNDA W G, PRICE N M, Morel F M M. Trace metal ion buffers and their use in culture studies. Algal Culturing Techniques, 2005, 4: 35-63 |
SUNDA W, KIEBER D J, KIENER P, et al. An antioxidant function for DMSP and DMS in marine algae. Nature, 2002, 418(6895): 317-320 DOI:10.1038/nature00851 |
VAN DUYL F C, GIESKES W W C, KOP A J, et al. Biological control of short-term variations in the concentration of DMSP and DMS during a Phaeocystis spring bloom. Journal of Sea Research, 1998, 40(3/4): 221-231 |
WATTS M C. Lagrangian modelling of the marine nitrogen and sulphur cycles. University of East Anglia, 1999
|
WITTEK B, CARNAT G, TISON J L, et al. Response of dimethylsulfoniopropionate (DMSP) and dimethylsulfoxide (DMSO) cell quotas to salinity and temperature shifts in the sea-ice diatom Fragilariopsis cylindrus. Polar Biology, 2020, 43: 483-494 DOI:10.1007/s00300-020-02651-0 |
YANG G P, ZHUANG G C, ZHANG H H, et al. Distribution of dimethylsulfide and dimethylsulfoniopropionate in the Yellow Sea and the East China Sea during spring: Spatio- temporal variability and controlling factors. Marine Chemistry, 2012, 138: 21-31 |
ZHANG W Y, GAO B Y, LI A F, et al. Effects of different culture conditions on growth and accumulation of bioactive components by Phaeodactylum tricornutum. Marine Sciences, 2016, 40(5): 57-65 [张文源, 高保燕, 李爱芬, 等. 不同培养条件对三角褐指藻生长及其生物活性成分积累的影响. 海洋科学, 2016, 40(5): 57-65] |
ZHOU M J, YAN T, ZHOU J Z. Preliminary analysis of the characteristics of red tide areas in Changjiang River Estuary and its adjacent sea. Journal of Applied Ecology, 2003, 14(7): 1031-1038 |



