2. 海水养殖生物育种与可持续产出全国重点实验室 中国水产科学研究院黄海水产研究所 山东 青岛 266071;
3. 崂山实验室 山东 青岛 266237
2. State Key Laboratory of Mariculture Biobreeding and Sustainable Goods, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Laoshan Laboratory, Qingdao 266237, China
循环水养殖系统(recirculating aquaculture system, RAS)是一种先进的工厂化养殖技术,具有占地面积小、养殖条件可控、环境友好等优势,同时能大幅减少水资源的浪费(王海姮等, 2023)。传统水产养殖过程中,残饵粪便产生积累的NH4+-N和NO2–-N对养殖生物存在严重的毒害作用(Bussel et al, 2011)。循环水养殖系统可利用生物滤池将NH4+-N和NO2–-N转化为毒性较低的NO3–-N。然而,越来越多的研究表明,硝酸盐的积累会对养殖生物产生慢性的不良影响(Davidson et al, 2017; van Duc et al, 2018)。此外,含高浓度硝酸盐的尾水排放到受纳海域中,可能会引起水体富营养化,水源恶化进一步影响养殖生物的生长(Yang et al, 2021)。因此,高效去除养殖尾水中的NO3–-N是海水循环水养殖业发展中至为关键的一环。
异养反硝化是一种被广泛使用的高效生物脱氮技术。海水养殖尾水具有高盐度、低碳氮比的特点,会限制反硝化的进行,因此,需要额外添加碳源以保证反硝化进程的高效进行。常见的液体碳源,如甲醇、乙醇和乙酸钠等存在投加量难控制、易产生N2O等弊端,糖类物质又由于结构复杂而分解较慢(朱启荣等, 2021)。使用固体碳源,如可生物降解聚合物和农业废弃物,可以有效解决这些问题。可生物降解聚合物是一类不溶于水但能被微生物降解的高分子材料,实践表明,以其为碳源的反硝化系统具有较高的脱氮效率,且持续作用时间长(Chu et al, 2013),但成本较高。农业废弃物碳源兼具成本低、可大量获取的优势和长期脱氮效果,但存在运行初期水色高、浊度大,亚硝酸盐积累的问题(葛海华等, 2019)。复合碳源是消除单一碳源的劣势、综合不同碳源优势的一条优良途径。已有研究发现,将聚己内酯(PCL)和玉米芯(CC)混合使用,既克服了成本较高的问题,又具有优秀的脱氮性能,是一种优良的外加碳源(Cui et al, 2023)。
课题组前期成功构建了基于PCL+CC复合碳源的柱式反硝化生物反应器,并取得了较好的脱氮效果(Cui et al, 2023),但关于该系统运行的最佳条件还不够明确。进水硝酸盐浓度(influent nitrate concentration, INC)会改变碳氮比而直接影响反硝化的进行(Ge et al, 2012),而温度又会改变微生物的生长代谢活性,从而影响反硝化(Li et al, 2016)。本研究在前期柱式反硝化生物反应器的基础上,探究INC和温度对以PCL+CC为外加碳源的固相反硝化系统脱氮效率和微生物群落结构的影响,以期为养殖尾水脱氮系统的优化提供理论依据。
1 材料与方法 1.1 反硝化系统构建本研究所采用的反硝化系统由进水池(180 L)、蠕动泵、柱式反应器和出水池(180 L)构成(图 1)。其中,蠕动泵购自孚诺泰水处理公司(阿尔道斯V系列,中国)。柱式反应器由透明亚克力板材制成,高900 mm、内径50 mm。反应器所加碳源PCL和CC以1∶1的质量比(干重)混合制备而成,分别购自广东省东莞市樟木头苏元塑料原料经营部和河南省巩义市恒润水处理材料有限公司。所选材料的粒径在3~5 mm之间,PCL和CC的比表面积分别为(0.047±0.011) m2/g和(0.198±0.031) m2/g,比表面积随机选取新鲜碳源使用Full Report Set (ASAP 2020 Plus 1.03,美国)测定。经洗净和烘干后加入反应器中使填充率达到50%。

|
图 1 柱式反硝化系统示意图 Fig.1 Schematic diagram of column denitrification system |
为提高反应器的挂膜启动效率,实验前驯化富集可适应高盐度的反硝化菌。采用海水循环水养殖系统排放的固体废弃物为泥种,使用天然海水配制的营养液(30 mg/L NO3–-N,1 mg/L PO43–-P)均匀混合后于序批式反应器(10 L)培养,初始污泥质量浓度约为3.0 g/L。实验启动时,反应器内分别加入复合碳源和700 mL经富集培养后的反硝化菌液。进水采用人工模拟配制的海水循环水养殖尾水(参数见表 1),NO3–-N、PO43–-P、NH4+-N和NO2–-N的浓度分别由KNO3、H2PO4、NH4Cl和NaNO2调节。
|
|
表 1 人工合成养殖尾水水质参数 Tab.1 Water quality parameters of synthetic aquaculture wastewater |
模拟尾水通过蠕动泵由进水池泵入反应器进水口(图 1),流经反应器,从出水口流出,水力停留时间(HRT)设定为5 h。为了探究INC对反硝化效果的影响,本实验设置了3个柱式反应器,分别调节INC为40、30和20 mg/L(以下简称N-40、N-30和N-20)。实验周期为90 d,其中挂膜阶段60 d,当出水的硝酸盐浓度(effluent nitrate concentration, ENC)低于1.5 mg/L时,反应器启动完成,开始连续30 d实验阶段,每天取进出水观察反硝化系统运行情况。
1.3 温度影响实验3个反应器的进水硝酸盐均设置为30 mg/L,分别置于3个独立房间内,利用恒温加热棒(森森水族,100 W JRB-210)分别调节进水温度为20 ℃、25 ℃、30 ℃(以下简称T-20、T-25和T-30),用空调调节室内恒定温度至与进水温度相同,因此,3个系统进水温度与反应温度之间无差异。其余条件同INC影响实验。
1.4 水质指标测定 1.4.1 无机氮(DIN)和总氮(TN)常规水质指标包括NO3–-N、NO2–-N、NH4+-N和TN浓度。每天从反应器的进水口和出水口取水样100 mL用于检测。水样经0.45 μm玻璃纤维滤膜过滤后,再通过营养盐自动分析仪(QuAAtro,SEAL,德国)测定NO3–-N、NO2–-N和NH4+-N含量,TN测定无需过膜。
硝酸盐去除率(NRE)由下式计算得到:
| $ \text{NRE}=\frac{{({\text{NO}}_{3}^{-}\text{-N})}_{inf}-{({\text{NO}}_{3}^{-}\text{-N})}_{eff}}{{({\text{NO}}_{3}^{-}\text{-N})}_{inf}}\times 100\% $ | (1) |
式中,(NO3–-N)inf代表进水水样中硝酸盐的浓度,(NO3–-N)eff代表出水水样中硝酸盐的浓度。
1.4.2 化学需氧量(COD)、溶解有机碳(DOC)和短链脂肪酸(SCFAs)连续实验阶段,每天取样100 mL用于测定水质COD和DOC,在第61、75和90天取样100 mL用来检测SCFAs。COD以《海洋监测规范》(GB17378.4-2007)中的碱性高锰酸钾法为依据进行测定。DOC使用总有机碳分析仪(ASI-V,Shimadzu,日本)进行测定。SCFAs通过气相色谱–质谱联用仪(GCMS QP2010-ULTRA, Shimadzu, 日本)测定,方法参考Chen等(2020)。
SCFAs利用率(ESCFAs)计算如下:
| $ {E_{{\text{SCFAs}}}} = \frac{{{C_1} - {C_2}}}{{{C_1}}} \times 100\% $ | (2) |
式中,C2为第75或90天出水中实测SCFAs浓度;C1是第61天出水中SCFAs浓度。
1.5 微生物群落结构分析实验结束后,取反应器碳源表面的生物膜使用FastDNA® Spin Kit for Soil (MP Biomedicals, 美国)提取基因组DNA。对细菌16S rRNA (V3~V4高变区)基因进行PCR扩增(引物为338F和806R)和纯化并使用quantum™荧光仪(Promega, 美国)进行定量。利用Illumina公司的Miseq PE600平台进行测序(北京百迈客生物科技有限公司)获得原始数据。使用Trimmomatic V0.33对原始数据进行质量过滤,然后使用Cutadapt V1.9.1进行引物序列的识别与去除,其后使用USEARCH V10对双端reads进行拼接并去除嵌合体(UCHIME, V8.1),最终得到高质量的序列用于后续分析。使用USEARCH V10.0在相似性97%的水平上对序列进行聚类,以测序所有序列数的0.005%作为阈值过滤OTUs,使用QIIME2 V2020.6对Silva v138 16S rRNA数据库进行分类分析,分类器置信度为0.7。
1.6 微生物反硝化功能基因丰度分析收集微生物样本用于实时荧光定量PCR (qRT- PCR)。利用ABI PRISM 7300序列检测系统(Applied Biosystems,美国)和ChamQ SYBR Color qPCR Master Mix (2×)进一步评估反硝化菌中功能基因的丰度,包括narG(编码膜结合硝酸盐还原酶)、napA(编码质外硝酸盐还原酶)、nirK(编码含铜亚硝酸盐还原酶)、nirS(编码含血红素亚硝酸盐还原酶)、norB(编码一氧化氮还原酶)和nosZ(编码氧化亚氮还原酶),引物参考Feng等(2023)。qPCR总体积为20 μL,含有10 μL 2× ChamQ SYBR Color qPCR Master Mix (中国南京诺唯赞生物科技有限公司)、2 μL DNA、正向和反向引物各0.8 μL、0.4 μL ROX参比染料Ⅱ(50×),并用无菌ddH2O补充至体积为20 μL。
1.7 分析方法使用Origin 2018软件进行统计和绘图。对于基因丰度和多样性指数,采用SPSS Statistics 26进行单因素方差分析(one-way ANOVA)和t检验(P < 0.05),以检测系统间的显著差异。
2 结果与分析 2.1 INC和温度对脱氮效能的影响 2.1.1 INC对脱氮效能的影响反应器启动前期(0~10 d),系统ENC较高(图 2a),NRE均处于较低水平(图 2b),分别为19.52% (N-20)、32.67% (N-30)和25.28% (N-40)。在10~45 d,随着反应器内碳源表面微生物逐渐生长繁殖和生物膜生成,ENC逐步下降,NRE升高。从11 d开始,N-40的反应器ENC大幅下降,NRE为43.84%,超过N-20 (22.59%)和N-30 (37.80%)。45 d,NRE均到达较高水平,超过了90%,为了系统的稳定性,观察出水情况至60 d。到60 d反应器启动完成后,反应器的出水均降至1 mg/L以下且逐渐保持稳定。在连续实验阶段,3个反应器的ENC均维持在较低水平,平均NRE达到98.68% (N-20)、99.12% (N-30)和98.31% (N-40)。TN的变化与ENC的曲线高度重合(图 2e),变化基本保持一致。
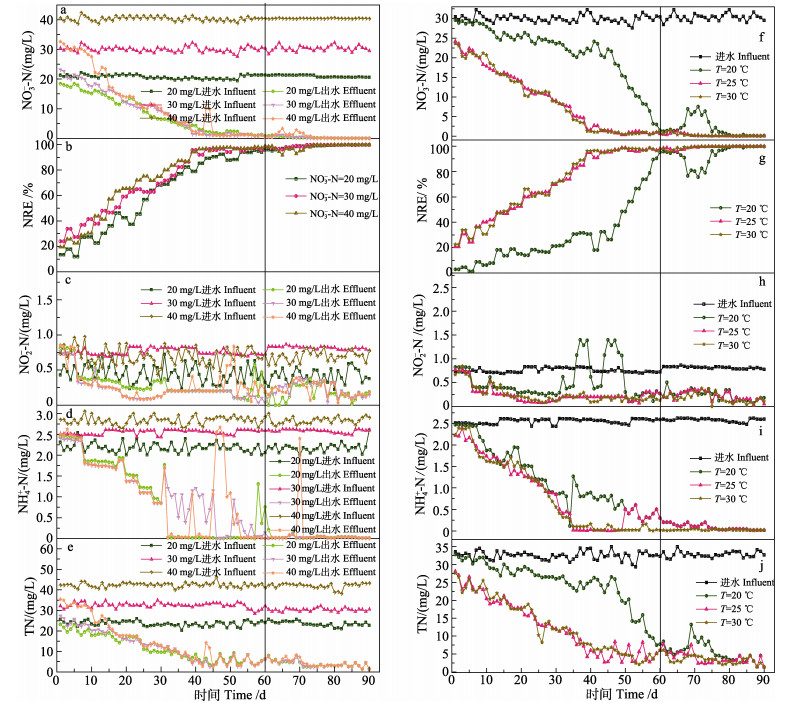
|
图 2 不同INC和温度对脱氮效能的影响实验 Fig.2 Experiment on the effect of different INC and temperature on the efficiency of denitrogenation a、f:进出水NO3–-N浓度;b、g:NRE;c、h:出水NO2–-N浓度;d、i:出水NH4+-N浓度;e、j:进出水TN浓度 a and f: NO3–-N concentration in inlet and outlet water; b and g: NRE; c and h: NO2–-N concentration in effluent; d and i: NH4+-N concentration in effluent; e and j: TN concentration in inlet and outlet water |
在反应器启动初期(1~5 d),出水NO2–-N浓度较高,分别为0.80 mg/L (N-20)、0.74 mg/L (N-30)、0.77 mg/L (N-40)(图 2c)。在5~60 d,出水NO2–-N浓度逐渐下降至0.26、0.18和0.30 mg/L,与NRE有一定的负相关性,随着INC上升,出水NO2–-N浓度也有一定增加。在连续实验阶段(61~90 d),3个反应器的出水NO2–-N均维持在较低浓度,分别为0.17、0.23和0.22 mg/L,未发现明显积累。在1~7 d,NH4+-N的出水浓度较高(图 2d),随着实验推进,浓度逐渐降低,并在连续实验阶段一直维持在较低水平。
2.1.2 温度对脱氮效能的影响第1天,3个系统的ENC均很高(图 2f),且T-20的系统出水NRE仅为2.79% (图 2g),远远低于T-25(20.70%)和T-30(22.50%)系统。在反应器启动阶段(1~60 d),各反应器的ENC逐渐降低,且随着温度升高,硝酸盐去除率也在升高,T-30的反应器的NRE (70.20%)高于T-25 (69.96%)和T-20 (28.63%)。同时可以看出,较低温度下(T=20 ℃),系统的脱氮效率提升较慢,在39 d的NRE才达到30.67%,而同时期其余2组系统均已达到90%以上。在连续实验阶段(61~90 d),各反应器的ENC都维持在较低水平,NRE分别为93.25%(T-20)、99.21% (T-25)和99.24(T-30)。
在启动阶段初期(1~10 d),各系统的出水NO2–-N浓度均较高(图 2h),其中,T-20的反应器出水浓度为0.69 mg/L,远高于T-25 (0.58 mg/L)和T-30 (0.57 mg/L)。随着实验进行,出水NO2–-N浓度逐渐降低,在32~60 d,T-20的反应器内出水NO2–-N浓度出现了较大的波动,一度达到了1.67 mg/L的高浓度,而T-25和T-30的未出现明显波动。在实验后期(61~ 90 d),反硝化速率上升,各反应器的出水NO2–-N浓度均保持在较低浓度,分别为0.24 mg/L (T-20)、0.22 mg/L (T-25)、0.16 mg/L (T-30)。随着实验的进行,各系统的出水NH4+-N浓度呈下降趋势(图 2i),且最终阶段出水浓度非常低,去除率均超过99%。同时发现,在50~90 d,各反应器出水NH4+-N浓度均出现不同程度的波动。TN的变化趋势与ENC相近(图 2j)。
2.2 INC和温度对DOC和COD的影响 2.2.1 INC对DOC和COD的影响在61~64 d,N-20和N-40的反应器变化较为相似,起初的浓度较高(61 d分别为5.89 mg/L和6.21 mg/L),在随后几天出水浓度快速降低。不同的是,在66~79 d,N-20的系统出水DOC浓度出现较大波动(3.2~7.4 mg/L)。随后N-20与N-40的系统均保持在较低出水DOC浓度并缓慢下降。N-30的系统出水比较稳定,未有明显波动,在61 d便降到4.06 mg/L的浓度,之后缓慢下降至1.91 mg/L (90 d)。在整个实验过程中,3个系统的平均出水DOC浓度为4.87 mg/L (N-20)、2.94 mg/L (N-30)、3.34 mg/L (N-40)。
3个系统的出水COD浓度变化趋势相近(图 3b),均经历了先上升再下降的过程,平均出水浓度分别为14.05 mg/L (N-20)、11.64 mg/L(N-30)、12.06 mg/L (N-40)。在连续实验前10 d,各反应器的出水COD浓度均迅速上升,随后逐步下降,其中,N-30的反应器COD浓度下降速率最快。
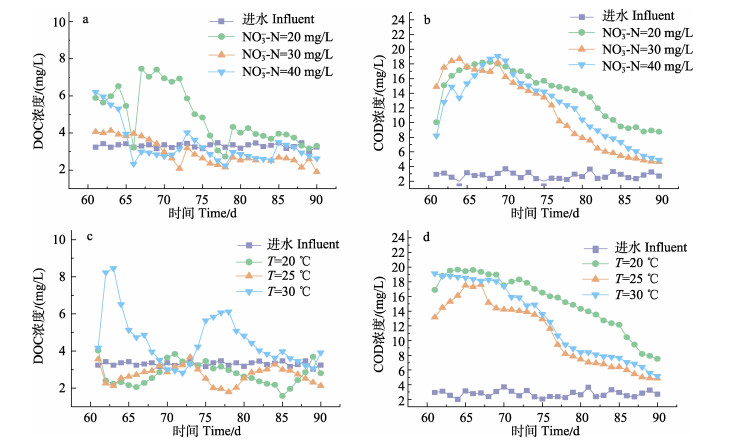
|
图 3 INC和温度对DOC和COD的影响 Fig.3 Effects of INC and temperature on DOC and COD a:INC对DOC浓度的影响;b:INC对COD浓度的影响;c:温度对DOC浓度的影响;d:温度对COD浓度的影响 a: Effects of INC on DOC concentration; b: Effects of INC on COD concentration; c: Effects of temperature on DOC concentration; d: Effects of temperature on COD concentration |
3个反应器的平均出水DOC浓度(图 3c)分别为2.77 mg/L(T-20)、2.71 mg/L(T-25)、4.56 mg/L(T-30),随着实验的进行,出水浓度逐渐减低。T-30的系统出水浓度明显高于另外2个系统且在61~68 d和74~82 d显著超过进水浓度且长时间保持在较高水平,而T-20和T-25反应器的出水除少数几天外皆保有一定的DOC去除率。
各系统的平均出水COD浓度(图 3d)分别为15.4 mg/L(T-20)、11.0 mg/L(T-25)和12.7 mg/L(T-30),均显著大于进水浓度。与INC对DOC和COD的影响类似,T-20和T-25的出水浓度均出现先上升后下降的现象,分别在61~66 d和61~67 d有一段浓度上升时期,而T-30的反应器内出水浓度下降比较平稳。
2.3 INC和温度对SCFAs的影响图 4a展示了不同INC下SCFAs的浓度变化。在第61天,随着INC的升高,各系统出水SCFAs的浓度分别为0.60、0.32和0.30 mg/L,N-20的系统内浓度最高。3个系统的ESCFAs差距较大,在第75天,分别为66.7%(N-20)、68.8%(N-30)和0%(N-40);到90 d,各系统的ESCFAs均降低,分别为50.0%(N-20)、–25.0% (N-30)和–66.7%(N-40)。
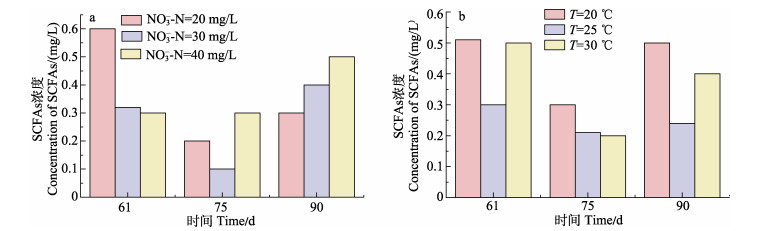
|
图 4 INC(a)和温度(b)对SCFAs影响 Fig.4 Effects of INC (a) and temperature (b) on SCFAs |
在61 d,各系统出水SCFAs浓度分别为0.51 mg/L(T-20)、0.30 mg/L(T-25)和0.50 mg/L(T-30) (图 4b)。在75 d,3个系统的ESCFAs分别为41.2% (T-20)、30.0% (T-25)和60.0%(T-30),T=20 ℃的系统中出现SCFAs积累。到第90天,各系统ESCFAs有所下降,分别下降至2.0%(T-20)、20%(T-25)、20%(T-30)。
表 2展示了不同INC和温度下各类型SCFAs浓度的变化。SCFAs包括乙酸、丙酸、丁酸和其他类型(如异丁酸、戊酸、异戊酸和己酸)。各系统中均未检出丁酸,在75 d和90 d,大多系统均未检出丙酸和其他类型,仅在90 d,T-20和T-30的系统检出低浓度的丙酸。乙酸的占比均最高,其和丙酸最低的浓度比为1.1。
|
|
表 2 出水SCFAs组成及含量 Tab.2 Effluent SCFAs composition and content |
本实验采用Illumina MiSeq高通量测序对实验结束后生物膜中的微生物群落结构进行分析。所有样本的Coverage指数均大于0.99,可以反映菌群的真实状况。ACE指数用来估计群落中含有物种数目,Chao1指数是物种数目丰富度的衡量标准之一,这2个指数越大,物种丰富度越大,二者展现出相似的结果(表 3),N-20和T-20的系统中物种丰度均最低。Shannon和Simpson指数用于衡量物种多样性,受样品群落中物种丰富度和物种均匀度的影响,数值越大,说明样品的物种多样性越高(Grice et al, 2019)。N-20和T-20的系统微生物多样性最低,N-30和T-25的多样性最高。所有的Alpha多样性指数均随着温度升高而下降。
|
|
表 3 菌群结构多样性指数 Tab.3 Microbial diversity index |
3个反应器的样品中共检测到34个门,其中,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、互养菌门(Synergistota)、厚壁菌门(Firmicutes)和弯曲菌门(Campylobacterota)是主要的微生物群落组成(图 5a)。变形菌门为优势菌群,丰度分别54.46%(N-20)、39.96%(N-30)、24.77%(N-40),其丰度随着进水NO3–-N浓度的升高而下降。拟杆菌门也具有较大的丰度占比,从大到小分别为N-30(20.65%)、N-40 (17.82%)、N-20(17.29%)。
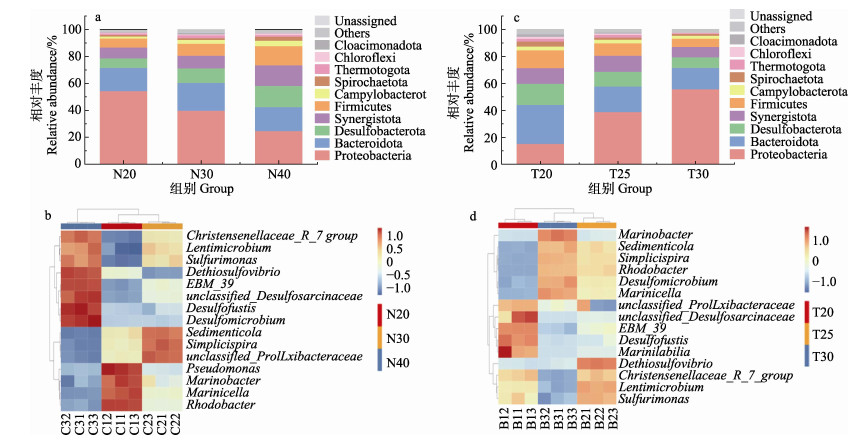
|
图 5 不同INC和温度对微生物群落结构组成的影响 Fig.5 Effects of different INC and temperature on the structural composition of microbial communities a:不同INC条件下门物种分布;b:不同INC条件下属物种分布;c:不同温度条件下门物种分布;d:不同温度条件下属物种分布 a: Distribution of phylum species under different INC; b: Distribution of genus species under different INC; c: Distribution of phylum species under different temperature; d: Distribution of genus species under different temperature |
在属水平上(图 5b),优势属为红细菌属(Rhodobacter),分别占19.53% (N-20)、13.26% (N-30)、10.08% (N-40)。亚优势菌群为海杆菌属(Marinobacter),其丰度为10.05% (N-20)、8.14% (N-30)、6.98% (N-40),该2种菌属的丰度均与进水NO3–-N浓度成反比。海胞菌属(Marinicella)和假单胞菌属(Pseudomonas)也被检出,它们的丰度随INC的升高而降低。
2.4.3 温度对微生物群落结构的影响门水平上的微生物群落结构如图 5c所示。优势菌门为变形菌门和拟杆菌门。T-30和T-25的反应器内变形菌门丰度最高,分别为55.86%和38.85%,拟杆菌门次之。而在T-25的反应器内,拟杆菌门为优势菌群,丰度达到28.87%,高于变形菌门的15.35%。作为反硝化系统中常见的菌门,去磺杆菌门(Desulfobacterota)、厚壁菌门、螺旋体门(Spirochaetota)、绿弯菌门(Chloroflexi)等也被检测到,且它们的丰度均随着温度的升高而下降。
在属水平上(图 5d),3个系统的优势菌属均为红细菌属,其丰度随温度升高而上升,分别为5.83% (T-20)、19.16% (T-25)和21.62% (T-30)。海胞菌属也是常见的反硝化细菌,与红细菌属有相似的变化规律,随温度升高其丰度分别为0.28%、2.75%和4.50%。海杆菌属在各反应器中也有一定的占比,在T=30 ℃时,其为亚优势菌为10.08%,其余丰度较低。温度升高能促进单螺旋体属(Simplicispira)的生长,在T-25系统内,其占比第2 (5.80%)。
2.5 反硝化功能基因丰度分析不同INC下各反应器反硝化功能基因丰度的差异如图 6a所示。INC的变化对narG和nosZ没有显著影响,其余基因在不同INC下有较大的差异。narG、nirS、nosZ的拷贝数比其余功能基因高几个数量级。各功能基因的拷贝数基本满足N-30 > N-20 > N-40的规律。而napA在N-20系统内拷贝数更多,N-40次之,N-30反而最少,但与同样表达硝酸盐还原的narG相比,其丰度较小。在所有系统中,norB的表达量均最低。
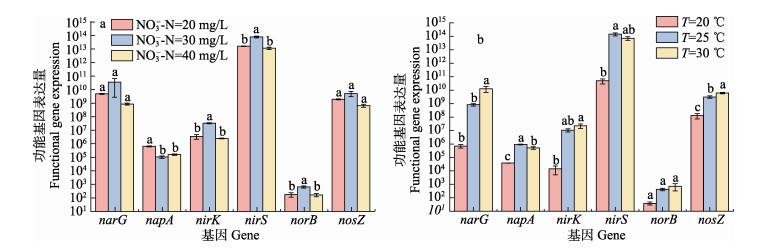
|
图 6 不同INC(a)和温度(b)对反硝化功能基因丰度的影响 Fig.6 Effects of different INC (a) and temperature (b) on the abundance of functional genes for denitrification 不同小写字母表示差异显著(P < 0.05)。 Different lowercase letters indicate significant differences (P < 0.05). |
各功能基因表达量随温度的变化如图 6b所示。NarG、nirS、nosZ的功能基因丰度在系统中占比相对较高。温度变化对norB的表达无显著影响,且表达量较低,其余功能基因受温度影响较大。T=20 ℃时,各功能基因的拷贝数均最低。T=25 ℃和T=30 ℃时,narG、napA、nosZ的拷贝数存在显著差异,其余功能基因均具有相近的表达量。
3 讨论 3.1 INC对反硝化性能的影响INC对脱氮效率有显著影响,浓度升高时,水中的碳氮比降低,碳源释放的碳相对于氮处于非饱和状态,无法为反硝化菌提供足够的电子供体(Ge et al, 2012),导致反硝化不完全出现NO2–-N的积累。在实验前期(0~10 d),随着INC增大,ENC也增大,且N-40的NRE低于N-30。这是因为在该阶段,反应器表面的微生物进行反硝化的能力有限,从而使N-30和N-40的反应器反硝化速率相近,同时,由于反硝化反应不完全,导致中间产物NO2–-N的浓度较高。但在中期(15~60 d),随着反应器表面微生物逐渐生长繁殖和生物膜形成,反硝化能力逐步提升,各组NRE增大,NO2–-N积累降低。而高浓度组由于单位体积内电子供体更多,有效反硝化的NO3–-N也更多,其反硝化速率更快(Wang et al, 2020)。同时发现,在挂膜启动完成后,提升INC对NRE没有明显影响,这与高书伟等(2023)以PCL为碳源的研究结果相似,说明在设置的浓度范围,复合碳源具有足够的处理能力。沈志强等(2014)和李华等(2016)分别对淀粉/PCL共混物和荔枝核/聚乙烯醇复合碳源进行反硝化研究,分别获得97%以上和96.81%的NRE,在连续实验阶段,各反应器的NRE均为98%以上,可以认为以CC+PCL为外加碳源的反硝化系统具有较好的脱氮能力。
3.2 温度对反硝化性能的影响温度也是影响反硝化效果的重要因素,它会影响反硝化菌的代谢速率和酶活性,对微生物群落结构也产生一定影响。在李致远等(2020)的研究中,当温度从18 ℃提高到28 ℃,生物膜成熟更快。而当温度从18 ℃下降到8 ℃,反硝化会被抑制(Li et al, 2016)。本研究中,随着温度升高,ENC逐渐降低,NRE提高,这是因为温度该范围内的上升导致微生物活性上升,生物膜成熟更快,提升了反硝化速率(李致远等, 2020),但温度从25 ℃升高到30 ℃带来的NRE提升并不明显。T-20的系统脱氮效率提升更慢,这与温度对生物膜成熟的影响有关。此外,该温度下NO2–-N浓度出现了2次明显的波动,分别在31~37 d (0.29~1.40 mg/L)和43~49 d (0.43~1.67 mg/L)。可能是此温度下反硝化菌的活性较低,降低了反硝化的速率,反硝化反应不充分,留下了中间产物NO2–-N (Du et al, 2017)。此外,分别在36~53 d和49~59 d,T-20和T-30的反应器出水均出现了NH4+-N浓度的波动,分别从0.80、0.02 mg/L骤升至1.26、0.14 mg/L,这与此时反应器内可能产生的硝酸盐异化还原为铵有关,该反应以NO3–-N为底物生成NH4+-N,同时由于其与反硝化的竞争关系导致反硝化速率下降,此结果也与NRE的变化相对应。课题组前期已开展了单一碳源的研究,CC和PCL都有较高的NRE,在180 h内最高分别达到84.12%和73.26% (Feng et al, 2023),本研究将2种碳源混合使用,在启动完成的180 h内使不同系统的NRE均达到了90%以上(91.00%~99.34%),提升了反硝化性能。
3.3 INC和温度对有机物利用的影响在61~75 d,高浓度和低浓度的INC都会造成较高的出水DOC浓度。在76~84 d,N-20的系统出水DOC出现了较大的波动,这与PCL结晶部分和CC木质纤维素组分的降解有关,这一阶段内的碳源释放DOC有一个增长的过程,且部分附着的微生物脱落,其活性受到影响。而N-30的系统出水DOC浓度下降稳定且迅速,可能是其碳源释放效率高,在系统启动完成前便已经完成了PCL结晶部分和CC木质纤维素组分的降解,达到了溶解平衡状态(周贵忠等, 2008)。N-30的反应器不仅出水浓度低且非常稳定,是较为理想的条件。在61~70 d,各系统的出水COD浓度迅速上升,在此阶段,碳源表面附着的小分子有机物和碳源内部一些脱出的小分子溶解到水溶液中,导致出水浓度上升(Li et al, 2022)。经过短暂的增长之后,反硝化细菌将这些小分子碳源降解,导致COD浓度逐渐降低(Guan et al, 2019)。目前,课题组已经探究了CC和PCL作为单一碳源时的释碳实验(Feng et al, 2023),CC (9.34 mg/g)的平均出水DOC浓度远高于PCL (0.92 mg/g),本实验系统的平均出水DOC浓度为3.54 mg/L,相较于CC出水浓度大幅下降且可为反硝化反应提高充足的碳源。
T-30的系统出水DOC浓度明显高于其他2组,这与微生物对有机碳物质的利用有关,该温度下,碳源降解最快,释放出大量有机物质,系统内微生物通过自身的生长和代谢无法完全利用这些有机碳物质,导致DOC的积累,而20 ℃和25 ℃的温度较为适宜。T-20和T-25的出水COD浓度均出现先上升后下降的现象,在此阶段,碳源表面的一些小分子和内部的结晶快速降解到水中,导致浓度上升,随后在微生物的分解下,出水浓度逐渐下降至较低水平。T-30的反应器内出水浓度下降比较平稳,可能是较高温度下碳源释放效率高,在连续实验阶段开始前(0~60 d),碳源已完成了表面小分子及易溶解有机组分的降解,进入了溶解平衡状态,COD释放较为稳定(周贵忠等, 2008)。
农业废弃物作为反硝化碳源时会通过产酸发酵分解产生乙酸、丙酸和丁酸等SCFAs (Atasoy et al, 2018)。与传统的外加有机物相比,SCFAs已被证明是能被微生物直接利用的碳源且释放缓慢,具有较高的利用率和反硝化速率(Liu et al, 2020a)。在反应器启动完成后,随着INC增大,SCFAs浓度降低,这可能是因为PCL+CC产生足够被反硝化反应利用的SCFAs,当INC较低时(20 mg/L),SCFAs含量超出可被微生物利用的量,致使利用量降低,存在SCFAs浪费的问题(Liu et al, 2020b)。而INC浓度较高(40 mg/L)时,碳氮比低,电子供体不足使得SCFAs未被完全利用,90 d时系统内出现了SCFAs的积累(Zhang et al, 2016),N-40后期NRE产生波动的现象也证明了这一结果。此外,与75 d相比,各系统90 d的ESCFAs都在下降,Li等(2022)研究发现,长期运行后,CC的脱氮性能会变差,从侧面解释了这一点,而PCL的高效脱氮可以持续270 d以上(Chu et al, 2013),推测在实验后期(75~90 d),反硝化碳源的释放由PCL主导。
乙酸主要为CC释放产生,已有研究发现,CC释放的SCFAs中乙酸最高可占60.19%,而丁酸含量则极低,当乙酸作为外加碳源时产生乙酰辅酶A,可直接被微生物利用在三羧酸循环中产生能量,是SCFAs中最易利用的类型(Li et al, 2022),各系统中乙酸的高占比表明碳源释放的有机物质可被微生物高效利用。高浓度丁酸对硝酸盐的去除存在抑制(Chen et al, 2017),各系统均未检出丁酸,保证了反硝化高效进行。此外,丙酸的浓度还与NO2–-N的积累有关,在Chen等(2017)的研究中,乙酸/丁酸≤1时会产生大量的NO2–-N积累,本系统产生的SCFAs中乙酸/丁酸最小为1.1,不产生明显积累。
3.4 微生物群落结构和功能基因丰度分析在各系统中,N-30系统的微生物群落具有最高的Alpha多样性,表明该浓度下具有更高的物种丰富度和多样性,该结果与N-30优秀的反硝化性能相对应。各系统中的优势菌门均为变形菌门,该类细菌具有降解多种有机物的作用。拟杆菌门也被大量检测到,且在N-30系统中丰度最大,它的主要作用是分解蛋白质、纤维素和纤维等大分子物质(Nakasaki et al, 2009)。这2门细菌常常在污水处理系统中主导反硝化进程(Chu et al, 2016; Feng et al, 2017),它们的高占比决定了该复合碳源反硝化的高效性。在属水平上,优势菌属为红细菌属,养殖水体中添加碳源对红细菌属有富集作用,其为水产养殖动物肠道的核心定殖菌群,可利用多种有机物为碳源进行异养代谢反应,起到降低水体中COD的作用(高繁等, 2022),Foesel等(2011)也曾在海水循环水养殖的生物滤池中分离出红细菌属。亚优势菌属为海杆菌属,这2种菌属的丰度均与INC成反相关。在这些细菌的共同作用下系统具有高效的反硝化能力。
本研究中,随着温度升高,微生物的多样性和种群丰度均增大,与污水处理得到的结论一致(康小虎等, 2020)。在T-20和T-30的系统内,优势菌门为变形菌门,而在T=20 ℃时,优势菌门为拟杆菌门。变形菌门在反硝化过程中占主导地位,拟杆菌门也常在高处理能力的反硝化系统中检出,这2门菌群在不同温度下的差异可以解释高温条件下NRE高而低温条件下出水DOC浓度低的问题。此外,部分种的去磺杆菌可以利用挥发性脂肪酸等物质,螺旋体门可以加快有机物向反硝化所需碳源的转变,厚壁菌门和绿弯菌门被认为有着分解大分子的能力(Nakasaki et al, 2009),温度的改变对这些微生物都有着不同程度的影响从而体现在反硝化的结果上。属水平上,优势菌属为红细菌属,该细菌还有还原硝酸盐、亚硝酸盐和一氧化二氮的功能,其丰度与温度成正相关,可以解释T-20的反应器出水亚硝酸盐积累的问题。Simplicispira为完全缺氧和好氧反硝化菌,T=20 ℃时其丰度减少导致反硝化性能变差。
NarG、nirS和nosZ的高表达量有利于发挥还原NO3–-N、NO2–-N的重要作用。各功能基因的拷贝数基本满足30 mg/L>20 mg/L>40 mg/L的规律,说明在N-30的条件下更有利于反硝化的进行。NapA在N-20的高表达数与变形菌门的丰度最大对应,其在N-20的反应器内的占比明显高于其余系统,据报道称napA基因与来自γ-Proteobacteria的基因具有高度的序列同一性(Flanagan et al, 1999)。N-30的反应器内各功能基因的表达量高,而过高的浓度(40 mg/L)会抑制各功能基因的表达。T-20的功能基因表达量均最低,适当升高温度有利于各功能基因的表达,这与T-20反应器较低的NRE,较高的NH4+-N、NO2–-N浓度相符合。T-25和T-30的系统内功能基因除narG、napA、nosZ外均无显著差异,因此,它们具有相近的反硝化能力。
4 结论进水硝酸盐浓度(INC)和温度都是反硝化的重要影响因素。在系统启动前期,过高的INC不利于反硝化系统的运行。在反应器启动后,改变INC对反硝化的影响不明显,硝酸盐去除率(NRE)最低为97.62%,N-30和N-40系统表现的反硝化性能和有机物利用能力相近,推测聚己内酯(PCL)和玉米芯(CC)的复合碳源可以承载更高的进水INC负荷,对该碳源的最大脱氮能力为之后研究的重点。在一定区间内,温度的提升能带来反硝化性能的增强。本研究中,最佳温度条件25 ℃时,具有较高的NRE和有机物利用率。INC和温度的改变都会造成微生物群落结构的变化。INC初期通过影响碳氮比改变优势菌群种类与丰度,进而改变微生物群落结构及其多样性,最终表现出反硝化效率的不同,但INC影响在反应器启动过后无显著差异,NRE均维持在97%以上。温度会影响微生物的生长繁殖,从而改变菌群的丰度和群落的多样性,进而造成反硝化性能的差异,但在一定区间内温度改变带来的影响较小,如25 ℃ (99.21%)和30 ℃(99.23%)的NRE相近。PCL+CC的复合碳源克服了PCL成本过高以及CC释放前期出水溶解有机碳浓度过高的劣势,且具有较高的反硝化效率,能为海水循环水养殖尾水固相反硝化的工艺优化提供理论依据。
ATASOY M, OWUSU-AGYEMAN I, PLAZA E, et al. Bio-based volatile fatty acid production and recovery from waste streams: Current status and future challenges. Bioresource Technology, 2018, 268: 773-786 DOI:10.1016/j.biortech.2018.07.042 |
BUSSEL V G C, SCHROEDER P J, WUERTZ S, et al. The chronic effect of nitrate on production performance and health status of juvenile turbot (Psetta maxima). Aquaculture, 2011, 326: 163-167 |
CHEN H, LIU S, LIU T, et al. Efficient nitrate removal from synthetic groundwater via in situ utilization of short-chain fatty acids from methane bioconversion. Chemical Engineering Journal, 2020, 393: 124594 DOI:10.1016/j.cej.2020.124594 |
CHEN Y, GUO L, ZHANG J, et al. Interaction of short-chain fatty acids carbon source on denitrification. Environmental Technology, 2017, 38(15): 1915-1925 DOI:10.1080/09593330.2016.1240714 |
CHU L, WANG J. Denitrification of groundwater using PHBV blends in packed bed reactors and the microbial diversity. Chemosphere, 2016, 155: 463-470 DOI:10.1016/j.chemosphere.2016.04.090 |
CHU L, WANG J. Denitrification performance and biofilm characteristics using biodegradable polymers PCL as carriers and carbon source. Chemosphere, 2013, 91(9): 1310-1316 DOI:10.1016/j.chemosphere.2013.02.064 |
CUI H, FENG Y, YIN Z, et al. Organic carbon release, denitrification performance and microbial community of solid-phase denitrification reactors using the blends of agricultural wastes and artificial polymers for the treatment of mariculture wastewater. Ecotoxicology and Environmental Safety, 2023, 255: 114791 DOI:10.1016/j.ecoenv.2023.114791 |
DAVIDSON J, GOOD C, WILLIAMS C, et al. Evaluating the chronic effects of nitrate on the health and performance of post-smolt Atlantic salmon Salmo salar in freshwater recirculation aquaculture systems. Aquacultural Engineering, 2017, 79: 1-8 DOI:10.1016/j.aquaeng.2017.08.003 |
DU R, CAO S, LI B, et al. Performance and microbial community analysis of a novel DEAMOX based on partial-denitrification and anammox treating ammonia and nitrate wastewaters. Water Research, 2017, 108: 46-56 DOI:10.1016/j.watres.2016.10.051 |
FENG L, CHEN K, HAN D, et al. Comparison of nitrogen removal and microbial properties in solid-phase denitrification systems for water purification with various pretreated lignocellulosic carriers. Bioresource Technology, 2017, 224: 236-245 DOI:10.1016/j.biortech.2016.11.002 |
FENG Y, WANG L, YIN Z, et al. Comparative investigation on heterotrophic denitrification driven by different biodegradable polymers for nitrate removal in mariculture wastewater: Organic carbon release, denitrification performance, and microbial community. Frontiers in Microbiology, 2023, 14: 1141362 DOI:10.3389/fmicb.2023.1141362 |
FLANAGAN D, GREGORY L, CARTER J, et al. Detection of genes for periplasmic nitrate reductase in nitrate respiring bacteria and in community DNA. FEMS Microbiology Letters, 1999, 177(2): 263-370 DOI:10.1111/j.1574-6968.1999.tb13742.x |
FOESEL B U, DRAKE H L, SCHRAMM A. Defluviimonas denitrificans gen. nov., sp. nov., and Pararhodobacter aggregans gen. nov., sp. nov., non-phototrophic Rhodobacteraceae from the biofilter of a marine aquaculture. Systematic and Applied Microbiology, 2011, 34(7): 498-502 DOI:10.1016/j.syapm.2011.08.006 |
GAO F, GAN E L, LIU W, et al. Screening of carbon sources for enrichment and directional isolation of Rhodobacteraceae from the gut of Litopenaeus vannamei. Acta Microbiologica Sinica, 2022, 62(5): 1805-1818 [高繁, 干恩磊, 刘巍, 等. 凡纳滨对虾肠道红杆菌科细菌富集碳源筛选及其定向分离. 微生物学报, 2022, 62(5): 1805-1818] |
GAO S W, ZHANG K, LI Z F, et al. Investigation of the performance of solid phase denitrification under different hydraulic retention times and influent nitrate concentration using banana stalk as a carbon source. Progress in Fishery Sciences, 2023, 44(3): 23-36 [高书伟, 张凯, 李志斐, 等. 不同水力停留时间和进水硝酸盐浓度下香蕉杆为碳源的固相反硝化性能研究. 渔业科学进展, 2023, 44(3): 23-36] |
GE H H, ZHU S C, LIU C X, et al. Current situation and research progress of denitrifying filter with natural cellulose substances. Environmental Science and Technology, 2019, 32(6): 71-75 [葛海华, 朱守超, 刘春晓, 等. 基于天然纤维素材质滤料的反硝化滤池脱氮现状及研究进展. 环境科技, 2019, 32(6): 71-75] |
GE S, PENG Y, WANG S, et al. Nitrite accumulation under constant temperature in anoxic denitrification process: The effects of carbon sources and COD/NO3–-N. Bioresource Technology, 2012, 114: 137-143 DOI:10.1016/j.biortech.2012.03.016 |
GRICE E A, KONG H H, et al. Topographical and temporal diversity of the human skin microbiome. Science, 2009, 324(5931): 1190-1192 DOI:10.1126/science.1171700 |
GUAN X, JI G, XU S, et al. Selection of agricultural straws as sustained-release carbon source for denitrification in a drawer-type biological filter. Water, Air, and Soil Pollution, 2019, 230(1): 1-11 DOI:10.1007/s11270-018-4051-3 |
KANG X H, LEN Y, ZENG X Y, et al. Review on activated sludge microbial community in sewage treatment. Environmental Science and Technology, 2020, 43(5): 49-54 [康小虎, 冷艳, 曾小英, 等. 污水处理活性污泥微生物群落研究进展. 环境科学与技术, 2020, 43(5): 49-54] |
LI C, WANG H, YAN G, et al. Initial carbon release characteristics, mechanisms and denitrification performance of a novel slow release carbon source. Journal of Environmental Sciences, 2022, 118(8): 32-45 |
LI H, ZHOU Z M, LIU Q S, et al. Denitrification of porous composite semen litchi/PVA solide carbon source in aquaculture wastewater. Technology of Water Treatment, 2016, 42(9): 51-55 [李华, 周子明, 刘青松, 等. 荔枝核-PVA多孔复合固体碳源在养殖废水中的脱氮研究. 水处理技术, 2016, 42(9): 51-55] |
LI P, ZUO J, WANG Y, et al. Tertiary nitrogen removal for municipal wastewater using a solid-phase denitrifying biofilter with polycaprolactone as the carbon source and filtration medium. Water Research, 2016, 93: 74-83 DOI:10.1016/j.watres.2016.02.009 |
LI Z Y, FAN J Z, LIU Y, et al. Effect of HRT and temperature on the start of biological fluidized bed (BFB) for purification of marine aquaculture wastewater. Journal of Liaoning Shihua University, 2020, 40(1): 10-14 [李致远, 范继泽, 刘鹰, 等. HRT和温度对BFB净化海水养殖废水的启动影响. 辽宁石油化工大学学报, 2020, 40(1): 10-14] |
LIU W, YANG H, YE J, et al. Short-chain fatty acids recovery from sewage sludge via acidogenic fermentation as a carbon source for denitrification: A review. Bioresource Technology, 2020a, 311: 123446 DOI:10.1016/j.biortech.2020.123446 |
LIU Y, LAI S Y, RITTMANN E B. Increased anode respiration enhances utilization of short-chain fatty acid and lipid wet-extraction from Scenedesmus acutus biomass in electro-selective fermentation. Renewable Energy, 2020b, 148: 374-379 DOI:10.1016/j.renene.2019.10.043 |
NAKASAKI K, IDEMOTO Y, ABE M, et al. Comparison of organic matter degradation and microbial community during thermophilic composting of two different types of anaerobic sludge. Bioresource Technology, 2009, 100(2): 676-682 DOI:10.1016/j.biortech.2008.07.046 |
SHEN Z Q, ZHOU Y X, WANG J L. Denitrification using Starch/PCL blends as solid carbon source and biofilm carrier. Journal of Environmental Engineering Technology, 2014, 4(2): 129-134 [沈志强, 周岳溪, 王建龙. 利用淀粉/PCL共混物作为反硝化固体碳源和生物膜载体的研究. 环境工程技术学报, 2014, 4(2): 129-134] |
VAN DUC L, SONG B, ITO H, et al. High growth potential and nitrogen removal performance of marine anammox bacteria in shrimp-aquaculture sediment. Chemosphere, 2018, 196: 69-77 DOI:10.1016/j.chemosphere.2017.12.159 |
WANG H Y, HOU H C, LIU Y. Research progress and development trending recirculating aquaculture system. Fisheries Science, 2023, 42(4): 735-741 [王海姮, 侯昊晨, 刘鹰. 循环水养殖系统的研究进展及发展趋势. 水产科学, 2023, 42(4): 735-741] |
WANG J, MA R, GUO Z, et al. Experiment and multicomponent model based analysis on the effect of flow rate and nitrate concentration on denitrification in low-permeability media. Journal of Contaminant Hydrology, 2020, 235: 103727 DOI:10.1016/j.jconhyd.2020.103727 |
YANG Z, ZHOU Q, SUN H, et al. Metagenomic analyses of microbial structure and metabolic pathway in solid-phase denitrification systems for advanced nitrogen removal of wastewater treatment plant effluent: A pilot-scale study. Water Research, 2021, 196: 117067 DOI:10.1016/j.watres.2021.117067 |
ZHANG Y, WANG C X, CHENG Z, et al. Effect of fermentation liquid from food waste as a carbon source for enhancing denitrification in wastewater treatment. Chemosphere, 2016, 144: 689-696 DOI:10.1016/j.chemosphere.2015.09.036 |
ZHOU G Z, SUN J, ZHANG X, et al. Carbon source study on biological denitrification in groundwater. Environmental Science and Technology, 2008, 31(7): 4-6 [周贵忠, 孙静, 张旭, 等. 地下水生物反硝化碳源材料研究. 环境科学与技术, 2008, 31(7): 4-6] |
ZHU Q R, CAO J S, ZHANG T, et al. Research progress of traditional and alternative carbon sources for denitrification in wastewater treatment plants. Applied Chemical Industry, 2021, 50(6): 1600-1606 [朱启荣, 操家顺, 张腾, 等. 污水厂反硝化传统及可供替代碳源研究进展. 应用化工, 2021, 50(6): 1600-1606] |



