2. 浙江省海洋水产养殖研究所 浙江省近岸水域生物资源开发与保护重点实验室 浙江 温州 325005;
3. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室 上海 201306
2. Zhejiang Key Laboratory of Exploitation and Preservation of Coastal Bio-Resource, Zhejiang Mariculture Research Institute, Wenzhou 325005, China;
3. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education; Shanghai Ocean University, Shanghai 201306, China
坛紫菜(Pyropia haitanensis)是我国特有的紫菜栽培品种,主要栽培于浙江、福建和广东沿海地区,其产量约占全国紫菜总产量的75% (曾呈奎等, 1985)。至今大规模人工栽培的紫菜品种仍是以自留种为主,且出现了明显的种质退化、产量和质量下降等现象,培育紫菜新种质仍是产业发展的重要需求。色彩突变是紫菜生活史中发生的一种特殊的生物学现象,对紫菜色彩突变体进行遗传学分析,不仅有助于掌握紫菜的基本遗传规律,还可以为紫菜良种培育提供重要的遗传资源。
目前,紫菜的色彩突变体主要通过诱变途径获得(Yan et al, 2000),最广泛应用的诱变剂为化学诱变剂甲基硝基亚硝基胍(MNNG)(Yan et al, 2004)和物理诱变剂γ射线(Lee et al, 2018a; Wang et al, 2000)。利用MNNG对条斑紫菜(P. yezonensis)、坛紫菜等生活史中各阶段的藻体,如丝状体(王金锋等, 2007; Li et al, 2008)、壳孢子萌发体(李琳等, 2006)、叶状体(Lee et al, 2018a; 严兴洪等, 2009)等进行诱变处理,成功地获得了大量的色彩突变体。采用60Co-γ射线分别对条斑紫菜叶状体和长紫菜(P. dentata)壳孢子萌发体进行诱变、分离并获得了多个色彩突变体(Lee et al, 2018b; 严兴洪等, 2009)。虽然,以上诱变剂都具有良好的诱变效果,但化学诱变剂对操作者有一定的污染风险,操作安全性低,存在二次污染的问题。物理诱变剂60Co-γ虽不存在化学诱变剂的实验操作问题,但仅适用于具有一定生物量的实验材料(叶状体和丝状体),不宜用于对微观孢子和原生质体等进行诱变。而紫外线辐射诱变具有无污染、设备简单、易于操作、成本低等优点(何培民等, 2007; Ding et al, 2020; 潘雪等, 2020)。波长范围为100~275 nm的短波紫外线(UV-C)可以解除生命体DNA和蛋白质之间的交联,使DNA链断裂形成嘧啶二聚体,从而导致基因突变(Elliott et al, 2001)。利用人工制备的UV-C光源不仅可以用于日常生活中的杀菌消毒,且UV-C辐照对植物和微生物具有较好的诱变效果(Pfendler et al, 2021; Slatinskaya et al, 2018; Jeon et al, 2018; Rezzan et al, 2014)。戴继勋等(1990)和严兴洪(1992)研究表明,利用紫外线辐照条斑紫菜和坛紫菜的原生质体,可以获得形态变异体和红色变异体。过去藻类学主要对紫菜原生质体、丝状体和叶状体等进行诱变(严兴洪等, 2000; 张倩等, 2019; 赵爽等, 2019; 陈昌生等, 2008),却鲜有对壳孢子进行诱变的研究报道。在坛紫菜世代交替的生活史中,壳孢子萌发初期是双倍丝状体(2n)转变成单倍叶状体(n)的关键发育阶段,也是减数分裂的发生时期,所产生的四分体是经过遗传重组后的产物,因此,这个发育转化过程产生的四分子细胞排列变化将决定后续叶状体的发育趋向(Ohme et al, 1986; Zhang et al, 2013)。基于此背景,对萌发初期的坛紫菜壳孢子进行诱变处理,极大地增加基因突变频率,且易于获取更多的遗传重组表型,这将不同于诱变叶状体产生的点状突变色块,也容易获得诱变出来的突变细胞。本研究采用短波紫外线(λ=254 nm)辐照坛紫菜壳孢子,以期获得具有色彩变异的壳孢子萌发体,并从色彩嵌合体分离出单色叶状体,为丰富坛紫菜诱变育种技术途径提供科学基础。
1 材料与方法 1.1 实验材料本研究所用坛紫菜野生型品系采自福建省平潭岛自然岩礁上,于2017年利用单性生殖技术建立遗传纯系,以自由丝状体的形式保存在实验室内。保存条件:温度为(23±1) ℃, 光照强度为4 μmol photons/(m2·s),光周期为10L︰14D,每半年更换1/2的MES培养液。
采用小型粉碎机将一定生物量的自由丝状体切碎成约100 μm的藻丝,将其接种到灭菌的贝壳表面。黑暗处理3 d后,将接种的贝壳转移至温度为(23±1) ℃、光照强度为5 μmol photons/(m2·s)、光周期为10L︰14D的条件下培养。培养10 d后,清洗贝壳表面上多余的自由丝状体,及时更换新鲜培养液,将光照强度提高到20 μmol photons/(m2·s),其他培养条件不变。培养数周后,当整个贝壳表面呈红紫色时,将培养温度提高到(28±1) ℃,同时,把光照强度低降到10 μmol photons/(m2·s),光周期为10L︰14D。数周后,当贝壳表面长出膨大藻丝时,取1~2个成熟的贝壳丝状体放入含有150 mL培养液和数根尼龙绳单丝的烧杯(250mL)中进行充气培养(Zhong et al, 2019),培养温度为(24±1) ℃,光照强度为40 μmol photons/(m2·s)。当镜检尼龙绳单丝上附着一定数目的壳孢子后,将放散的壳孢子经过100目尼龙筛绢滤去杂质后,利用细胞漏斗收集到250 mL烧杯内以供诱变实验。
1.2 紫外线诱变和色彩突变体的分离将收集到的坛紫菜壳孢子悬浮液摇晃均匀,悬浮液中壳孢子的密度在10×20倍显微镜下每个视野约有20个壳孢子为宜,平均置于24个培养皿(Φ=9 cm)中,培养皿内孢子液水层高度约为2 mm。采用短波紫外灯管作为辐照源,使用LS126C型紫外照度计测量UV-C辐射强度(425 μW/cm2),按照公式:辐照剂量(J/m2)=辐照时间(s)×辐照强度(W/m2),分别设置辐照剂量为0 (对照组)、50、100、200、300、400、500和600 J/m2,每个剂量组设置3个平行组。经辐照过的壳孢子在黑暗条件下静置培养3 d,再转移至白光下继续培养7 d,统计每组壳孢子存活数目和萌发数目。培养条件:温度为(23±1) ℃,光照强度为30 μmol photons/(m2·s),光周期为10L︰14D。在相同条件下,将壳孢子萌发体继续培养7 d,再统计发生色彩变异的壳孢子萌发体数目。再继续培养7 d,随机抽取30个样本,测定各实验组壳孢子萌发体的长度和宽度,计算其长宽比值。使用Leica DMi8倒置显微镜(德国)观察壳孢子萌发和生长过程中的细胞形态变化,整个培养期为35 d。将色彩突变嵌合叶状体进行酶解处理,制备体细胞单离细胞,经培养后发育成再生叶状体(Zhang et al, 2011),且参照色名字典对色彩变异体分别命名(Wada, 1956)。
1.3 数据分析壳孢子的存活率、萌发率、突变率的计算公式如下:
| $\text {存活率(survival rate, } \%, \mathrm{SR})=D_1 / D_0 \times 100 \%$ |
| $\text {萌发率(germination rate, } \%, \mathrm {GR})=D_2 / D_0 \times 100 \%$ |
| $\text {突变率(mutation rate, } \%, \mathrm{MR})=D_3 / D_2 \times 100 \%$ |
式中,D0为实验开始时坛紫菜壳孢子的数目,D1为黑暗培养3 d后存活的壳孢子数目。D2为光照培养7 d后的壳孢子萌发体数目,D3为实验结束时发生色彩突变的壳孢子萌发体数目。
采用Excel 2010软件进行实验数据的统计,使用IBM SPSS 20软件对实验数据进行差异显著性分析,所有实验数据进行单因素方差分析(one-way ANOVA)检验,设置差异水平为P<0.05,统计值采用平均值±标准差(Mean±SD)表示,所有图表使用Origin 9.0软件制作。
2 结果 2.1 坛紫菜壳孢子的存活率(SR)与萌发率(GR)UV-C辐照对坛紫菜壳孢子有不同程度的致死效应。辐照后,各组壳孢子SR均低于对照组(图 1)。低剂量(50和100 J/m2)的UV-C辐照对壳孢子萌发有一定的促进作用,当辐照剂量超过100 J/m2时,GR呈下降趋势,且随着辐照剂量增加,壳孢子的SR明显下降,当辐照剂量达到600 J/m2时,少有壳孢子萌发,且壳孢子SR最低(图 1)。UV-C辐照剂量为300 J/m2时,恢复正常光照培养3 d后,可以观察到部分壳孢子出现萎缩,色素减淡和细胞解体(图 2a),再经正常光照培养7 d后,少部分壳孢子则发育成双细胞的细胞团(图 2b),最后经正常光照培养7 d后,少部分壳孢子发育成正常的幼苗(图 2c)。
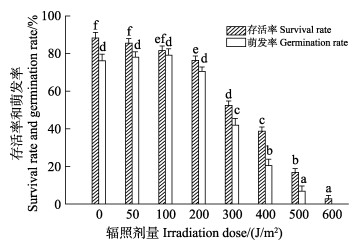
|
图 1 不同剂量UV-C辐照下壳孢子的存活率和萌发率 Fig.1 Survival rate and germination rate of conchospores under different doses of UV-C irradiation 柱形图上方字母不同表示差异显著(P<0.05)。 Different letters on the top of the columns indicate significant differences (P<0.05). |
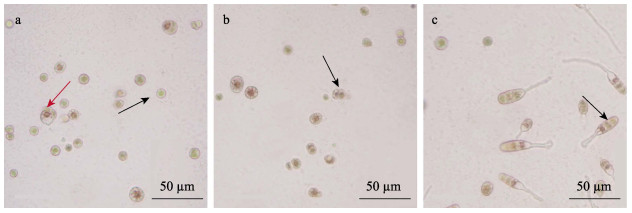
|
图 2 UV-C辐照后坛紫菜壳孢子的萌发 Fig.2 Germination of conchospores of P. haitanensis after UV-C irradiation a:UV-C辐照后,部分壳孢子呈现正常的色素体(红色箭头),但大量壳孢子色素体减淡、细胞萎缩或死亡(黑色箭头);b:UV-C辐照后,出现双细胞团(黑色箭头);c:在UV-C辐照后,壳孢子发育成正常的幼苗(黑色箭头)。 a: After UV-C irradiation, a few conchospores with normal chromatophores (red arrow), but a large number of conchospores with light colored chromatophores shrinked in shape or died (black arrow); b: Two-celled clusters appeared after UV-C irradiation (black arrow); c: Conchospores developed into normal germlings after UV-C irradiation (black arrow). |
辐照剂量在100~600 J/m2范围内,随着UV-C辐照剂量的增加,壳孢子萌发体死亡率(death rate,DR,%)呈上升趋势,辐照剂量为600 J/m2时,壳孢子几乎全部死亡(DR为97.65%)。以色彩变异作为突变性状进行统计,在辐照剂量为50~400 J/m2时,色彩嵌合的壳孢子萌发体的频率(MR)随着UV-C辐照剂量的增加呈上升的趋势;UV-C辐照剂量超过400 J/m2时,MR则呈下降趋势;UV-C辐照剂量达到500 J/m2时,MR最低。当UV-C辐照剂量为300和400 J/m2时,MR达到较大值,分别为15.22%和17.18%,二者之间无显著差异(P>0.05),但与其他实验组相比差异显著(P<0.05) (表 1)。
|
|
表 1 紫外线辐照对坛紫菜壳孢子的诱变效果(平均值±标准差, n =3) Tab.1 Mutagenic effect of UV-C irradiation on conchospores of P. haitanensis (Mean±SD, n =3) |
经不同剂量UV-C照射后,存活的壳孢子所产生的萌发体在恢复光照培养21 d后发育成叶状体。与对照组相比,100~600 J/m2剂量组叶状体的长宽比存在显著差异(P<0.05),且高剂量(300~600 J/m2)辐照组的叶状体长宽比显著下降(表 1)。与此同时,观察了UV-C辐照对壳孢子所产生的壳孢子萌发体的形态变化。结果显示,对照组壳孢子萌发体始终保持正常的披针形状(图 3a)。但在UV-C辐照后恢复光照正常培养14 d,壳孢子萌发体的颜色和形态明显发生变化(图 3b~f),壳孢子萌发体的顶端细胞出现滞育现象(图 3g~l)。
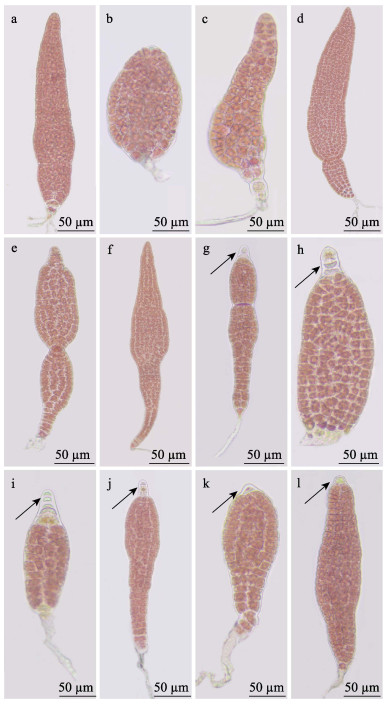
|
图 3 壳孢子萌发体形态和顶端细胞的滞育 Fig.3 Cell morphology and apical diapause of conchospore germlings a:发育正常的壳孢子萌发体;b~f:形态异常的壳孢子萌发体;g~l:顶端细胞滞育(箭头)的壳孢子萌发体。 a: Normally developed conchospore germlings; b~f: Abnormally shaped conchospore germlings; g~l: Apical diapaused cells (arrow) of conchospore germlings. |
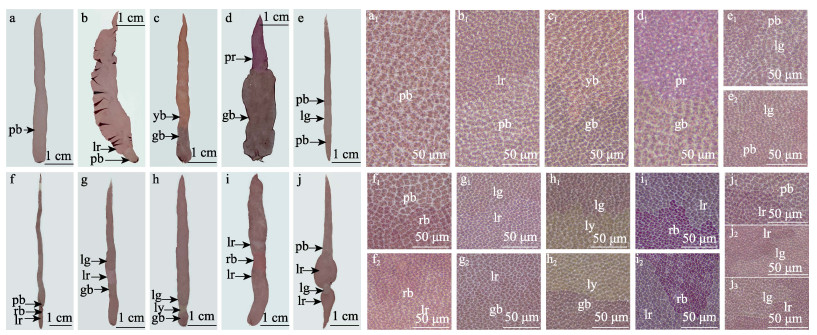
不同剂量UV-C辐照密度为104个/mL的壳孢子后产生的壳孢子萌发体中均出现嵌合色块,而对照组未出现(图 4),说明色彩突变体是由UV-C辐照诱导所产生的。出现色彩突变的嵌合叶状体以2色块嵌合体和3色块嵌合体居多,4色块嵌合体最少(图 5)。组成嵌合叶状体色块的颜色主要有紫褐色、红褐色、黄褐色、浅红色等,其中,除紫褐色为正常苗体的颜色外,突变色块中以黄褐色出现的频率最高,其次为灰棕色,而紫红色和浅绿色则出现频率最低。在辐照强度为50~500 J/m2范围内,随着辐照强度的增加,叶状体上出现色素突变细胞块的数目呈先增高后降低的趋势,辐照强度为300和400 J/m2时,颜色突变的数量最多,表明这2个诱变剂量是诱导坛紫菜壳孢子产生色彩突变的嵌合叶状体有效的辐照强度(表 1和表 2)。在恢复光照培养35 d后,大部分叶状体仍能正常发育,呈现单一的紫褐色(图 6a)。然而,各实验组发生色彩突变的嵌合叶状体中出现的2色块嵌合体占50%以上(图 5、图 6b~d)。

|
图 4 四分子发生色彩突变的壳孢子萌发体 Fig.4 Apparent pigmentation mutants of tetrads in conchospore germlings a:发育正常的壳孢子萌发体;b~p:色彩突变色块线性排列于嵌合壳孢子萌发体。 a: Normally developed conchospore germlings; b~p: Apparent sectored pigmentation mutants linearly arranged in conchospore germlings. |
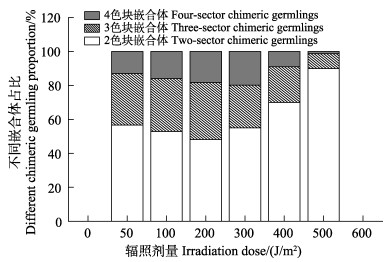
|
图 5 不同色彩嵌合体的比例 Fig.5 Proportions of different chimeric germlings |
|
|
表 2 壳孢子经不同剂量UV-C辐照后培养35 d后产生的嵌合叶状体中出现颜色突变的类型和数量 Tab.2 Types and numbers of color mutations in chimeric blades produced by conchospores irradiated with different doses of UV-C for 35 days |
|
图 6 UV-C辐照壳孢子产生色彩突变的嵌合叶状体 Fig.6 Pigmentation mutations in chimeric thallus developed from conchospores irradiated with UV-C a:正常发育的单色叶状体;b~d:两色块嵌合叶状体;e~i:三色块嵌合叶状体;j:四色块嵌合叶状体。pb:紫褐色;rb:红褐色;yb:黄褐色;pr:紫红色;lr:浅红色;ly:浅黄色;lg:浅灰色;lg:浅绿色;gb:灰棕。 a: Normally developed blades with single color; b~d: 2-color sectors; e~i: 3-color sectors; j: 4-color sectors. pb: Purple brown; rb: Red brown; yb: Yellow brown; pr: Purple red; lr: light red; ly: Light yellow; lg: Light gray; lg: Light green; gb: Gray brown. |
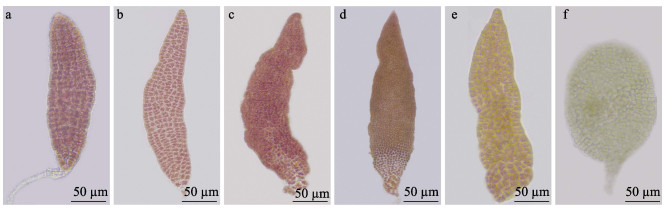
将含有7种不同色彩突变色块的嵌合叶状体各选取1株进行酶解,获得了大量的单离体细胞,经光照培养60 d后,从体细胞再生体中挑选了黄褐、红褐、浅黄、浅绿和浅红等5种颜色的单色突变体各10株,变异体的颜色与原有嵌合叶状体上观察到的色素变异细胞颜色保持一致(图 7)。
|
图 7 突变色块的体细胞再生体 Fig.7 Somatic cell germlings with color mutation isolated from chimeric thallus a:正常色泽;b:浅红色;c:红褐色;d:黄褐色;e:浅黄色;f:浅绿色。 a: Normal color; b: Light red; c: Red brown; d: Yellow brown; e: Light yellow; f: Light green. |
在已有的紫菜诱变方法中,报道最多的是使用诱变剂MNNG和60Co-γ,但UV-C辐照是一种操作简单、应用广泛、污染风险低的诱变方法,更适合对孢子和原生质体进行诱变。虽然,UV-C辐射诱变条斑紫菜原生质体的研究已有报道,但由于实验条件的限制,并未对诱变效率进行分析(严兴洪, 1992)。本研究以壳孢子为诱变材料,相比于具有细胞壁结构的叶状体和丝状体细胞,刚释放的壳孢子无细胞壁,更易于UV-C的穿透。同时,壳孢子发生减数分裂形成遗传重组的四分体,对壳孢子进行诱变更利于获得突变细胞,这完全不同于诱变叶状体和丝状体所产生的点状突变。
本研究使用UV-C辐照坛紫菜的壳孢子取得了较好的色彩突变体诱变效果。在辐照强度为50和100 J/m2时,随着辐照强度的增加,壳孢子死亡数量的增加并不明显,只有少部分壳孢子细胞颜色变淡和内缩,但壳孢子GR却呈上升趋势,这与使用低剂量UV-C辐射对条斑紫菜原生质体的诱变结果相似(严兴洪, 1992),这可能是因为低剂量的紫外诱变引起细胞在感受DNA损伤胁迫后产生了生理应激反应,使细胞分裂加快。低剂量的UV-C辐照可以促进壳孢子的生长发育,而高剂量的UV-C辐照则抑制其生长(Anastasios et al, 2015),因此,在生产中使用低剂量的UV-C照射,以促进壳孢子的萌发,提高紫菜的生产效率。
在辐照剂量为100~400 J/m2范围内,随着辐照剂量的增强,突变壳孢子及其萌发体的死亡率随之上升,突变率也随之增加,辐照剂量为300和400 J/m2时,突变率分别达到15.22%和17.18%,壳孢子萌发体的死亡率分别为51.70%和61.00%。当辐照剂量达到500 J/m2时,坛紫菜壳孢子细胞大部分死亡,是死亡率达83.98%,且出现突变体的频率明显低于300和400 J/m2剂量组。说明UV-C辐照剂量为300和400 J/m2时,能较好地诱导坛紫菜壳孢子发生突变,便于获得丰富的遗传基因重组表型。本研究不同于采用60Co-γ射线辐照坛紫菜叶状体诱变突变体时,是死亡率不超过50%,即可获得最大突变率(严兴洪等, 2005),最适使用剂量也略高于使用UV-C辐照诱变圆紫菜(P. suborbiculata)与皱紫菜(P. crispata)叶状体所获得的最佳剂量(80 μW/cm2×5 min=240 J/m2) (张倩等, 2019; 赵爽等, 2019),这可能是刚刚从壳孢囊枝释放出来的壳孢子,其细胞壁尚未形成,抵御不利环境胁迫的能力相对较弱,水层高度也可能一定程度上影响了UV-C辐照的穿透效果。
本研究中,经UV-C照射后,恢复光照培养7 d时发现,壳孢子萌发体出现了不同于对照组壳孢子萌发体的色彩突变细胞块,随着培养时间的延长,色彩突变的壳孢子萌发体逐渐分裂并形成2~4个单色块嵌合的叶状体,单个变异色块的细胞大小和颜色等均完全相同。坛紫菜壳孢子萌发初期,减数分裂的2次细胞分裂所形成的产物为线性排列的四分子嵌合体,也是基因重组的产物(严兴洪等, 2000、2006)。本研究中,坛紫菜壳孢子萌发体上的嵌合色块起源于壳孢子萌发初期发生减数分裂的4个子细胞(四分子),单个嵌合块仅与四分子中的1个细胞相对应。这种色泽分离现象是由于成熟丝状体释放的壳孢子在萌发初期产生的四分子发生了色彩变异,且变异细胞持续进行有丝分裂,最终发育成由2~4个色块构成的镶嵌叶状体。将含有色彩突变的嵌合叶状体酶解获得单离细胞,经过60 d的体外培养,所获得的5种单色突变体的颜色种类,基本上与母体嵌合叶状体上观察到的色素变异细胞种类一致,这说明获得的色彩突变体来自母体嵌合叶状体上的单个突变细胞。
本研究中,UV-C引起了壳孢子的不可逆突变或死亡,对后期坛紫菜叶状体的形态形成有显著影响,主要表现为细胞形态发生变异和色彩突变嵌合叶状体的形成。坛紫菜叶状体的生长方式为散生长,当四分子细胞因受辐照影响而出现分裂停滞或分生速度不同步时,出现了早期的表观形态形成的多样性(Pueschel et al, 1982; Pueschel, 2021)。如壳孢子辐照后产生的叶状体的长宽比显著降低(P<0.05),其主要原因是由于辐照造成了壳孢子萌发体顶部细胞发育滞缓,中基部细胞向两极发育受到抑制而增加横向发育。这对于揭示紫菜壳孢子萌发体在不适环境条件下的形态形成具有一定的参考意义。
紫菜的质量主要取决于叶状体的色泽,而叶绿素a (Chlorophyll a, Chl-a)、藻蓝蛋白(phycocyanin, PC)和藻红蛋白(phycoerythrin, PE) 3种光合色素的含量和组成比例决定了紫菜的色彩变化。研究表明,Chl-a和藻胆素的含量和组成比例的变化可能是由于某种基因发生突变,可以直接或间接地干扰色素的合成和稳定性,从而通过各种合成途径调节色素的比例,引起色素的变异(张海波等, 2007)。坛紫菜色素突变的形成也可能是色素蛋白合成过程中一些相关调控基因发生突变所致(黄惠珍等, 2012; 曾高雄等, 2023)。本研究使用的诱变剂UV-C可以使细胞DNA链断裂形成嘧啶二聚体,从而导致基因突变,但如何影响坛紫菜色素合成途径的基因表达调控这一问题还有待研究。
4 结论本研究利用不同剂量UV-C诱变坛紫菜处于萌发阶段的壳孢子以影响壳孢子四分体排列变化来获得色彩嵌合突变体,对壳孢子存活率、萌发率和壳孢子萌发体突变率等进行综合分析。结果显示,UV-C能有效地诱变坛紫菜壳孢子,适当的辐照剂量(300或400 J/m2)可以获得一定数量的色彩嵌合叶状体,且可以从这些色彩嵌合叶状体中分离出单色突变体。本研究结果为利用UV-C诱变处理坛紫菜壳孢子进行突变株系筛选和新种质选育提供了新途径。
ANASTASIOS I, DARRAS, et al. Disease resistance and growth responses in Pelargonium× hortorum plants to brief pulses of UV-C irradiation. Scientia Horticulturae, 2015, 181: 95-101 DOI:10.1016/j.scienta.2014.10.039 |
CHEN C S, XU Y, XIE C T, et al. Preliminary study on mutation breeding of Porphyra haitanensis strains. Journal of Fisheries of China, 2008, 32(3): 327-334 [陈昌生, 徐燕, 谢潮添, 等. 坛紫菜诱变育种的初步研究. 水产学报, 2008, 32(3): 327-334 DOI:10.3321/j.issn:1000-0615.2008.03.002] |
DAI J X, ZHANG Q Q, BAO Z M, et al. Studies on the pure line culture, mutagenization and interspecific fusion of Porphyra protoplasts. Oceanologia et Limnologia Sinica, 1990, 21(3): 293-296 [戴继勋, 张全启, 包振民, 等. 紫菜原生质体的纯系培育、诱变处理和种间细胞融合的研究. 海洋与湖沼, 1990, 21(3): 293-296] |
DING H C, FEI Q J, ZHANG P, et al. Isolation and characterization of a heat-resistant strain with high yield of Pyropia haitanensis induced by ultraviolet ray. Aquaculture, 2020, 521: 3031-3041 |
ELLIOTT M L, JARDIN E A D, BATSON W E, et al. Viability and stability of biological control agent son cotton and snap bean seed. Pest Management Science, 2001, 57(8): 695-706 DOI:10.1002/ps.342 |
HE P M, QIN S, YAN X J, et al. Seaweed biological technology and application. Beijing: Chemical Industry Press, 2007: 59-61 [何培民, 秦松, 严小军, 等. 海藻生物技术及其应用. 北京: 化学工业出版社, 2007: 59-61]
|
HUANG H Z, XIE C T, JI D H, et al. Quantitative analysis of pigment gene expression in pigment mutants of Porphyra haitanensis. Journal of Fisheries of China, 2012, 36(6): 884-892 [黄惠珍, 谢潮添, 纪德华, 等. 坛紫菜色素突变体色素基因的表达定量分析. 水产学报, 2012, 36(6): 884-892] |
JEON Y M, SON K H, KIM S M, et al. Growth of dropwort plants and their accumulation of bioactive compounds after exposure to UV lamp or LED irradiation. Horticulture Environment & Biotechnology, 2018, 59(5): 659-670 |
LEE H J, CHOI J I, KIM G H. Characterization of Porphyra lucasii pigment mutant induced by gamma irradiation. Phycological Research, 2018a, 66(3): 199-208 DOI:10.1111/pre.12216 |
LEE H J, CHOI J. Isolation and characterization of a high-growth-rate strain in Pyropia yezoensis induced by ethyl methane sulfonate. Journal of Applied Phycology, 2018b, 30: 2513-2522 DOI:10.1007/s10811-018-1426-1 |
LI L, YAN X H. Isolation and characterization of a green type mutant in Porphyra haitanensis Chang et Zheng (Bangiales, Rhodophyta). Journal of Shanghai Ocean University, 2006, 15(1): 30-35 [李琳, 严兴洪. 坛紫菜绿色突变体的分离与特性分析. 上海海洋大学学报, 2006, 15(1): 30-35 DOI:10.3969/j.issn.1004-7271.2006.01.007] |
LI Y X, WANG G C, XU P, et al. Induction and characterization of green pigmentation mutant in Porphyra yezoensis Ueda. Aquaculture, 2008, 282: 117-123 DOI:10.1016/j.aquaculture.2008.05.026 |
OHME M, KUNIFUJI Y, MIURA A. Cross experiments of the color mutants in Porphyra yezoensis Ueda. Japanese Journal of Phycology, 1986, 34(2): 101-106 |
PAN X, MAO Y X, WANG J H, et al. Effects of UV-B ultraviolet radiation on the physiology and biochemistry of Pyropia yezoensis. Progress in Fishery Sciences, 2020, 41(3): 125-132 [潘雪, 茅云翔, 王俊皓, 等. UV-B紫外辐射对条斑紫菜生理生化的影响. 渔业科学进展, 2020, 41(3): 125-132] |
PFENDLER S, EINHORN O, ALAOUI-SOSSÉ L, et al. Factors inducing bryophyte growth on prehistoric pigments and effect of UV-C treatment. Environmental Science and Pollution Research, 2021, 28(3): 2987-2994 DOI:10.1007/s11356-020-10681-8 |
PUESCHEL C M, COLE K M. Rhodophycean pit plugs: An ultrastructural survey with taxonomic implications. American Journal of Botany, 1982, 69(5): 703-720 DOI:10.1002/j.1537-2197.1982.tb13310.x |
PUESCHEL C M. Formation of secondary pit connections by conjunctor cells in a coralline red alga. Phycologia, 2021, 60(6): 644-652 DOI:10.1080/00318884.2021.1986662 |
REZZAN K, MEHMET U K. Biochemical and color changes of fresh-cut melon (Cucumis melo L. cv. Galia) treated with UV-C. Food Science and Technology, 2014, 34(3): 547-551 |
SLATINSKAYA O V, PROTOPOPOV F F, SEIFULLINA N K, et al. A study of the state of photosynthetic pigments of hybrid maize seeds exposed to ultraviolet and radiation. Biophysics, 2018, 63(4): 611-620 DOI:10.1134/S000635091804019X |
WADA S. Dictionary of color names. Journal of the Franklin Institute, 1956, 261(4): 442-445 DOI:10.1016/0016-0032(56)91264-9 |
WANG J F, XU P, ZHU J Y, et al. Studies on the pigment mutation in Porphyra (Bangiales, Rhodophyta). Progress in Fishery Sciences, 2007, 28(2): 28-35 [王金锋, 许璞, 朱建一, 等. 紫菜属海藻色素突变的研究. 渔业科学进展, 2007, 28(2): 28-35 DOI:10.3969/j.issn.1000-7075.2007.02.005] |
WANG S J, ZHENG Y Z, MA L B, et al. Gamma-rays induction of mutation in conchocelis of Porphyra yezoensis. Oceanologia et Limnologia Sinica, 2000, 18(1): 47-53 |
YAN X H, FUJITA Y, ARUGA Y. High monospore-producing mutants obtained by treatment with MNNG in Porphyra yezoensis Ueda (Bangiales, Rhodophyta). Hydrobiologia, 2004, 512(1/2/3): 133-140 |
YAN X H, FUJITA Y, ARUGA Y. Induction and characterization of pigmentation mutants in Porphyra yezoensis Ueda (Bangiales, Rhodophyta). Journal of Applied Phycology, 2000, 12(1): 69-81 DOI:10.1023/A:1008129119065 |
YAN X H, LI L, ARUGA Y. Cross experiments and analysis of the position of meiosis in Porphyra haitanensis (Rhodophyta). Journal of Fisheries of China, 2006, 30(1): 1-8 [严兴洪, 李琳, 有贺祐胜. 坛紫菜减数分裂位置的杂交试验分析. 水产学报, 2006, 30(1): 1-8] |
YAN X H, LIANG Z Q, SONG W L, et al. Induction and isolation of artificial pigmentation mutants in Porphyra haitanensis Chang et Zheng (Bangiales, Rhodophyta). Journal of Fisheries of China, 2005, 29(2): 166-172 [严兴洪, 梁志强, 宋武林, 等. 坛紫菜人工色素突变体的诱变与分离. 水产学报, 2005, 29(2): 166-172] |
YAN X H, TANAKA J, ARUGA Y. Isolation and characterization of pigmentation mutants in Porphyra yezoensis Ueda (Bangiales, Rhodophyta). Journal of Fisheries of China, 2000, 24(3): 221-228 [严兴洪, 田中次郎, 有贺佑胜. 条斑紫菜色彩突变体的诱导、分离和特性分析. 水产学报, 2000, 24(3): 221-228 DOI:10.3321/j.issn:1000-0615.2000.03.005] |
YAN X H, ZHANG S J, HUANG L B. Induction and isolation of pigmentation mutants of Porphyra yezoensis Ueda (Bangiales, Rhodophyta) by 60Co-γ ray irradiation. Oceanologia et Limnologia Sinica, 2009, 40(1): 56-61 [严兴洪, 张淑娟, 黄林彬. 60Co-γ射线对条斑紫菜(Porphyra yezoensis)的诱变效果与色素突变体分离. 海洋与湖沼, 2009, 40(1): 56-61] |
YAN X H. Effects of UV irradiation on the development and variations of protoplast progenies in Porphyra yezoensis. Journal of Shanghai Ocean University, 1992, 1(1/2): 71-78 [严兴洪. 紫外线辐射与条斑紫菜原生质体后代发育和变异. 上海海洋大学学报, 1992, 1(1/2): 71-78] |
ZENG C K, WANG S J, LIU S J, et al. Seaweed cultivation. Shanghai: Shanghai Science and Technology Press, 1985: 135-150 [曾呈奎, 王素娟, 刘思俭, 等. 海藻栽培学. 上海: 上海科学技术出版社, 1985: 135-150]
|
ZENG G X, XU K, XU Y, et al. cDNA cloning and functional verification of transcription factor NhbZIP1 from Neoporphyra haitanensis. Progress in Fishery Sciences, 2023, 44(1): 201-209 [曾高雄, 许凯, 徐燕, 等. 坛紫菜转录因子NhbZIP1克隆和功能验证. 渔业科学进展, 2023, 44(1): 201-209] |
ZHANG B L, YAN X H, HUANG L B. Evaluation of an improved strain of Porphyra yezoensis Ueda (Bangiales, Rhodophyta) with high-temperature tolerance. Journal of Applied Phycology, 2011, 23(5): 841-847 |
ZHANG H B, HOU H S. Research progress in pigment mutants of Porphyra. Letters in Biotechnology, 2007, 18(2): 4 [张海波, 侯和胜. 紫菜色素突变体研究进展. 生物技术通讯, 2007, 18(2): 4] |
ZHANG Q, DING H C, YAN X H, et al. Isolation and characterization of pigmentation mutants of Pyropia crispata (Bangiales, Rhodophyta). Journal of Shanghai Ocean University, 2019, 28(4): 526-534 [张倩, 丁洪昌, 严兴洪, 等. 皱紫菜色素突变体的分离与特性分析. 上海海洋大学学报, 2019, 28(4): 526-534] |
ZHANG Y, YAN X H. The sex and sex determination in Pyropia haitanensis (Bangiales, Rhodophyta). The Public Library of Science, 2013, 8: 1-8 |
ZHAO S, YAN X H, DING H C, et al. Induction and isolation of pigmentation mutants in Pyropia suborbiculata Kjellman (Bangiales, Rhodophyta). Acta Oceanologica Sinica, 2019, 41(2): 114-122 [赵爽, 严兴洪, 丁洪昌, 等. 圆紫菜人工色素突变体的诱导与分离. 海洋学报, 2019, 41(2): 114-122] |
ZHONG C H, ARUGA Y, YAN X H. Morphogenesis and spontaneous chromosome doubling during the partheno genetic development of haploid female gametophytes in Pyropia haitanensis (Bangiales, Rhodophyta). Journal of Applied Phycology, 2019, 31(4): 2729-2741 |



