2. 海南大学三亚南繁研究院 海南 三亚 572000;
3. 海南大学 南海海洋资源利用国家重点实验室 海南省热带水生生物技术重点实验室 海南 海口 570228
2. Sanya Nanfan Research Institute, Hainan University, Sanya 57200, China;
3. State Key Laboratory of Marine Resource Utlization in South China Sea, Hainan Key Laboratory of Tropical Hydrobiological Technology, Hainan University, Haikou 570228, China
栉江瑶(Atrina pectinata)是一种大型双壳贝类,俗称带子、海锨、大海红,广泛栖息于日本、韩国、中国沿海潮下带的泥质或砂质沉积物中,具有极高的商业价值(Lee et al, 2015)。据《中国渔业年鉴2022》不完全统计,我国2021年海水贝类养殖产量为1 526.07万t,是全国海水养殖产量(2 211.14万t)的69.02% (农业农村部渔业渔政管理局等, 2022)。我国贝类养殖产业取得的巨大成绩,与经济贝类人工育苗技术的突破有直接关系,加上养殖技术的创新与进步,使我国贝类产业在海水养殖业中有着举足轻重的作用。
马氏珠母贝(Pinctada fucata martensii)、欧洲大扇贝(Pecten maximus)和太平洋牡蛎(Crassostrea gigas)等多数双壳贝类以体外受精的方式进行生殖繁育,精子与卵子在水环境中发生受精作用(Alavi et al, 2014; Boulais et al, 2019)。这类受精方式的贝类精子在排出亲本体外前一直处于静止或低迷运动状态,只有当精子被激活游泳运动时才具备与卵子结合的能力,且游泳运动能力会直接影响受精率的高低(Arita et al, 2012; Demoy-Schneider et al, 2012; 周丽青等, 2011)。由此可见,精子游泳运动有效激活对海洋双壳贝类人工授精的成功有着重要意义,也是发展及优化人工繁殖技术的关键之一。栉江瑶与上述双壳贝类相似,以体外受精的方式进行繁殖。
双壳贝类的精子收集方法可分为亲本刺激排放收集法和人工剥离收集法。亲本刺激排放收集法是指亲本自然或经人工阴干、升温等方式刺激后将精子排出体外,是在水体中进行精子样品收集的方法;人工解剖获得法是指直接解剖亲本个体从性腺中获得精子的方法。2种精子收集方法各有利弊:亲本刺激排精法具有方法简单、操作简便、对亲本伤害较小等优点,但易受到黏液和粪便等杂质的影响,导致精子活力下降;人工剥离法可直接获取性腺内的成熟精子,通过使用缓冲液进行稀释保存,可避免精子受到污染,但该法获得的精子样品质量和成熟度参差不齐,需要进一步的激活处理,但可以控制精子激活时间,在精卵排放不同步的情况下更利于人工育苗的操作(Beirão et al, 2019; 许帅等, 2021; 郑兴, 2019)。
在贝类的人工授精过程中,由于存在精子质量不一、活化后精子活力不足等现象,商业育苗场常面临精子供应短缺的问题(Rurangwa et al, 2004)。不同贝类精子所需要的激活液种类与浓度具有差异性,筛选出有效的激活液可推动其人工繁殖技术进一步发展。现有研究针对栉江瑶精子所采取的激活方式不一,多参考其他双壳贝类的激活液进行选择,所获得的精子激活率从20%~90%不等(Awaji et al, 2018; 于非非等, 2016),尚未形成标准化的精子激活方案,且均未对栉江瑶精子的运动学指标和能量代谢内容进行研究。此外,关于栉江瑶配子的研究主要围绕卵母细胞开展(Awaji et al, 2018、2022; Qiu et al, 2014),鲜见关于精子游泳运动特征量化描述及相关能量代谢特征的基础研究。
本文以海南地区繁殖季节的栉江瑶为研究对象,探究了海水中铵离子浓度和pH的变化对新鲜精子运动率及运动特征的作用,并对高度活化状态下栉江珧精子的能量代谢特征进行研究,以期为栉江瑶精子激活机制研究奠定基础,支持栉江瑶人工繁育技术的发展与优化。
1 材料与方法 1.1 实验材料与管理实验于2021年6月至2022年1月在海南省文昌市烟墩养殖场进行。栉江瑶亲本来源于海棠湾蜈支洲岛海域,获得亲本后马上运至文昌市烟墩养殖场,置于水泥池中暂养,水温为(27±1) ℃,pH为8.18,盐度为29,投喂亚心形扁藻(Platymonas subcordiformis)和角毛藻(Chaetoceros sp.)混合液,每天早晚各投喂1次。
1.2 精子收集方法经显微镜进行性别辨别后,取性腺成熟的雄性亲本作为实验个体。使用解剖刀切断闭壳肌,打开贝壳,用干净纸巾吸干海水及组织液混合物,取下性腺放入干净烧杯中,加入适量无钙生理缓冲液(Ca-free HBSS,Sigma),随后采用消毒后的剪刀充分剪碎性腺,获得精浆悬浮液,再用300目筛绢过滤精浆悬浮液,去除多余组织碎片,获得较干净的精子悬浮液,用无菌离心管装好、标记,放于冰上待用。
1.3 精子激活方法与实验设计本研究所采用的激活方法是以1∶500的比例将精子悬浮液与激活液在2 mL圆底EP管中混合,用旋涡混合器快速混合后,取3 μL样品点入Leja玻片中,在精子质量分析系统下进行连续性观察,直至大部分精子不再运动。实验在室温[(25±1) ℃]及控温平台(25 ℃)条件下进行。
研究以人工无氨海水(ASW,pH为8.20,盐度为30)作为实验对照组,观察用不同浓度氨海水(1、2、3、4和5 mmol/L)激活精子后21 min内精子运动率的变化规律;观察精子被与氨海水组pH相对应的人工配置的不同pH海水(8.64、9.10、9.27、9.36、9.42)激活后21 min内运动率的变化规律;观察最佳活化状态下精子的曲线运动速率(VCL)、直线运动速率(VSL)、平均路径运动速率(VAP)、鞭毛摆动频率(BCF)、ATP含量、Na+-K+-ATP酶活性、Ca2+-Mg2+-ATP酶活性和SOD活性的变化规律。
1.4 缓冲液及激活液的配置与保存无钙生理缓冲液:取1 mL的10×Ca-free HBS (Sigma,美国)加入到9 mL无菌超纯水中,混匀,4 ℃保存待用。
无氨人工海水(ASW):参照Cavanaugh (1975)的方法,称取24.837 g NaCl、0.671 g KCl、0.910 g CaCl2、4.676 g MgCl2、6.161 g MgSO4、0.181 g NaHCO3溶于1 L无菌超纯水中,曝气2 h,为氨海水配制的基础液,常温保存。
不同氨浓度人工海水:使用25%浓氨水及无氨人工海水分别配制成1、2、3、4、5 mmol/L的人工氨海水。常温保存待用,现用现配。作为精子激活液使用。
不同pH人工海水:使用Good´s buffer调节无氨人工海水pH,分别配制成pH为8.64、9.10、9.27、9.36和9.42的人工海水。常温保存待用。作为精子激活液使用。
1.5 检测指标和方法 1.5.1 激活率与运动学参数使用SCA精子质量分析仪(v.6.1)进行精子激活率及运动学参数测定。SCA精子质量分析系统选择无脊椎动物模型模块,其镜像采集设置参数:最大采集面积为80 μm2;帧数频率为300 f/s;样品漂移参数为4 μm/s。将每次镜头捕捉的精子个数控制在300~400个之间。
本研究所涉及具体指标及标准设定如下:精子总运动率(TM,%,VCL≥10 μm/s)、VCL (μm/s)、VSL (μm/s)、VAP (μm/s)和BCF (Hz)。
1.5.2 精子活力等级划分方法根据Billard (1983)和Cosson等(2008)的方法,将精子活力等级(MI)分为6个水平(表 1),即MI=0~5。MI=0表示精子处于未活化状态;MI=1表示活化精子<1%;MI=2表示活化精子在1%~<25%之间;MI=3表示活化精子在25%~<50%之间;MI=4表示活化精子在50%~<75%之间;MI=5表示活化精子在75%~100%之间。
|
|
表 1 精子活力等级划分标准 Tab.1 Criteria for grading sperm motility |
将精子悬浮液在4 ℃、4 000 r/min条件下离心15 min,收集精子细胞沉淀,舍去上清液。沉淀经生理盐水混匀后进行超声波破碎,分别按照试剂盒提供的方法测量上清液的ATP浓度、Na+-K+-ATP酶活性、Ca2+-Mg2+-ATP酶活性和SOD活性。实验所用试剂盒购自南京建成生物工程研究所。
1.6 数据处理与统计实验数据用统计分析软件DPS 14.5进行统计分析,P<0.05表示具有显著性差异。
2 结果 2.1 铵离子浓度、pH对精子总运动率活化效果的影响及比较人工氨海水的pH会随着海水中的铵离子浓度增加而变高,人工海水所含铵离子浓度分别为1、2、3、4和5 mmol/L时,溶液的pH分别为8.64、9.10、9.27、9.36和9.42。
不同铵离子浓度和pH的人工海水处理栉江珧新鲜精子后的总运动率如图 1所示。栉江珧精子在对照组(无氨人工海水)中呈不运动或极低迷的运动状态(MI≤1),在激活21 min内,精子总运动率在(1.89± 1.44)%~(6.66±1.22)%范围内浮动变化。在合适范围内,随着铵离子浓度和pH的升高,栉江珧新鲜精子总运动率也会显著提高,但所对应的最佳激活时间有所不同。
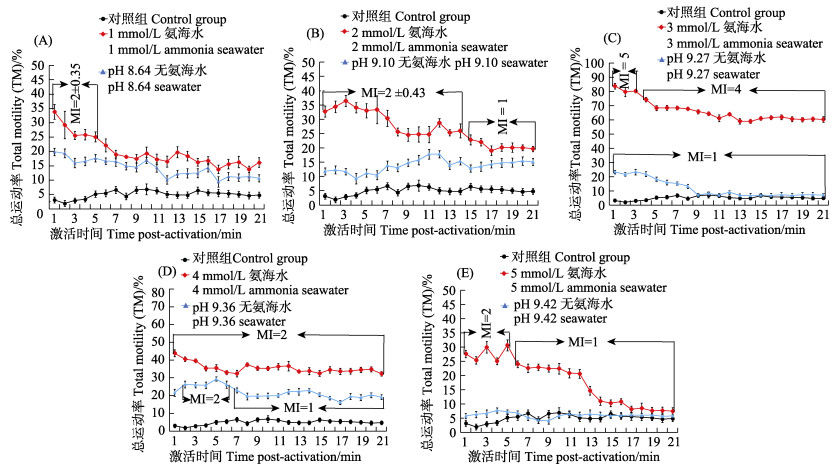
|
图 1 不同浓度铵离子和pH的人工海水激活后栉江珧精子总运动率的变化 Fig.1 The kinetics of A. pectinata total motility (TM) after dilution with artificial seawater of different ammonia ion concentration and pH |
如图 1A所示,在浓度为1 mmol/L的氨海水激活溶液中,栉江珧精子被激活1 min后,TM显著升高至(33.89±2.60)% (P<0.05),活力在MI=2状态保持了5 min;被激活6 min后,TM开始明显降低,活力直至实验结束一直维持在MI=1的状态,最低TM为(13.84±1.14)%。而在与1 mmol/L氨海水激活溶液pH值对应的无氨人工海水激活液中(pH=8.64),栉江珧精子活力状态则一直维持在MI=1,TM最高为(19.88±1.28)%,激活效果显著差于1 mmol/L氨海水溶液,但显著高于对照组,即pH=8.64的实验组与对照组相比也存在一定程度的运动激活效果。
如图 1B所示,栉江珧精子运动被2 mmol/L的氨海水激活后,活力在激活14 min内一直维持在MI=2的状态,TM最高为(36.48±1.91)%,而在激活第15分钟开始呈现逐步降低的趋势,精子活力降至MI=1的状态,直至实验结束。而在与2 mmol/L氨海水激活溶液pH值对应的无氨人工海水激活液中(pH=9.10),栉江珧精子活力状态一直维持在MI=1,TM最高为(17.82±1.24)%,激活效果显著差于氨海水溶液,但显著高于对照组,且呈略微上升的趋势。
如图 1C所示,栉江珧精子运动被3 mmol/L的氨海水激活后,活力在激活21 min内一直保持在MI≥4的状态,在激活的前3 min内,总运动率都在80%以上,第4分钟开始呈下降趋势并进入较平稳状态(MI=4),直至实验结束精子运动率均高于60%,在整个实验组中精子激活效果最优。而在与3 mmol/L氨海水激活溶液pH值对应的无氨人工海水激活液中(pH=9.27),栉江珧精子活力状态一直维持在MI=1,TM最高为(23.32±1.93)%,激活效果显著差于氨海水溶液,且呈逐步下降趋势。
如图 1D所示,栉江珧精子运动被4 mmol/L的氨海水激活后,活力在激活21 min内一直保持在MI=2的状态,精子运动率在(43.96±1.92)%~(32.44±1.26)%范围内浮动变化。而与4 mmol/L氨海水激活溶液pH值对应的无氨人工海水激活液中(pH=9.36),栉江珧精子运动率整体低于在4 mmol/L氨海水激活液中,但优于对照组,在激活后第2分钟显著上升至(26.40±1.88)%,并在5 min内维持着MI=2的状态活力,随后运动率呈波动状态,保持活力MI=1的状态。
如图 1E所示,栉江珧精子运动被5 mmol/L的氨海水激活后,活力在激活前5 min内一直保持在MI=2的状态,精子运动率在(25.04±1.22)%~(30.64±1.93)%范围内浮动变化。随后呈逐步降低的趋势,活力降至MI=1的状态,实验结束后,TM显著降低至(7.44±1.26)%。在与5 mmol/L氨海水激活溶液pH值对应的无氨人工海水激活液中(pH=9.42),栉江珧精子运动率在实验过程中只有略微上升,在激活4 min时,TM达最高值,仅为(7.71±1.26)%,随后呈波动变化,活力一直为MI=1的状态,其运动率出现低于对照组的现象。
2.2 高度活化状态下栉江珧精子游泳运动特征分析由总运动率实验结果可知,3 mmol/L氨海水可有效激活栉江珧精子游泳运动,为进一步分析栉江珧精子游泳运动特征,本研究选择3 mmol/L氨海水作为栉江珧新鲜精子最优激活液,继而开展精子激活后游泳速度参数和鞭毛摆动频率特征的分析。
2.2.1 游泳速度变化特征栉江珧新鲜精子经3 mmol/L氨海水激活后,游泳运动速度参数都随着激活时间的推移而呈逐步降低的趋势(图 2)。VCL在3 mmol/L氨海水激活后,3 min内保持着较高速率(>56 μm/s),在第5分钟显著降低至(47.69±1.40) μm/s (P<0.05),在第9分钟显著降低至(40.87±1.08) μm/s (P<0.05),随后保持较平稳的状态。VSL在激活后第4分钟由(17.51±1.64) μm/s显著降低至(12.14±1.35) μm/s (P<0.05),随后基本在(7.41±1.43)~(8.46±1.37) μm/s之间浮动变化(P>0.05)。VAP在激活后第3分钟由(30.37±1.32) μm/s显著降低至(26.25±1.30) μm/s (P<0.05),在第6分钟时,再次显著降低至(21.32±1.36) μm/s (P<0.05),随后,未出现显著变化,基本维持在20 μm/s左右(P>0.05)。
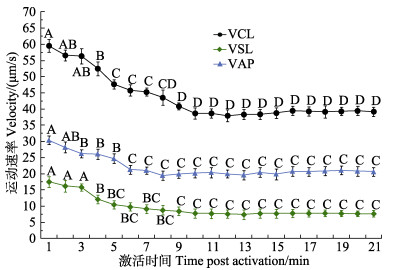
|
图 2 经3 mmol/L氨海水激活后栉江珧精子运动速度参数(VCL、VSL、VAP)的变化 Fig.2 Variation of velocity parameters (VCL, VSL, VAP) of the A. pectinata sperm movement after activated by artificial seawater of 3 mmol/L ammonia ion VCL:曲线运动速率(μm/s);VSL:直线运动速率(μm/s);VAP:平均路径运动速率(μm/s);不同字母代表显著性差异(P<0.05),下同。 VCL: Curvilinear velocity (μm/s); VSL: Straight line velocity (μm/s); VAP: Average path velocity (μm/s). Different letters indicated significant difference (P<0.05), the same below. |
栉江珧新鲜精子经3 mmol/L氨海水激活后,BCF随着激活时间的推移呈先升高后快速降低的趋势(图 3)。栉江珧精子在3 mmol/L氨海水中激活后,前4 min的鞭毛摆动频率在(6.14±0.58)~(6.60±0.32) Hz之间浮动变化(P>0.05),在第5分钟显著降低至(4.97±0.33) Hz (P<0.05),随后呈持续缓慢降低的趋势。在第10分钟降低至(3.68±0.40) Hz后,基本维持在3.3 Hz左右。
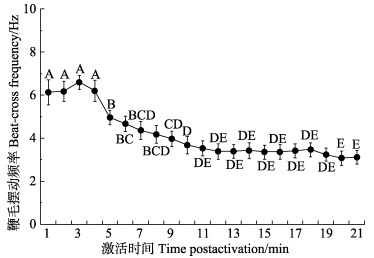
|
图 3 经3 mmol/L氨海水激活后栉江珧精子鞭毛摆动频率的变化 Fig.3 Variation of beat-cross frequency (BCF) of A. pectinata sperm after activated by artificial seawater of 3 mmol/L ammonia ion |
栉江瑶精子激活后的ATP含量随时间的变化如图 4所示。未经激活液处理的精子具有最高的ATP含量[(425.17±45.36) μmol/g prot],精子ATP含量在激活后的5 min内显著下降至(128.80±66.92) μmol/g prot,约为初始含量的30.29% (P<0.05),并在随后略微升高,最终稳定在200 μmol/g prot左右。
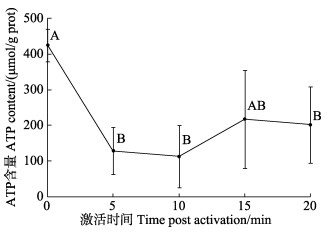
|
图 4 精子激活后ATP含量随时间的变化 Fig.4 Variation of ATP content of the A. pectinata sperm post activation |
栉江瑶精子激活后ATP酶活性随时间的变化如图 5所示。精子Na+-K+-ATP酶活性在前15 min保持稳定,无显著差异(P>0.05),并在15~20 min内显著升高(P<0.05)。精子Ca2+-Mg2+-ATP酶活性基本保持稳定,并在激活后15 min内逐渐升高,随后稍下降。其中,栉江瑶精子Na+-K+-ATP酶活性较低[(0.62± 0.03) U/mg prot],Ca2+-Mg2+-ATP酶具有较高的活性[(6.08±0.04) U/mg prot]。

|
图 5 精子激活后ATP酶活性随时间的变化 Fig.5 Variation of ATPase activity of the A. pectinata sperm post activation |
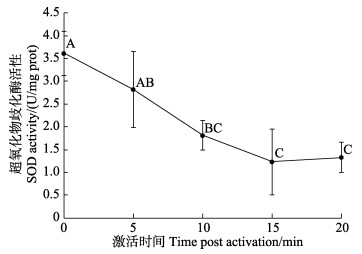
栉江瑶精子激活后SOD活性变化如图 6所示。在激活后的15 min内精子SOD活性呈逐渐下降的趋势,并在激活15 min后达到最低值[(1.23±0.73) U/mg prot]。随后,SOD活性维持稳定且不再有显著性变化(P>0.05)。
|
图 6 精子激活后SOD酶活性随时间的变化 Fig.6 Variation of SOD activity of the A. pectinata sperm post activation |
大多数海洋无脊椎动物精子的激活机制相对而言比较保守,以体外受精方式繁殖的海洋双壳贝类精子游泳运动的调控被认为是受水环境中诸多因素共同作用的,其中,离子和pH起着主要作用(Boulais et al, 2019; Zheng et al, 2018)。诸多研究认为,外界水环境的pH偏碱化会使在水体中的游离精子细胞内的pH也发生碱化,从而进一步催化精子的运动;而酸性或中性介质则会抑制精子运动。在该过程中,K+、Na+等离子也会参与其中并协同发挥作用(Boulais et al, 2018; Christen et al, 1983)。牡蛎和扇贝等双壳贝类的精子可被自然海水直接激活,正是这种精子运动催化机制在发挥作用。
然而,海洋双壳贝类精子游泳运动的激活存在着物种间的差异。Boulais等(2018)研究发现,海水盐度的变化会显著影响太平洋牡蛎精子的运动率及游泳速度;而同为广盐性生物的马氏珠母贝精子运动激活研究发现,海水的盐度变化对其精子运动能力并未直接造成显著影响(Zheng et al, 2020)。本研究表明,直接从性腺中剥离的栉江珧精子是未被活化的、不运动的,即使把它和新鲜自然海水混合在一起,也只有极少部分的精子呈现低迷的运动状态,且仅通过简单碱化人工海水的方式并不会明显影响其精子游泳运动,而与之相反的是,通过铵离子碱化人工海水的方式可有效触发栉江珧精子的游泳运动。在马氏珠母贝(Zheng et al, 2020)和皱纹盘鲍(Haliotis discus)(蒋玉荣等, 2017)精子游泳运动的相关研究中也得到海水中铵离子的存在可有效激发精子发生强烈游泳运动的结论。这意味着栉江珧和马氏珠母贝等物种的精子在体外激活过程中,可能存在一套与牡蛎和扇贝等不一样的精子激活机制,精子在海水中无法得到直接激活,还需要铵离子等其他条件的额外刺激。氨水、NaOH和KOH在以往的精子相关研究中主要是作为碱化水体的媒介,即起到提高水体pH的作用(Alavi et al, 2014; Christen et al, 1983; Wada, 1961),因此,这些研究的关注点主要还是在水体的pH变化,而其他离子的作用则往往被忽略。本研究表明,水体pH的碱化并不是触发和催化栉江珧精子运动的关键因素,而铵离子的存在则可能是催化栉江珧精子发生游泳运动的关键原因。此外,本研究认为,3 mmol/L的氨海水对栉江珧精子具有较好的激活效果,可获得较高的精子运动率。
3.2 精子游泳运动特征分析精子运动能力对体外人工授精成功率是至关重要的,精子必须要有足够的运动能力到达卵子表面并进入卵子完成受精作用(Billard, 1983; Pandey et al, 2017)。精子游泳运动的相关速度是精子运动能力的典型特征,近年来,越来越多的学者加强了对精子游泳速度的研究(De Los Ángeles et al, 2018; Demoy- Schneider et al, 2012; Zheng et al, 2018),这使得对精子运动能力的评价更为全面和客观。本研究表明,海水中的铵离子可有效提高栉江珧精子游泳运动的相关速度,而高速的精子运动能力有可能提高受精成功率。此外,较高的游泳运动速度及相对较长的运动持续时间的特性可使繁殖亲本减少近距离配对的麻烦,可以保证未和精子同时排放的卵子也有机会成功受精,这可被认为是其在自然界中繁殖策略的表现形式之一(Demoy-Schneider et al, 2012; Pandey et al, 2017)。
精子鞭毛的摆动频率是评价精子鞭毛运动的一个典型参数,精子细胞通过线粒体合成ATP,为鞭毛运动提供能量(Gagnon et al, 2006)。鞭毛摆动频率越高,间接代表着精子细胞鞭毛结构及功能越完整,精子细胞线粒体能量的产生越稳定(Murphy et al, 2018)。近年来,精子鞭毛的运动特点也受到了研究者的关注,因为鞭毛运动可以在一定程度上对精子的运动轨迹进行定量描述。在水生动物精子鞭毛的研究中,海胆(Paracentrotus lividus)精子鞭毛的研究较为广泛,相关研究表明,海胆鞭毛的摆动频率为36 Hz左右(Fabbrocini et al, 2017; Gibbons, 1986; Gray, 1955)。本研究表明,栉江珧精子激活后鞭毛摆动频率约为6 Hz,这可为栉江珧精子运动学的后续研究提供一定的理论基础。
3.3 精子能量代谢特征分析精子需要消耗大量的ATP以维持其高速游泳运动,精子的ATP初始含量常被认为与其受精潜力密切相关(Kommisrud et al, 2020)。在包括鱼类和海胆在内的大多数海洋生物中,精子的ATP含量控制着精子的运动时间,精子运动会因ATP的耗尽而停止(Cosson et al, 2008; Kommisrud et al, 2020)。其中,海洋鱼类的精子运动时间相对较短,通常在30 s~20 min之间(Boulais et al, 2019; Dzyuba et al, 2017);而海洋双壳贝类的精子运动时间可长达数小时(Alavi et al, 2014; Suquet et al, 2013)。本研究中,栉江瑶精子的ATP含量在激活后的前15 min持续下降,在这一过程中,约有70%的存储ATP被消耗。表明在栉江瑶精子运动初期,其ATP合成速率较低,ATP消耗速率高于ATP合成速率。随后,其ATP合成速率逐渐升高,并与ATP消耗速率相平衡,以保持ATP含量趋于稳定。诸多研究表明,精子在性腺内可预先储存部分ATP,用于精子运动初期的迅速消耗(Boulais et al, 2015; Fedorov et al, 2015)。Boulais等(2015)研究表明,精子运动初期ATP含量的持续下降触发了相应的调控机制,促使精子加强产能作用以平衡运动阶段的能量消耗。
精子鞭毛轴丝的微管呈“9+2”形式排列,微管上存在大量的动力蛋白,动力蛋白通过消耗ATP产生力与运动来调节鞭毛的摆动频率、振幅和波形,进而调控精子的游泳运动(Bondarenko et al, 2019)。动力蛋白的活性在酸性条件下受抑制(pH<7.2),并受细胞内Na+、K+和Ca2+等离子浓度变化的影响,精子的胞内碱化与离子浓度的动态调控对精子运动的激活与延续至关重要(Boulais, 2019)。Na+-K+-ATP酶与Ca2+- Mg2+-ATP酶是精子细胞膜与细胞器膜上重要的蛋白酶,其通过调节细胞内Na+、K+和Ca2+等离子的浓度来调控精子的能量代谢过程,并在维持细胞内稳态、细胞膜电化学梯度、细胞器功能完整等方面具有关键作用,常被作为评定细胞代谢是否紊乱的重要指标(Bradley et al, 1980; Jimenez et al, 2012)。当Na+-K+-ATP酶活性受抑制时,会导致精子运动的中止(Woo et al, 2000),当Ca2+-Mg2+-ATP酶活性降低时,易造成细胞内Ca2+浓度过高,导致线粒体功能受损(Boulais et al, 2019)。本研究中,栉江瑶精子的Na+-K+-ATP酶与Ca2+-Mg2+-ATP酶活性基本保持不变,这表明精子在运动过程中可维持良好的细胞内稳态,并通过稳定的代谢途径来保证持续性运动(Medrano et al, 2006)。
精子通过糖酵解与氧化磷酸化合成ATP,其中氧化磷酸化是精子在运动过程中的主要产能途径(Boulais et al, 2019)。许多研究表明,精子持续产能的过程会引发细胞内活性氧(ROS)的过度累积,致使精子处于氧化应激状态(Chianese et al, 2021; Guthrie et al, 2012)。精子作为高度特化的细胞,其细胞膜内含有大量的多不饱和脂肪酸。当精子细胞内的活性氧含量过高时,会造成精子细胞膜脂质的过氧化,导致离子通道活性下降与线粒体功能受损,致使无法产生ATP (Correa et al, 2018; Guthrie et al, 2012)。本研究发现,栉江瑶精子的抗氧化酶活性在其激活后的15 min内逐渐降低。抗氧化能力的降低表明,栉江瑶精子有处于氧化应激状态的风险(Li et al, 2023),进一步导致的线粒体受损或许是因为ATP含量在激活后无法继续维持较高水平。
4 结论本研究表明,简单提高海水pH对栉江瑶精子活化效果不明显,铵离子对精子运动的触发具有重要的促进作用。其中,3 mmol/L氨海水对栉江珧人工剥离获得的精子具有较佳的激活效果,可使精子获得较高的运动率和游泳运动速度。栉江瑶精子在运动阶段初期伴有大量的能量消耗,并在后续的运动过程中维持稳定的ATP含量。尽管精子的Na+-K+-ATP酶与Ca2+-Mg2+-ATP酶活性在激活后保持稳定,但抗氧化能力的下降或使精子有暴露于氧化应激状态的风险。
ALAVI S M H, MATSUMURA N, SHIBA K, et al. Roles of extracellular ions and pH in 5-HT-induced sperm motility in marine bivalve. Reproduction, 2014, 147(3): 331-345 DOI:10.1530/REP-13-0418 |
ARITA K, ISOWA K, ISHIKAWA T, et al. Effects of cooling rate on post-thaw motility and fertility of Japanese pearl oyster Pinctada fucata martensii spermatozoa. Fisheries Science, 2012, 78(3): 625-630 DOI:10.1007/s12562-012-0487-3 |
AWAJI M, MATSUMOTO T, FUNAYAMA S, et al. Artificial fertilisation method for the production of pen shell Atrina pectinata juveniles in hatcheries. Aquaculture, 2022, 553: 738101 DOI:10.1016/j.aquaculture.2022.738101 |
AWAJI M, MATSUMOTO T, OJIMA D, et al. Oocyte maturation and active motility of spermatozoa are triggered by retinoic acid in pen shell Atrina pectinata. Fisheries Science, 2018, 84(3): 535-551 DOI:10.1007/s12562-018-1187-4 |
BEIRÃO J, BOULAIS M, GALLEGO V, et al. Sperm handling in aquatic animals for artificial reproduction. Theriogenology, 2019, 133: 161-178 DOI:10.1016/j.theriogenology.2019.05.004 |
BILLARD R. Ultrastructure of trout spermatozoa: Changes after dilution and deep-freezing. Cell and Tissue Research, 1983, 228(2): 205-218 |
BONDARENKO V, COSSON J. Structure and beating behavior of the sperm motility apparatus in aquatic animals. Theriogenology, 2019, 135: 152-163 DOI:10.1016/j.theriogenology.2019.06.005 |
BOULAIS M, DEMOY-SCHNEIDER M, ALAVI S M H, et al. Spermatozoa motility in bivalves signaling, flagellar beating behavior, and energetics. Theriogenology, 2019, 136: 15-27 DOI:10.1016/j.theriogenology.2019.06.025 |
BOULAIS M, MARC S, ARSENAULT-PERNET E J, et al. pH controls spermatozoa motility in the Pacific oyster (Crassostrea gigas). Biology Open, 2018, 7(3): bio031427 |
BOULAIS M, SOUDANT P, LE GOÏC N, et al. Involvement of mitochondrial activity and OXPHOS in ATP synthesis during the motility phase of spermatozoa in the Pacific oyster, Crassostrea gigas. Biology of Reproduction, 2015, 93(5): 118 |
BRADLEY M P, FORRESTER I T. A [Ca2++Mg2+]-ATPase and active Ca2+ transport in the plasma membranes isolated from ram sperm flagella. Cell Calcium, 1980, 1(6): 381-390 DOI:10.1016/0143-4160(80)90040-8 |
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2022. Beijing: China Agriculture Press, 2022 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2022中国渔业统计年鉴. 北京: 中国农业出版社, 2022]
|
CAVANAUGH G M. Formulae and methods of the marine biological chemical room. Marine Biological Laboratory: Woods Hole, 1975
|
CHIANESE R, PIERANTONI R. Mitochondrial reactive oxygen species (ROS) production alters sperm quality. Antioxidants, 2021, 10(1): 92 DOI:10.3390/antiox10010092 |
CHRISTEN R, SCHACKMANN R W, SHAPIRO B M. Metabolism of sea urchin sperm. Interrelationships between intracellular pH, ATPase activity and mitochondrial respiration. Journal of Biological Chemistry, 1983, 258(9): 5392-5399 |
CORREA F, PAVóN N, BUELNA-CHONTAL M, et al. Calcium induces mitochondrial oxidative stress because of its binding to adenine nucleotide translocase. Cell Biochemistry and Biophysics, 2018, 76(4): 445-450 DOI:10.1007/s12013-018-0856-3 |
COSSON J, GROISON A L, SUQUET M, et al. Marine fish spermatozoa: Racing ephemeral swimmers. Reproduction, 2008, 136(3): 277-294 DOI:10.1530/REP-07-0522 |
DE LOS ÁNGELES P M M, JAVIER V S, ALBERTO R O D. Evaluation of sperm quality in adult white fish (Chirostoma estor) Jordan 1879, Mexico. Journal of Entomology and Zoology Studies, 2018, 6(1): 121-126 |
DEMOY-SCHNEIDER M, LEVêQUE A, SCHMITT N, et al. Motility activation and metabolism characteristics of spermatozoa of the black-lip-pearl oyster Pinctada margaritifera var: cumingii (Jameson, 1901). Theriogenology, 2012, 77(1): 53-64 DOI:10.1016/j.theriogenology.2011.07.014 |
DZYUBA B, BONDARENKO O, FEDOROV P, et al. Energetics of fish spermatozoa: The proven and the possible. Aquaculture, 2017, 472: 60-72 DOI:10.1016/j.aquaculture.2016.05.038 |
FABBROCINI A, D'ADAMO R. Motility of sea urchin Paracentrotus Lividus spermatozoa in the post-activation phase. Aquaculture Research, 2017, 48(11): 5526-5532 DOI:10.1111/are.13373 |
FEDOROV P, DZYUBA B, FEDOROVA G, et al. Quantification of adenosine triphosphate, adenosine diphosphate, and creatine phosphate in sterlet Acipenser ruthenus spermatozoa during maturation. Journal of Animal Science, 2015, 93(11): 5214-5221 DOI:10.2527/jas.2015-9144 |
GAGNON C, DE LAMIRANDE E. Controls of sperm motility. In: DE JONGE C J, BARRATT C L R. The sperm cell: Production, maturation, fertilization, regeneration. New York: Cambridge University Press, 2006, 108–132
|
GIBBONS I R. Transient flagellar waveforms in reactivated sea urchin sperm. Journal of Muscle Research and Cell Motility, 1986, 7(3): 245-250 DOI:10.1007/BF01753557 |
GRAY J. The movement of sea-urchin spermatozoa. Journal of Experimental Biology, 1955, 32(4): 775-801 DOI:10.1242/jeb.32.4.775 |
GUTHRIE H D, WELCH G R. Effects of reactive oxygen species on sperm function. Theriogenology, 2012, 78(8): 1700-1708 DOI:10.1016/j.theriogenology.2012.05.002 |
JIANG Y R, LI X, QIN Y J, et al. Activation and cryopreservation of spermatoza in Haliotis discus. Journal of Yantai University (Natural Science and Engineering Edition), 2017, 30(4): 348-351 [蒋玉荣, 李霞, 秦艳杰, 等. 皱纹盘鲍精子的激活及超低温保存研究. 烟台大学学报(自然科学与工程), 2017, 30(4): 348-351] |
JIMENEZ T, SáNCHEZ G, BLANCO G. Activity of the Na, K-ATPase α4 isoform is regulated during sperm capacitation to support sperm motility. Journal of Andrology, 2012, 33(5): 1047-1057 DOI:10.2164/jandrol.111.015545 |
KOMMISRUD E, MYROMSLIEN F D, STENSETH E B. Viability, motility, ATP content and fertilizing potential of sperm from Atlantic salmon (Salmo salar L. ) in milt stored before cryopreservation. Theriogenology, 2020, 151: 58-65 |
LI J Z, DONG C F, WU H Y, et al. Transcriptomic analysis and stress response of Chlamys farreri to paralytic shellfish toxins. Progress in Fishery Sciences, 2023, 44(6): 166-176 [李谨祯, 董晨帆, 吴海燕, 等. 栉孔扇贝对麻痹性贝类毒素的生理响应及转录组分析. 渔业科学进展, 2023, 44(6): 166-176] |
LEE Y, CHOI K, LEE D, et al. The role of the adductor muscle as an energy storage organ in the pen shell Atrina japonica (Reeve, 1858). Journal of Molluscan Studies, 2015, 81(4): 502-511 |
MEDRANO A, FERNÁNDEZ NOVELL J M, RAMIÓ L, et al. Utilization of citrate and lactate through a lactate dehydrogenase and ATP-regulated pathway in boar spermatozoa. Molecular Reproduction and Development: Incorporating Gamete Research, 2006, 73(3): 369-378 |
MURPHY E M, O'MEARA C, EIVERS B, et al. Comparison of plant- and egg yolk-based semen diluents on in vitro sperm kinematics and in vivo fertility of frozen-thawed bull semen. Animal Reproduction Science, 2018, 191: 70-75 |
PANDEY D, RYU Y W, MATSUBARA T. Features of sperm motility and circadian rhythm in Japanese anchovy (Engraulis japonicus). Fisheries and Aquaculture Journal, 2017, 8(2): 203 |
QIU T L, ZHANG T, BAI Y C, et al. Gonad development of the pen shell Atrina pectinata from Shandong Province, China. Journal of Shellfish Research, 2014, 33(2): 465-471 |
RURANGWA E, KIME D E, OLLEVIER F, et al. The measurement of sperm motility and factors affecting sperm quality in cultured fish. Aquaculture, 2004, 234(1/2/3/4): 1-28 |
SUQUET M, QUERE C, MINGANT C, et al. Effect of sampling location, release technique and time after activation on the movement characteristics of scallop (Pecten maximus) sperm. Aquatic Living Resources, 2013, 26(3): 215-220 |
WADA S K. Fertilizability of Crassostrea and Pinctada eggs as related to germinal vesicle breakdown. Memoirs of Faculty of Fisheries Kagoshima University, 1961, 1–8
|
WOO A L, JAMES P F, LINGREL J B. Sperm motility is dependent on a unique isoform of the Na, K-ATPase. Journal of Biological Chemistry, 2000, 275(27): 20693-20699 |
XU S, SUN J C, LIU S L, et al. Progress in research on cryopreservation technology for echinoderm sperm. Progress in Fishery Sciences, 2021, 42(3): 26-37 [许帅, 孙景春, 刘石林, 等. 棘皮动物精子超低温冷冻保存技术研究进展. 渔业科学进展, 2021, 42(3): 26-37] |
YU F F, YU X Y, ZHENG J, et al. Cryopreservation of spermatozoa in pen shell (Atrina pectinata) and suminoe oyster (Crassostrea rivularis). Journal of Agricultural Biotechnology, 2016, 24(2): 305-312 [于非非, 余祥勇, 郑娇, 等. 栉江珧和近江牡蛎的精子超低温冷冻保存. 农业生物技术学报, 2016, 24(2): 305-312] |
ZHENG X, DENG Z H, QIN J G, et al. Noble scallop, Chlamys nobilis, sperm motility duration in the post-activation phase. Animal Reproduction Science, 2018, 196: 197-204 |
ZHENG X, FU Z Y, LIN S Q, et al. Which is the major trigger in aquatic environment for pearl oyster Pinctada fucata martensii sperm from gonad: Ammonia ion or pH?. Aquaculture, 2020, 520: 734673 |
ZHENG X. Sperm swimming movement characteristics and cryopreservation for Pinctada fucata martensii and Chlamys nobilis. Doctoral Dissertation of Hainan University, 2019
|
郑兴. 马氏珠母贝和华贵栉孔扇贝精子的游泳运动学特征及超低温保存技术研究. 海南大学博士研究生学位论文, 2019
|
ZHOU L Q, YANG A G, LIU Z H, et al. Fertilization biology of eggs and sperms in two scallop species, Patinopecten yessoensis and Chlamys farreri. Progress in Fishery Sciences, 2011, 32(1): 75-81 [周丽青, 杨爱国, 刘志鸿, 等. 扇贝精子及卵子的受精生物学特征. 渔业科学进展, 2011, 32(1): 75-81] |



