2. 上海市水产动物良种创制与绿色养殖协同创新中心 上海 201306;
3. 南方海洋科学与工程广东省实验室(广州) 广东 广州 511458
2. Shanghai Collaborative Innovation Center for Cultivating Elite Breeds and Green-Culture of Aquaculture Animals, Shanghai 201306, China;
3. Southern Marine Science and Engineering Guangdong Laboratory(Guangzhou), Guangzhou 511458, China
海洋向人类提供了丰富的优质蛋白,被誉为“蓝色粮仓”。近40年来,我国将开发利用海洋渔业资源作为一项发展重点,其中,以海水养殖为主要发展对象,带动了海藻、海洋虾类、海洋贝类、海洋鱼类和海珍品等养殖产业的浪潮,使我国的养殖总产量自20世纪90年代以来一直稳居世界首位(杨金龙等, 2004)。而今,局部水域环境遭受污染、养殖过程各环节中病害加重等因素导致海产品的质与量均无法得到有力保障,且传统的海水养殖模式已难以适应我国对健康发展海洋渔业及其相关生态环境的要求。因而,除浅海网箱养殖向多营养层次综合养殖转变、深远海大型围栏不断优化构建智能化生态养殖模式等一系列海洋渔业产业升级外,海洋牧场作为我国海洋渔业发展的重要方向之一,如何进一步提升其功效受到广泛关注(杨金龙等, 2004; 杨红生, 2016; 吴文广等, 2022; 宋炜等, 2022)。
海洋牧场通常指资源增殖,主要通过增殖放流和人工鱼礁取得增殖效益,其目标是增加生物量、恢复资源和修复海洋生态系统(唐启升, 2019)。海洋牧场是一种以环境和生态和谐为目的导向的海洋渔业经济新业态,其中,人工鱼礁是指将人工构造物有目的地投放于海底,用以改善海域生态环境的人工设施,主要功能为丰富饵料生物、聚集渔业资源(Seaman, 2000; Manoudis et al, 2005; 唐启升, 2019; 索安宁等, 2022)。人工鱼礁的投放能改变礁体周围几百米海域的水环境状况(Wilding et al, 2002),包括对营养盐的循环及传输的影响(Alongi et al, 2008; 林军等, 2006),对沉积物生物化学变化的影响(Falcao et al, 2007)。与此同时,人工鱼礁也能为海洋生物提供良好的栖息环境(Henderson et al, 2014)。
人工鱼礁投放后,可以作为一种附着基,诱集周边生物逐渐附着在其表面。而附着的生物通常可作为礁区栖息鱼类和其他大型生物的主要饵料来源,因此,礁体表面附着生物的丰富度和多样性越高,能够诱集的生物数量就越多,种类也更加丰富。礁体上附着生物种类和数量的多寡是人工鱼礁生物效应的重要体现(2019)研究发现,3种材料鱼礁中,添加贝壳粉硅酸盐水泥的附着基上收集到的生物种类和生物量最大,生物附着效果最好;李真真等(2017)研究发现,5种混凝土鱼礁中,火山灰质硅酸盐水泥上的附着生物量最多,粉煤灰硅酸盐水泥上的生物种类最多;陈传曦等(2021)研究发现,渤海莱州湾芙蓉岛人工鱼礁区浮游动物群落组成存在明显的季节差异,但区域间无显著差异。
通常情况下,将具有洁净表面的附着材料投放到海水中,在其表面会迅速形成生物被膜(2010)研究表明,自然生物被膜可以促进珍珠牡蛎(Pinctada fucata)的幼虫附着;Unabia等(1999)研究发现,华美盘管虫(Hydroides elegans)幼体趋向附着于附有生物被膜的表面而非洁净的表面,且从生物被膜分离出的34株细菌中有11株成功诱导了华美盘管虫幼虫的附着。人工鱼礁投入水体后,可作为海洋水体细菌的附着基,在人工鱼礁表面形成生物被膜。但目前有关人工鱼礁表面细菌及其形成的生物被膜与贝类附着行为之间关系的研究鲜有报道。
本研究以我国东海重要的经济贝类厚壳贻贝(Mytilus coruscus)为对象,利用从人工鱼礁表面分离的9株细菌分别形成生物被膜并诱导厚壳贻贝稚贝附着,筛选得到一株高诱导活性细菌和一株低诱导活性细菌,对比分析这2株细菌形成单一细菌被膜的细菌密度、蛋白质及多糖含量等生物学特性,进一步探究不同细菌生物被膜与厚壳贻贝稚贝附着之间的关系,以期为人工鱼礁表面生境营造技术研发、以人工鱼礁为基础的海洋生态养殖业以及海洋资源的可持续发展提供支撑。
1 材料与方法 1.1 人工鱼礁海区投放与样品采集2021年10月,在浙江省舟山市嵊泗县枸杞乡后头湾码头贻贝养殖海区,以坐标点(122°46′ E; 30°43′ N)为中心,半径50 m的范围里投放9个边长为30 cm的白色亚克力板–正四面体结构型人工鱼礁,投放水深约为1 m。人工鱼礁投放后1个月在投放区域内随机选择人工鱼礁进行样品采集。用灭菌后的载玻片在拆卸后的人工鱼礁表面上随机刮取2 cm×2 cm区域的自然生物被膜至盛有20 mL灭菌过滤海水(autoclaved filtered sea water, AFSW)的小烧杯中形成悬浮液,每个面刮取3次,12个样品为一组。
1.2 人工鱼礁表面细菌的分离人工鱼礁表面细菌的分离参考Bao等(2007)的方法,将样品采集后得到的悬浮液稀释10 000倍后,通过2216E平板培养法分离、纯化,最终得到单一菌株。分离的海洋细菌均匀混合于保种液(0.9% NaCl, 30%甘油)中,–80 ℃保存。
1.3 分离细菌种属的鉴定细菌种属的鉴定参考Li等(2014)的方法。使用细菌基因组DNA试剂盒(上海博彩生物科技有限公司)提取所分离细菌的DNA,进行PCR扩增,再将扩增的PCR产物送至生工生物工程(上海)进行基因测序。将获得的基因序列上传至NCBI数据库,并进行Blast序列比对,得到分离菌株的种、属名及序列号等相关信息。
1.4 系统发育分析序列比对及系统发育分析参考杨金龙等(2015)的方法。使用MEGA 6.06软件进行分析,首先将序列与其近源物种的16S rRNA序列进行比对,再根据最大简约法(MP)、最小进化法(ME)和邻接法(NJ) 3种方法来进行系统发育分析,遗传距离的构建则使用Jukos-Cantor法。
1.5 制备单一细菌生物被膜生物被膜的制备参考杨金龙等(2015)的方法。将此前分离纯化的不同种属人工鱼礁表面细菌分别通过2216E液体培养基避光扩大培养24 h,培养温度为25 ℃。在1 600×g的条件下离心15 min去除培养基,并用AFSW清洗并重悬细菌细胞。细菌悬浮液稀释100倍后在0.22 μm滤膜上过滤,使用0.1%的吖啶橙染液避光染色5 min,在奥林巴斯BX51显微镜下放大1 000倍,随机选取10个视野计细菌密度,再根据计数结果将所对应的细菌悬浮液适量加入到盛有灭菌玻璃片的培养皿中,以达到实验所需的1×106、1×107、1×108和5×108 cells/mL初始细菌密度,最后在18 ℃下避光培养48 h完成生物被膜的制备。
1.6 厚壳贻贝稚贝附着实验本实验所用的厚壳贻贝稚贝来源于浙江省嵊泗县,由东海贻贝科技创新服务有限公司提供。所有稚贝需在实验室中避光暂养7 d,每隔2 d换水一次,养殖在18 ℃恒温环境下。以湛江等鞭金藻(Isochrysis zhanjiangensis)作为喂食饵料,每天投喂1次。
稚贝附着实验参考Yang等(2014)的方法。首先准备好灭菌的玻璃培养皿,每个培养皿中加入20 mL AFSW。再将表面附着有不同初始细菌密度下形成的生物被膜的玻片转移至玻璃培养皿中,每皿中加入10只稚贝,放置在18 ℃避光条件下,分别记录12、24和48 h的附着情况,计算不同时间点的稚贝附着率。每株菌的4个初始细菌密度实验组均设置9个平行,以玻璃培养皿中盛有等量AFSW和稚贝数的灭菌玻片作为空白对照组。
1.7 生物被膜细菌密度计数实验方法参考Yang等(2013)。将制备好的生物被膜使用福尔马林溶液固定24 h,再用AFSW轻轻涮洗3次,使用0.1%吖啶橙避光染色5 min后在奥林巴斯BX51显微镜下放大1 000倍,随机选取10个视野计细菌密度。每组设置3个平行。
1.8 生物被膜蛋白含量测定将Tissue Protein Extraction Reagent置于冰上预冷后,取适量试剂按照1∶99比例加入Protease Inhibitor Cocktail配制成1×工作液。用灭菌载玻片将生物被膜刮至盛有5 mL ddH2O的小烧杯中形成悬浮液,分次加入同一个1.5 mL离心管中,16 000×g离心1 min后去除上清液,得到生物被膜沉淀物。向所得沉淀物中加入300 μL 1×工作液,吹打混匀2 min,并在冰上孵育20 min后10 000×g离心20 min,转移上清液至新的离心管中,利用改良型BCA法蛋白质浓度测定试剂盒(上海生工生物工程)进行生物被膜蛋白质含量测定。每株菌设置3个平行组。
1.9 生物被膜多糖含量测定多糖含量测定参考张哲等(2017)的方法。采用灭菌载玻片将12片玻片上的生物被膜刮至盛有1 mL ddH2O的1.5 mL离心管中形成悬浮液,100 ℃沸水浴加热10 min,13 000×g离心15 min,收集上清液,加ddH2O至2 mL得到待测试液,并以2 mL蒸馏水作为对照组。分别加入1 mL苯酚水溶液(5%, m/V)和5 mL浓硫酸,80℃水浴加热反应20 min,冷却至室温后用分光光度计测定485 nm处的吸光度,每株菌设置3个平行组。
1.10 卡尔科弗卢尔定量分析纤维素含量纤维素含量测定参照Zeng等(2015)的方法。使用2216E液体培养基培养24 h的菌液,稀释至OD600 nm为1.5,加入15 μg/mL的卡尔科弗卢尔后,在30 ℃条件下震荡混匀2 h,并以未加入菌液的卡尔科弗卢尔作为阳性对照。在13 000×g条件下离心15 min后,在350 nm处测定吸光度,每株菌设置3个平行组。
1.11 数据处理人工鱼礁表面细菌对厚壳贻贝稚贝附着的诱导活性通过稚贝附着率来反映。通过JMP软件进行数据的统计分析。细菌诱导活性与细菌密度之间的相关性通过JMP中的Spearman多元分析法进行分析,P<0.05时则认为有显著性差异。
2 结果 2.1 人工鱼礁表面细菌的测序结果本实验分离鉴定得到的9株人工鱼礁表面细菌中,Mesoflavibacter sp.2属于拟杆菌门(Bacteroidetes),Pseudoalteromonas sp.31、Pseudoalteromonas sp.32、Vibrio sp.22和Phaeobacter sp.2同属于变形菌门(Proteobacteria),Exiguobacterium sp.1、Sutcliffiella sp.1、Cytobacillus sp.1和Jeotgalibacillus sp.1同属于厚壁菌门(Firmicutes),细菌具体的种、属名及序列号见表 1。
|
|
表 1 人工鱼礁表面细菌测序结果 Tab.1 Sequencing results of bacteria on the surface of artificial reefs |
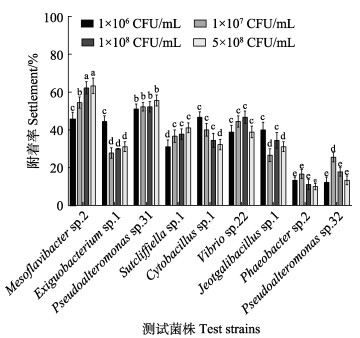
本实验中的9株细菌在所有实验时间内对厚壳贻贝稚贝附着的诱导活性趋势基本相同,因此,仅展示48 h时的附着率(图 1)。结果显示,9株人工鱼礁表面细菌对厚壳贻贝稚贝附着的诱导活性存在显著差异,其中,Mesoflavibacter sp.2诱导活性最高,在5×108 CFU/mL时,稚贝附着率达63.33%,而Phaeobacter sp.2诱导活性最低,在5×108 CFU/mL时,稚贝附着率仅有10%。
|
图 1 人工鱼礁表面细菌生物被膜 Fig.1 Inducing activity of M. coruscus plantigrade settlement on the different bacterial biofilm on the surface of artificial reefs 对厚壳贻贝稚贝附着的诱导率不同字母表示有显著性差异(P<0.05)。下同。 Different letters indicate significant differences (P<0.05). The same below. |
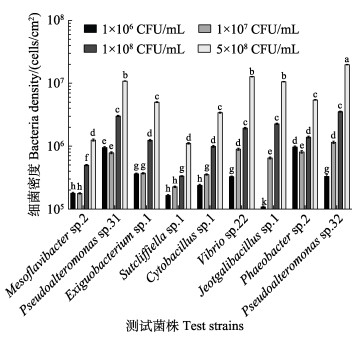
本实验中的9株细菌在初始细菌密度不同的情况下,最终其生物被膜的细菌密度也呈现出不同的变化趋势。如图 2所示,在5×108 CFU/mL初始细菌密度下,9株细菌的细菌密度均达到最高。同时,9株细菌中Pseudoalteromonas sp.32形成的生物被膜细菌密度最高,和其他8株细菌相比均有显著差异(P<0.05),Mesoflavibacter sp.2和Sutcliffiella sp.1形成的生物被膜细菌密度最低。
|
图 2 人工鱼礁表面细菌生物被膜的细菌密度 Fig.2 Bacteria density of different bacterial biofilm on the surface of artificial reefs |
本实验中的9株细菌的细菌密度与诱导活性之间的相关性分析结果如表 2所示。Sutcliffiella sp.1和Jeotgalibacillus sp.1的细菌密度与诱导活性呈显著正相关,Cytobacillus sp.1和Phaeobacter sp.2的细菌密度与诱导活性呈显著负相关(P<0.05)。
|
|
表 2 人工鱼礁表面细菌生物被膜细菌密度与诱导活性之间的相关性 Tab.2 Correlation between bacteria density and inducing activity of bacterial biofilm on the surface of artificial reefs |
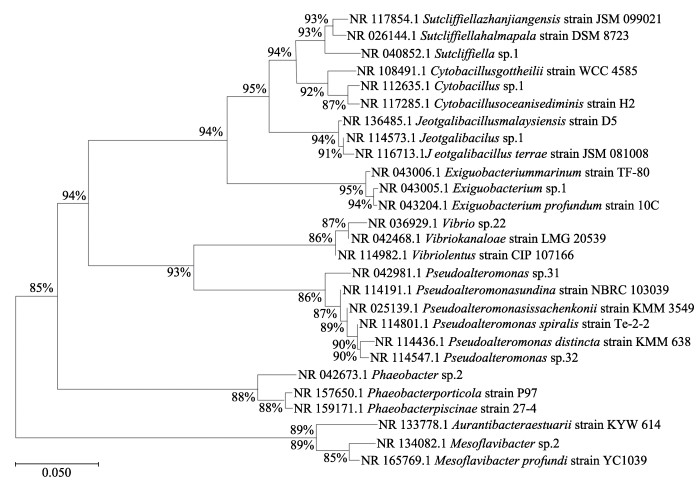
通过3种方法进行人工鱼礁表面细菌的系统发育所得到的结果一致,本研究展示以邻接法的分析结果(图 3)。表 3为本研究所用细菌的遗传距离。结果显示,同属于假交替单胞菌属的Pseudoalteromonas sp.31与Pseudoalteromonas sp.32之间遗传距离为0.027 9,是所有人工鱼礁表面分离得到的细菌中遗传距离最近的;Mesoflavibacter sp.2与Jeotgalibacillus sp.1的遗传距离为0.414 6,是所有人工鱼礁表面细菌中遗传距离最远的。上述2株细菌聚为一支后与Jeotgalibacillus sp.1和Exiguobacterium sp.1聚为一支。这一分支再与Phaeobacter sp.2聚为一支,之后与同属于变形菌门的Pseudoalteromonas sp.31、Pseudoalteromonas sp.32和Vibrio sp.22聚为另一分支,最后再和属于拟杆菌门的Mesoflavibacter sp.2聚类。
|
图 3 本研究中人工鱼礁表面细菌的系统发育树 Fig.3 Phylogenetic tree of bacteria on the surface of artificial reefs in this study |
|
|
表 3 本研究中人工鱼礁表面细菌的遗传距离 Tab.3 Genetic distance of bacteria on the surface of artificial reefs in this study |
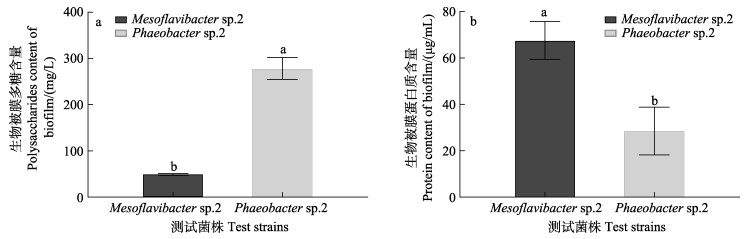
低诱导活性细菌Phaeobacter sp.2形成的生物被膜多糖含量要显著高于高诱导活性细菌Mesoflavibacter sp.2 (P<0.05),提高了近5倍(图 4a)。Phaeobacter sp.2形成的生物被膜所含蛋白质总量显著低于Mesoflavibacter sp.2 (P<0.05),相比之下降低了57.79% (图 4b)。通过分析蛋白质、多糖含量与其诱导活性的相关性发现(表 4),多糖与稚贝的诱导活性呈显著负相关(P<0.05),而蛋白质与对稚贝的诱导活性呈正相关性(P<0.05)。
|
图 4 生物被膜蛋白质及多糖含量分析 Fig.4 Content analysis of proteins and polysaccharides in biofilms |
|
|
表 4 生物被膜蛋白质及多糖含量与稚贝诱导活性的相关性分析 Tab.4 Correlation analysis of proteins and polysaccharides in biofilms and inducing activity of M. coruscus plantigrade settlement |
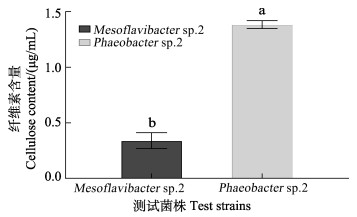
通过卡尔科弗卢尔试剂对高诱导活性细菌Mesoflavibacter sp.2和低诱导活性细菌Phaeobacter sp.2进行荧光增白,发现生物被膜多糖含量较高的细菌Phaeobacter sp.2含有的纤维素含量也更高,相较于Mesoflavibacter sp.2菌株,其纤维素含量增加3.07倍(图 5) (P<0.05)。
|
图 5 纤维素含量比较 Fig.5 Comparison of cellulose content |
本研究中,从人工鱼礁表面分离的9株海洋细菌分别属于Mesoflavibacter、Pseudoalteromonas、Exiguobacterium、Sutcliffiella、Cytobacillus、Vibrio、Jeotgalibacillus和Phaeobacter等8个菌属,其中,Mesoflavibacter、Pseudoalteromonas、Vibrio和Phaeobacter菌属在以往的厚壳贻贝肠道细菌相关研究中同样存在(徐嘉康等, 2021; 杨娜等, 2017)。9株细菌形成的单一细菌生物被膜对厚壳贻贝稚贝附着的诱导活性不同,且同一菌属的不同菌种之间诱导活性也不同,这说明单一细菌生物被膜对厚壳贻贝稚贝附着的诱导活性与细菌菌种无关,此前的研究也证实了这一点(Yang et al, 2013; Li et al, 2014; 杨金龙等, 2015)。
以往研究表明,细菌密度作为生物被膜的生物学特性之一,与海洋无脊椎动物的附着过程息息相关。孙俊杰等(2015)研究表明,从硅烷基化的附着基表面获取的9株测试菌株中,有7株海洋细菌对厚壳贻贝稚贝附着的诱导活性与其生物被膜细菌密度显著相关。Li等(2014)研究发现,从玻璃表面附着的自然生物被膜上分离得到的10株海洋细菌中,9株对厚壳贻贝稚贝附着的诱导活性与单一细菌生物被膜的细菌密度呈显著相关。而在厚壳贻贝肠道菌群的相关研究中,杨娜等(2017)研究发现,10株测试的厚壳贻贝肠道细菌中,仅有5株呈显著相关;徐嘉康等(2021)研究表明,测试的10株厚壳贻贝肠道细菌中,有6株的厚壳贻贝稚贝诱导活性与其生物被膜细菌密度显著相关。在本研究中,测试的9株人工鱼礁表面细菌中,仅有4株细菌形成的生物被膜密度与附着率呈显著相关。由此推测,虽然细菌密度在厚壳贻贝稚贝附着的过程中发挥着一定的作用,但并不适用于所有的海洋细菌,可能与菌株的来源有关。此外,本研究还发现,随着初始细菌密度的升高,各菌株对厚壳贻贝稚贝附着的诱导活性变化趋势也不尽相同,这说明并非初始细菌密度越高,稚贝的附着率就越高,各菌株都有各自的最适细菌密度,且与细菌种属有关,这与以往研究结果相同(杨娜等, 2017; Peng et al, 2020b)。
对本研究分离得到的9株细菌的遗传进化与厚壳贻贝稚贝附着诱导活性进行相关性分析,系统发育分析的结果显示,Pseudoalteromonas sp.31与Pseudoalteromonas sp.32的遗传距离最近,其对厚壳贻贝稚贝的诱导活性具有显著差异;而Mesoflavibacter sp.2与Jeotgalibacillus sp.1的遗传距离最远,二者对厚壳贻贝稚贝的诱导活性也具有显著差异,这说明细菌遗传距离的远近与厚壳贻贝稚贝的附着无关,与以往结论相一致(Yang et al, 2013)。
以往的研究表明,某些特定细菌分泌的化学信号诱导分子可能在贝类等海洋无脊椎动物的附着变态中发挥着一定的作用(Yang et al, 2013; Chung et al, 2010; Fuqua et al, 1994; Tran et al, 2011)。本研究选取了对厚壳贻贝稚贝具有高诱导活性的Mesoflavibacter sp.2及低诱导活性的Phaeobacter sp.2两株细菌进行生物被膜胞外蛋白分析,发现其生物被膜对厚壳贻贝稚贝的诱导活性与蛋白含量呈显著正相关。结合实验室以往对胞外蛋白质的研究,发现P. marina鞭毛蛋白合成基因fliP缺失和鞭毛蛋白fliC-02330基因缺失均导致生物被膜上蛋白质含量显著增高、β-多糖含量显著降低,同时降低了厚壳贻贝幼虫的附着变态率(Liang et al, 2020; 蔡雨姗等, 2022);且在P. marina形成生物被膜的过程中,添加鞭毛蛋白能够显著增加生物被膜上蛋白质、多糖等物质的含量,促进厚壳贻贝稚贝的附着(蔡雨姗等, 2021)。在本研究中,Phaeobacter sp.2形成的生物被膜蛋白质含量较Mesoflavibacter sp.2低,据此推测,Mesoflavibacter sp.2生物被膜中的某类蛋白质可能影响了多糖类物质的产生,导致形成的生物被膜对厚壳贻贝稚贝附着表现出低诱导活性。
本研究中,2株测试菌株的生物被膜多糖含量与诱导活性呈显著负相关。根据以往对多糖的研究可知,弧菌形成的生物被膜上胞外多糖的变化规律则与稚贝附着情况变化相一致(2021)的研究中,2株测试菌株的生物被膜胞外产物中,α-多糖与厚壳贻贝附着诱导活性呈显著负相关,该发现与本实验结果类似。多糖类物质对厚壳贻贝附着变态诱导能力的研究表明,脂多糖(吴静娴等, 2022)、藻酸盐(陈慧娥等, 2022)、可拉酸(Peng et al, 2020a)等多糖类物质会促进厚壳贻贝的附着变态。然而,本研究Phaeobacter sp.2形成的生物被膜多糖含量较Mesoflavibacter sp.2显著升高,据此推测可能是Phaeobacter sp.1分泌的多糖类物质中含有抑制性活性物,对厚壳贻贝稚贝表现出低诱导活性。通过测定Mesoflavibacter sp.2和Phaeobacter sp.2两株菌株产生纤维素的能力发现,低诱导活性菌株Phaeobacter sp.2的纤维素含量是高诱导活性菌株Mesoflavibacter sp.2的4倍,由此推测,2株细菌的诱导活性差异是纤维素含量变化的结果。相似的,以往研究发现,纤维素能够抑制厚壳贻贝附着变态的作用(梁箫等, 2020b; 邵安琪等, 2023)。同时,在对P. marina纤维素合成基因bcsQ的研究中发现,该基因的缺失会导致生物被膜的形成能力下降,胞内c-di-GMP含量下降,通过影响c-di-GMP含量调控多糖分泌,降低了厚壳贻贝幼虫附着变态率(Liang et al, 2021)。这一结果表明,细菌种属虽然对厚壳贻贝稚贝的附着没有直接影响,但细菌可能通过影响胞外产物分泌间接影响厚壳贻贝的附着。
综上所述,本研究中的9株人工鱼礁表面细菌对厚壳贻贝稚贝附着的诱导能力存在显著性差异,但与细菌之间的遗传距离无必然关联。通过测试2株对厚壳贻贝稚贝具有不同程度诱导活性的菌株生物被膜所含活性物质的含量,发现生物被膜中蛋白质与多糖含量均对厚壳贻贝稚贝附着有一定的影响作用,同时,对纤维素含量测定的实验验证了特定多糖类物质对厚壳贻贝稚贝附着的负调控作用。本研究首次探索了人工鱼礁表面细菌对厚壳贻贝稚贝附着的影响,为后续进一步在自然海区开展人工鱼礁表面生物被膜与海洋无脊椎动物附着的互作关系研究奠定理论基础,同时,对于人工鱼礁表面海洋生物附着机制的研究具有重要的实践价值。
ALONGI D M, TROTT L A, PFITZNER J. Biogeochemistry of inter-reef sediments on the northern and central Great Barrier Reef. Coral Reefs, 2008, 27(2): 407-420 DOI:10.1007/s00338-007-0347-2 |
BAO W Y, YANG J L, SATUITO C G, et al. Larval metamorphosis of the mussel Mytilus galloprovincialis in response to Alteromonas sp.1: Evidence for two chemical cues?. Marine Biology, 2007, 152(3): 657-666 DOI:10.1007/s00227-007-0720-2 |
CAI Y S, REN H Y, ZHU Y T, et al. Deletion of fliC-02330 from Pseudoalteromonas marina affects the biofilm formation and the settlement and metamorphosis of Mytilus coruscus. Microbiology China, 2022, 49(3): 899-910 [蔡雨姗, 任泓妤, 竹攸汀, 等. 海假交替单胞菌fliC-02330基因缺失影响生物被膜形成及厚壳贻贝幼虫附着变态. 微生物学通报, 2022, 49(3): 899-910] |
CAI Y S, ZHANG X K, ZHU Y T, et al. Effects of Pseudoalteromonas marina flagellin on biofilm formation and settlement of Mytilus coruscus. Acta Oceanologica Sinica, 2021, 43(4): 75-83 [蔡雨珊, 张秀坤, 竹攸汀, 等. 海假交替单胞菌(Pseudoalteromonas marina)鞭毛蛋白对生物被膜形成及厚壳贻贝附着的影响. 海洋学报, 2021, 43(4): 75-83] |
CHEN C X, ZHANG J B, WANG X M, et al. Zooplankton community structure and its relationship with environmental factors in an artificial reef near Furong Island, Laizhou Bay, Bohai Sea. Journal of Fishery Sciences of China, 2021, 28(3): 299-313 [陈传曦, 张建柏, 王新萌, 等. 渤海莱州湾芙蓉岛人工鱼礁区浮游动物群落结构特征及其与环境因子的关系. 中国水产科学, 2021, 28(3): 299-313] |
CHEN H E, HE K, HE C H, et al. Effects of alginate on biofilm formation of Pseudoalteromonas marina and larval settlement and metamorphosis of the mussel Mytilus coruscus. Journal of Dalian Ocean University, 2022, 37(4): 620-626 [陈慧娥, 贺康, 贺楚晗, 等. 藻酸盐对海假交替单胞菌生物被膜形成及厚壳贻贝附着变态的影响. 大连海洋大学学报, 2022, 37(4): 620-626] |
CHUNG H C, LEE O O, HUANG Y L, et al. Bacterial community succession and chemical profiles of subtidal biofilms in relation to larval settlement of the polychaete Hydroides elegans. ISME Journal, 2010, 4(6): 817-828 DOI:10.1038/ismej.2009.157 |
FALCAO M, SANTOS M N, VICENTE M, et al. Biogeochemical processes and nutrient cycling within an artificial reef off Southern Portugal. Marine Environmental Research, 2007, 63(5): 429-444 DOI:10.1016/j.marenvres.2006.12.001 |
FUQUA W C, WINANS S C, GREENBERG E P. Quorum sensing in bacteria: The LuxR-LuxI family of cell density- responsive transcriptional regulators. Journal of Bacteriology, 1994, 176(2): 269-275 DOI:10.1128/jb.176.2.269-275.1994 |
HENDERSON M J, FABRIZIO M C, LUCY J A. Movement patterns of summer flounder near an artificial reef: Effects of fish size and environmental cues. Fisheries Research, 2014, 153: 1-8 DOI:10.1016/j.fishres.2014.01.001 |
JIANG Z Y, GUO Z S, ZHU L X, et al. Structural design principle and research progress of artificial reef. Journal of Fisheries of China, 2019, 43(9): 1881-1889 [姜昭阳, 郭战胜, 朱立新, 等. 人工鱼礁结构设计原理与研究进展. 水产学报, 2019, 43(9): 1881-1889] |
LI Y F, GUO X P, YANG J L, et al. Effects of bacterial biofilms on settlement of plantigrades of the mussel Mytilus coruscus. Aquaculture, 2014, 433: 434-441 DOI:10.1016/j.aquaculture.2014.06.031 |
LI Z Z, GONG P H, GUAN C T, et al. Study on the organisms attachment of artificial reefs constructed with five different cements. Progress in Fishery Sciences, 2017, 38(5): 57-63 [李真真, 公丕海, 关长涛, 等. 不同水泥类型混凝土人工鱼礁的生物附着效果. 渔业科学进展, 2017, 38(5): 57-63] |
LIANG X, LIU H Y, YANG L T, et al. Effects of dynamic succession of Vibrio biofilms on settlement of the mussel Mytilus coruscus. Journal of Fisheries of China, 2020a, 44(1): 118-129 [梁箫, 刘红雨, 杨丽婷, 等. 弧菌生物被膜的动态演替对厚壳贻贝附着的影响. 水产学报, 2020a, 44(1): 118-129] |
LIANG X, TONG H, PENG L H, et al. Regulation of formation of biofilms and larval settlement and metamorphosis of mussel Mytilus coruscus by cellulose. Journal of Dalian Ocean University, 2020b, 35(1): 75-82 [梁箫, 童欢, 彭莉华, 等. 纤维素对海洋细菌生物被膜形成及厚壳贻贝幼虫附着变态的调控. 大连海洋大学学报, 2020b, 35(1): 75-82] |
LIANG X, ZHANG X K, PENG L H, et al. The flagellar gene regulates biofilm formation and mussel larval settlement and metamorphosis. International Journal of Molecular Sciences, 2020, 21(3): 710 DOI:10.3390/ijms21030710 |
LIANG X, ZHANG J B, SHAO A Q, et al. Bacterial cellulose synthesis gene regulates cellular c-di-GMP that control biofilm formation and mussel larval settlement. International Biodeterioration and Biodegradation, 2021, 165: 105330 DOI:10.1016/j.ibiod.2021.105330 |
LIN J, ZHANG S Y. Research advances on physical stability and ecological effects of artificial reef. Marine Fisheries, 2006, 28(3): 257-262 [林军, 章守宇. 人工鱼礁物理稳定性及其生态效应的研究进展. 海洋渔业, 2006, 28(3): 257-262 DOI:10.3969/j.issn.1004-2490.2006.03.015] |
MANOUDIS G, ANTONIADOU C, DOUNAS K, et al. Successional stages of experimental artificial reefs deployed in Vistonikos Gulf (N. Aegean Sea, Greece): Preliminary results. Belgian Journal of Zoology, 2005, 135(2): 209-215 |
PENG L H, LIANG X, CHANG R H, et al. A bacterial polysaccharide biosynthesis-related gene inversely regulates larval settlement and metamorphosis of Mytilus coruscus. Biofouling, 2020a, 36(7): 753-765 DOI:10.1080/08927014.2020.1807520 |
PENG L H, LIANG X, XU J K, et al. Monospecific biofilms of Pseudoalteromonas promote larval settlement and metamorphosis of Mytilus coruscus. Scientific Reports, 2020b, 10(1): 2577 DOI:10.1038/s41598-020-59506-1 |
SEAMAN W J. Artificial reef evaluation: With application to natural marine habitats. CRC Press, 2000
|
SHAO A Q, LI J Z, ZHANG J B, et al. Effect of cellulose on Pseudoalteromonas marina biofilm extracellular products and larval settlement and metamorphosis of Mytilus coruscus. Journal of Fisheries of China, 2023, 47(8): 118-125 [邵安琪, 李嘉政, 张俊波, 等. 纤维素对海假交替单胞菌生物被膜生物学特性及厚壳贻贝幼虫附着变态的影响. 水产学报, 2023, 47(8): 118-125] |
SONG W, HAN X C, XIE Z L, et al. Development status and the prospect of deep-sea large-scale fence culture in China. Progress in Fishery Sciences, 2022, 43(6): 111-120 [宋炜, 韩昕辰, 谢正丽, 等. 我国深远海大型围栏养殖发展现状与展望. 渔业科学进展, 2022, 43(6): 111-120] |
SUN J J, ZHANG X, GUO X P, et al. Effects of marinebacteria from silanizing surfaces on plantigrade settlement of the mussel Mytilus coruscus. Journal of Fisheries of China, 2015, 39(10): 1530-1538 [孙俊杰, 张显, 郭行磐, 等. 硅烷化表面海洋细菌对厚壳贻贝稚贝附着的影响. 水产学报, 2015, 39(10): 1530-1538] |
SUO A N, DING D W, YANG J L, et al. Application analysis of "three fields and one channel" theory in marine ranching habitat construction. Marine Fisheries, 2022, 44(1): 1-8 [索安宁, 丁德文, 杨金龙, 等. 海洋牧场生境营造中"三场一通道"理论应用研究. 海洋渔业, 2022, 44(1): 1-8 DOI:10.3969/j.issn.1004-2490.2022.01.001] |
TANG Q S. Fishery resources breeding, marine pasture, breeding fishery and its development orientation. China Fisheries, 2019(5): 28-29 [唐启升. 渔业资源增殖、海洋牧场、增殖渔业及其发展定位. 中国水产, 2019(5): 28-29] |
TRAN C, HADFIELD M G. Larvae of Pocillopora damicornis (Anthozoa) settle and metamorphose in response to surface-biofilm bacteria. Marine Ecology Progress Series, 2011, 433: 85-96 DOI:10.3354/meps09192 |
UNABIA C R C, HADFIELD M G. Role of bacteria in larval settlement and metamorphosis of the polychaete Hydroides elegans. Marine Biology, 1999, 133(1): 55-64 DOI:10.1007/s002270050442 |
WANG Z, GONG P H, GUAN C T, et al. Effect of different artificial reefs on the community structureof organisms in Shique Beach of Qingdao. Progress in Fishery Sciences, 2019, 40(4): 163-171 [王震, 公丕海, 关长涛, 等. 青岛石雀滩海域人工鱼礁材料对附着生物群落结构的影响. 渔业科学进展, 2019, 40(4): 163-171] |
WILDING T A, SAYER M D J. Evaluating artificial reef performance: approaches to pre- and post-deployment research. ICES Journal of Marine Science, 2002, 59: S222-S230 DOI:10.1006/jmsc.2002.1266 |
WU J X, LI J Z, HU X M, et al. Effects of lipopolysaccharide on biofilm formation and larval metamorphosis of the mussel Mytilus coruscus. Journal of Fisheries of China, 2022, 46(11): 2134-2142 [吴静娴, 李嘉政, 胡晓梦, 等. 脂多糖对细菌生物被膜形成及厚壳贻贝幼虫变态的影响. 水产学报, 2022, 46(11): 2134-2142] |
WU W G, ZHANG J H, LIU Y, et al. Analysis of the effectiveness of the polyculture of shellfish and algae and influencing factors in the Xuejiadao sea cage aquaculture area. Progress in Fishery Sciences, 2022, 43(3): 146-155 [吴文广, 张继红, 刘毅, 等. 薛家岛海水网箱养殖海域贝藻综合养殖效果及其影响因素分析. 渔业科学进展, 2022, 43(3): 146-155] |
XU J K, WANG J S, FANG Y H, et al. Effects of intestinal bacterial biofilms on settlement process of larvae and plantigrades in Mytilus coruscus. Acta Oceanologica Sinica, 2021, 43(9): 81-91 [徐嘉康, 王劲松, 方怡涵, 等. 厚壳贻贝肠道细菌的生物被膜对其幼虫和稚贝附着的影响. 海洋学报, 2021, 43(9): 81-91] |
YANG H S, HUO D, XU Q. Views on modern marine ranching. Journal of Oceans and Limnology, 2016, 47(6): 1069-1074 [杨红生, 霍达, 许强. 现代海洋牧场建设之我见. 海洋与湖沼, 2016, 47(6): 1069-1074] |
YANG H S. Construction of marine ranching in China: Reviews and prospects. Journal of Fisheries of China, 2016, 40(7): 1133-1140 [杨红生. 我国海洋牧场建设回顾与展望. 水产学报, 2016, 40(7): 1133-1140] |
YANG J L, GUO X P, CHEN Y R, et al. Effects of bacterial biofilms formed on middle wetability surfaces on settlement of plantigrades of the mussel Mytilus coruscus. Journal of Fisheries of China, 2015, 39(3): 421-428 [杨金龙, 郭行磐, 陈芋如, 等. 中湿度表面的海洋细菌对厚壳贻贝稚贝附着的影响. 水产学报, 2015, 39(3): 421-428] |
YANG J L, LI X, LIANG X, et al. Effects of natural biofilms on settlement of plantigrades of the mussel Mytilus coruscus. Aquaculture, 2014, 424: 228-233 |
YANG J L, SHEN P J, LIANG X, et al. Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to monospecific bacterial biofilms. Biofouling, 2013, 29(3): 247-259 |
YANG J L, SHEN P J, WANG C, et al. Effects of biofilms on settlement of plantigrades of the mussel Mytilus coruscus. Journal of Fisheries of China, 2013, 37(6): 904-909 [杨金龙, 慎佩晶, 王冲, 等. 微生物膜对厚壳贻贝稚贝附着的影响. 水产学报, 2013, 37(6): 904-909] |
YANG J L, WU X Y, SHI G F, et al. Overview of marine ranching technology. Chinese Fisheries Economics, 2004(5): 48-50 [杨金龙, 吴晓郁, 石国峰, 等. 海洋牧场技术的研究现状和发展趋势. 中国渔业经济, 2004(5): 48-50] |
YANG N, LIANG X, PENG L H, et al. Effects of gut bacteria on the settlement of spats of Mytilus coruscus. Journal of Marine Sciences, 2017, 41(11): 45-54 [杨娜, 梁箫, 彭莉华, 等. 肠道细菌对厚壳贻贝稚贝附着的作用研究. 海洋科学, 2017, 41(11): 45-54] |
YU X J, HE W H, LI H X, et al. Larval settlement and metamorphosis of the pearl oyster Pinctada fucata in response to biofilms. Aquaculture, 2010, 306(1/2/3/4): 334-337 |
ZENG Z, GUO X P, LI B, et al. Characterization of self-generated variants in Pseudoalteromonas lipolytica biofilm with increased antifouling activities. Applied Microbiology and Biotechnology, 2015, 99(23): 10127-10139 |
ZHANG Z, YANG F, LI X P, et al. Optimization fo extraction and content determination of capsular polysaccharide from Streptococcus agalactiae. Progress in Veterinary Medicine, 2017, 38(7): 41-45 [张哲, 杨峰, 李新圃, 等. 无乳链球菌荚膜多糖的粗提及多糖含量测定条件优化. 动物医学进展, 2017, 38(7): 41-45] |



