2. 中国水产科学研究院 农业农村部水产品质量安全控制重点实验室 北京 100141
2. Key Laboratory of Control of Quality and Safety for Aquatic Products, Ministry of Agriculture and Rural Affairs, Chinese Academy of Fishery Sciences, Beijing 100141, China
鱼虱病是水产养殖中常见的寄生虫病,会导致鱼体生长速率降低、死亡率提高,且鱼肉品质严重降低,对水产养殖业造成巨大经济损失。除虫脲(diflubenzuron, DFB)作为一种病害虫防控的新型药剂,其杀虫机理主要是通过抑制体内几丁质的生物合成(乔璐等, 2022),进而阻碍害虫蜕皮、变态发育及直接杀卵等方面来控制其生长发育和繁殖。因其具有杀虫谱广、选择性强、生物活性高等特点,在水产动物(刘亿婕, 2021)、畜禽动物(徐玉珍等, 2022)、农作物(辛天蓉等, 2019)等病虫害防治领域广泛应用。
近年来,已有学者在农田灌溉水、河水、湖水以及海域表层沉积物等环境基质中监测到DFB的存在(贾叶青等, 2019; Placencia et al, 2018),并发现其在水中降解半衰期长达80~96 d。残存的DFB及其代谢产物不仅会对自然环境造成污染,同时很容易在水产动物体内残留积累,并伴随着食物链进入人体,可能会影响人体器官的基本功能,损伤遗传基因,具有潜在致畸、致癌、致突变性(胡存中, 2019)。Parsons等(2021)研究发现,DFB会在海洋沉积物上积累,并对底栖海洋生物群落结构与物种多样性造成影响。DFB对淡水鱼的急性毒性研究发现,除虫脲对鱼类的半致死浓度(LC50)为10~12 mg/L,而且除虫脲会对鱼体造成组织损伤,并以剂量依赖的方式造成鱼类死亡(Abe et al, 2019)。目前,国内外有关DFB杀虫剂的研究仅限于用法用量、残留代谢情况及其对环境的毒理影响,有关DFB对鱼类暴露分子毒性响应机制尚鲜有报道。
随着科技的发展,转录组学技术逐渐成为研究水生生物毒理学机制的重要手段,通过获取水生生物响应环境因子相关转录组学信息,进而从分子层面阐释其对水生生物的作用机制(Zhang et al, 2017; 罗辉等, 2015)。Xu等(2022)利用转录组学技术揭示了水环境中四环素暴露对罗非鱼(Oreochromis niloticus)鳃的毒理机制。Zheng等(2021)利用转录组学揭示了2, 2´, 4, 4´ -四溴二苯醚暴露对斑马鱼(Danio rerio)早期神经发育毒性的影响。孙晶等(2022)采用转录组学技术解析了环境中氧化石墨烯和多环芳烃复合暴露对成年斑马鱼脑组织的分子毒理效应。
鲤(Cyprinus carpio)是我国重要的淡水鱼养殖品种,广泛分布于江河、湖泊、池沼等水体底层,是探究DFB对鱼类毒理作用的理想模型。肝脏作为机体参与糖代谢、脂质代谢、蛋白质代谢以及能量代谢的代谢中枢(Kietzmann et al, 2019),能够率先感知外界环境的有害刺激并迅速做出机体响应,是研究DFB分子毒害机制的理想靶器官。
本研究采用RNA-Seq转录组测序技术对不同DFB暴露浓度下鲤肝脏的基因表达差异进行分析,探讨其对水生动物在基因层面的毒理作用,揭示环境相关浓度DFB暴露对鱼类的毒理分子响应机制,以期为其在水产领域的限量标准制定和环境安全评价提供科学基础。
1 材料与方法 1.1 实验样品及处理 1.1.1 实验鱼从天津某养殖场选择个体质量为(150±20) g/尾的福瑞鲤,运输至中国水产科学研究院房山五渡实验基地实验室,用2%食盐水消毒10 min,然后投放于用高锰酸钾消毒过的水族缸(直径200 cm, 高45 cm)中暂养2周。暂养期间每日08:00~09:00和16:00~l7:00各投喂1次饲料,日投喂总量为鱼体总重量的1.5%,每天换水1次(20%体积)。
1.1.2 暴露实验暂养结束后,选择规格整齐、活跃、无明显外伤的个体进行实验,实验前停饲24 h。文献报道除虫脲对罗非鱼的LC50为10~12 mg/L,药浴实验时,根据GB/T 31270.7-2014《化学农药环境安全评价试验准则第7部分:生物富集试验》,设置2个除虫脲浓度组:高浓度药浴浓度为1.00 mg/L,该浓度低于半致死浓度10倍,为可生存较高浓度;低浓度药浴浓度为0.10 mg/L,低于半致死浓度100倍。将实验设置为低浓度组、高浓度组和对照组,每组3个重复,每个重复20条。养殖实验用水为存放并曝气去氯处理24 h以上的自来水。采用连续充氧,保持水中溶氧 > 8.0 mg/L,水温为(20.0±1.0) ℃,pH为7.2±0.2,总硬度为(28.00±0.05) mg/L,盐度为0.60±0.02,白天和黑夜的光照时间保持在12/12 h。采用半静态换水补药的方式,于0.10 mg/L和1.00 mg/L DFB暴露浓度下养殖15 d。
1.1.3 样品采集于第15天采样,采样前24 h停止喂食。3组各取6条鲤(每个平行组随机取2条鲤)用MS-222麻醉后将其放置在医用垫上,并用冰袋保持鱼处于低温状态下,快速分离其肝脏,放置于无酶管中,随后置于低温冰盒中,用于后续转录分析使用。
1.2 总RNA提取、文库构建及测序分别取低浓度组、高浓度组和对照组鲤的肝脏组织(每个平行组中2条鲤的肝脏组织混合),采用TRIzol液(Ambion/Invitrogen, 美国)提取鱼肝脏的总RNA,通过Oligo (dT)富集mRNA,随后在fragmentation buffer中用二价阳离子片段化RNA,接着反转合成DNA连接adaptor。使用NanoDrop 2000分光光度计和琼脂糖凝胶电泳分别对RNA纯度和质量进行检验。使用Agilent 2100生物分析仪和Qubit 2.0荧光计分别对RNA进行完整性和定量检测。对检测合格的RNA样品构建文库,文库构建所用试剂盒为NEBNext® Ultra™ RNA library prep kit for Illumina®。转录组文库建成后,用qRT-PCR对文库有效浓度进行准确定量(文库有效浓度高于2 nmol/L),并用Agilent 2100和Qubit 2.0分别检测文库的插入片段和定量分析。库检合格后,采用Illumina NovaSeq 6000 (Illumina, 美国)进行高通量测序。
1.3 数据质控统计去除原始序列数据(raw reads)中带接头(adapter)的reads、含N (N表示无法确定碱基信息)的reads和低质量reads (Qphred≤20的碱基数占全部read长度的50%以上的reads)。利用HISAT2软件将clean reads与参考基因组进行快速精确的比对,获取reads在参考基因组上的定位信息(Mortazavi et al, 2008),将得到的unique map用于后续定量数据分析。使用StringTie软件完成新转录本组装,对新转录本进行GO、KEGG数据库注释。
1.4 基因定量分析采用subread软件中featureCounts工具(Liao et al, 2014)计算各样本所有基因的表达值(FPKM),用于估计不同样本间的基因表达水平,并先后对测序深度和基因长度进行校正(Bray et al, 2016)。根据各样本所有基因的FPKM值计算组内及组间样本的相关性系数R2,并绘制样本相关性图。为了评估组间差异及组内样本重复情况,本研究对所有样本的基因表达值(FPKM)采用主成分分析(PCA)方法对数以万计的基因变量进行降维及主成分提取。
1.5 差异表达基因的筛选及分析通过DESeq2软件包以Padj < 0.05和|log2Fold Change|≥1为标准筛选差异表达基因(DEGs),使用clusterProfiler (3.8.1)软件完成DEGs的功能富集分析和通路分析(GO功能注释和KEGG通路富集分析)。
2 结果 2.1 转录组的测序与组装鲤肝脏转录组测序的数据质量及比对结果见表 1,GC含量为46.25%~47.96%,Q20为97.49%~97.82%,Q30为93.23%~93.86%,错配率为0.03%。将各样品的clean_reads与鲤参考基因组进行序列比对,比对率达79.59%以上。上述结果表明,转录组测序质量良好,可以开展后续的生物信息分析。
|
|
表 1 转录组测序质量和序列比对 Tab.1 Quality and sequence alignment of transcriptomics sequencing |
将鲤肝脏的对照组与DFB急性胁迫组样本所匹配到的基因进行对比分析。如图 1A所示,在肝脏组织中3组之间共表达的基因有31 950个,分别有1 990、2 917、1 759个基因在LC组、LL组、LH组特异表达;样本间基因表达水平相关性是检验实验可靠性和样本选择是否合理的重要指标。根据各样本所有基因的FPKM值计算组内及组间样本的皮尔逊相关系数,R2越接近1,表明样本间相关性系数越高,其表达模式越接近。图 1B为样本相关性热图。
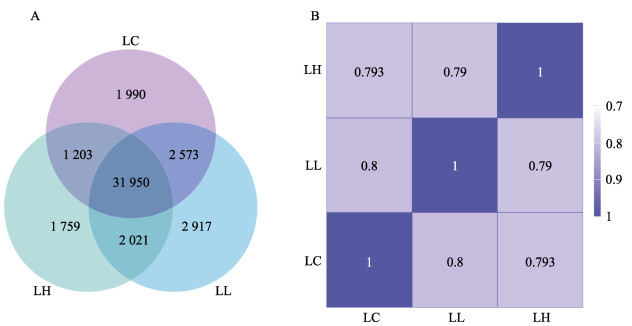
|
图 1 样本基因表达水平分析 Fig.1 Sample gene expression level analysis A为基因表达韦恩图,B为样本相关性热图。LC、LL和LH分别表示对照组、低浓度组和高浓度组。图 2同。 A: Venn diagram of gene expression; B: Sample correlation heatmap. LC, LL, and LH are liver control group, liver low concentration group, and liver high concentration group respectively. The same as in Fig. 2. |
对DFB暴露组的肝脏DEGs以Padj < 0.05和|log2Fold Change|≥1为标准进行筛选。采用层次聚类分析法对各组基因的FPKM值进行均一化处理(Z-score),各组间DEGs的相对表达量和它们之间的关系以热图的形式展示。如图 2A所示,这些DEGs在对照组与各实验组之间有明显的分色,并且随着DFB浓度的增加,这种差异愈发明显。图 2C~D的火山图展示了各组DEGs的总体分布情况。与对照组相比,LL组含有1 195个上调的DEGs和1 211个下调的DEGs,LH组含有1 394个上调的DEGs和1 294个下调的DEGs,2组共表达的DEGs有821个(图 2B),结果表明,3组之间存在显著差异表达。提示DEB暴露对鲤肝脏的转录有显著影响。
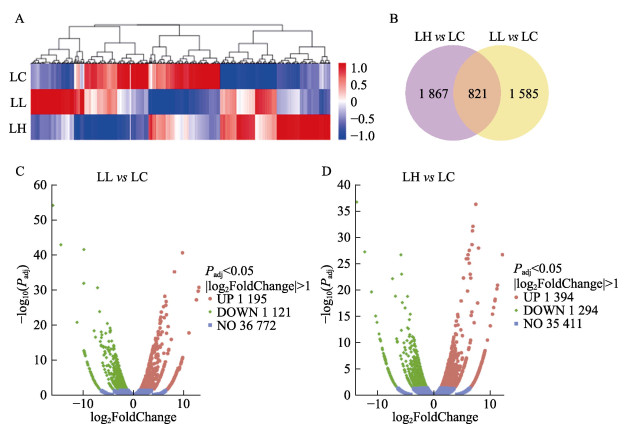
|
图 2 差异表达基因分析 Fig.2 Analysis of differentially expressed genes A:差异表达基因聚类热图;B:差异表达基因韦恩图;C和D:差异表达基因火山图。 A: Heatmap of DEGs; B: Venn diagram of DEGs; C and D: Volcano map of DEGs. |
将对照组和各DFB暴露组的DEGs进行GO数据库功能注释和富集分析,这些DEGs注释到生物过程(biological process, BP)、细胞组分(cell composition, CC)和分子功能(molecular function, MF) 3个GO分类中。对各个GO分类中DEGs富集排列前10的通路进行展示(图 3A~B)。与对照组LC相比,暴露于0.1 mg/L DFB的LL组中的差异表达基因显著富集在255个GO terms中,涉及108个生物学过程、38个细胞组分和109个分子功能;暴露1.0 mg/L DFB的LH组中的DEGs共富集到298个GO条目,包括141个生物过程、35个细胞组成以及122个分子功能。在不同暴露水平下,鲤肝脏差异表达基因主要参与“DNA整合”、“氧化还原过程”等生物学过程,参与“细胞外区”、“细胞外空间”等细胞组成,集中在“NAD结合”、“核苷结合”等分子功能。差异基因GO富集分析结果显示(图 3C~D),0.1 mg/L DFB暴露主要影响鲤肝脏“GTP结合”、“嘌呤核苷结合”、“核苷结合”以及“NAD结合”等分子功能相关基因表达,1.0 mg/L DFB暴露除了影响上述分子功能,还显著影响鲤肝脏“ATP酶活性”、“半胱氨酸型肽酶活性”和“氧化还原酶活性”等分子功能相关基因的表达。
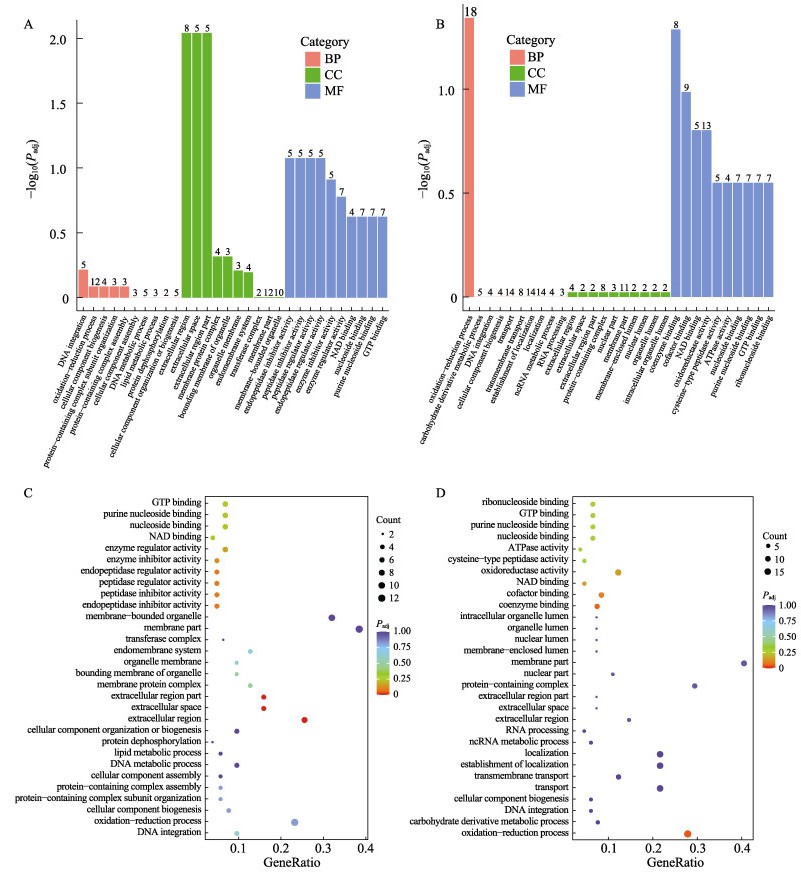
|
图 3 DEGs的GO功能注释及富集分析(富集排名前30) Fig.3 GO annotation and enrichment analysis of DEGs (top30) A:LL组中DEGs的GO功能注释;B:LH组中DEGs的GO功能注释;C:LL组中DEGs的GO富集分析;D:LH组中DEGs的GO富集分析。 A: GO annotation of DEGs in the LL group; B: GO annotation of DEGs in the LH group; C: GO enrichment analysis of DEGs in the LL group; D: GO enrichment analysis of DEGs in the LH group. |
将所有DEGs定位到KEGG通路,各DFB暴露组的前20条富集度较高的代表性通路如图 4所示。在0.1 mg/L DFB急性暴露条件下,肝脏中DEGs富集到146条KEGG通路,其中,24条通路受到显著影响(Padj < 0.05)。对24条显著KEGG通路进行分类统计,主要涉及16条代谢、3条有机体系统、2条细胞过程以及2条环境信息等4大类别。具体而言,包括细胞色素P450对异生素的代谢、药物代谢–细胞色素P450、药物代谢–其他酶等与异生物质的生物降解和代谢有关的通路,类固醇激素生物合成、初级胆汁酸生物合成及花生四烯酸代谢等与脂质代谢相关的通路,抗坏血酸和醛糖代谢、丙酮酸代谢、戊糖和葡萄糖醛酸相互转化等与碳水化合物代谢有关的通路以及有关氨基酸代谢通路等16条新陈代谢通路均发生显著改变。除了与新陈代谢相关的通路外,差异表达基因还富集在有机体的免疫系统和内分泌系统相关的代谢途径中,如RIG-I样受体信号通路、NOD样受体信号通路和PPAR信号通路。其次,与细胞过程相关的基因在铁死亡和过氧化酶体等细胞生长和死亡,运输和分解代谢过程中被显著富集。此外,环境信息加工中的信号分子和相互作用通路在pathway中也被富集,如神经活性配体–受体相互作用及细胞因子受体相互作用。
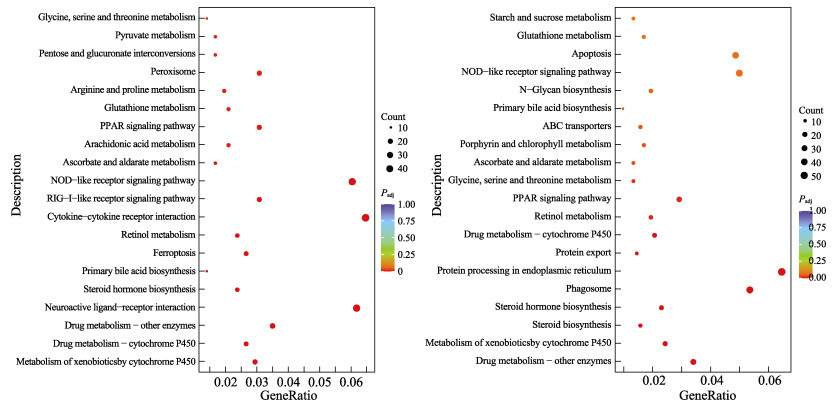
|
图 4 DEGs的KEGG富集分析(富集排名前20) Fig.4 KEGG enrichment analysis of DEGs (top 20) |
在1.0 mg/L DFB急性暴露条件下,肝脏中DEGs富集到149条KEGG通路,其中,15条被显著富集(Padj < 0.05)。对15条显著KEGG通路进行分类统计,主要涉及10条代谢、2条遗传信息处理、1条细胞过程、1条有机系统、1条环境信息加工等5大类别。差异表达基因数目较多的次级富集通路依次为异生物质的生物降解与代谢、折叠、分拣和降解、运输和分解代谢、脂类代谢、辅助因子和维生素的代谢、内分泌系统、膜运输、氨基酸代谢、碳水化合物代谢。随着DFB暴露浓度的提高,鲤肝脏中与遗传信息处理相关的蛋白质的折叠、分类和降解受到显著影响。
3 讨论DFB是农作物等病虫害防治常用的杀虫剂,已在包括中国在内的全球各地的地表水和地下水以及土壤中检测到。目前,大多数DFB的研究集中在用法用量、残留代谢情况、毒性研究及其对环境的影响,有关其对水产动物的暴露毒性及其分子响应机制研究较少。转录组测序可以大规模表征基因表达水平,是研究水生生物毒理学的有力手段。因此,本研究采用RNA-Seq测序技术探究DFB暴露对鲤肝脏转录组的影响,结果表明DFB暴露严重干扰了鲤肝脏生物学过程、细胞组分以及分子功能,并造成异生物质的生物降解和代谢、脂质代谢、碳水化合物代谢紊乱,产生急性炎症反应、内质网应激以及免疫毒性等。
3.1 细胞色素P450酶系失衡细胞色素P450家族(CYP450)是降解和代谢内源性物质、参与外源性药物和环境毒物的代谢过程的主要酶系,CYP450中约有三分之一用于外源性物质的代谢(Guengerich, 2013)。本研究的转录组学结果表明,在DFB急性暴露条件下,鲤肝脏中细胞色素P450对异生物质的代谢、药物代谢–细胞色素P450代谢途径被显著富集,CYP1A、CYP1B以及编码谷胱甘肽S-转移酶(GSTs)、葡萄糖醛酸转移酶(UGTs)、羰基还原酶1的基因GST、UGT、CBR1表达水平都显著上调。CYP450属于生物转化的Ⅰ相解毒酶,而GSTs和UGT属于Ⅱ相解毒酶。许多外源性有害物质在CYP450第一相生物转化过程中极易形成某些生物活性中间产物,与细胞生物大分子重要成分发生共价结合,对机体造成损害;而GSTs和UGT可以和第一相与反应的活性中间产物结合,可防止发生共价结合从而起到解毒作用。在2种暴露浓度水平下,上述基因表达情况反映了鲤肝脏启动了对外源性物质DFB的生物降解和代谢,这与Zaidi等(2011)和Maduenho等(2008)研究结果一致。另外,CYP450作为一类单加氧酶,参与许多类固醇激素、胆固醇和其他脂质合成等生物过程(Di Giulio et al, 2008; Olsvik et al, 2013)。在本研究中,CYP450家族成员CYP1A、CYP1B、CYP7A1、CYP24A1、CYP27B1、CYP26A1等基因表达水平显著上调。CYP7A1是胆固醇敏感的核激素受体即肝脏X受体α (LXRα)的靶基因,具有抑制炎症、抑制肿瘤细胞增殖、调节脂质代谢、抑制自身免疫等生物学效应,CYP7A1呈现高表达则与肝组织炎症和纤维化的发生、发展密切相关(贾沛轩等, 2016)。CYP24A1和CYP27B1参与维生素D的分解代谢,从而维持机体钙磷代谢平衡以及促进细胞的增殖、分化和凋亡(Jones et al, 2012)。CYP1A和CYP26A1是参与视黄醇代谢常见的基因,视黄醇及其衍生物是动物体内维生素A的主要存在形式,在卵巢类固醇激素生成、卵母细胞成熟和早期胚胎发育中发挥重要作用(杨言昭等, 2019)。本研究中CYP450家族基因的显著上调,不仅促进了对DFB外源性化合物的代谢和降解,还影响了鲤肝脏组织中类固醇激素生物合成、类固醇生物合成、初级胆汁酸生物合成以及视黄醇代谢。值得注意的是,随着DFB暴露浓度水平的增加,鲤肝脏中CYP450酶系的基因表达水平呈下降趋势,说明高浓度DFB暴露水平会破坏鲤肝脏CYP450酶系活性。本研究结果与拟除虫菊酯杀虫剂诱导大鼠肝(Martínez et al, 2018)和邻苯二甲酸盐酯增塑剂诱导鲫(Ctenopharyngodon idella)鳃(Liu Y et al, 2022)细胞色素P450酶系失衡的结果具有相似性。
3.2 脂质代谢紊乱脂质代谢在大多数真核生物中调节膜流动性、稳定性、渗透性和细胞信号传导等方面起着至关重要的作用。已有研究证实,丁草胺、邻苯二甲酸酯、重金属等环境内分泌干扰物会诱导水生生物脂质代谢异常(Farombi et al, 2008; Zhang et al, 2018; 孙胜香等, 2019)。花生四烯酸代谢在介导炎症反应过程中发挥重要作用(蔡亚玮等, 2021)。过氧化物酶体能够清除细胞中的分子氧和过氧化物,并与糖脂、胆固醇、胆酸的合成有关,是在氧化还原信号和脂质稳态中起关键作用的细胞器(Schrader et al, 2020; 褚贝贝等, 2015; Wanders et al, 2013)。在本研究中,在低浓度DFB暴露下,鲤肝脏中参与花生四烯酸代谢与亚油酸代谢的磷脂酶A2的PLA2G1B、前列腺素E合酶的PTGES3B,以及参与过氧化物酶体的PXMP2、PEX19等基因表达水平显著升高。结果表明,低浓度DFB会造成鲤肝脏脂质代谢异常,肝脏通过加强过氧化物酶体的基因表达来清除DFB产生的毒害物质。过氧化物酶体增殖物激活受体(PPARs)是由不饱和脂肪酸及其产生物所活化的核激素受体,PPARs包括PPARα、PPARβ/δ和PPARγ三种亚型,广泛参与机体的脂质和碳水化合物代谢以及细胞生长分化及生殖等过程(叶林秀等, 2002)。其中,PPARα能够调控和参与多个脂质代谢过程中有关基因的表达,是脂质代谢过程的重要因子(仝巧云等, 2016)。在低浓度DFB暴露浓度下,PPAR信号通路中脂肪酸结合蛋白的FABP1、长链脂酰辅酶A合成酶的LACS1、载脂蛋白的ApoA-1、CYP7A1等基因表达水平显著升高,极长链脂酰辅酶A合成酶的VLACS1、肝脏X受体α的LXRα等基因表达水平显著下降。在高浓度DFB暴露下,鲤肝脏PPAR信号通路中PPARα、FABP1、CYP7A1等基因表达水平显著升高,ApoA-1、LXRα、肉碱棕榈酰转移酶的CPT1、与脂滴相关蛋白的Plin2以及血管生成素样蛋白的ANGPTL4等表达水平显著下降。CPT1是脂肪酸氧化过程中的一种限速酶(陈书健等, 2020),其基因表达水平下降表明高浓度DFB暴露会抑制鲤肝脏中脂肪酸β-氧化。由于作为天然PPARα配体的脂肪酸代谢物的存在,肝细胞中脂肪酸/甘油三酯的积累可能导致PPARα的持续激活,而在高浓度DFB暴露下,肝脏PPARα表达水平显著升高,说明随着DFB暴露浓度的增加,鲤肝脏脂肪酸β-氧化严重受阻,甚至发生脂肪滴在肝脏中积累,可能诱变为脂肪肝,对鲤肝脏造成严重损伤。
3.3 内质网应激和免疫失调研究表明,内质网(endoplasmic reticulum, ER)是细胞内负责蛋白质合成、加工及转运的细胞器,也是细胞内Ca2+贮存的主要场所,对应激因素极为敏感(Liu H et al, 2022)。当受到内外部环境因素刺激后,由于细胞内质网稳态和功能发生改变,导致蛋白质的加工和运输受到阻碍,使大量未折叠或错误折叠的蛋白质在内质网中积累。当应激导致内质网内错误折叠与未折叠蛋白聚集以及钙离子平衡紊乱等状况,会激活未折叠蛋白反应(unfolded protein response, UPR)和内质网超负荷反应(endoplasmic recticulum overload response, EOR)来维持内质网的正常功能。在本研究中,在高浓度DFB暴露下,有53个DEGs显著富集到蛋白质内质网加工通路,其中,HSP90A、CALR3B、ERO1A、EDEM2、RBX1等46个基因表达显著上调。HSP90作为蛋白成熟过程中的分子伴侣,在蛋白质的折叠、组装、翻译后修饰、运输、分泌以及降解过程中具有重要作用,参与细胞周期调节、DNA损伤修复及细胞凋亡等多个生物学过程(罗紫蝶等, 2022),其表达情况反映了鱼类的应激程度,这与虹鳟(Oncorhynchus mykiss)通过上调HSP90提高其盐度适应性研究结果一致(周启苓等, 2022)。ERO1在维持内质网氧化还原稳态和促进蛋白质二硫键合成过程中起到重要作用(吴敏等, 2021)。EDEM2与错误折叠蛋白通过内质网相关蛋白降解(ER-associated degradation, ERAD)途径的逆向转运和降解有关(Hosokawa et al, 2021)。CALR是一种高度保守的内质网Ca2+结合蛋白,具备分子伴侣活性、调节细胞内钙稳态以及细胞凋亡等多种生物学功能(Pandya et al, 2020)。研究表明,0.1 mg/L DFB暴露浓度对鲤肝脏产生的内质网应激不显著,但1.0 mg/L暴露浓度造成了严重的内质网应激损伤,通过诱导内质网分子伴侣的表达激活UPR、ERAD等相关保护机制维持内质网稳态,但持续而强烈的内质网应激可诱导内质网相关性细胞凋亡,最终影响应激细胞的损伤或凋亡。
天然免疫通路是保护机体免受病原侵袭的第一道屏障(Hou et al, 2016),主要包括RIG-I样受体信号通路、NOD样受体信号通路以及Toll样受体通路等。病毒、细菌和死细胞的RNA进入细胞质后,可以与RIG-I受体或者NOD样受体结合并引起NF-κB信号的激活和基因表达的改变,导致炎症复合体的形成。在由cGAS介导的胞质DNA传感途径中,STING已被确定为RIG-I的信号辅助因子和关键衔接蛋白,并与位于线粒体外膜表面的衔接蛋白MAVS相互作用,从而激活下游的转录因子IRF3、IRF7和NF-κB,诱导Ⅰ型干扰素和促炎细胞因子的产生(张颖等, 2022)。白细胞介素8 (CXCL8)是一种由巨噬细胞和上皮细胞等分泌的趋化细胞因子,将中性粒细胞从血管募集到受到影响的组织,从而引发机体局部的急性炎症反应,达到杀菌的目的(Awwad et al, 2018)。半胱天冬酶在程序性细胞死亡的启动和执行中起关键作用,Casp8既可作为死亡受体诱导的细胞凋亡的关键分子,又可作为抗原受体激活NF-κB的选择性信号转导器(Zou et al, 2021)。本研究中,低浓度DFB的暴露条件下,43个DEGs显著富集到了RIG-I样受体信号通路和NOD样受体信号通路,MAPK12B、STING1、TKFC等8个基因表达水平上调,IRF7、CXCL8、CASP8等35个基因表达水平显著下调,说明DFB能够诱发鲤肝脏产生急性炎症反应,导致肝脏在全身免疫稳态中的作用受损。
4 结论本研究通过RNA-Seq技术对不同除虫脲暴露浓度下鲤肝组织进行了转录组测序。结果显示,DFB严重影响鲤肝脏生物学过程、细胞组分及分子功能,严重干扰了细胞色素P450对异生素的代谢、PPAR信号通路、内质网中的蛋白质加工、RIG-I样受体信号通路和NOD样受体信号通路等。其中,参与细胞色素P450对异生素的代谢通路的CYP7A1呈现高表达,表明发生了肝组织炎症和纤维化。与此同时,除虫脲导致鲤机体免疫失调,参与RIG-I样受体信号通路和NOD样受体信号通路的STING1表达水平显著升高,CXCL8、CASP8表达水平显著下降,表明DFB能够引发肝急性炎症反应、内质网应激以及免疫毒性,导致肝脏受损。本研究在转录层面为DFB暴露下影响鱼类的分子响应机制提供了新的见解,为DFB在水产领域的限量标准制定和环境安全评价提供了科学数据,也为探讨其他有机污染物对水生生物和人类健康的影响提供了技术方法和理论参考。
ABE F R, MACHADO A A, COLEONE A C, et al. Toxicity of diflubenzuron and temephos on freshwater fishes: Ecotoxicological assays with Oreochromis niloticus and Hyphessobrycon eques. Water, Air, and Soil Pollution, 2019, 230(3): 1-10 |
AWWAD O, COPERCHINI F, PIGNATTI P, et al. The AMPK-activator AICAR in thyroid cancer: Effects on CXCL8 secretion and on CXCL8-induced neoplastic cell migration. Journal of Endocrinological Investigation, 2018, 41(11): 1275-1282 DOI:10.1007/s40618-018-0862-8 |
BRAY N L, PIMENTEL H, MELSTED P, et al. Near-optimal probabilistic RNA-Seq quantification. Nature Biotechnology, 2016, 34(5): 525-527 DOI:10.1038/nbt.3519 |
CAI Y W, LIU J H, MA N. Research status of arachidonic acid-targeted metabonomics in inflammation. Chinese Journal of Clinical Pharmacology, 2021, 37(19): 2721–2723, 2728 [蔡亚玮, 刘建宏, 马宁. 花生四烯酸靶向代谢组学在炎症中的研究现状. 中国临床药理学杂志, 2021, 37(19): 2721–2723, 2728] |
CHEN S J, WU C L, YE J Y, et al. Effect of dietary vitamin A on growth, serum biochemical index, digestive enzyme activities and glucose and lipid metabolism in juvenile Mylopharyngodon piceus. Journal of Fisheries of China, 2020, 44(1): 85-98 [陈书健, 吴成龙, 叶金云, 等. 饲料中维生素A对青鱼幼鱼生长、血清生化指标和肝脏糖脂代谢酶活性及基因表达的影响. 水产学报, 2020, 44(1): 85-98] |
CHU B B, SONG B L. Lysosome-peroxisome membrane contacts mediate cholesterol transport. Chinese Journal of Cell Biology, 2015, 37(6): 759-763 [褚贝贝, 宋保亮. 溶酶体与过氧化物酶体形成膜接触介导胆固醇转运. 中国细胞生物学学报, 2015, 37(6): 759-763] |
DI GIULIO R T, HINTON D E. The toxicology of fishes. CRC Press, 2008
|
FAROMBI E O, AJIMOKO Y R, ADELOWO O A. Effect of butachlor on antioxidant enzyme status and lipid peroxidation in fresh water African catfish, (Clarias gariepinus). International Journal of Environmental Research and Public Health, 2008, 5(5): 423-427 DOI:10.3390/ijerph5050423 |
GUENGERICH F P. Cytochrome P450 activation of toxins and hepatotoxicity: Drug-induced liver disease. Elsevier, 2013, 15–33
|
HOSOKAWA N, WADA I, HASEGAWA K, et al. A novel ER α-mannosidase-like protein accelerates ER-associated degradation. EMBO Reports, 2001, 2(5): 415-422 DOI:10.1093/embo-reports/kve084 |
HOU C W, LAURO M L, LEIMKUHLER GRIMES C. Redefining the defensive line: Critical components of the innate immune system. ACS Infectious Diseases, 2016, 2(11): 746-748 DOI:10.1021/acsinfecdis.6b00174 |
HU C Z. Studies on residual degradation of diflubenzuron in Chinese kale and dietary risk assessment. Masterxs Thesis of Nanjing Agricultural University, 2019 [胡存中. 除虫脲在芥蓝中的残留及膳食风险评估研究. 南京农业大学硕士研究生学位论文, 2019]
|
JIA P X, FU C X, RONG P, et al. Microcystin effects on the expression of GST and CYP7A1 genes in the liver of silver carp. Journal of Agricultural Science and Technology, 2016, 18(6): 158-163 [贾沛轩, 付春雪, 荣萍, 等. 微囊藻毒素对鲢鱼肝脏GST和CYP7A1基因表达的影响. 中国农业科技导报, 2016, 18(6): 158-163] |
JIA Y Q, NIAN Q X, ZHANG L, et al. Determination of 4 benzoylurea pesticides in irrigation water by high performance liquid chromatography with magnetic solid-phase extraction. Journal of Instrumental Analysis, 2019, 38(1): 46-51 [贾叶青, 念琪循, 张磊, 等. 磁固相萃取结合高效液相色谱检测农田灌溉水中4种苯甲酰脲类农药. 分析测试学报, 2019, 38(1): 46-51 DOI:10.3969/j.issn.1004-4957.2019.01.006] |
JONES G, PROSSER D E, KAUFANN M. 25-Hydroxyvitamin D-24-hydroxylase (CYP24A1): Its important role in the degradation of vitamin D. Archives of Biochemistry and Biophysics, 2012, 523(1): 9-18 DOI:10.1016/j.abb.2011.11.003 |
KIETZMANN T. Liver zonation in health and disease: Hypoxia and hypoxia-inducible transcription factors as concert masters. International Journal of Molecular Sciences, 2019, 20(9): 2347 DOI:10.3390/ijms20092347 |
LIAO Y, SMYTH G K, SHI W. FeatureCounts: An efficient general purpose program for assigning sequence reads to genomicfeatures. Bioinformatics, 2014, 30(7): 923-930 DOI:10.1093/bioinformatics/btt656 |
LIU H J, DONG M, JIANG W D, et al. Acute nitrite exposure-induced oxidative damage, endoplasmic reticulum stress, autophagy and apoptosis caused gill tissue damage of grass carp (Ctenopharyngodon idella): Relieved by dietary protein. Ecotoxicology and Environmental Safety, 2022, 243: 113994 DOI:10.1016/j.ecoenv.2022.113994 |
LIU Y J. Determination of diflubenzuron residues in salmon by LC-MS/MS with QuEChERS. Food Industry, 2021, 42(12): 436-440 [刘亿婕. QuEChERS/LC-MS/MS法测定三文鱼中除虫脲残留. 食品工业, 2021, 42(12): 436-440] |
LIU Y, CHEN Z, LI S, et al. Multi-omics profiling and biochemical assays reveal the acute toxicity of environmental related concentrations of di-(2-ethylhexyl) phthalate (DEHP) on the gill of crucian carp (Carassius auratus). Chemosphere, 2022, 307: 135814 DOI:10.1016/j.chemosphere.2022.135814 |
LUO H, YE H, XIAO S J, et al. Application of transcriptomics technology to aquatic animal research. Journal of Fisheries of China, 2015, 39(4): 598-607 [罗辉, 叶华, 肖世俊, 等. 转录组学技术在水产动物研究中的运用. 水产学报, 2015, 39(4): 598-607] |
LUO Z D, GUO S J, ZENG C, et al. Toxic effects of cadmium exposure on zebrafish embryo development. Research of Environmental Sciences, 2022, 35(5): 1315-1322 [罗紫蝶, 郭少娟, 曾晨, 等. 镉暴露对斑马鱼胚胎发育的毒性效应研究. 环境科学研究, 2022, 35(5): 1315-1322] |
MADUENHO L P, MARITINEZ C B R. Acute effects of diflubenzuron on the freshwater fish Prochilodus lineatus. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2008, 148(3): 265-272 DOI:10.1016/j.cbpc.2008.06.010 |
MARTÍNEZ M A, ARES I, RODRÍGUEZ J L, et al. Pyrethroid insecticide lambda-cyhalothrin induces hepatic cytochrome P450 enzymes, oxidative stress and apoptosis in rats. Science of the Total Environment, 2018, 631: 1371-1382 |
MORTAZAVI A, WILLIAMS B A, MCCUE K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq. Nature Methods, 2008, 5(7): 621-628 DOI:10.1038/nmeth.1226 |
OLSVIK P A, SAMUELSEN O B, et al. Toxicological assessment of the anti-salmon lice drug diflubenzuron on Atlantic cod Gadus morhua. Diseases of Aquatic Organisms, 2013, 105(1): 27-43 DOI:10.3354/dao02613 |
PANDYA U M, MANZANARES M A, TELLECHEA A, et al. Calreticulin exploits TGF-β for extracellular matrix induction engineering a tissue regenerative process. The FASEB Journal, 2020, 4(12): 15849-15874 |
PARSONS A E, SAMUELSEN O B, JOHNSEN I A, et al. Distribution and persistence of diflubenzuron and teflubenzuron in the marine environment around salmonid aquaculture facilities. Frontiers in Marine Science, 2021, 780
|
PLACENCIA J A, SAAVEDRA F, FERNANDEZÁNDEZ J, et al. Occurrence and distribution of deltamethrin and diflubenzuron in surface sediments from the Reloncaví Fjord and the Chiloé Inner-Sea (~39.5°S–43°S), Chilean Patagonia. Bulletin of Environmental Contamination and Toxicology, 2018, 100(3): 384–388
|
QIAO L, CHEN L, XU J H, et al. Residual risk of benzoylurea insecticides and their research progress in aquaculture. Freshwater Fisheries, 2022, 52(4): 65-76 [乔璐, 陈璐, 徐锦华, 等. 苯甲酰脲类杀虫剂的残留风险及在水产养殖中的研究进展. 淡水渔业, 2022, 52(4): 65-76 DOI:10.3969/j.issn.1000-6907.2022.04.009] |
SCHRADER M, KAMOSHITA M, ISLINGER M. Organelle interplay-peroxisome interactions in health and disease. Journal of Inherited Metabolic Disease, 2020, 43(1): 71-89 DOI:10.1002/jimd.12083 |
SUN J, LI W, CONG R, et al. Toxicity and metabolism of adult zebrafish brain tissue induced by combined exposure to graphene oxide and polycyclic aromatic hydrocarbons. Journal of Agro-Environment Science, 2022, 41(7): 1417-1423 [孙晶, 李伟, 丛瑞, 等. 氧化石墨烯和多环芳烃复合暴露诱导成年斑马鱼脑组织毒性及其代谢研究. 农业环境科学学报, 2022, 41(7): 1417-1423] |
SUN S X, DU Z Y. The effects of environmental endocrine disrupting chemicals on lipid metabolism in fish: Review and perspectives. Progress in Fishery Sciences, 2019, 40(2): 1-14 [孙胜香, 杜震宇. 环境内分泌干扰物对鱼类脂质代谢的影响: 回顾与展望. 渔业科学进展, 2019, 40(2): 1-14] |
TONG Q Y, GE C J, ZHENG S H. Expression of PPARα and Acox1 in rats with alcoholic fatty liver disease. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2016, 45(3): 288-291 [仝巧云, 葛存锦, 郑世华. PPARα及Acox1在酒精性脂肪肝中的表达. 华中科技大学学报: 医学版, 2016, 45(3): 288-291 DOI:10.3870/j.issn.1672-0741.2016.03.010] |
WANDERS R J A. Peroxisomes in human health and disease: Metabolic pathways, metabolite transport, interplay with other organelles and signal transduction. Sub-Cellular Biochemistry, 2013, 69: 23-44 |
WU M, HUANG Y G. Research progress of endoplasmic reticulum oxidoreductin ERO1 and its relationship with tumor. Chongqing Medicine, 2021, 50(6): 1048-1052 [吴敏, 黄尤光. 内质网氧化还原蛋白1及其与肿瘤关系的研究进展. 重庆医学, 2021, 50(6): 1048-1052 DOI:10.3969/j.issn.1671-8348.2021.06.031] |
XIN T R, LIAN T, LI X E, et al. Sublethal effects of diflubenzuron on the growth and reproduction of an experimental population of Tetranychus cinnabarinus (Boisduval) (Acari: Tetranychidae). Chinese Journal of Applied Entomology, 2019, 56(4): 736-743 [辛天蓉, 练涛, 李雪儿, 等. 亚致死浓度除虫脲对朱砂叶螨生长和繁殖的影响. 应用昆虫学报, 2019, 56(4): 736-743] |
XU Y C, LIU G H, XU Y H, et al. Physiological and transcriptomic analyses reveal the toxicological mechanism and risk assessment of environmentally-relevant waterborne tetracycline exposure on the gills of tilapia (Oreochromis niloticus). Science of the Total Environment, 2022, 806: 151290 DOI:10.1016/j.scitotenv.2021.151290 |
XU Y Z, LIU X W, QIN Z, et al. Methodology study on determination of diflubenzuron in swine plasma by liquid chromatography-tandem mass spectrometry. China Animal Husbandry and Veterinary Medicine, 2022, 49(7): 2746-2756 [徐玉珍, 刘希望, 秦哲, 等. 液相色谱-串联质谱法检测猪血浆中除虫脲的方法学研究. 中国畜牧兽医, 2022, 49(7): 2746-2756] |
YANG Y Z, ZHANG Y M, LIU Y, et al. Research progress oil the role of retinol in ovary development. Chinese Journal of Animal Science, 2019, 55(5): 1-5 [杨言昭, 张艳敏, 刘颖, 等. 视黄醇在卵巢发育中的作用研究进展. 中国畜牧杂志, 2019, 55(5): 1-5] |
YE L X, XU Y C, ZHU Y L. Nuclear transcription factor PPARs and metabolic syndrome. International Journal of Genetics, 2002, 25(4): 232-234 [叶林秀, 徐焱成, 朱宜莲. 核转录因子PPARs与代谢综合征. 国际遗传学杂志, 2002, 25(4): 232-234 DOI:10.3760/cma.j.issn.1673-4386.2002.04.015] |
ZAIDI N, SOLTANI N. Environmental risks of two chitin synthesis inhibitors on Gambusia affinis: Chronic effects on growth and recovery of biological responses. Biological Control, 2011, 59(2): 106-113 DOI:10.1016/j.biocontrol.2011.04.001 |
ZHANG L, HU Y, SUN W, et al. Transcriptomic responses of Nile tilapia (Oreochromis niloticus) liver to environmental concentration of di-(2-ethylhexyl) phthalate. Ecotoxicology and Environmental Safety, 2018, 165: 70-77 DOI:10.1016/j.ecoenv.2018.08.100 |
ZHANG X, ZHOU Q, ZOU W, et al. Molecular mechanisms of developmental toxicity induced by graphene oxide at predicted environmental concentrations. Environmental Science and Technology, 2017, 51(14): 7861-7871 DOI:10.1021/acs.est.7b01922 |
ZHANG Y, CHEN C Y, FU Y. Research progress on the CGAS-STING signaling pathway in autoimmune diseases. Current Immunology, 2022, 42(3): 254-258 [张颖, 陈超越, 付妤. cGAS-STING信号通路在自身免疫性疾病中的研究进展. 现代免疫学, 2022, 42(3): 254-258] |
ZHENG S, HUANG W, LIU C, et al. Behavioral change and transcriptomics reveal the effects of 2, 2', 4, 4'-tetrabromodiphenyl ether exposure on neurodevelopmental toxicity to zebrafish (Danio rerio) in early life stage. Science of the Total Environment, 2021, 752: 141783 DOI:10.1016/j.scitotenv.2020.141783 |
ZHOU Q L, MA Q, MAO F F, et al. Analysis of the transcriptomic response to salinity acclimation in the scale of rainbow trout (Oncorhynchus mykiss). Progress in Fishery Sciences, 2022, 43(5): 168-178 [周启苓, 马骞, 毛非凡, 等. 盐度驯化影响虹鳟鳞组织基因表达的转录组分析. 渔业科学进展, 2022, 43(5): 168-178] |
ZOU J, XIA H, ZHANG C, et al. Casp8 acts through A20 to inhibit PD-L1 expression: The mechanism and its implication in immunotherapy. Cancer Science, 2021, 112(7): 2664-2678 DOI:10.1111/cas.14932 |



