2. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 山东 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academic of Fishery Sciences, Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs, Qingdao 266071, China
美人鱼发光杆菌美人鱼亚种(Photobacterium damselae subsp. damselae, PDD)是一种在全球海洋环境中广泛分布的革兰氏阴性病原菌,可感染多种海洋生物如鱼类、软体动物以及哺乳动物(Takahashi et al, 2008)。2016、2017年间,山东省长岛深远海网箱养殖的许氏平鲉(Sebastes schlegelii)先后2次暴发疾病,病鱼表现出鳍基出血和皮肤溃疡等临床症状,经过组织剖检、细菌分离鉴定和人工感染实验验证,证实PDD是造成网箱养殖许氏平鲉暴发大规模疾病的主要致病菌(Zhang et al, 2019)。目前,PDD在海水养殖产业内的致病案例逐渐增多,且致病宿主多样化,对我国海水养殖行业的健康发展造成了新的危害(施琳妮, 2019)。
国内外研究表明,PDD的毒力因子主要由胞外蛋白酶类,胞外溶血素以及细胞毒素三大类组成(Terceti et al, 2016),细菌毒力因子是导致宿主感染、产生病理损伤和避开宿主防御的主要因素(Austin et al, 2007)。溶血素在多种致病菌中均有发现(Labella et al, 2020),是多种致病菌的重要毒力因子之一,尤其在弧菌属(Vibrio)细菌中普遍存在,如哈维氏弧菌(Vibrio harveyi)就具有多种溶血素(Zhang et al, 2001)。宿主感染PDD后的症状通常表现为出血性败血症(吴同垒等, 2018),因此,针对PDD致病机理的研究多集中于其溶血能力的研究。现有的研究结果显示,PDD产生的毒素分别为毒性质粒pPHDD1编码产生的毒素damselysin (Dly)和phobalysin P (PhlyP) (Rivas et al, 2011),以及染色体Ⅰ编码产生的磷脂酶(phospholipase) (PlpV)和溶血素(phobalysin C, PhlyC) (Terceti et al, 2017),同时,质粒编码的溶血素与染色体编码的溶血素之间的协同作用同样对菌株的溶血能力及毒力具有重要影响(Vences et al, 2017)。
本实验室目前分离收集到45株PDD,经过dly、PhlyP、PhlyC和PlpV等多个毒力基因的鉴定结合动物感染实验,将收集保存的PDD菌株分为强毒株、中毒株和弱毒株(刘潇等, 2021),其中,具有高致病性的强毒株的实验室编号为PDD1608和PDD1605,与其他中毒株和弱毒株相比,高致病性的强毒株含有上述4种毒力基因且溶血性最强,对宿主具有很强的致病力。中毒株和弱毒株未携带毒力基因dly和PhlyP,对宿主的致病力与强毒株相比明显降低,并且中、弱毒株分别表现为弱溶血活性和无溶血活性。本研究以其中的1株高致病性强毒株PDD1608作为对象,通过构建野生株PDD1608毒力基因dly缺失株,比较野生株和缺失株的生长、耐药性、生理生化表型和菌株及其胞外产物(extracellular products,ECP)的溶血性、磷脂酶活性等多种生物学特性,同时,进行野生株和缺失株及其ECP对海水青鳉鱼(Oryzias melastigma)的人工感染实验并计算LD50,以期为PDD致病机制研究和疫苗研发提供参考。
1 材料与方法 1.1 菌株和质粒实验选取的菌株PDD1608现存于中国水产科学研究院黄海水产研究所海水养殖病原菌株库内,分离自海水网箱养殖患病许氏平鲉的体表溃疡处(Zhang et al, 2019)。质粒pACYC184和pCVD442购自武汉淼灵生物科技有限公司;大肠杆菌(Escherichia coli) β2155购自宝赛生物公司。
1.2 主要试剂及引物高保真酶PrimeSTAR® Max DNA polymerase购自宝日医生物技术(北京)有限公司;20×PBS缓冲液和革兰氏染色液购自北京索莱宝科技有限公司;限制性内切酶SmaⅠ购自赛默飞世尔科技公司;T4 DNA连接酶、细菌DNA提取试剂盒、胶回收DNA纯化试剂盒和BCA蛋白浓度测定试剂盒均购自南京诺唯赞生物科技股份有限公司;无菌脱纤维绵羊血购自南京森贝伽生物科技有限公司;抗菌药物药敏纸片购自杭州微生物试剂有限公司;生化鉴定管和50%卵黄乳液购自青岛海博生物技术有限公司;NaCl购自国药集团化学试剂有限公司;胰蛋白胨大豆肉汤(TSB)和TCBS琼脂培养基购自北京陆桥技术股份有限公司;琼脂、LB培养基和引物(表 1)由生工生物工程(上海)股份有限公司提供。
|
|
表 1 PDD毒力基因dly缺失株构建的引物信息 Tab.1 Primers for the virulence gene dly-deleted mutant strain construction |
以美人鱼发光杆菌美人鱼亚种野生株PDD1608基因组DNA为模版,用引物dly-5F/5R和dly-3F/3R扩增dly基因上、下游同源臂片段;用引物dly-CmF/ dly-CmR从pACYC184质粒上扩增氯霉素抗性基因(Cm抗性基因)作为替换dly基因的片段,通过融合PCR技术将dly基因上、下游同源臂片段和Cm抗性基因片段连接构成为打靶片段Δdly1608::Cm,再将其克隆入自杀质粒pCVD442,获得打靶质粒pCVD442-Δdly1608::Cm。
通过电转化法(Lee et al, 2009)将打靶质粒pCVD442-Δdly1608::Cm转入大肠杆菌DH5α λpir,在双抗LB平板(氨苄青霉素和氯霉素含量分别为50 μg/mL和17 μg/mL)上,于37 ℃培养至单克隆形成。单克隆经测序验证正确后,将其接种于3 mL双抗LB液体培养基(氨苄青霉素和氯霉素含量分别为50 μg/mL和17 μg/mL),在37 ℃、180 r/min条件下过夜培养,次日使用试剂盒纯化提取质粒DNA。
将打靶载体pCVD442-Δdly1608::Cm电转化进入大肠杆菌β2155菌株,涂布于含100 μg/mL氨苄青霉素和0.5 mmol/L二氨基庚二酸(DAP,阿拉丁试剂)的LB平板,37 ℃培养至单克隆菌落形成,此克隆即为用于接合实验的供体菌株E.coli β2155/pCVD442-Δdly1608::Cm。
供体菌株E.coli β2155/pCVD442-Δdly1608::Cm和野生株PDD1608分别过夜培养,各取500 μL菌液混合,进行接合实验,取50 μL接合后的菌液涂布于含有氯霉素(10 μg/mL)的1.5% NaCl LB平板,30 ℃培养至单克隆形成,随机挑取数个(n≥5)单克隆菌体,用引物dly-inF/dly-inR、dly-outF/dly-outR对单克隆菌体进行2次PCR产物测序验证,引物dly-inF/dly-inR检测结果阴性,而引物dly-outF/dly-outR检测结果阳性的单克隆菌株即为毒力基因dly缺失株,命名为ΔdlyPDD1608::Cm。
1.4 野生株和dly基因缺失株的表型测定菌液制备:将菌株PDD1608和Δdly PDD1608::Cm划线接种于含1.5% NaCl的TSB固体培养基,于28 ℃培养箱内静置培养,挑取2株菌的单菌落分别接种于10 mL含1.5% NaCl的TSB液体培养基中,于28 ℃、180 r/min条件下过夜培养,调整各菌株OD600 nm=0.6。
1.4.1 生长曲线测定将制备的菌液按1∶100比例稀释接种于96孔板中,每孔300 μL,每株菌做3个平行,含1.5% NaCl的TSB液体培养基为空白对照。用全自动生长曲线分析仪(型号:Bioscreen C°Pro)每隔2 h测1次OD600 nm值,绘制生长曲线。
1.4.2 涌动性(swarming)检测用移液枪分别吸取3 μL菌液垂直滴加到半固体TSB培养基(含0.6%琼脂)中,每株菌设5个平行,将平板正置放于28 ℃生化培养箱中培养24 h,观察记录各菌株涌动圈大小。
1.4.3 生理生化特性测定用购自青岛海博生物技术有限公司的细菌微量生化鉴定管进行菌株PDD1608和Δdly PDD1608::Cm的生理生化特性测定,于28 ℃培养24~48 h后观察不同菌株的生理生化反应实验结果。
1.4.4 生物被膜形成能力测定将菌液按1∶100稀释。取200 µL稀释后的菌液添加至无菌96孔板中,每株菌设3个平行,以新鲜TSB液体培养基作为阴性对照。96孔板加盖后用封口膜密封,静置于28 ℃生化培养箱中培养48 h,吸净菌液,使用无菌磷酸盐缓冲液(phosphate buffered solution,PBS)清洗添加过菌液的加样孔,自然风干后,每孔加200 µL甲醇固定15 min,吸净甲醇,晾干后用1%结晶紫溶液染色5 min,使用ddH2O清洗3次。完全干燥后,使用95%乙醇溶液溶解黏附的被膜,使用酶标仪测定OD595 nm值(Zhang et al, 2021)。
1.5 药物敏感性实验采用K-B纸片扩散法进行菌株PDD1608和Δdly PDD1608::Cm的抗生素药敏实验,用灭菌镊子夹取药敏纸片(购自杭州微生物试剂有限公司)贴于涂有菌液的平板之上,28 ℃生化培养箱中静置培养12 h,测量抑菌圈直径,药敏实验结果与美国临床实验室标准化协会(CLSI)标准对比,从而判定不同菌株的药物敏感度。
1.6 菌株及ECP溶血活性和磷脂酶活性测定 1.6.1 菌液制备和ECP的提取菌株PDD1608和Δdly PDD1608::Cm在TSB平板上活化并纯化培养后,挑取2株菌的单菌落,接种于50 mL的液体TSB培养基中,于28 ℃、180 r/min振荡培养10 h制备种子液。分别取5 mL种子液稀释至105 CFU/mL备用。参考李永杰等(2022)的方法,进行109 CFU/mL高浓度菌液和ECP原液的制备,并对ECP原液进行有无活菌的检验,吸取100 μL的ECP原液涂布于TSB平板,经检验,培养基上无菌落长出,将ECP原液分装进50 mL离心管中备用。
1.6.2 菌株及ECP的溶血性测定在含有1.5% NaCl的TSB中添加5% (V/V)脱纤维绵羊血,并在平板中央放置一枚牛津杯制备成打孔绵羊血平板,用于测定菌株及ECP的溶血能力(刘潇等, 2021)。每个绵羊血平板的牛津杯孔中分别加入100 μL的菌液和ECP原液进行溶血性的测定,在28 ℃培养箱中静置24~48 h,及时观察并拍照记录,对照组为无菌TSB液体培养基,重复实验3次。
1.6.3 菌株及ECP的磷脂酶活性测定在含有1.5% NaCl的TSB中添加3% (V/V)卵黄乳液,并在平板中央放置一枚牛津杯制备成打孔卵黄平板,用于测定菌株及ECP分解卵磷脂的能力(刘潇等, 2021)。每个卵黄平板的牛津杯孔中分别加入100 μL的菌液和ECP原液进行卵磷脂分解能力的测定,在28 ℃培养箱中静置24~48 h,及时观察并拍照记录,对照组为无菌TSB液体培养基,重复实验3次。
1.7 菌株及ECP的致病力验证从山东省青岛市某公司购买健康海水青鳉鱼,平均体长为2.5 cm,平均体重为55 mg。参照海水青鳉鱼饲养方法(Wittbrodt et al, 2002; Takao et al, 2010),养殖系统为充分曝气的海水循环系统,水温为(23±1) ℃,每日投喂1次卤虫(Artemia salina)饵料,投喂量以5 min内吃完为宜。320尾实验鱼在水循环和增氧条件下暂养7 d,实验前24 h停止喂食。
参照1.6制备109 CFU/mL的高浓度菌液和ECP原液,菌液经10倍稀释法涂布、计算后,记录初始菌液浓度;使用BCA蛋白浓度试剂盒测定ECP的蛋白浓度。
实验选用海水青鳉鱼作为宿主,在对鱼体进行背部肌肉轻微创伤后,分别进行PDD1608、ΔdlyPDD1608::Cm菌液及ECP的浸浴攻毒实验。每个菌液的攻毒实验设定5个浓度梯度(108、107、106、105和104 CFU/mL),每个梯度攻毒实验组10条海水青鳉鱼,设置2组平行实验,使用无菌PBS作为对照。每个菌株ECP的攻毒实验设定5个浓度梯度(1、1/2、1/4、1/8和1/16 ECP原液),每个实验组10条海水青鳉鱼,设置2组平行实验,以无菌PBS为对照实验组。
于攻毒后2、4、6、8、12、16、20、24、48、72、96、120、144和168 h进行观察,及时记录不同浓度组的死亡数量,直至连续3 d以上未出现死亡后可结束实验,参考Bliss算法计算半数致死量LD50。
1.8 数据处理及分析本研究中,生长曲线测定、涌动性、生物被膜测定和宿主攻毒感染等实验中得到的数据,均利用统计学软件Graphpad Prism8进行数据汇总、分析及作图。
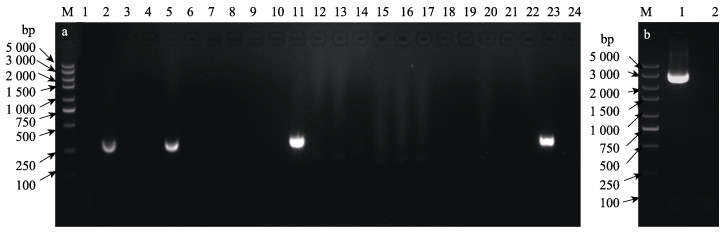
2 结果 2.1 缺失株Δdly PDD1608::Cm的鉴定利用λRed重组法构建获得dly基因缺失株,随机挑取单克隆菌落(n > 10)进行PCR鉴定。用检测毒力基因dly的引物dly-inF/dly-inR进行PCR扩增,结果见图 1a。野生株PDD1608作为阳性对照扩增出335 bp的目的片段(编号23),挑取的22个单克隆(编号1~22)菌落中有19个未扩增出目的片段,3个单克隆扩增出目的片段(编号2、5、11)。从未扩增出条带的单克隆菌落中选取一个单克隆(1号单克隆)进行毒力基因dly外部基因的检测,利用引物dly-outF/dly-outR进行PCR扩增得到3 058 bp的目的片段(图 1b),经过测序验证后,表明毒力基因dly缺失株构建成功,命名为Δdly PDD1608::Cm。
|
图 1 dly基因缺失株的鉴定结果 Fig.1 Results of dly-deleted mutant strain identification a:单克隆菌落毒力基因dly琼脂糖凝胶电泳检测结果;b:1号单克隆菌落毒力基因dly的上下游同源臂(含Cm基因片段)琼脂糖凝胶电泳检测结果。 a: Agarose gel electrophoresis test of monoclonal colony virulence genes dly; b: Agarose gel electrophoresis test of the upstream and downstream homology arms (containing Cm gene fragment) of the No.1 monoclonal colony virulence gene dly. |
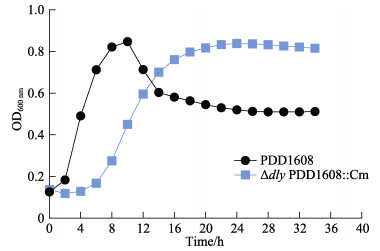
菌株PDD1608和ΔdlyPDD1608::Cm在TSB液体培养基中经过全自动生长曲线分析仪32 h的检测记录(OD600 nm)后,导出数据并绘制生长曲线。结果显示,野生株PDD1608生长速度较快,在2~10 h内处于生长对数期阶段。缺失株ΔdlyPDD1608::Cm生长速度与野生株PDD1608生长速度相比有所降低,在8~16 h内处于对数生长期(图 2)。由此得出,dly基因的缺失在一定程度上减缓了PDD1608菌株在TSB液体培养基中的生长速度。
|
图 2 野生株PDD1608和缺失株Δdly PDD1608::Cm的生长曲线 Fig.2 Growth curves of wild type strain PDD1608 and mutant strain Δdly PDD1608::Cm |
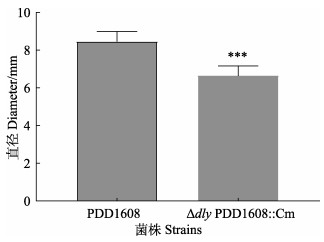
菌株PDD1608和ΔdlyPDD1608::Cm在28 ℃培养24 h,测量对比发现,dly基因缺失后,缺失株ΔdlyPDD1608::Cm与野生株PDD1608相比涌动性降低,有极显著差异(P < 0.01) (图 3)。
|
图 3 野生株PDD1608和缺失株Δdly PDD1608::Cm涌动性分析 Fig.3 Swarming motility of wild type strain PDD1608 and mutant strain Δdly PDD1608::Cm ***表示差异极显著(P < 0.01)。 *** indicate highly significant difference (P < 0.01). |
菌株PDD1608和ΔdlyPDD1608::Cm的26种生化鉴定管结果显示,2株菌26种生化鉴定管的结果一致,毒力基因dly缺失后对菌株的生理生化表型未造成改变(表 2)。
|
|
表 2 野生株PDD1608和缺失株ΔdlyPDD1608::Cm的生理生化特性 Tab.2 The physiological and biochemical characteristics of wild type strain PDD1608 and mutant strain Δdly PDD1608::Cm |
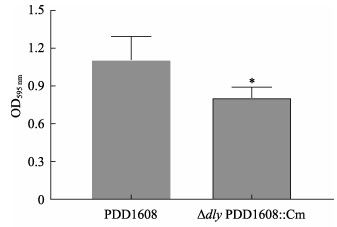
使用结晶紫染色法对PDD1608和ΔdlyPDD1608::Cm两株菌的生物被膜形成测定结果显示,与野生株PDD1608相比,ΔdlyPDD1608::Cm的生物被膜形成能力显著下降(P< 0.05)(图 4),这表明毒力基因dly可能参与调控了PDD菌株生物被膜的形成。
|
图 4 野生株PDD1608和缺失株ΔdlyPDD1608::Cm生物被膜形成能力 Fig.4 Biofilm formation ability of wild type strain PDD1608 and mutant strain Δdly PDD1608::Cm *表示差异显著(P < 0.05)。 * indicate significant difference (P < 0.05). |
菌株PDD1608和ΔdlyPDD1608::Cm的38种抗生素药敏结果显示,毒力基因dly缺失后,菌株对氯霉素的敏感性减弱,氯霉素抗性减弱的原因是构建缺失株Δdly PDD1608::Cm的过程中插入了氯霉素抗性基因(Cm);其他37种抗生素药敏实验的结果不存在差异(表 3)。
|
|
表 3 野生株PDD1608和缺失株ΔdlyPDD1608::Cm的的抗生素敏感性实验结果 Tab.3 Antibiotic susceptibility test results of wild type strain PDD1608 and mutant strain Δdly PDD1608::Cm |
野生株PDD1608及ECP表现出极强的溶血活性和磷脂酶活性,而缺失株Δdly PDD1608::Cm及ECP的溶血性和磷脂酶活性较低,与野生株PDD1608的实验结果相比,溶血活性和磷脂酶活性均表现为降低(图 5)。结果表明,毒力基因dly的缺失对PDD1608的溶血活性和磷脂酶活性产生较为显著的影响,导致溶血活性和磷脂酶活性降低。

|
图 5 野生株PDD1608和缺失株ΔdlyPDD1608::Cm及其ECP的磷脂酶活性和溶血活性 Fig.5 Phospholipase and hemolytic activities of wild type strain PDD1608 and mutant strain Δdly PDD1608::Cm and their ECP a:2个菌株及其ECP的磷脂酶活性;b:2个菌株及其ECP的溶血活性。 a: Phospholipase activity of the two strains and their ECP; b: Hemolytic activity of the two strains and their ECP. |
菌株PDD1608和ΔdlyPDD1608::Cm对海水青鳉鱼的攻毒实验测得2株菌的LD50分别为1.31×105 CFU/mL和1.71×107 CFU/mL,毒力基因dly缺失株的LD50升高,是野生株的130.53倍。同时,2株菌攻毒后的生存曲线表明,相同攻毒浓度条件下,缺失株的致死速率降低,且低浓度条件下,缺失株攻毒的海水青鳉鱼存活率明显高于野生株(图 6a~b),说明毒力基因dly的缺失影响了菌株PDD1608的致病性,导致其毒力降低。

|
图 6 野生株PDD1608和缺失株ΔdlyPDD1608::Cm及其ECP人工感染实验结果 Fig.6 Artificial infection test results of wild type strain PDD1608 and mutant strain Δdly PDD1608::Cm and their ECP a:野生株PDD1608;b:缺失株ΔdlyPDD1608::Cm;c:野生株PDD1608 ECP;d:缺失株ΔdlyPDD1608::Cm ECP。 a: PDD1608; b: Δdly PDD1608::Cm; c: PDD1608 ECP; d: Δdly PDD1608::Cm ECP. |
菌株PDD1608和Δdly PDD1608::Cm胞外产物ECP的攻毒实验测得2株菌ECP的LD50分别为101.46μg/mL和110.19 μg/mL,缺失株ECP的LD50与野生株ECP相比,提高了0.09倍,但二者的致死时间存在明显差异(图 6c~d),缺失株ECP在相同稀释倍数条件下对海水青鳉鱼的致死速率降低,说明毒力基因dly的缺失对PDD菌株胞外产物ECP的毒力产生了一定影响,结合溶血活性的实验结果,推测dly基因的缺失降低了PDD菌株胞外产物ECP的溶血能力,进而降低了PDD菌株ECP的致病性。
菌株的致病性结果和菌株ECP的致病性结果具有正相关性,野生株PDD1608及其ECP的致病性均高于缺失株ΔdlyPDD1608::Cm及其ECP的致病性,说明毒力基因dly对菌株PDD1608的致病性存在促进作用。
3 讨论PDD在海洋环境中广泛分布,最初在1981年以Vibrio damselae命名报道(Love et al, 1981),经Smith等(1991)进一步研究后,将其命名修改为美人鱼发光杆菌美人鱼亚种(Photobacterium damselae subsp. damselae)。近10多年来,有关PDD对海洋动物致病的报道逐渐增多,且PDD致病的宿主种类也呈现多样性,宿主包括六带鲹(Caranx sexfasciatus) (Yashgin et al, 2015)、斑节对虾(Penaus monodon) (Vaseeharan et al, 2007)、脊尾白虾(Exopalaemon carinicauda) (Liu et al, 2016)和半滑舌鳎(Cynoglossus semilaevis) (Shao et al, 2019)等。因此,需要深入研究PDD的致病机制,以期有针对性地建立防控技术措施,降低其对海洋生物的危害。
研究表明,位于质粒pPHDD1上的毒力基因dly、PhlyP和位于染色体的毒力基因PhlyC为PDD菌株溶血性相关基因,且毒力基因dly具有一定磷脂酶-D的活性(Osorio et al, 2000)。位于染色体的毒力基因PlpV为磷脂酶活性相关基因,这4种毒力基因与PDD菌株致病力强弱密切相关(Rivas et al, 2015)。为深入研究实验室保存的高致病性野生株PDD1608的致病机制,选择构建溶血性相关基因dly的缺失株ΔdlyPDD1608::Cm,进行生长特性、药物敏感性、溶血活性、磷脂酶活性和菌株致病性等多个验证实验,探究dly基因在PDD1608致病过程中的关键作用。
本研究发现,dly基因缺失未改变菌落形态特征,但导致缺失株的生长速度变慢,缺失株进入对数生长期的时间比野生株推迟6 h左右。而在其他学者的相关研究中也存在类似情况,如延凯娜等(2020)构建的肠出血型大肠杆菌vscG基因缺失株生长速度与野生株相比有所减慢,而张海洋等(2021)构建的副溶血弧菌(Vibrio parahemolyticus) VP2918基因缺失株、彭新亮等(2022)构建的溶藻弧菌(V.alginolyticus) VcrV基因缺失株等的生长速度与野生株相比未产生变化。由此推测,PDD1608菌株的dly基因与生长调控基因之间可能存在协同效应,但dly基因是如何参与PDD菌株生长的调控机制还需进行深入的研究。
PDD菌株在海水环境中生存适应能力很强,并且对多种海洋动物都有致病性,因此,需要挑选合适的抗生素来抑制其生长繁殖或消杀,但滥用抗生素会导致耐药细菌的出现(Santos et al, 2018)。因此,本研究选取了38种抗生素和26种生理生化鉴定管,对野生株PDD1608和缺失株Δdly PDD1608::Cm进行定性和定量实验,目的是为了更好的研究毒力基因dly对菌株的耐药和理化特性的影响。dly基因缺失株与野生株相比,药物敏感性和生理生化特性的结果并未有差异,缺失株对氯霉素药物敏感性降低是由于在构建dly基因缺失株的过程中,通过引入外源Cm抗性基因将dly基因替换,从而降低了缺失株对氯霉素的敏感性。因此推断,毒力基因dly不参与菌株PDD耐药基因的调控表达,同时,对菌株的理化特性没有影响。
但当毒力基因dly缺失后,缺失株的涌动性表现为极显著性降低(P< 0.01),生物被膜形成能力显著性降低(P< 0.05)。生物膜不仅有助于细菌附着于宿主细胞,同时,还能协助细菌逃避宿主免疫反应(Göçer et al, 2017)。细菌生物膜形成与细菌的鞭毛具有一定关联性,有研究表明,鞭毛的调控蛋白对细菌的运动能力也有影响,如空肠弯曲菌(Campylobacter jejuni)鞭毛基因flgA产生插入突变后,细菌的运动性和依附于食物表面形成生物膜的能力显著降低(Kim et al, 2015)。对溶藻弧菌的相关研究证实,基因FlhF能够正向调节极性鞭毛数量和细菌的涌动性(Kusumoto et al, 2006)。本研究中,毒力基因dly缺失后,PDD菌株的涌动性降低,生物膜形成能力降低,而涌动性和生物膜形成能力与细菌运动性相关,进而影响PDD菌株对宿主的黏附能力,最终,对PDD菌株的致病力产生影响。
本研究中,缺失株ΔdlyPDD1608::Cm的溶血性和磷脂酶活性与野生株PDD1608相比都有所降低,且缺失株ECP的溶血性和磷脂酶活性与野生株ECP相比也是降低的。各菌株及ECP的实验结果之间呈现正相关性,证实了毒力基因dly在野生株PDD1608中起到增强溶血性和磷脂酶活性的作用,dly基因的缺失可能对PDD菌株胞外产物的成分产生了影响,一些溶血活性相关的产物减少,进而导致其ECP的溶血能力降低,这一实验结果与Osorio等(2000)的研究结果相类似。
本研究挑选了模式生物海水青鳉鱼作为人工感染实验的宿主,利用梯度稀释的菌液和2倍稀释的ECP分别进行鱼体创伤后的浸浴感染实验,最终测定野生株PDD1608和缺失株ΔdlyPDD1608::Cm的LD50分别为1.31×105 CFU/mL和1.71×107 CFU/mL,PDD1608 ECP和缺失株ΔdlyPDD1608::Cm ECP的LD50分别为101.46 μg/mL和110.19 μg/mL。缺失株ΔdlyPDD1608::Cm的LD50是野生株的130.53倍;缺失株Δdly PDD1608::Cm ECP的LD50是野生株ECP的1.09倍。菌液和ECP的攻毒实验结果之间存在正相关性,缺失株及其ECP的致病性降低,表明dly基因的缺失影响了PDD菌株的毒力。
ECP作为病原菌致病感染过程中的重要物质,其中包含多种产物,如溶血素、脂多糖和活性酶等,是细菌致病的关键毒力因子(Pablos et al, 2010)。细菌通过黏附、寄生在宿主细胞和血液中,繁殖生长并产生ECP而引起宿主发病死亡,整个过程中,ECP起到了极其重要的作用(Ben et al, 2018)。因此,本研究中缺失株ECP致病性降低,推测由于毒力基因dly参与调控PDD菌株毒力因子的表达和分泌,并且影响PDD菌株对宿主细胞及组织的侵染能力,这需要进一步的组织病理和细胞毒理实验来验证。
本研究结果有助于进一步了解毒力基因dly对PDD菌株生物学特性的影响,从而研究合适的防控措施来控制其传播和感染。而关于模式生物海水青鳉鱼的攻毒实验有助于为深入探究PDD菌株对宿主的致病机制和侵染过程提供动物参考模型,ECP的相关实验结果可以为PDD亚单位疫苗的研发提供理论参考。
AUSTIN B, AUSTIN D A. Bacterial fish pathogens: Diseases of farmed and wild fish (4th edition). Springer, 2007 |
BEN H S, TAVARES R P M J, TACHIBANA L, et al. Fish pathogen bacteria: Adhesion, parameters influencing virulence and interaction with host cells. Fish and Shellfish Immunol, 2018, 80: 550-562 DOI:10.1016/j.fsi.2018.06.053 |
GÖÇER H, EMIR D, ÖNGER M E, et al. Effects of bone cement loaded with teicoplanin, N-acetylcysteine or their combination on Staphylococcus aureus biofilm formation: An in vitro study. Joint Diseases and Related Surgery, 2017, 28(1): 13-18 DOI:10.5606/ehc.2017.52507 |
KIM J S, PARK C W, KIM J Y. Role of flgA for flagellar biosynthesis and biofilm formation of Campylobacter jejuni NCTC11168. Journal of Microbiology and Biotechnology, 2015, 25(11): 1871-1879 DOI:10.4014/jmb.1504.04080 |
KUSUMOTO A, KAMISAKA K, YAKUSHI T, et al. Regulation of polar flagellar number by the flhF and flhG genes in Vibrio alginolyticus. Journal of Biochemistry, 2006, 139(1): 113-121 DOI:10.1093/jb/mvj010 |
LABELLA A M, ROSADO J J, BALADO M, et al. Virulence properties of three new Photobacterium species affecting cultured fish. Journal of Applied Microbiology, 2020, 129(1): 37-50 DOI:10.1111/jam.14437 |
LEE D J, BINGLE L E, HEURLIER K, et al. Gene doctoring: A method for recombineering in laboratory and pathogenic Escherichia coli strains. BMC Microbiol, 2009, 9(1): 252-265 DOI:10.1186/1471-2180-9-252 |
LI Y J, YU Y X, WANG Y G, et al. Virulence of the extracellular products of highly pathogenic strains of Photobacterium damselae subsp.damselae. Acta Microbiologica Sinica, 2022, 62(8): 2995-3006 [李永杰, 于永翔, 王印庚, 等. 高致病性美人鱼发光杆菌美人鱼亚种胞外产物的毒力特性分析. 微生物学报, 2022, 62(8): 2995-3006] |
LIU F, LIU G X, LI F H. Characterization of two pathogenic Photobacterium strains isolated from Exopalaemon carinicauda causing mortality of shrimp. Aquaculture, 2016, 464: 129-135 DOI:10.1016/j.aquaculture.2016.06.019 |
LIU X, ZHANG Z, WANG L F, et al. Phenotypic and genetic diversity of Photobacterium damsela subsp. damsela isolated from aquatic animals in Hainan Province and Bohai Sea region. Acta Microbiologica Sinica, 2021, 61(7): 2101-2111 [刘潇, 张正, 王丽芳, 等. 海南地区与环渤海湾美人鱼发光杆菌美人鱼亚种水产动物分离株的表型与遗传特征分析. 微生物学报, 2021, 61(7): 2101-2111] |
LOVE M, TEEBKEN-FISHER D, HOSE J E, et al. Vibrio damsela, a marine bacterium, causes skin ulcers on the damselfish Chromis punctipinnis. Science, 1981, 214(4525): 1139-1140 DOI:10.1126/science.214.4525.1139 |
OSORIO C R, ROMALDE J L, BARJA J L, et al. Presence of phospholipase-D (dly) gene coding for damselysin production is not a pre-requisite for pathogenicity in Photobacterium damselae subsp.damselae. Microbial Pathogenesis, 2000, 28(2): 119-126 DOI:10.1006/mpat.1999.0330 |
PABLOS M, REMACHA M A, RODRÍGUEZ J M, et al. Identity, virulence genes, and clonal relatedness of Aeromonas isolates from patients with diarrhea and drinking water. European Journal of Clinical Microbiology and Infectious Diseases: Official Publication of the European Society of Clinical Microbiology, 2010, 29(9): 1163-1172 DOI:10.1007/s10096-010-0982-3 |
PENG X L, JIAN J C, DING Y. Construction of VcrV-deleted mutant of Vibrio alginolyticus and its biological characteristics. Chinese Journal of Biotechnology, 2022, 38(8): 3062-3075 [彭新亮, 简纪常, 丁燏. 溶藻弧菌VcrV基因缺失株的构建及生物学特性. 生物工程学报, 2022, 38(8): 3062-3075] |
RIVAS A J, BALADO M, LEMOS M L, et al. The Photobacterium damselae subsp.damselae hemolysins damselysin and HlyA are encoded within a new virulence plasmid. Infection and Immunity, 2011, 79(11): 4617-4627 DOI:10.1128/IAI.05436-11 |
RIVAS A J, VON HOVEN G, NEUKIRCH C, et al. Phobalysin, a small beta-pore-forming toxin of Photobacterium damselae subsp.damselae. Infection and Immunity, 2015, 89(11): 4335-4348 |
SANTOS L, RAMOS F. Antimicrobial resistance in aquaculture: Current knowledge and alternatives to tackle the problem. International Journal of Antimicrobial Agents, 2018, 52(2): 135-143 DOI:10.1016/j.ijantimicag.2018.03.010 |
SHAO P, YONG P, ZHOU W, et al. First isolation of Photobacterium damselae subsp.damselae from half-smooth tongue sole suffering from skin-ulceration disease. Aquaculture, 2019, 511: 734208 DOI:10.1016/j.aquaculture.2019.734208 |
SHI L N. Pathogenicity difference of different Photobacterium damselae subsp. Damselae strains to Sebastes schlegelii. Master′s Thesis of Shanghai Ocean University, 2019 [施琳妮. 不同美人鱼发光杆菌美人鱼亚种菌株对许氏平鲉致病力差异分析. 上海海洋大学硕士研究生学位论文, 2019]
|
SMITH S K, SUTTON D C, FUERST J A, et al. Evaluation of the genus Listonella and reassignment of Listonella damsela (Love et al.) MacDonell and Colwell to the genus Photobacterium as Photobacterium damsela comb. nov. with an emended description. International Journal of Systematic Bacteriology, 1991, 41(4): 529--534 DOI:10.1099/00207713-41-4-529 |
TAKAHASHI H, MIYA S, KIMURA B, et al. Difference of genotypic and phenotypic characteristics and pathogenicity potential of Photobacterium damselae subsp.damselae between clinical and environmental isolates from Japan. Microbial Pathogenesis, 2008, 45(2): 150-158 DOI:10.1016/j.micpath.2008.04.008 |
TAKAO S, MINORU T, KAYO K, et al. The national bioresource project Medaka (NBRP Medaka): An integrated bioresource for biological and biomedical sciences. Experimental Animals, 2010, 59(1): 13-23 DOI:10.1538/expanim.59.13 |
TERCETI M S, OGUT H, OSORIO C R. Photobacterium damselae subsp.damselae, an emerging fish pathogen in the Black Sea: Evidence of a multiclonal origin. Applied and Environmental Microbiology, 2016, 82(13): 3736-3745 DOI:10.1128/AEM.00781-16 |
TERCETI M S, RIVAS A J, ALVAREZ L, et al. rstB regulates expression of the Photobacterium damselae subsp.damselae major virulence factors damselysin, phobalysin P and phobalysin C. Frontiers in Microbiology, 2017, 8: 582 |
VASEEHARAN B, SUNDARARAJ S, MURUGAN T, et al. Photobacterium damselae ssp. damselae associated with diseased black tiger shrimp Penaeus monodon fabricius in India. Letters in Applied Microbiology, 2007, 45(1): 82-86 DOI:10.1111/j.1472-765X.2007.02139.x |
VENCES A, RIVAS A J, LEMOS M L, et al. Chromosome-Encoded hemolysin, phospholipase, and collagenase in plasmidless isolates of Photobacterium damselae subsp.damselae contribute to virulence for fish. Applied and Environmental Microbiology, 2017, 83(11): 401-417 |
WITTBRODT J, SHIMA A, SCHARTL M. Medaka-A model organism from the Far East. Nature Reviews Genetics, 2002, 3(1): 53-64 DOI:10.1038/nrg704 |
WU T L, JIN X M, WANG H B, et al. Prokaryotic expresion and preparation of immune serum of hlych gene of Photobacterium damselae. Progress in Veterinary Medicine, 2018, 39(10): 31-35 [吴同垒, 靳晓敏, 王洪彬, 等. 美人鱼发光杆菌溶血素Hlych基因的原核表达及免疫血清制备. 动物医学进展, 2018, 39(10): 31-35 DOI:10.3969/j.issn.1007-5038.2018.10.006] |
YAN K N, WANG X Y, WAN C S. Construction of an enterohemorhagic Escherichia coli O157:H7 espG knockout strain and analysis of its biological characteristics. Journal of Pathogen Biology, 2020, 15(10): 1144-1150 [延凯娜, 王湘雨, 万成松. 肠出血型大肠埃希菌O157:H7 espG基因缺失株的构建及其生物学特性分析. 中国病原生物学杂志, 2020, 15(10): 1144-1150] |
YASHGIN H, NIMA B, MAJID B S. First time isolation of Photobacterium damselae subsp.damselae from Caranx sexfasciatus in Persian Gulf, Iran. Iranian Journal of Microbiology, 2015, 7(3): 178-184 |
ZHANG H Y, WANG Q, LIU S, et al. Gene deletion and functional analysis of vp2918 gene in Vibrio parahemolyticus. Acta Microbiologica Sinica, 2021, 61(11): 3705-3714 [张海洋, 王权, 刘爽, 等. 副溶血弧菌VP2918基因缺失株的构建及功能研究. 微生物学报, 2021, 61(11): 3705-3714] |
ZHANG X H, MEADEN P G, AUSTIN B. Duplication of hemolysin genes in a virulent isolate of Vibrio harveyi. Applied and Environmental Microbiology, 2001, 67(7): 3161-3167 DOI:10.1128/AEM.67.7.3161-3167.2001 |
ZHANG Y Q, DENG Y Q, FENG J, et al. CqsA inhibits the virulence of Vibrio harveyi to the pearl gentian grouper (♀Epinephelus fuscoguttatus×♂Epinephelus lanceolatus). Aquaculture, 2021, 535: 736346 DOI:10.1016/j.aquaculture.2021.736346 |
ZHANG Z, YU Y X, WANG K, et al. First report of skin ulceration caused by Photobacterium damselae subsp.damselae in net-cage cultured black rockfish (Sebastes schlegeli). Aquaculture, 2019, 503: 1-7 DOI:10.1016/j.aquaculture.2018.12.088 |



