2. 扬州大学动物科学与技术学院 江苏 扬州 225009;
3. 江苏省农业种质资源保护与利用平台 江苏 南京 210014
2. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China;
3. Jiangsu Provincial Platform for Conservation and Utilization of Agricultural Germplasm, Nanjing 210014, China
斑点叉尾鮰(Ictalurus punctatus)因其肉质鲜美少刺,且生长迅速、环境适应性强,受到消费者和养殖者的喜爱,已成为我国重要的淡水养殖鱼类(Mischke, 2012; Zhong et al, 2016)。然而,随着斑点叉尾鮰养殖密度的增加,病害的发生尤为频繁。传统的抗生素治疗水产养殖动物疾病会产生耐药性和药物残留的问题(Amable et al, 2022; Song et al, 2022)。因此,许多科研人员致力于开发安全无害的抗生素替代品,研究表明,饲料中添加益生菌可显著提高水产动物的免疫力,减少疾病的发生。
发酵饲料是指利用乳杆菌(Lactobacillus)、芽孢杆菌(Bacillus)、酵母菌(Saccharomyces)等有益菌对饲料原料进行厌氧或好氧发酵,使原料中的纤维素、果胶等分解为动物易消化吸收的成分,可以减轻动物肠道负担,提高动物消化吸收能力,促进生长(Socol et al, 2017)。同时,发酵饲料中添加益生菌可以提高机体抗氧化酶活性,提高动物免疫力,及时抵御和消灭病原(徐亚飞, 2018)。与普通饲料相比,发酵饲料中的益生菌在代谢过程中可以形成各种酶,用于分解水中的有害物质和有机物,进而优化水质(于梦楠等, 2021)。张书环等(2021)研究发现,饲料中添加枯草芽孢杆菌(Bacillus subtilis)可降低杂交鲟(Acipenser sinensis)的饵料系数,增强其对血糖和脂肪的利用率,并可改善肠道微生物菌群结构。唐杨等(2017)研究表明,饲料中添加蜡样芽孢杆菌(Bacillus cereus)可改善凡纳对虾(Penaeus vannamei)肠道菌群,提高其生长速度。王海瑞等(2020)在饲料中添加丁酸梭菌(Clostridium butyricum)可显著提高黄颡鱼(Pelteobagrus fulvidraco)的血清抗氧化能力,且黄颡鱼肠道内的短链脂肪酸含量显著升高。然而,过量投喂饲料会产生一系列不良后果,如增加饲料成本和饵料系数,增加水产动物发病率和死亡率,还会带来环境污染的问题,使得养殖成本和养殖风险升高(Zhang et al, 2020)。目前,关于斑点叉尾鮰发酵饲料科学投喂方式尚属空白,本研究通过对发酵饲料投喂方式的探索,研究其对斑点叉尾鮰生长、肠道微生物组成及代谢组学的影响,旨在为发酵饲料在斑点叉尾鮰饲料中的合理利用提供理论基础。
1 材料与方法 1.1 实验设置实验在江苏省淡水水产研究所永宁基地开展,选择标准化养殖池塘9个(面积为0.667 hm2左右,水深为1.5 m)。6月初,按18 000尾/hm2的密度投放规格60 g左右的斑点叉尾鮰鱼种。实验设持续投喂组(A)、间隔投喂组(B)和空白对照组(C),每组3个重复。实验用配合饲料为斑点叉尾鮰膨化配合饲料(浙江澳华饲料有限公司),饲料成分和营养组成:水分≤12.0%,粗蛋白≥32.0%,粗脂肪≥4.0%,粗灰分≤16.0%,粗纤维≤8.0%,总磷≥0.5%,赖氨酸≥1.6%。发酵饲料为生物饲料丰鱼肽宝Ⅰ型(广西澳华农牧科技有限公司),饲料成分和营养组成:水分≤32.0%,粗蛋白≥35.0%,粗灰分≤12.0%,粗纤维≤12.0%,总磷≥0.4%,赖氨酸≥1.8%,有机酸≥2.0%,益生菌总量为3×106 CFU/g。每日早晚2次投喂,6月饲料投喂量为鱼体重的4%,之后逐步下降,10—11月投喂量为2%。发酵饲料按投喂总量的20%添加,与膨化饲料混匀后直接投喂。持续投喂组即在6个月实验期间持续在膨化饲料中添加发酵饲料,间隔投喂组即在膨化饲料中按周间隔添加发酵饲料,空白对照组实验期间只投喂膨化饲料。
1.2 样品采集和处理实验养殖周期6个月,期间所有池塘开展正常养殖管理。11月末养殖实验结束,饥饿24 h后,每口池塘随机捕捞3尾个体(每组9尾,共27尾),75%酒精擦拭鱼体表面消毒后置于冰上迅速解剖,取出肠道,挤出肠道内容物于无菌EP管中,经液氮速冻后于–80 ℃保存,用于后续分析。在实验结束后,对各组实验用鱼的体质量进行测量,测量前饥饿24 h。
1.3 高通量测序和数据分析实验组的肠道微生物总DNA使用FastPure®细胞/组织DNA试剂盒(DC102, 诺唯赞)提取。DNA浓度和纯度使用NanoDrop2000检测。以通用引物338F和806R扩增16S rRNA基因V3~V4区。建库和测序由上海美吉生物医药科技有限公司完成。测序平台为Illumina NovaSeqPE250,对原始数据进行拼接质控后,使用美吉生物云平台(https://cloud.majorbio.com)进行数据分析,共获得1 133 769个优化序列,平均序列长度为412 bp。
1.4 代谢组学测定代谢物非靶向代谢组学测定由上海美吉生物医药科技有限公司进行。原始数据经去噪平滑、基线校正等LC/MS分析信息提取,以及原始数据缺失值过滤和填充、数据归一化、数据转换等数据预处理,最终得到用于后续分析的数据矩阵。预处理后的数据在美吉生物云平台(https://cloud.majorbio.com)进行分析。
1.5 数据统计分析实验数据使用Excel 2020和SPSS 22.0软件进行统计分析,数据以平均值±标准误(Mean±SE)表示,P < 0.05为差异显著。多样性指数分析,使用单因素方差分析(one-way ANOVA),多重比较分析用Duncan′s法进行。差异代谢物分析采用Student′s T检验分析。
2 结果与分析 2.1 不同投喂方式对斑点叉尾鮰生长的影响发酵饲料不同投喂方式喂养斑点叉尾鮰6个月后,称量各组实验鱼体重。结果发现,间隔投喂组终末体重为(745.60±214.57) g,显著高于对照组与持续投喂组(P < 0.05)。其中,对照组终末体重为(588.10± 168.62) g,持续投喂组终末体重为(624.10±194.70) g。
2.2 不同投喂方式对斑点叉尾鮰肠道菌群多样性的影响Simpson指数值与群落多样性呈反比,而Shannon指数值与群落多样性呈正比。持续投喂和间隔投喂方式下的斑点叉尾鮰肠道细菌群落Shannon指数、Simpson指数、ACE指数和Chao指数无显著性差异(P > 0.05) (表 1)。间隔投喂组的Shannon指数最大,Simpson指数最小,说明间隔投喂肠道菌群多样性最大。ACE指数和Chao指数反映群落丰富度,间隔投喂组ACE指数和Chao指数最大,说明间隔投喂组微生物群落的丰富度最高。持续投喂组的Shannon指数仅次于间隔投喂组,但高于对照组,说明添加发酵饲料可以改变斑点叉尾鮰肠道菌群的多样性,并且发酵饲料不同投喂方式在不同程度上影响多样性。持续投喂组的Simpson指数大于对照组,并且ACE指数和Chao指数小于对照组,可见持续添加发酵饲料反而使得斑点叉尾鮰肠道菌群的多样性和丰富度有所下降(表 1)。
|
|
表 1 不同投喂方式对斑点叉尾鮰肠道菌群多样性的影响 Tab.1 Effects of different feeding methods on the diversity of intestinal bacterial community of channel catfish |
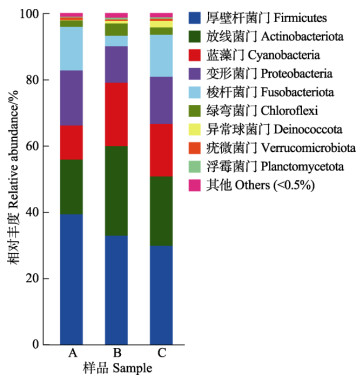
门水平上,3组中,优势门是厚壁杆菌门(Firmicutes)、放线菌门(Actinobacteriota)、蓝藻门(Cyanobacteria)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteriota)、绿弯菌门(Chloroflexi)、异常球菌门(Deinococcota)。与对照组相比,持续投喂组和间隔投喂组的厚壁杆菌门相对丰度上升,持续投喂组放线菌门和蓝藻门相对丰度下降,而在间隔投喂组中放线菌门和蓝藻门相对丰度上升。变形菌门的相对丰度在持续投喂组最高,在间隔投喂组中最低。同时,3组中,间隔投喂组的梭杆菌门相对丰度最低,绿弯菌门相对丰度最高,而异常球菌门的相对丰度在持续投喂组中最低(图 1)。
|
图 1 斑点叉尾鮰肠道微生物在门水平上的群落丰度 Fig.1 Community abundance at the phylum level in the intestine microbiota of the channel catfish A:持续投喂组;B:间隔投喂组;C:对照组。 A: Continuous feeding group; B: Interval feeding group; C: Control group. |
属水平上,未命名的叶绿体科中的一个属(norank_f_norank_o_Chloroplast)、分枝杆菌属(Mycobacterium)、鲸杆菌属(Cetobacterium)、罗姆布茨菌属(Romboutsia)、微小杆菌属(Exiguobacterium)、狭义梭菌属(Clostridium_sensu_stricto_1)在样本中占比较大。未命名的叶绿体科中的一个属和分枝杆菌属相对丰度在持续投喂组中最低,而在间隔投喂组中相对丰度最高。与对照组相比,间隔投喂组中鲸杆菌属相对丰度最低,持续投喂组和间隔投喂组中罗姆布茨菌属和狭义梭菌属的相对丰度升高,而条件致病菌葡萄球菌属的相对丰度降低(图 2)。

|
图 2 斑点叉尾鮰肠道微生物在属水平上的群落丰度百分比 Fig.2 Relative abundance of species at the genus level in the intestine microbiota of the channel catfish A:持续投喂组;B:间隔投喂组;C:对照组。 A: Continuous feeding group; B: Interval feeding group; C: Control group. |
采用Student′s T检验对照组与持续投喂组之间的差异代谢物,在正负离子模式下,以VIP > 1、P < 0.05以及FC > 1或FC < 1对持续投喂组与对照组差异代谢产物进行筛选,共获得44种显著差异代谢物。与对照组相比,持续投喂组获得24个显著上调产物和20个显著下调产物,其中,差异代谢物胆酸甲酯、2-甲氧基-4-十五烷基苯甲酸极显著上调(P < 0.01),而去甲基雷帕霉素、丙氨酰-脯氨酸极显著下调(P < 0.01)。与对照组相比,间隔投喂组共有3种差异代谢物极显著下调(P < 0.01),分别为2-苯乙基β-D-吡喃葡萄糖苷、O-琥珀酰-L-高丝氨酸和2-吲哚羧酸。与持续投喂组相比,间隔投喂组差异代谢物2-甲氧基-4-十五烷基苯甲酸和尼亚齐米辛A显著下调(P < 0.05),2-吡咯酰基甘氨酸和丙氨酰-脯氨酸显著上调(P < 0.05)。
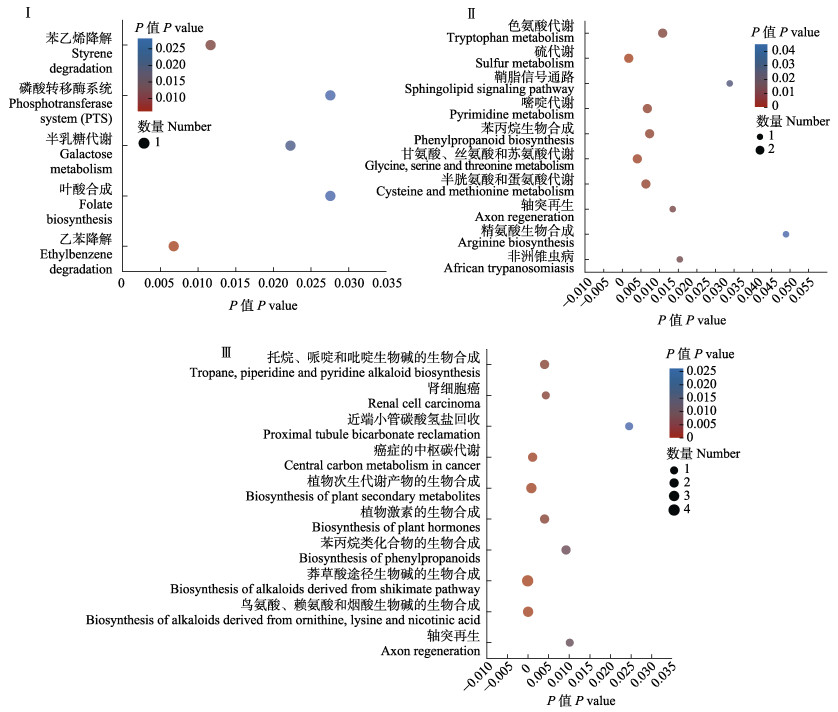
2.5 代谢通路分析KEGG通路富集分析中,当P < 0.05时,认为此通路存在显著富集情况。对P值在前10的通路进行分析,与对照组相比,持续投喂组显著富集的代谢通路见图 3Ⅰ,其中,半乳糖代谢通路和磷酸转移酶系统通路都涉及上调代谢产物N-乙酰-D-半乳糖胺(P < 0.05)。间隔投喂组显著富集的通路见图 3Ⅱ,其中,色氨酸代谢通路中差异代谢物5-羟基-L-色氨酸和L-犬尿氨酸的含量显著下调(P < 0.05)。同时,L-丝氨酸在硫代谢、鞘脂信号代谢、甘氨酸、丝氨酸和苏氨酸代谢及半胱氨酸和蛋氨酸代谢中显著上调(P < 0.05),在持续投喂组与间隔投喂组之间显著富集的通路见图 3Ⅲ,间隔投喂组托烷、哌啶和吡啶生物碱的生物合成、癌症的中枢碳代谢、植物次生代谢产物的生物合成、植物激素的生物合成、苯丙烷类化合物的生物合成和鸟氨酸及赖氨酸和烟酸生物碱的生物合成代谢通路中L-苯丙氨酸显著上调(P < 0.05)。
|
图 3 差异代谢通路富集分析 Fig.3 Differential metabolic pathway enrichment analysis Ⅰ:对照组与持续投喂组差异代谢通路富集分析;Ⅱ:对照组与间隔投喂组差异代谢通路富集分析;Ⅲ:持续投喂组与间隔投喂组差异代谢通路富集分析。 Ⅰ: Enrichment analysis of differential metabolic pathways between control group and continuous feeding group; Ⅱ: Enrichment analysis of differential metabolic pathways between control group and interval feeding group; Ⅲ: Enrichment analysis of differential metabolic pathways between continuous feeding group and interval feeding group. |
本研究中,在斑点叉尾鮰肠道中优势菌门为厚壁杆菌门、放线菌门、蓝藻门、变形菌门、梭杆菌门和绿弯杆菌门。耿彬等(2021)研究表明,梭菌门、厚壁杆菌门、变形菌门和拟杆菌门是斑点叉尾鮰肠道中优势菌门;熊向英等(2022)研究发现,斑点叉尾鮰肠道中主要菌群是厚壁杆菌门、拟杆菌门和梭杆菌门,合计占细菌总量92.43%;雷宇杰等(2020)研究表明,在斑点叉尾鮰肠道中,丰度前3分别是拟杆菌门、梭杆菌门和厚壁杆菌门。以上研究和本研究结果稍有不同,本研究中,拟杆菌门的占比很小,可能是养殖环境差异造成的。
肠道微生物多样性被认为是宿主健康和代谢能力的指标,低多样性表明肠道微生物群落稳定性差,宿主患病风险大(Jena et al, 2018; 金若晨等, 2020)。草鱼(Ctenopharyngodon idella)病毒感染组的Shannon指数和Pielou均匀度显著低于对照组(朱文根等, 2019)。金若晨(2020)同样发现,对健康池塘和发病池中的凡纳对虾进行多样性分析发现,发病虾肠道菌群的多样性指数显著低于健康池塘,并且菌群组成单一。本研究中,与对照组相比,持续投喂发酵饲料和间隔投喂发酵饲料斑点叉尾鮰肠道微生物群落的多样性均无显著差异,但间隔投喂组的ACE指数和Chao指数值大于对照组和持续投喂组,且Shannon指数最大,Simpson指数最小,说明间隔投喂组群落多样性和丰富度最高。结果表明,间隔投喂可维持肠道菌群功能稳定,降低斑点叉尾鮰患病的风险。
厚壁杆菌门中部分菌群有促进食物消化的功能,拟杆菌门可参与糖类代谢和运输,促进宿主生长,为宿主提供能量(吴金凤等, 2016; 卢德胤, 2019)。厚壁杆菌门与拟杆菌门的比值与脂质代谢和存储呈正相关(Jiao et al, 2021)。放线菌门在肠道通透性调节、免疫调节及代谢中起着关键作用(Binda et al, 2018)。水体中含有大量的变形菌门细菌,但大量出现在养殖动物肠道内则反映肠道群落的失调,炎症反应发生的风险增大(Shin et al, 2015)。本研究中,与对照组相比,持续投喂组和间隔投喂组中的拟杆菌门相对丰度下降,并且间隔投喂组中,厚壁杆菌门与拟杆菌门的比值最高,持续投喂组中,厚壁杆菌门与拟杆菌门的比值次之。持续投喂组的厚壁杆菌门相对丰度增加,放线菌门相对丰度降低,变形菌门的相对丰度增加。而在间隔投喂组中,厚壁杆菌门和放线菌门的相对丰度均增加,变形菌门的相对丰度相比对照组下降。持续投喂组和间隔发酵饲料组中,厚壁杆菌门丰度无显著差异(P > 0.05),可见投喂发酵饲料可使肠道内厚壁杆菌门的丰度增加,可促进斑点叉尾鮰的消化吸收。间隔投喂组中,放线菌门丰度的增加有利于斑点叉尾鮰肠道内稳态和免疫的调节。而持续投喂组中,变形菌门占比的增加有诱发斑点叉尾鮰炎症反应的风险。梭杆菌门则与低密度脂蛋白胆固醇的含量呈正相关,与机体与脂类的利用率呈负相关(徐佳莹等, 2020)。同时,梭杆菌门也是水体中的条件致病菌,为革兰氏阴性菌。实验组中,间隔投喂组中梭杆菌门相对丰度最低,梭杆菌门丰度的降低能提高宿主对脂质的利用,进而改善斑点叉尾鮰的消化吸收能力,降低患病率。
鲸杆菌属参与宿主维生素代谢,可产生维生素B12和抗菌肽,并且具有发酵多肽碳水化合物的功能(Roeselers et al, 2011)。李东亮(2016)的研究表明,鲸杆菌属丰度的降低反而会提高机体免疫力。本研究中,间隔投喂组的鲸杆菌属相对丰度最低,可在一定程度上提高鱼体的免疫力,而持续投喂组与对照组相比无显著差异(P > 0.05)。罗姆布茨菌属可利用简单碳水化合物合成鱼体所需的氨基酸和维生素,进而促进鱼体生长(Koren et al, 2011)。梭菌属可以发酵碳水化合物和糖类,为鱼体提供营养和能量,进而促进生长,增强免疫功能(Larsen et al, 2014)。本研究中,属水平上,罗姆布茨菌属和梭菌属相对丰度在持续投喂组和间隔投喂组中的升高可促进鱼体对碳水化合物的代谢,不断给鱼体供能,促进其生长发育。乳球菌属是养殖动物肠道内重要益生菌,对宿主免疫调节有着重要作用,其在繁殖过程中可产生乳酸等抑制有害菌的入侵和生长(Tsuchiya et al, 2008)。然而,随着发酵饲料的投入,相比对照组,实验组中鱼体内乳球菌属的含量明显降低,乳球菌属含量在持续投喂组中最低,具体影响机制待进一步研究。苏黎世杆菌属属于双歧杆菌目,作为产短链脂肪酸的靶向菌群,可产丁酸,而丁酸在调节肠道健康、抑制炎症等方面意义重大(Feng et al, 2018)。车浩等(2022)研究发现,丁酸盐作为肠道菌群代谢产物,可通过G蛋白耦连受体促进肠道上皮屏障的形成,进而降低致病菌及其代谢产物对机体的影响。本研究中,苏黎世杆菌属在持续投喂组中的相对丰度最高,说明持续投喂发酵饲料可在一定程度上提高苏黎世杆菌属的相对丰度,通过其代谢产物丁酸调节肠道健康,增强抵制病原菌的能力。
同时,实验所用发酵料中含有的益生菌为芽孢杆菌和乳酸菌两大类。在肠道菌群组成分析中,芽孢杆菌属与乳酸杆菌属的相对丰度均 < 0.4%,占比很小。组间差异显著性检验结果表明,芽孢杆菌属与乳酸杆菌属在3组中无显著差异(P > 0.05),可以排除斑点叉尾鮰肠道菌群及代谢组学差异是由发酵饲料本身带来的。
3.2 投喂方式对斑点叉尾鮰肠道代谢组学的影响有研究表明,乳酸球菌摄入乳糖或半乳糖主要通过酶系统和磷酸转移酶系统代谢乳糖和半乳糖(Wu et al, 2017)。本研究中,与对照组相比,持续投喂组富集的代谢通路是半乳糖代谢和磷酸转移酶系统代谢,且在物种组成分析中,持续投喂组乳球菌属相对丰度最低,推测持续投喂组可能影响乳球菌属的半乳糖代谢和磷酸转移酶代谢作用,进而影响斑点叉尾鮰的能量代谢,具体作用机理有待研究。色氨酸代谢主要有3条代谢途径,其中,犬尿氨酸途径由限速酶介导,生成烟酸、犬尿酸、喹啉酸等,可参与神经递质、炎症和免疫反应(Kennedy et al, 2017)。研究表明,阿尔茨海默症小鼠血清中的犬尿氨酸浓度明显上升时,可引起神经毒性反应,造成认知损伤(王荣杰等, 2021)。本实验中,与对照组相比,间隔投喂组中色氨酸代谢产物5-羟基-L-色氨酸和L-犬尿氨酸含量显著下调。表明斑点叉尾鮰在间隔投喂发酵料后,下调色氨酸代谢产物L-犬尿氨酸,可降低斑点叉尾鮰神经毒性的发生。
L-丝氨酸可代谢为丙酮酸参与三羧酸循环,也可生成甘氨酸。同时,L-丝氨酸还能为蛋氨酸提供碳原子,促进相关功能代谢产物的合成,进而影响免疫因子的表达(Labuschagne et al, 2014; Maddocks et al, 2016)。甘氨酸参与肌酸、嘌呤、血红素等代谢产物的合成,在机体生命活动中发挥重要作用(Manso Filho et al, 2009)。蛋氨酸可参与多种代谢过程,如核苷酸和多胺的合成(Sanderson et al, 2019)。本研究间隔投喂组中,L-丝氨酸在硫代谢、鞘脂信号代谢、甘氨酸、丝氨酸和苏氨酸代谢及半胱氨酸和蛋氨酸代谢中显著上调,说明间隔投喂发酵料会使斑点叉尾鮰肠道菌群代谢产物L-丝氨酸显著上调,使斑点叉尾鮰获得更多的能量,其免疫表达水平得到提高。精氨酸是合成蛋白质、鸟氨酸、肌酸以及多胺的前体,其中,多胺中的腐胺和精胺影响细胞生长和调节(Puleston et al, 2017)。然而,高含量的腐胺具有遗传毒性,容易导致机体病变,诱导肿瘤的发生(Rist et al, 2013)。本研究间隔投喂组精氨酸生物合成代谢通路中,N2-乙酰-L-鸟氨酸显著下调,影响精氨酸的生物合成,进而降低腐胺等多胺的生成,保证细胞正常生长,预防斑点叉尾鮰机体病变。
同时,L-苯丙氨酸是机体的必需氨基酸,对机体的脂肪代谢和糖代谢有着促进作用(Aubi et al, 2021)。动植物缺乏苯丙氨酸,会导致酪氨酸合成受阻,造成甲状腺素水平下降,影响机体正常代谢活动,严重时影响智力水平(吴迪等, 2022)。与持续投喂组相比,间隔投喂组中托烷、哌啶和吡啶生物碱的生物合成、癌症的中枢碳代谢、植物次生代谢产物的生物合成等6条代谢通路中的L-苯丙氨酸显著上调,说明间隔投喂发酵饲料可提高机体脂肪代谢和糖代谢,预防鱼体神经性疾病,促进斑点叉尾鮰健康生长。本研究中,间隔投喂组斑点叉尾鮰的终末体重显著高于对照组与持续投喂组(P < 0.05),可见在斑点叉尾鮰养殖期间持续投喂发酵料,不但增加养殖成本,还使得饲料中营养成分利用率降低,不利于鱼体增重。
4 结论本研究表明,斑点叉尾鮰采用间隔投喂发酵饲料的投饲方式可提高其肠道菌群的α多样性,提高鲸杆菌属、罗姆布茨菌属、梭菌属和苏黎世杆菌属等有益菌群的相对丰度,降低条件致病菌葡萄球菌属的相对丰度,还可增加鱼体终末体重。综上,间隔投喂组的优势菌群在提高鱼体免疫力、抑制有害菌等方面优于持续投喂组,并且可通过显著上调L-丝氨酸和L-苯丙氨酸含量,影响硫代谢、氨基酸代谢等代谢通路,提高斑点叉尾鮰免疫、抗炎症的能力,再结合饲料成本,养殖斑点叉尾鮰时采用间隔投喂发酵饲料的方式更有利于其生长和繁殖。
AMABLE V I, VAIDÉZ AMARILLA M J, SALAS P L, et al. Fluoroquinolones and tetracyclines as growth factors in aquaculture: Increase of biometrical parameters versus emergence of resistant bacteria and residues in meat. Aquaculture, 2022, 561: 640-655 |
AUBI O, PRESTEGARD K S, JUNG-KC K, et al. The Pah-R261Q mouse reveals oxidative stress associated with amyloid-like hepatic aggregation of mutant phenylalanine hydroxylase. Nature Communications, 2021, 12(1): 2073 DOI:10.1038/s41467-021-22107-1 |
BINDA C, LOPETUSO L R, RIZZATTI G, et al. Actinobacteria: A relevant minority for the maintenance of gut homeostasis. Digestive and Liver Disease, 2018, 50(5): 421-428 DOI:10.1016/j.dld.2018.02.012 |
CHE H, YING X J, LI Z J, et al. Regulation of Toll-like receptors and their downstream factors by butyrate. Acta Physiologica Sinica, 2022, 74(5): 827-836 [车浩, 应晓江, 李振军, 等. 丁酸盐对Toll样受体及其下游因子的调节. 生理学报, 2022, 74(5): 827-836] |
FENG W Q, WU Y C, CHEN G X, et al. Sodium butyrate attenuates diarrhea in weaned piglets and promotes tight junction protein expression in colon in a GPR109A-dependent manner. Cellular Physiology and Biochemistry, 2018, 47(4): 1617-1629 DOI:10.1159/000490981 |
GENG B, CHEN K J, LIU X, et al. Effects of different supplemental levels of corn distillers' dried grains with soluble in diets on growth, body color, flesh color, serum biochemical indexes and intestinal microbiota structure of channel catfish (Ictalurus punctatus). Chinese Journal of Animal Nutrition, 2021, 33(5): 2864-2874 [耿彬, 陈开健, 刘祥, 等. 饲料中添加不同水平玉米干酒糟及其可溶物对斑点叉尾生长、体色、肉色、血清生化指标及肠道菌群结构的影响. 动物营养学报, 2021, 33(5): 2864-2874] |
JENA P K, SHENG L L, NAGAR N, et al. The effect of synbiotics Bifidobacterium infantis and milk oligosaccharides on shaping gut microbiota community structure and NASH treatment. Data in Brief, 2018, 19: 1025-1029 DOI:10.1016/j.dib.2018.05.127 |
JIAO P, HU G, LIANG G, et al. Dietary supplementation with Macleaya cordata extract inclusion affects growth performance, rumen fermentation, bacterial communities, and immune responses of weaned lambs. Animal Feed Science and Technology, 2021, 282: 115127 DOI:10.1016/j.anifeedsci.2021.115127 |
JIN R C, JIANG M, SUN S Y, et al. Microbial community in Litopenaeus vannamei intestine and its aquaculture environment. Journal of Fisheries of China, 2020, 44(12): 2037-2054 [金若晨, 江敏, 孙世玉, 等. 凡纳滨对虾养殖环境及肠道微生物群落特征分析. 水产学报, 2020, 44(12): 2037-2054 DOI:10.11964/jfc.20200312188] |
JIN R C. Study on water quality and microbial community in Litopenaeus vannamei intestine and aquaculture environment. Master′s Thesis of Shanghai Ocean University, 2020, 40-42 [金若晨. 凡纳滨对虾养殖池塘水质及养殖环境和虾肠道微生物群落结构研究. 上海海洋大学硕士研究生学位论文, 2020, 40-42]
|
KENNEDY P J, CRYAN J F, DINAN T G, et al. Kynurenine pathway metabolism and the microbiota-gut-brain axis. Neuropharmacology, 2017, 112: 399-412 DOI:10.1016/j.neuropharm.2016.07.002 |
KOREN O, SPOR A, FELIN J, et al. Human oral, gut, and plaque microbiota in patients with atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(S1): 4592-4598 |
LABUSCHAGNE C F, VAN DEN BROEK N J F, MACKAY G M, et al. Serine, but not glycine, supports one-carbon metabolism and proliferation of cancer cells. Cell Reports, 2014, 7(4): 1248-1258 DOI:10.1016/j.celrep.2014.04.045 |
LARSEN A M, MOHAMMED H H, ARIAS C R. Characterization of the gut microbiota of three commercially valuable warm water fish species. Journal of Applied Microbiology, 2014, 116(6): 1396-1404 DOI:10.1111/jam.12475 |
LEI Y J, LIU K F, LI Z, et al. Effect of yeast culture on growth performance, nutrient digestibility, immunity and intestinal flora of juvenile channel catfish. Feed Research, 2020, 43(7): 52-57 [雷宇杰, 刘开放, 李峥, 等. 饲料添加酵母培养物对斑点叉尾幼鱼生长性能、营养物质消化率、免疫性能和肠道菌群的影响. 饲料研究, 2020, 43(7): 52-57] |
LI D L. Study of the intestinal flore structure of grass carp infection with Aeromonas hydrophila. Master′s Thesis of Northwest A&F University, 2016, 51-52 [李东亮. 感染嗜水气单胞菌草鱼肠道菌群结构研究. 西北农林科技大学硕士研究生学位论文, 2016, 51-52]
|
LU D Y. Studies on molting, metabolomics and gut microbiotas under different foods and temperatures of Chinese mitten crab. Master′s Thesis of Shanghai Ocean University, 2019, 37-39 [卢德胤. 不同饵料组合、温度对中华绒鳌蟹的蜕壳、代谢组学与肠道微生物研究. 上海海洋大学硕士研究生学位论文, 2019, 37-39]
|
MADDOCKS O D K, LABUSCHAGNE C F, ADAMS P D, et al. Serine metabolism supports the methionine cycle and DNA/RNA methylation through de novo ATP synthesis in cancer cells. Molecular Cell, 2016, 61: 210-221 DOI:10.1016/j.molcel.2015.12.014 |
MANSO FILHO H C, COSTA H E, WU G, et al. Equine placenta expresses glutamine synthetase. Veterinary Research Communications, 2009, 33(2): 175-182 DOI:10.1007/s11259-008-9167-2 |
MISCHKE C C. Channel catfish pond fertilization. Aquaculture pond fertilization. Oxford: Wiley-Blackwell, 2012, 135-146 |
PULESTON D J, VILLA M, PEARCE E L. Ancillary activity: Beyond core metabolism in immune cells. Cell Metabolism, 2017, 26(1): 131-141 DOI:10.1016/j.cmet.2017.06.019 |
RIST V T S, WEISS E, EKLUND M, et al. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health: A review. Animal, 2013, 7(7): 1067-1078 DOI:10.1017/S1751731113000062 |
ROESELERS G, MITTGE E K, STEPHENS W Z, et al. Evidence for a core gut microbiota in the zebrafish. The ISME Journal, 2011, 5(10): 1595-1608 DOI:10.1038/ismej.2011.38 |
SANDERSON S M, GAO X, DAI Z, et al. Methionine metabolism in health and cancer: A nexus of diet and precision medicine. Nature Reviews Cancer, 2019, 19: 625-637 DOI:10.1038/s41568-019-0187-8 |
SHIN N R, WHON T W, BAE J W. Proteobacteria: Microbial signature of dysbiosis in gut microbiota. Trends in Biotechnology, 2015, 33(9): 496-503 DOI:10.1016/j.tibtech.2015.06.011 |
SOCOL C R, COSTA E S F D, LETTI L A J, et al. Recent developments and innovations in solid state fermentation. Biotechnology Research and Innovation, 2017, 1(1): 52-71 DOI:10.1016/j.biori.2017.01.002 |
SONG Z W, YANG F, LIU Y, et al. Residue depletion of danofloxacin in Yellow River carp (Cyprinus carpio haematopterus) following multiple oral administration. Aquaculture, 2022, 562: 738-747 |
TANG Y, LIU W L, SONG X L, et al. Effects of dietary with Bacillus cereus on the growth rate and intestinal microflora of Litopenaeus vannamei. Journal of Fisheries of China, 2017, 41(5): 766-774 [唐杨, 刘文亮, 宋晓玲, 等. 饲料中补充蜡样芽孢杆菌对凡纳滨对虾生长及其肠道微生物组成的影响. 水产学报, 2017, 41(5): 766-774] |
TSUCHIYA C, SAKATA T, SUGITA H. Novel ecological niche of Cetobacterium somerae, an anaerobic bacterium in the intestinal tracts of freshwater fish. Letters in Applied Microbiology, 2008, 46(1): 43-48 |
WANG H R, MO W Y, ZHAO H X, et al. Effects of adding Clostridium butyricum in diets on growth performance, serum biochemical indices, immune function and antioxidant ability of yellow catfish (Pelteobagrus fulvidraco). Chinese Journal of Animal Nutrition, 2020, 34(8): 1-9 [王海瑞, 莫文艳, 赵红霞, 等. 饲料添加丁酸梭菌对黄颡鱼生长性能及血清生化指标、免疫功能和抗氧化能力的影响. 动物营养学报, 2020, 34(8): 1-9] |
WANG R J, HAN Y Q, WANG Z R, et al. Research progress in relationship between kynurenic acid and cognitive impairment. Journal of Nanchang University (Medical Sciences), 2021, 61(5): 83-86 [王荣杰, 韩彦青, 王志荣, 等. 犬尿喹啉酸与阿尔茨海默病的研究进展. 南昌大学学报(医学版), 2021, 61(5): 83-86] |
WU D, WANG L, WANG L S. Research progress of phenylalanine in aquatic animals. Chinese Journal of Animal Nutrition, 2022, 34(7): 4189-4199 [吴迪, 王良, 王连生. 水产动物苯丙氨酸研究进展. 动物营养学报, 2022, 34(7): 4189-4199 DOI:10.3969/j.issn.1006-267x.2022.07.012] |
WU J F, XIONG J B, WANG X, et al. Intestinal bacterial community is indicative for the healthy status of Litopenaeus vannamei. Chinese Journal of Applied Ecology, 2016, 27(2): 611-621 [吴金凤, 熊金波, 王欣, 等. 肠道菌群对凡纳滨对虾健康的指示作用. 应用生态学报, 2016, 27(2): 611-621] |
WU Q, SHAH N P. The potential of species-specific tagatose-6-phosphate (T6P) pathway in Lactobacillus casei group for galactose reduction in fermented dairy foods. Food Microbiology, 2017, 62: 178-187 DOI:10.1016/j.fm.2016.10.027 |
XIONG X Y, ZHAO Y F, WANG Z C, et al. Analysis of microbial community structure of channel catfish Ictalurus punctatus intestine and culture water. Fisheries Science, 2022, 41(4): 589-596 [熊向英, 赵艳飞, 王志成, 等. 斑点叉尾肠道及其养殖环境菌群结构分析. 水产科学, 2022, 41(4): 589-596] |
XU J Y, LI Y, XIE Z L, et al. Comparison of intestinal microbiota of three freshwater fishes in two regions of north and south China. Acta Laser Biology Sinica, 2020, 29(1): 68-74 [徐佳莹, 李演, 谢芝玲, 等. 三种淡水鱼类在中国南北两个地区的肠道菌群差异比较. 激光生物学报, 2020, 29(1): 68-74] |
XU Y F. Research progress on application of Bacillus licheniformis in aquaculture. Journal of Fisheries Research, 2018, 40(1): 83-88 [徐亚飞. 地衣芽孢杆菌在水产养殖中的应用研究进展. 渔业研究, 2018, 40(1): 83-88] |
YU M N, CHEN Y K, ZHANG Y R, et al. Application of microbial fermented feed in aquaculture. China Feed, 2021(2): 70-73 [于梦楠, 陈玉珂, 张宇柔, 等. 微生物发酵饲料在水产养殖中的应用. 中国饲料, 2021(2): 70-73] |
ZHANG S H, WU J P, CHU Z P, et al. Effects of feeding Bacillus subtilis on growth and intestinal microflora of hybrid sturgeon. Marine Fisheries, 2021, 43(1): 71-80 [张书环, 吴金平, 褚志鹏, 等. 饲喂枯草芽孢杆菌对杂交鲟生长和肠道菌群结构的影响. 海洋渔业, 2021, 43(1): 71-80] |
ZHANG Y, LU R, QIN C, et al. Precision nutritional regulation and aquaculture. Aquaculture Reports, 2020, 18: 100496 |
ZHONG L Q, SONG C, CHEN X H, et al. Channel catfish in China: Historical aspects, current status, and problems. Aquaculture, 2016, 465: 367-373 |
ZHU W G, LI X H, RAO L Y, et al. Effects of reovirus infection on the intestinal microbiota diversity of grass carp (Ctenopharyngodon idella). Acta Hydrobiologica Sinica, 2019, 43(1): 109-116 [朱文根, 李星浩, 饶刘瑜, 等. 感染草鱼呼肠孤病毒对肠道菌群多样性的影响. 水生生物学报, 2019, 43(1): 109-116] |




