2. 中国水产科学研究院黄海水产研究所 青岛海洋科技中心海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academic of Fishery Sciences, Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao Marine Science and Technology Center, Qingdao 266071, China
凡纳对虾(Penaeus vannamei)是我国重要的养殖对虾品种之一(刘峻宇等, 2021)。据统计,2021年我国海水养殖凡纳对虾产量为127.36万t,占海水养殖虾类总产量的81%。同时,2021年凡纳对虾苗种投放量为1.28万亿尾,约占虾类育苗量75.4% (农业农村部渔业渔政管理局等, 2022)。优质苗种的繁育是对虾产业可持续发展的基石和重要保障。随着对虾养殖产业高密度、集约化养殖模式的发展,虾苗繁育过程中的苗种质量下降、病害问题日益突出。由于育苗系统相对封闭,虾体密度高,免疫力差,以及饵料、残骸和排泄物积累,导致细菌大量滋生,极易造成育苗期幼体细菌性疾病暴发(黄雪敏, 2020)。
近年来,对虾“玻璃苗”在我国暴发并迅速传播,发病时间一般在标苗后2~3 d,出现症状24 h内大量死亡,具有发病快、死亡率极高的特点,导致虾苗供应不足,给对虾养殖产业造成巨大的经济损失。患病虾苗通常表现为活力弱、厌食、体色暗浊、空肠空胃、肝胰腺组织萎缩、轮廓模糊、颜色变浅呈淡黄色、甚至呈无组织结构的“玻璃化”状态,因此,将其命名为虾苗细菌性玻化症(bacterial vitrified syndrome, BVS) (王印庚等, 2021)。
溶藻弧菌(Vibrio alginolyticus)、新喀里多尼亚弧菌(V. neocaledonicus)或副溶血弧菌(V. parahaemolyticus)感染可导致虾苗BVS (王印庚等, 2021; Zou et al, 2020)。也有研究人员指出,高致病性的副溶血弧菌和其细菌毒素均可引起类似病症的发生(Yang et al, 2021)。目前,该病主要通过消毒剂、抗生素、微生态制剂等联合用药进行防控。但抗生素的频繁和不当使用容易导致细菌的耐药性和药物残留等问题(程波等, 2017; 李翠苹等, 2020)。研究显示,不同养殖模式下虾苗肠道细菌耐药性较成虾高(杨泽禹等, 2022),给本病的防控带来更大的挑战。与抗生素相比,中草药因具有抗菌、调节机体免疫力、毒副作用小、不易产生耐药性和药物残留等优点,近年来逐渐受到人们的关注,遗憾的是,目前还未有针对BVS的有效中药制剂。因此,研制防治虾苗BVS的中药复方对于推动对虾绿色健康养殖具有重要意义。
本研究围绕从患病虾苗中分离出的致病性溶藻弧菌和副溶血弧菌,开展体外抑菌实验,并建立主要致病菌溶藻弧菌感染的虾苗BVS模型,从死亡率、组织病理学和超微组织病理学角度评价不同中药复方对于患病虾苗的保护和治疗效果,从而筛选出效果最佳的中药复方,以期为进一步开发防治BVS的中药制剂、保障对虾健康养殖提供参考。
1 材料与方法 1.1 实验材料 1.1.1 实验菌株实验选取的溶藻弧菌(实验室编号为P4A)、副溶血弧菌(实验室编号为P2D)均分离自养殖场典型患BVS的凡纳对虾虾苗,保存于中国水产科学研究院黄海水产研究所海水养殖病原库。
1.1.2 实验药物受试药物:诃子(Chebulae fructus)、五倍子(Galla chinensis)、丁香(Caryophylli flos)、五味子(Schisandrae chinensis fructus)、牡丹皮(Moutan cortex)、地榆(Sanguisorbae radix)、金樱子(Rosae laevigatae fructus)、乌梅(Mume fructus)、石榴皮(Granati pericarpium)、赤芍(Paeoniae radix rubra)、女贞子(Ligustri lucidi fructus)、黄连(Coptidis rhizoma)、花椒(Zanthoxyli pericarpium)、黄精(Polygonati rhizoma)、吴茱萸(Euodiae fructus)、大黄(Rhei radix et rhizoma)、青蒿(Artemisiae annuae herba)、连翘(Forsythiae fructus)、山楂(Crataegi fructus)、山茱萸(Corni fructus)、秦皮(Fraxini cortex)、木香(Aucklandiae radix)、枳实(Aurantii fructus immaturus)、栀子(Gardeniae fructus)、鸡血藤(Spatholobi caulis)、败酱草(Patriniae herba)、紫苏叶(Perillae folium)、乌药(Linderae radix)、虎杖(Polygoni cuspidati rhizoma et radix)、黄芩(Scutellariae radix)、甘草(Glycyrrhizae radix et rhizoma)、杜仲(Eucommiae cortex)、蒲公英(Taraxaci herba)、辛夷(Magnoliae flos)、白芷(Angelicae dahuricae radix)、灵芝(Ganoderma)、茵陈(Artemisiae scopariae herba)、穿心莲(Andrographis herba)、柴胡(Bupleuri radix)、马鞭草(Verbenae herba)、黄柏(Phellodendri chinensis cortex)、苍术(Atractylodis rhizoma)、金银花(Lonicerae japonicae flos)、大青叶(Isatidis folium)、鱼腥草(Houttuyniae herba)、马齿苋(Portulacae herba)、茯苓(Poria)、苦参(Sophorae flavescentis radix)、香附(Cyperi rhizoma)、厚朴(Magnoliae officinalis cortex) 50种符合国家标准的中药饮片均购自青岛同仁堂药店。
对照药物:20%氟苯尼考粉,100 g/袋,批号为190372539,购自南海东方澳龙制药有限公司。本实验室前期研究发现,BVS主要致病菌溶藻弧菌对氟苯尼考等抗生素敏感(Yu et al, 2023),同时,氟苯尼考粉是《水产养殖用药明白纸2022年2号》批准的水产养殖用兽药,故选取20%氟苯尼考粉作为对照药物。
1.1.3 实验动物与饲养管理健康的PL6凡纳对虾虾苗购自河北某凡纳对虾苗种场,于实验室实验缸中暂养3 d后用于实验。实验期间水温为(28±2) ℃,持续充氧。每日早晚投喂2次,饲料投喂量为对虾体重的3%,吸底、换水1次,换水量为总体积的1/3。
1.2 实验方法 1.2.1 实验菌液的培养实验前,使用TSB琼脂平板对溶藻弧菌和副溶血弧菌进行活化并纯化培养后,分别挑取其单菌落,接种于TSB液体培养基中,28 ℃,180 r/min恒温振荡,过夜培养至对数生长期。
1.2.2 中药药液及药饵的制备单味中药药液制备方法:称取药材,加12倍水浸泡1 h后煎煮1 h,过滤,药渣再分别加10倍和8倍水煎煮1 h,过滤,滤液合并、减压浓缩,制成生药含量为500 mg/mL的药液,121 ℃高压灭菌后于4 ℃冷藏保存。
复方中药(处方1~3)制备方法:药材粉碎过四号筛,按照比例称取药材粉末并混合,加10倍70%乙醇浸泡30 min,超声提取30 min,过滤,药渣再加8倍70%乙醇超声提取30 min,过滤,减压回收乙醇,浓缩;药渣再加5倍水加热提取1 h,过滤,减压浓缩,与上述醇提浓缩液合并,减压浓缩至生药含量为250 mg/mL的药液,过滤,121 ℃高压灭菌,4 ℃保存备用。
含药饵料的制备:将处方1~3以30 g/kg的剂量,20%氟苯尼考粉以0.7 g/kg的剂量溶于一定量水中,喷于饲料表面,搅拌均匀后阴干,密封保存备用。
1.2.3 单味中药对BVS致病菌的抑菌圈测定采用牛津杯法测定50种中药对溶藻弧菌和副溶血弧菌的抑菌效果。使用TSB液体培养基将对数生长期的溶藻弧菌稀释至1×107 CFU/mL。取100 μL菌液均匀涂布于TSB琼脂平板上,将HB四连式牛津杯放置于平板上,使用压杯板摁压牛津杯,使其与培养基紧密接触。其中,3个孔内分别加入150 μL的500 mg/mL的药液,1个孔内加入150 μL ddH2O作为阴性对照。28 ℃恒温培养箱中正置培养24 h后测量抑菌圈直径。
1.2.4 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定参考姜燕(2016)的方法,采用二倍稀释法测定中药对溶藻弧菌和副溶血弧菌的MIC和MBC值。使用TSB液体培养基将对数生长期的溶藻弧菌稀释至1×106 CFU/mL。使用TSB液体培养基将500 mg/mL的中药药液稀释至200 mg/mL。取100 μL药液加入96孔板,并使用等量的TSB液体培养基对其进行二倍稀释,而后加入等量的1×106 CFU/mL的菌液。即实验组为100 μL菌液+100 μL含药培养基。阳性对照组为100 μL菌液+100 μL培养基,空白对照组为200 μL培养基。各组每孔再分别加入10 μL红四氮唑(TTC),以检验细菌是否生长。每组设置3个平行。将96孔板置于28 ℃恒温培养箱中培养,当阳性对照变红时,取出96孔板拍照记录。实验组变色孔的上一列所对应的浓度即为MIC。从未变红的实验组各孔取样100 μL,分别涂布于TSB琼脂平板,28 ℃恒温培养24 h,观察结果。琼脂平板上细菌菌落数小于5且药液浓度最低的,即为MBC。
1.2.5 溶藻弧菌攻毒剂量的测定通过不同浓度的溶藻弧菌对健康的PL9虾苗的感染实验,确定溶藻弧菌的感染剂量。使用无菌1.5% NaCl溶液将对数生长期的溶藻弧菌离心重悬制备成菌悬液。将健康的PL9虾苗随机分为6组,其中5组为攻毒组,1组为空白对照组,每组3个平行(标记为编号1、2和3),每个平行40尾虾苗。将菌悬液加入感染组水体中,使水体中溶藻弧菌的终浓度分别为1×103、1×104、1×105、1×106和1×107 CFU/mL,空白对照组加入相同体积的1.5% NaCl溶液。浸浴攻毒48 h后对养殖水体进行日常换水1/3。为减少虾苗应激,同时考虑到随机抽取能够代表总体发病率。因此,实验开始后,每隔12 h观察记录各组中编号为1、2的实验缸中的虾苗死亡情况。对死亡患病虾苗进行病原菌分离鉴定,并根据改良寇氏法计算菌株的半致死浓度(LD50)。同时,在各组编号为3的实验缸中,根据实验环节要求,随机取10尾虾苗在带水情况下快速镜检虾苗肝胰腺和肠道病理症状或健康状况,且观察后立刻放回。
1.2.6 防治实验溶藻弧菌菌悬液配制方法见1.2.5。将健康的PL9凡纳对虾虾苗随机分为6组,分别为处方1~3实验组、氟苯尼考对照组、空白对照组和阳性对照组,每组设3个平行(标记为编号1、2和3),每个平行40尾虾苗。除空白对照组加入1.5% NaCl溶液,其余各组均选用5×104 CFU/mL的溶藻弧菌进行浸浴攻毒,攻毒48 h后对养殖水体进行日常换水1/3。攻毒的同时,处方1~3实验组投喂含有处方1~3复方中药的饲料,药物对照组投喂含20%氟苯尼考粉的饲料,空白对照组和阳性对照组投喂正常的空白饲料。实验开始后,每隔12 h观察记录各组中编号为1、2的实验缸中虾苗死亡情况。同时,在各组编号为3的实验缸中,根据实验环节要求,随机取10尾虾苗在带水情况下快速镜检虾苗肝胰腺和肠道病理症状或健康状况,且观察后立刻放回。
1.2.7 组织病理学观察防治实验周期为7 d,在给药结束时(即第7天),各组分别随机取样10尾虾苗,固定于Davidson´s固定液,24 h后换入70%乙醇中长期保存。常规苏木精–伊红染色法(HE)染色,进行组织病理学检测。同时,各组分别随机取样5尾对虾虾苗,使用2.5%戊二醛固定,进行超微病理观察。
1.3 数据处理实验结果以平均值±标准差(
单味中药对溶藻弧菌和副溶血弧菌的抑菌结果显示(表 1和表 2),五味子、乌梅、石榴皮、马鞭草和木香等中药对溶藻弧菌的抑菌效果较好,抑菌圈可达12 mm以上;诃子、五味子、牡丹皮和地榆等中药对副溶血弧菌的抑菌效果较好,抑菌圈可达13 mm以上。在50种中药中,诃子、五倍子、丁香、石榴皮、地榆、乌梅和五味子7味中药对溶藻弧菌和副溶血弧菌均有较好的抑菌效果。
|
|
表 1 中药对溶藻弧菌的抑菌圈直径(mm) Tab.1 The diameters of bacteriostatic circles of Chinese herbal medicines on V. alginolyticus (mm) |
|
|
表 2 中药对副溶血弧菌的抑菌圈直径(mm) Tab.2 The diameters of bacteriostatic circles of Chinese herbal medicines on V. parahaemolyticus (mm) |
选取对溶藻弧菌和副溶血弧菌抑菌圈直径较大的中药以及具有保肝健脾效果的香附、栀子2味中药,测定MIC和MBC。实验结果显示(表 3),诃子、五倍子、丁香、五味子、地榆、石榴皮和乌梅对溶藻弧菌和副溶血弧菌的抑菌效果相对较好。其中,五倍子、诃子、丁香和五味子对溶藻弧菌和副溶血弧菌的抑菌效果良好,MIC均≤12.5 mg/mL,MBC均≤50 mg/mL。同一中药对这2种弧菌的MIC与MBC存在差异,部分中药差异较大。一些中药对弧菌的MIC与MBC值一致,这可能是由于二者较为接近,采用二倍稀释法未能准确测定的缘故。中药的MIC和MBC值基本与抑菌圈直径测定结果相近,整体上符合抑菌圈越大,其MIC值越小的规律。
|
|
表 3 中药对溶藻弧菌和副溶血弧菌的最小抑菌浓度(MIC)和最小杀菌浓度(MBC) (mg/mL) Tab.3 MIC and MBC of Chinese herbal medicines against V. alginolyticus and V. parahaemolyticus (mg/mL) |
为筛选防治虾苗BVS的有效中药复方,以抑菌圈直径、MIC和MBC的测定结果为基础,结合疏肝解郁、健脾行气的配伍原则,增加香附和栀子2味中药,组合形成3种复方中药(表 4)。
|
|
表 4 体内药效实验的中药复方 Tab.4 Chinese herbal compounds for in vivo efficacy test |
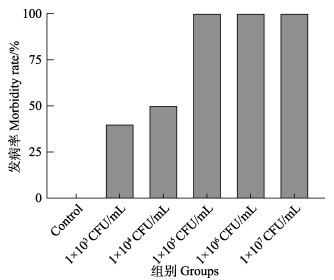
实验共进行72 h,实验期间空白对照组虾苗未出现BVS症状。患病虾苗临床症状表现为活力下降、厌食、体色暗浊、空肠空胃。镜检发现,患病虾苗出现肝胰腺萎缩、轮廓模糊、颜色变浅呈淡黄色等症状,与自然感染症状一致。空白对照组和1×103、1×104、1×105、1×106和1×107 CFU/mL实验组虾苗在感染12 h时,发病率见图 1;48 h时,感染组虾苗全部出现病症。
|
图 1 不同组攻毒12 h后凡纳对虾虾苗发病率 Fig.1 Morbidity rates of P. vannamei larvae after 12 h challenge in different treatments |
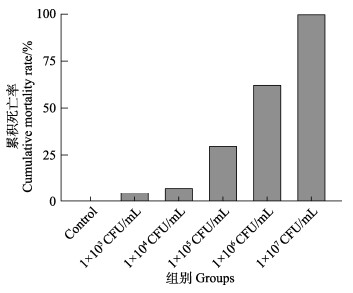
实验期间,空白对照组虾苗未出现死亡,各组虾苗72 h时累积死亡率见图 2,其中,1×107 CFU/mL实验组虾苗在12 h时全部死亡。再次从人工感染虾苗分离出的优势菌株经分离鉴定为溶藻弧菌,符合科赫法则。采用改良寇氏法计算获得,溶藻弧菌浸浴感染72 h时对虾苗的LD50为2.82×105 CFU/mL。
|
图 2 不同组攻毒72 h时凡纳对虾虾苗累积死亡率 Fig.2 Cumulative mortality rates of P. vannamei larvae after 72 h challenge in different treatments |
根据《水产养殖用抗菌药物药效实验技术指导原则》(农业农村部兽药评审中心, 2022),人工感染的感染量应为受试动物的最小致死量或能使80%以上感染动物出现明显发病症状的剂量。同时,结合攻毒剂量筛选实验中的虾苗发病率和死亡率结果,本实验采用比半致死浓度较低的5×104 CFU/mL溶藻弧菌浸浴攻毒48 h,以确保所有虾苗均可发病,且死亡数量适当。
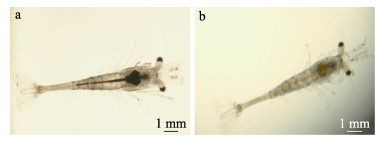
实验结果表明,人工攻毒造模成功。阳性对照组在感染12 h后全部虾苗出现活力弱,肝胰腺萎缩、轮廓模糊、颜色变浅呈淡黄色等BVS典型症状。阳性对照组24 h内出现急性死亡,最终死亡率达33.75%。空白对照组虾苗体色、活力、摄食以及肝胰腺状态等均正常(图 3)。
|
图 3 健康虾苗(a)和人工感染患病虾苗(b)的表观症状 Fig.3 Apparent symptoms of healthy (a) and artificially infected (b) shrimp larvae |
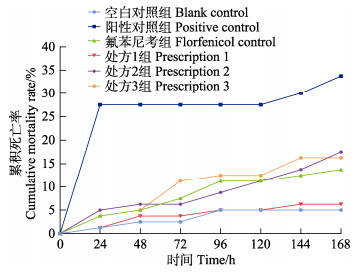
给药7 d时,各组累积死亡率由低至高依次为空白对照组、处方1组、氟苯尼考对照组、处方3组、处方2组、阳性对照组。处方1组虾苗死亡率显著低于阳性对照组虾苗死亡率(P < 0.05),低于氟苯尼考对照组虾苗死亡率(P>0.05);处方2、处方3组、氟苯尼考对照组死亡率低于阳性对照组虾苗死亡率,但差异不显著(P > 0.05) (图 4)。
|
图 4 不同组攻毒后凡纳对虾虾苗累积死亡率 Fig.4 Cumulative mortality rate of L. vannamei larvae after challenge in different treatments |
结果显示,给药7 d时,空白对照组虾苗肝胰腺组织中,肝胰腺肝小管上皮细胞排列整齐有序而致密,细胞核呈蓝紫色、细胞质呈红色(图 5A);肠道上皮细胞排列紧密,与基膜连接有序(图 6A)。阳性对照组患病虾苗肝胰腺组织发生严重病变,肝小管上皮细胞严重坏死、脱落、甚至消失;最后,大部分肝胰腺组织结构消失,成为浆质化状态(图 5B);肠壁肠绒毛脱落、缺失严重,肠道内有大量组织碎片(图 6B)。处方1组的虾苗肝胰腺组织和肠道上皮结构更为完整,肝小管数量多,上皮细胞脱落、坏死程度较轻(图 5C),肠道上皮细胞较为丰富且排列整齐(图 6C)。处方2、处方3组和氟苯尼考对照组患病虾苗肝胰腺组织发生病变,肝小管大部分上皮细胞坏死、脱落,部分肝胰腺组织结构消失(图 5D、E、F);肠壁肠绒毛脱落、缺失,肠道内有大量组织碎片(图 6D、E、F)。说明处方1~3和20%氟苯尼考粉对患病虾苗的肝胰腺和肠道组织结构具有不同程度的保护作用,处方1优于20%氟苯尼考粉、处方2和处方3。
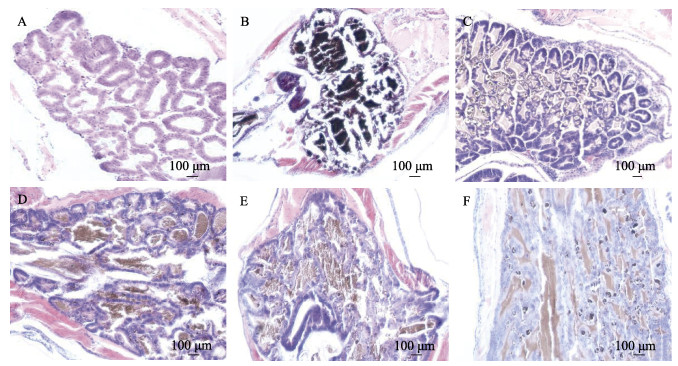
|
图 5 凡纳对虾虾苗肝胰腺组织切片 Fig.5 Section of hepatopancreases of P. vannamei larvae A:空白对照组;B:阳性对照组;C:处方1组;D:处方2组;E:处方3组;F:氟苯尼考对照组。 A: Blank control; B: Positive control; C: Prescription 1; D: Prescription 2; E: Prescription 3; F: Florfenicol control. |
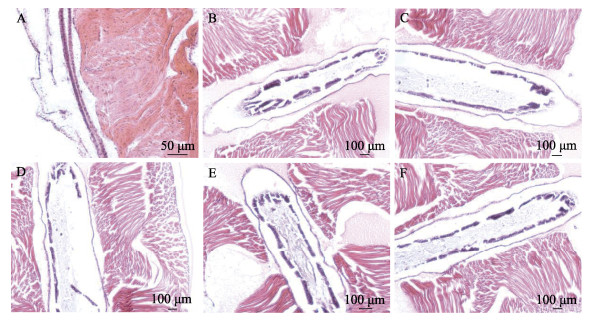
|
图 6 凡纳对虾虾苗肠道切片 Fig.6 Sections of intestines of P. vannamei larvae A:空白对照组;B:阳性对照组;C:处方1组;D:处方2组;E:处方3组;F:氟苯尼考对照组。 A: Blank control; B: Positive control; C: Prescription 1; D: Prescription 2; E: Prescription 3; F: Florfenicol control. |
基于不同组凡纳对虾虾苗死亡率和组织病理学结果,选取空白对照组、阳性对照组、处方1实验组、氟苯尼考对照组虾苗的肝胰腺组织进行超微组织病理学观察。结果显示,给药7 d时,空白对照组虾苗肝小管上皮细胞排列整齐、结构完整,细胞核、细胞膜和细胞器均正常(图 7A、B)。阳性对照组虾苗肝小管上皮细胞的细胞膜消融,细胞与细胞间界限模糊,细胞核固化,线粒体、内质网等细胞器解体,细胞质中形成电子密度较高的黑色颗粒,细胞质消融,形成空泡状,甚至大面积细胞解体呈现空白区(图 7C、D)。与阳性对照组相比,处方1组虾苗肝小管上皮细胞的细胞膜、细胞核正常,线粒体、内质网丰富且基本正常(图 7E、F)。氟苯尼考对照组虾苗肝小管部分上皮细胞的细胞膜消融、细胞与细胞间界限模糊,细胞核固化,细胞器解体,甚至出现连片的细胞消失(图 7G、H)。
综上,以超微组织病理学的角度证实,处方1对患病虾苗肝胰腺组织的保护作用优于20%氟苯尼考粉。
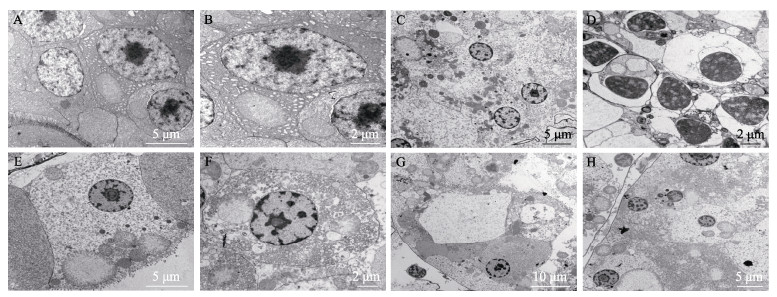
|
图 7 凡纳对虾虾苗肝胰腺超微组织病理 Fig.7 Ultrastructural pathology of hepatopancreases of P.vannamei larvae A、B:空白对照组;C、D:阳性对照组;E、F:处方1组;G、H:氟苯尼考对照组。 A, B: Blank control; C, D: Positive control; E, F: Prescription 1; G, H: Florfenicol control. |
溶藻弧菌为嗜盐性革兰氏阴性菌,是多种水产动物的条件性致病菌(陈强等, 2006)。本研究使用的溶藻弧菌为本课题组前期从患有BVS虾苗中分离获得。本研究利用溶藻弧菌浸浴感染凡纳对虾虾苗,感染组虾苗出现活力弱,肝胰腺萎缩、轮廓模糊、颜色变浅呈淡黄色等典型临床症状,与王印庚等(2021)的研究结果一致,溶藻弧菌感染凡纳对虾虾苗的临床症状和病理变化与BVS相符。证明同一实验室内模型复制的稳定性良好,但106~107 CFU/mL溶藻弧菌浸浴攻毒造成62.5%~100%的虾苗死亡,死亡率远高于邹卫丽等(2012)的浸浴攻毒剂量,可能与不同来源的菌株致病性、虾苗品种和日龄等因素有关。
3.2 中草药对水产养殖重要致病弧菌的抑制作用近年来,许多研究人员发现中药在水产动物疾病防治方面具有良好的抑杀作用。展文豪(2021)从30种中草药中筛选对溶藻弧菌、副溶血弧菌、霍乱弧菌(V. cholerae)、哈维氏弧菌(V. harveyi)和鳗弧菌(V. anguillarum)具有抗菌效果的中草药,发现诃子、乌梅、山楂、黄芩和苏木5味中草药对上述5种弧菌均具有良好的抑制作用。侯竹美(2015)选取11种中草药对鱼肠道弧菌(V. ichthyoenteri)、副溶血弧菌和溶藻弧菌抑菌作用进行研究,其中,五倍子的抑菌效果最强、其次是诃子和石榴皮。陈辉等(2012)从100种中药中筛选对溶藻弧菌抑菌效果好的中药,结果显示,五倍子、公丁香和石榴皮能够有效地抑杀溶藻弧菌。徐晓津等(2019)研究发现,诃子、乌梅和醋五味子对溶藻弧菌抑菌作用显著,为极敏感。本研究选取50味中药对BVS的致病菌(溶藻弧菌和副溶血弧菌)进行体外抑菌实验,结果显示,诃子、五倍子、五味子、石榴皮、丁香、地榆和乌梅对溶藻弧菌和副溶血弧菌的抑菌圈直径均 > 10 mm。诃子、五倍子、丁香和五味子对溶藻弧菌和副溶血弧菌的MIC均≤12.5 mg/mL、MBC均≤50 mg/mL。综合以上结果,诃子、五倍子、丁香和五味子对溶藻弧菌和副溶血弧菌的抗菌作用良好,本研究结果与上述文章报道的结果相似。
3.3 中药复方对凡纳对虾虾苗BVS的防治效果使用不同的中药复方对虾苗BVS进行治疗实验,结果发现,给药后7 d时,处方1组虾苗死亡率低于处方2、处方3组、氟苯尼考对照组和阳性对照组。通过不同给药实验组虾苗死亡率与阳性对照组比较分析可知,处方1组虾苗死亡率显著低于阳性对照组(P < 0.05);处方2、处方3组和氟苯尼考对照组虾苗死亡率低于阳性对照组,但差异不显著(P > 0.05)。因此,从死亡率来看,处方1能显著降低虾苗死亡率。应用组织病理HE染色技术研究处方1~3和20%氟苯尼考粉对虾苗肝胰腺和肠道组织的保护作用,发现处方1组的患病虾苗肝胰腺和肠道组织结构更为完整,肝小管数量多,上皮细胞脱落、坏死程度较轻,肠道上皮细胞较为丰富且排列整齐。而处方2、处方3组和氟苯尼考对照组的患病虾苗肝胰腺和肠道组织结构受损相对严重。超微组织病理学发现,处方1组的患病虾苗肝小管上皮细胞的细胞膜、细胞核正常,线粒体、内质网丰富且基本正常。而氟苯尼考对照组的患病虾苗肝小管部分上皮细胞的细胞膜消融、细胞器解体、细胞核固化,甚至连片的细胞消失。因此,从组织学角度看,处方1对患病虾苗肝胰腺和肠道组织的保护效果优于其他给药组。这可能与处方1中诃子和五味子具有较好的抗菌作用有关(杨雨航等, 2022; 张文青等, 2012)。此外,现代药理学研究结果显示,诃子、五味子和香附3味中药具有相对较好的保肝和抗氧化等作用。诃子具有良好的抗氧化能力,其抗氧化机制为清除自由基、影响脂质过氧化过程等(吴士云, 2010)。其中,酚类化合物的存在可能是诃子抗氧化能力强的原因(Soumya et al, 2018)。Ramgopal等(2014)在诃子醇提物对于高血脂大鼠(Rattus norvegicus)模型作用的研究中发现,诃子醇提物能够提高大鼠的肝组织中超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活力。王金华等(2012)研究表明,诃子醇提物能显著抑制肝微粒体脂质过氧化。有研究指出,五味子乙素(Sch B)对于长期乙醇诱导的大鼠肝损伤有良好的保护作用,增加了线粒体的抗氧化能力(Lam et al, 2010)。五味子木脂素提取物能有效减轻小鼠(Mus musculus)的应激性肝损伤,并通过防止过量的自由基产生和堆积来显著降低肝细胞的氧化损伤,增强肝脏的抗氧化能力。同时也可降低血浆中的丙氨酸转氨酶(ALT),减轻肝脏炎症和坏死(Pu et al, 2012)。香附具有疏肝理气、保护肝脏的作用(颜正华等, 2006)。因此,从药理作用上来讲,诃子、五味子和香附对肝脏均具有一定的保护作用,并能一定程度上修复肝脏的损伤,但这几味中药对于溶藻弧菌引起的虾苗肝胰腺损伤的保护机制还有待进一步研究。
综上所述,处方1能够显著降低溶藻弧菌所导致的患BVS虾苗的死亡率,对患病虾苗肝胰腺和肠道有良好的保护效果,且对患病虾苗的防治效果优于处方2、处方3和常规治疗药物20%氟苯尼考粉。因此,初步推荐防治虾苗BVS的中药处方为诃子30 g、五味子20 g、香附20 g。本研究为进一步开发防治BVS的中药制剂提供了参考,为申报新兽药提供了实验数据和参考资料,同时,为专用渔药的商业化开发提供了储备。
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2022. Beijing: China Agriculture Press, 2022 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2022中国渔业统计年鉴. 北京: 中国农业出版社, 2022]
|
CHENG B, AI X H, CHANG Z Q, et al. Direction of innovation and development for the study on drug metabolism residues of aquatic animals——The prediction technique based on PBPK model. Chinese Fishery Quality and Standards, 2017, 7(6): 42-47 [水产动物药物代谢残留研究及创新发展方向——基于PBPK模型的残留预测技术. 中国渔业质量与标准, 2017, 7(6): 42-47 DOI:10.3969/j.issn.2095-1833.2017.06.007] |
CHEN Q, YAN Q P, MA S. Progress on pathogenicity research of Vibrio alginolyticus. Marine Sciences, 2006, 30(8): 83-89 [溶藻弧菌致病性研究进展. 海洋科学, 2006, 30(8): 83-89 DOI:10.3969/j.issn.1000-3096.2006.08.018] |
CHEN H, ZHANG Q Z. Antibacterial effect of 100 Chinese herbal medicines against Vibrio alginolyticus in vitro. Chinese Journal of Preventive Veterinary Medicine, 2012, 34(6): 452-455 [100种中草药对溶藻弧菌的体外抑菌实验. 中国预防兽医学报, 2012, 34(6): 452-455 DOI:10.3969/j.issn.1008-0589.2012.06.08] |
Evaluation Center for Veterinary Drugs, Ministry of Agriculture and Rural Affairs. Compilation of technical guidelines for research on veterinary chemical drugs and traditional Chinese medicine (2022). Beijing: China Agricultural Science and Technology Press, 2022 [农业农村部兽药评审中心. 兽用化药中药研究技术指导原则汇编(2022). 北京: 中国农业科学技术出版社, 2022]
|
HOU Z M. Preliminary study on the therapeutic effect of Chinese herbal medicine on vibriosis. Scientific Fish Farming, 2015(10): 58 [中草药对弧菌病治疗效果的初步研究. 科学养鱼, 2015(10): 58] |
HUANG X M. Bacterial Resource mining from larviculture system of Litopenaeus vannamei and primary genome analysis of Vibrio alginolyticus strains. Master´s Thesis of Guangdong Ocean University, 2020 [黄雪敏. 凡纳滨对虾育苗系统细菌资源挖掘及溶藻弧菌基因组初步分析. 广东海洋大学硕士研究生学位论文, 2020]
|
JIANG Y. In vitro bacteriostatis Chinese herb compound selection for acute hepatopancreas necrosis syndrome in Litopenaeus vannamei. Master´s Thesis of Dalian Ocean University, 2016 [姜燕. 凡纳滨对虾急性肝胰腺坏死病防治中草药的筛选. 大连海洋大学硕士研究生学位论文, 2016]
|
LAM P Y, CHIU P Y, LEUNG H Y, et al. Schisandrin B co-treatment ameliorates the impairment on mitochondrial antioxidant status in various tissues of long-term ethanol treated rats. Fitoterapia, 2010, 81(8): 1239-1245 DOI:10.1016/j.fitote.2010.08.010 |
LI C P, ZHAI Q Q, WANG X, et al. Isolation and identification of Vibrio parahaemolyticus from shrimp culture ponds and analysis of its drug resistance and virulence genes. Progress in Fishery Sciences, 2020, 41(6): 174-180 [对虾养殖池副溶血弧菌的分离鉴定及其耐药特征、毒力基因分析. 渔业科学进展, 2020, 41(6): 174-180 DOI:10.19663/j.issn2095-9869.20190820003] |
LIU J Y, LIU J H, KONG J, et al. Development of SNP markers and verification analysis of relationship on family in Litopenaeus vannamei. Progress in Fishery Sciences, 2021, 42(1): 108-116 [凡纳滨对虾SNP标记开发与家系亲缘关系验证分析. 渔业科学进展, 2021, 42(1): 108-116 DOI:10.19663/j.issn2095-9869.20191022001] |
PU H J, CAO Y F, HE R R, et al. Correlation between antistress and hepatoprotective effects of Schisandra lignans was related with its antioxidative actions in liver cells. Evidence-Based Complementray and Alternative Medicine, 2012, 2012: 1-7 |
RAMGOPAL M, KRUTHIKA B S, SUREKHA D, et al. Terminalia paniculata bark extract attenuates non-alcoholic fatty liver via down regulation of fatty acid synthase in high fat diet-fed obese rats. Lipids in Health and Disease, 2014, 13(1): 58-64 DOI:10.1186/1476-511X-13-58 |
SOUMYA K, JESNA J, SUDHEESH S. Screening study of three medicinal plants for their antioxidant and cytotoxic activity. International Journal of Pharmaceutical Sciences Review and Research, 2018, 9(9): 3781-3787 |
WANG Y G, YU Y X, LIU X, et al. Pathogens and histopathological characteristics of shrimp postlarvae bacterial vitrified syndrome (BVS) in the Litopenaeus vannamei. Journal of Fisheries of China, 2021, 45(9): 1563-1573 [凡纳滨对虾虾苗细菌性玻化症(BVS)的病原、病理分析. 水产学报, 2021, 45(9): 1563-1573] |
WANG J H, SUN F Y, YUAN D Y, et al. Anti-oxidative effect of Terminalia chebula Retz. Pharmacology and Clinics of Chinese Materia Medica, 2012, 28(5): 124-126 [诃子乙醇提取物的抗氧化作用研究. 中药药理与临床, 2012, 28(5): 124-126] |
WU S Y. Study on antioxidant activity of Terminalia chebula Retz. Master´s Thesis of Jiangsu University, 2010 [吴士云. 诃子抗氧化活性的研究. 江苏大学硕士研究生学位论文, 2010]
|
XU X J, LI X H, MA Y F, et al. In vitro bacteriostasis of 49 kinds of Chinese herbs, antibiotics and their compound prescriptions against Vibrio alginolyticus. Journal of Guangdong Ocean University, 2019, 39(6): 30-38 [49味中药及其复方与抗生素对溶藻弧菌的体外抑菌作用. 广东海洋大学学报, 2019, 39(6): 30-38 DOI:10.3969/j.issn.1673-9159.2019.06.005] |
YANG F, XU L M, HUANG W Z, et al. Highly lethal Vibrio parahaemolyticus strains cause acute mortality in Penaeus vannamei post-larvae. Aquaculture, 2021, 548(2): 737605 |
YANG Y H, HOU L Y, YANG Y, et al. Research progress on components, biological functions and application of Chebulae fructus in aquaculture. Feed Research, 2022, 45(15): 144-148 [诃子的成分、生物学功能及其在水产养殖领域中应用的研究进展. 饲料研究, 2022, 45(15): 144-148] |
YANG Z Y, WAN X H, SHI W J, et al. Study on bacterial resistance in Litopenaeus vannamei intestinal culturable bacteria at different growth stages. Progress in Fishery Sciences, 2022, 43(2): 175-184 [凡纳滨对虾不同生长阶段肠道可培养细菌耐药性研究. 渔业科学进展, 2022, 43(2): 175-184 DOI:10.19663/j.issn2095-9869.20201209002] |
YAN Z H, CHANG Z F, ZHANG B, et al. Traditional Chinese pharmacy. Beijing: People´s Medical Publishing House, 2006 [颜正华, 常章富, 张冰, 等. 中药学. 北京: 人民卫生出版社, 2006]
|
YU Y X, TANG M M, WANG Y G, et al. Virulence and antimicrobial resistance characteristics assessment of Vibrio isolated from shrimp (Penaeus vannamei) breeding system in south China. Ecotoxicology and Environmental Safety, 2023, 252: 114615 DOI:10.1016/j.ecoenv.2023.114615 |
ZHAN W H. Reseach on inhibitory effect and mechanism of Chinese herbal medicine on pathogenic Vibrio of Penaeus vannamei. Master´s Thesis of Tianjin University of Science and Technology, 2021 [展文豪. 中草药对南美白对虾致病弧菌的抑制作用与机理研究. 天津科技大学硕士研究生学位论文, 2021]
|
ZHANG W Q, GONG Y F, JIN S, et al. Antimicrobial tests of Chinese herbal medicines and their mixtures on Aeromonas hydrophila. Progress in Fishery Sciences, 2012, 33(1): 114-121 [中草药及其配伍对嗜水气单胞菌的抑菌作用. 渔业科学进展, 2012, 33(1): 114-121] |
ZOU W L, DAI X L, ZHU Q J, et al. Effects of Vibrio alginolyticus on survival rate and five enzymes activity in Macrobrachium rosenbergii. Guangdong Agricultural Sciences, 2012, 39(16): 129–134, 141 [溶藻弧菌对罗氏沼虾成活率及5种酶活性的影响. 广东农业科学, 2012, 39(16): 129–134, 141] |
ZOU Y, XIE G S, JIA T C, et al. Determination of the infectious agent of translucent post-larva disease (TPD) in Penaeus vannamei. Pathogens (Basel, Switzerland), 2020, 9(9): E741 |



