2. 海水养殖生物育种与可持续产出全国重点实验室 中国水产科学研究院黄海水产研究所 山东 青岛 266071;
3. 福建省农业科学院生物技术研究所 福建 福州 350003;
4. 烟台开发区天源水产有限公司 山东 烟台 264001;
5. 宁德市南海水产科技有限公司 福建 宁德 352102
2. State Key Laboratory of Mariculture Biobreeding and Sustainable Goods, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Biotechnology Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350003, China;
4. Tianyuan Aquatic Products Co., Ltd., Yantai Development Zone, Yantai 264001, China;
5. Ningde Nanhai Fishery Technology Co., Ltd., Ningde 352102, China
绿鳍马面鲀(Thamnaconus septentrionalis),隶属于鲀形目(Tetraodontiformes)、单角鲀科(Monacanthidae)、马面鲀属(Thamnaconus)(苏锦祥等, 2002),是我国沿海常见的经济性鱼类。绿鳍马面鲀养殖性状优良,杂食性,易于驯化养殖,尤其适宜网箱和可清洁网衣养殖,可有效降低人力成本。绿鳍马面鲀商品规格多样,100 g便可养成上市。在18~25 ℃水温下,经5~6个月的养殖即可达到商品规格。黄渤海冬季寒冷,绿鳍马面鲀网箱养殖的适养周期为每年的5―11月。自然条件下,黄渤海绿鳍马面鲀的产卵期为5月上旬至6月上旬(苏锦祥等, 2002),无法很好地利用网箱养殖的适养周期。因而,需要通过开展生殖调控使绿鳍马面鲀的繁殖期提前。
为开展生殖调控,需要进行性腺发育相关研究。目前,仅有少数有关绿鳍马面鲀性腺发育的研究,如温海深等(2010a、b)对黄海野生绿鳍马面鲀雌、雄性腺结构和发育组织学进行了研究,并对其卵巢、精巢的形态结构、特点及其变化进行了系统描述。张冬茜等(2013)用cDNA末端快速扩增技术(RACE)对绿鳍马面鲀cyp19a基因的cDNA全长序列进行克隆,并对该基因在各组织的表达特点进行分析。赵梅琳等(2014)利用简并引物扩增得到绿鳍马面鲀erα基因的核心序列,并分析了该基因的组织表达特征。温海深等(2014)检测了cyp17-i基因在绿鳍马面鲀繁殖周期中的动态表达规律,发现其对雄性激素睾酮的生成具有关键调控作用。现有研究多为单个基因的表达和功能分析,而基于组学的性腺相关基因整体表达分析未见报道。
转录组测序技术(RNA-Seq)是利用高通量测序技术对由mRNA逆转录生成的cDNA序列进行测序,从而获得样品中的RNA信息。近年来,转录组测序技术已广泛应用于鱼类性腺相关研究。Wang等(2018)利用组织学和RNA-Seq分析方法,鉴定了大菱鲆(Scophthalmus maximus)精巢在不同发育阶段的生殖周期中参与精子发生的一些关键基因和途径。孙承熙等(2022)通过对大口黑鲈(Micropterus salmoides)雌雄性腺转录组比较分析,发现了dmrt、sox、tgf-β超家族、细胞色素P450芳香酶家族和17β-雌二醇脱氢酶家族等与性别决定、性别分化和配子生成及繁殖相关的基因家族和通路。李营等(2020)对人工养殖的施氏鲟(Acipenser schrenckii)雌雄性腺进行高通量分析,筛选了性别决定和性别分化的相关基因,鉴定了性腺发育的主要代谢通路。本研究利用绿鳍马面鲀的精巢和卵巢材料建立cDNA文库,采用高通量转录组测序与生物信息学分析方法得到雌雄性腺的转录本数据库并注释基因,分析精巢与卵巢的差异基因,筛选出差异表达的基因用于实时荧光定量PCR(qRT-PCR)鉴定。
1 材料与方法 1.1 实验动物采集本实验所用绿鳍马面鲀成鱼性腺样品取材于烟台开发区天源水产有限公司,雌雄鱼各取3尾,鱼体长为(23.0±1.6) cm,体重为(316.6±32.7) g,雄鱼编号为M1、M2和M3,雌鱼编号为F4、F5和F6。用MS-222麻醉后进行快速解剖,取出性腺。分别置于液氮和Bouin´s固定液保存,分别用于RNA的提取和石蜡切片观察。
1.2 RNA提取、cDNA文库构建本实验RNA的提取使用TIANGEN RNAsimple总RNA提取试剂盒(离心柱法),通过NanoDrop检测RNA纯度(OD260/280、OD260/230)和Agilent 2100对RNA片段长度进行检测。文库的构建和RNA-Seq测序由奥维森基因科技公司完成,测序平台为HiSeqTM 2500/4000 (Illumina, 美国)。
1.3 测序与分析本研究利用Trinity技术对全基因组进行了de novo拼接,获得了全基因组的转录本,并将其中最长的一段转录产物称为unigene,以其为参照序列(Grabherr et al, 2011),使用RSEM软件中的bowtie程序将各样品的质控后数据(clean reads)与参照序列进行比对(Li et al, 2011)。在此基础上,利用RSEM对bowtie的比对结果进行统计,进而获得各样本对应的各基因的测序数(read count),并计算标准化的FPKM值、log2(fold change)值及P-value值(Anders et al, 2010),以便分析2组样品中不同基因的表达量。其中差异表达基因(DEG)(DEGSeq v1.12.0)为|log2(fold change)| > 1且P-value < 0.005的基因。在此基础上,利用7个数据库(NR、NT、KO、SWISSPROT、PFAM、KOG和GO)来研究这些基因的功能。此外,对获得的DEGs进行GO功能分级和KEGG代谢途径富集分析。通过对已知与鱼类性别决定、配子形成、生殖发育等生物学行为密切相关的基因进行深度挖掘,以期获得更多鱼类性别相关的基因功能信息。
1.4 实时荧光定量PCR验证为验证转录组测序结果是否可靠,筛选出一些表达量较大的基因设计引物,并对其进行qRT-PCR (ABI StepOnePlus)鉴定。利用Primer Premier 5.0进行特异性引物的设计,全部引物由华大基因股份有限公司合成(表 1)。本实验采用7500实时定量PCR系统(ABI StepOnePlus),使用ChamQ SYBR Color qPCR Master Mix (诺唯赞)试剂盒进行qRT-PCR,具体反应程序参考徐郑鑫等(2021)的方法。首先依据样本Ct值和内参基因Ct值推算ΔCt值,然后和对照组ΔCt值进行对比,并采用2–ΔΔCt法进行数据处理,用GraphPad Prism 9软件对结果统计分析。
|
|
表 1 qRT-PCR验证使用的引物 Tab.1 Primer sequences used for qRT-PCR |
按照鱼性腺分期标准(Hochleithner et al, 1999)并参考绿鳍马面鲀性腺分期(张家男, 2010),用石蜡包埋法对绿鳍马面鲀的性腺进行组织学研究。图 1A为雄鱼性腺,精小叶界限明显,小叶腔较小,细胞核明显,呈蓝色,可观察到精子细胞,为Ⅲ期末。图 1B为雌鱼性腺,卵母细胞呈不规则的多角圆形,细胞质嗜碱性较低,细胞质中出现少量液泡,判断其处于Ⅱ期。

|
图 1 绿鳍马面鲀性腺切片 Fig.1 Histological examination of T. septentrionalis A:雄鱼;B:雌鱼。SD:精子细胞;LL:小叶腔;CG:卵母细胞;N:细胞核;CA:液泡 A: Male fish; B: Female fish. SD: Sperm cells; LL: Lobular cavity; CG: Oocyte; N: Nucleus; CA: Cortical alveoli |
本实验利用Illumina高通量测序平台,采用PE150测序策略,从绿鳍马面鲀精巢和卵巢的cDNA中共测得165 981 523 raw reads,经过质控,得到161 234 846 clean reads。绿鳍马面鲀性腺组织测序数据统计结果见表 2,雌雄鱼各3个。错误率为0.01%的各样品,其Q20在98.43%以上,Q30在95.25%以上;样品碱基GC含量均不小于52.31%。错误率为0.02%的各样品,其Q20在95.59%以上,Q30在59.73%以上;样品碱基GC含量均不小于52.44%。
|
|
表 2 样品测序数据汇总 Tab.2 Summary of sample sequencing data |
通过Trinity软件将获得的clean data进行从头组装,共获得119 219个unigenes和150 739个transcripts。拼接后的unigenes长度为201~18 419 bp,N50 (累加后的转录本长度超过组装总长度的一半)为1 225 bp。拼接后的transcripts长度为201~18 419 bp,N50为1 517 bp。将所有unigenes和transcripts根据序列长度进行从小到大排列(图 2),序列长度在 < 300 bp的区间最多,并随着序列长度的增加而逐渐减少。
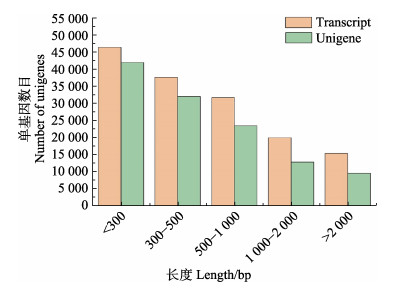
|
图 2 原始拼接transcripts和unigene中序列长度分布 Fig.2 Sequence length distribution of original stitching transcripts and unigene |
对组装后获得的unigenes分别在7大数据库进行基因功能注释,其中,7 908个(6.63%) unigenes在7个数据库中都获得注释。在绿鳍马面鲀性腺转录组测序得到的119 219个基因中,有24 009个(20.14%)基因与NR数据库成功匹配(表 3)。
|
|
表 3 基因注释统计结果 Tab.3 Statistical results of gene annotation |
GO分类注释用于描述序列的功能,分为3大类,45个子类(图 3)。参与生物过程(biological process)的子类最多,其中,unigenes参与最多的过程是细胞过程(GO: 0008150, 2 922个基因)。其次是细胞成分(cellular process)中的细胞功能(GO: 0005575, 3 691个基因),最后是分子功能(molecular function)中参与最多的连接功能(GO: 0003674, 1 435个基因)。
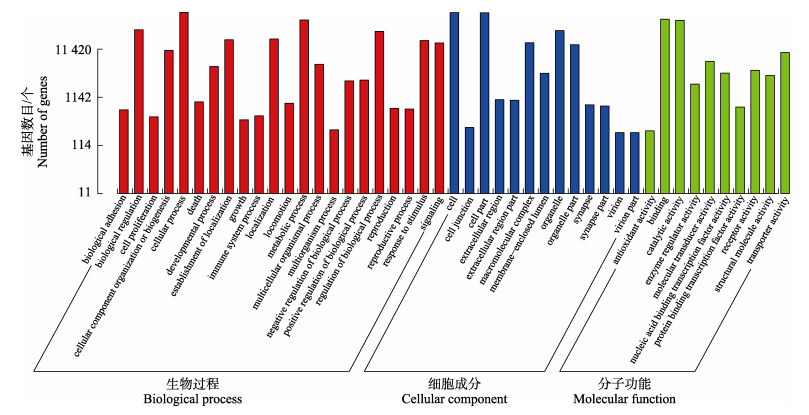
|
图 3 GO分类 Fig.3 GO classification diagram |
为了更加系统地了解绿鳍马面鲀性腺基因的生物学功能,对获得的unigenes进行了KEGG注释,注释结果可分为5个大类(图 4)。其中,有机系统(organismal systems)分支富集的基因最多,达2 115个,分布在9条通路上;其次为代谢(metabolism)分支,共富集到1 444个基因,分布在12条通路上;环境信息处理(environmental information processing)共富集到1 200个基因,分布在3条相关通路上;遗传信息处理(genetic information processing)共富集到1 128个基因,分布在4条相关通路上;细胞过程(cellular processes)相关通路富集到的基因数为927个,分布在4条相关通路上。信号转导(signal transduction)通路是KEGG通路注释基因最多的,共804个。
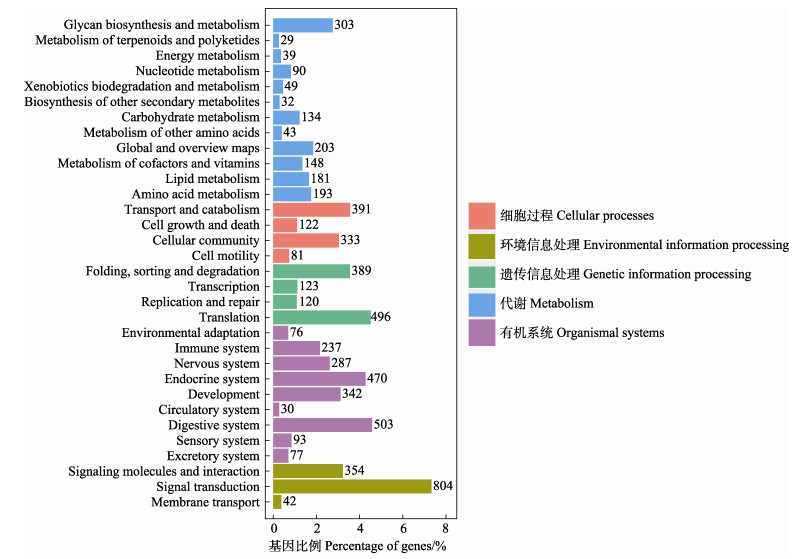
|
图 4 KEGG分类 Fig.4 KEGG classification diagram |
本实验在KOG数据库中共有24 546个unigenes得到注释,根据相应功能分为26类。其中,信号转导机制类(signal transduction mechanisms)注释的unigene最多,为5 411个;其次为有4 252个unigene的一般功能预测类(general function prediction only);再次为有1 713个unigene的蛋白后修饰、蛋白折叠和伴侣蛋白类(posttranslational modification, protein turnover, chaperones);转录类(transcription),1 613个;以及其他相关功能(图 5)。
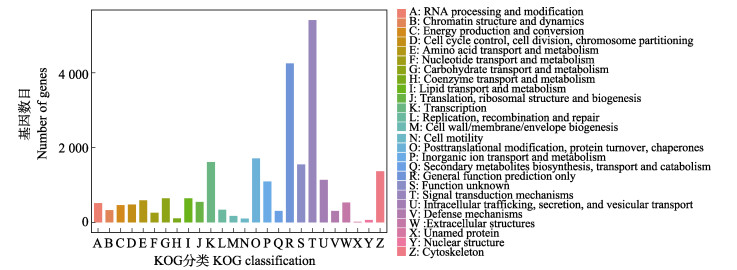
|
图 5 KOG功能分类 Fig.5 KOG function classification |
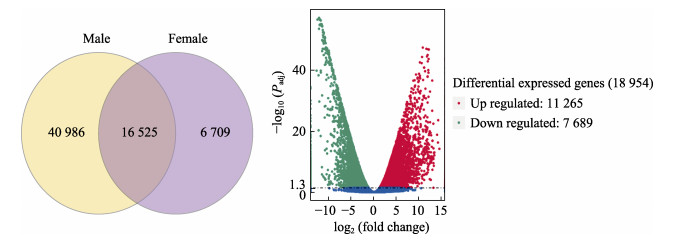
对unigene进行差异基因筛选,发现有6 079个unigenes在卵巢特异性表达,40 986个在精巢特异性表达。火山图分析绿鳍马面鲀性腺基因的差异表达情况显示(图 6),相对于精巢,卵巢中共得到18 954个差异表达基因,11 265个差异基因上调,7 689个下调。
|
图 6 绿鳍马面鲀卵巢和精巢差异表达基因的比较 Fig.6 Comparison of differentially expressed genes in ovary and testis of Puffer |
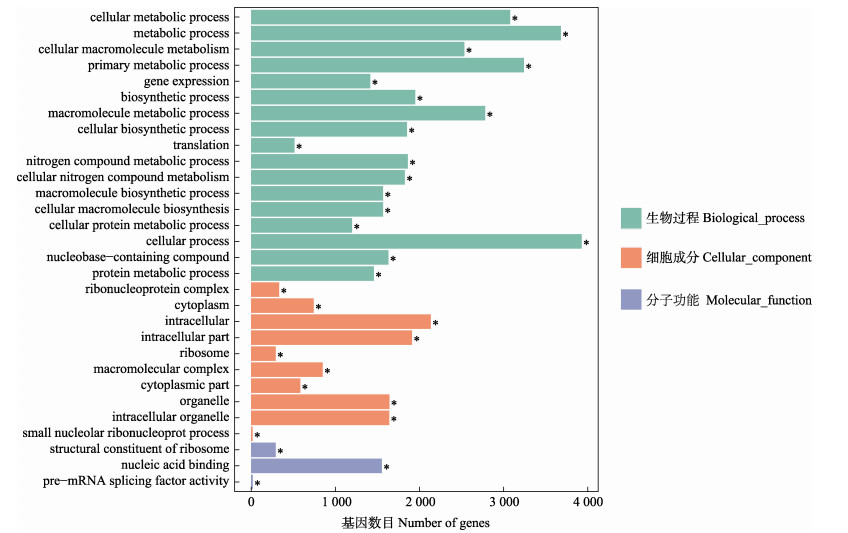
DEG经GO功能富集分析发现,生物过程中的细胞过程、细胞组分(cellular component)亚类中的胞内组分(intracellular)、分子功能下属分类中的核酸结合(nucleic acid binding)富集的DEGs最多(图 7)。
|
图 7 绿鳍马面鲀卵巢和精巢差异表达基因的GO富集分析 Fig.7 GO enrichment analysis of differentially expressed genes in ovary and testis of Pufferfish |
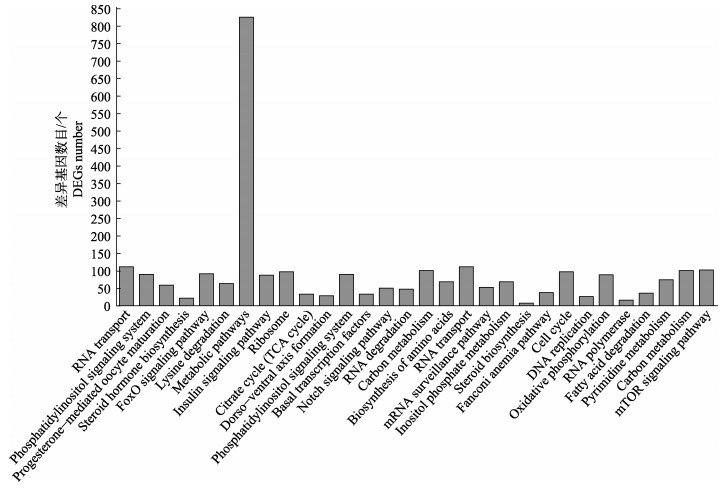
利用KEGG数据库筛选与绿鳍马面鲀性别分化和性腺发育相关功能通路,并对其表达调控机制进行深入研究。在本研究中,共有154条KEGG路径被包括在内,从中选出前30个KEGG路径,并绘制出条状图以供参考(图 8)。代谢通路中表达基因数量最多的功能通路与性腺性别分化和性腺发育密切相关,这些功能通路包括胰岛素信号通路(insulin signaling pathway)、类固醇激素生物合成(steroid hormone biosynthesis)、FoxO信号通路(FoxO signaling pathway)、M-TOR信号通路(M-TOR signaling pathway)以及黄体酮介导的卵母细胞成熟途径(progesterone-mediated oocyte maturation)。
|
图 8 KEGG富集通路 Fig.8 KEGG enrichment pathway |
通过qRT-PCR检测了9个基因在绿鳍马面鲀雌雄性腺的表达情况:卵巢中,bmp2、foxl2、sox3、figla、hsd17b1和cyp19a基因的表达量较高;精巢中,cyp17、star和amh是主要表达基因。qRT-PCR结果与RNA-Seq分析一致(图 9),表明本研究RNA-seq测序数据准确,DEGs筛选结果可靠。

|
图 9 qRT-PCR验证RNA-Seq结果 Fig.9 Validation of the RNA-Seq data by qRT-PCR verification |
本研究通过石蜡切片观察发现,绿鳍马面鲀精巢处于Ⅲ期末,卵巢处于Ⅱ期。在此基础上,对绿鳍马面鲀的精巢和卵巢进行了转录组测序分析,经de novo拼装,获得119 219个单基因(unigene)并完成了注释,其中,37%在至少1个数据库中被注释。黄勇等(2019)利用RNA-Seq技术对大口黑鲈全组织进行转录组测序,获得35 659条unigenes,48.38%至少在1个数据库中注释成功。黄勇等(2018)使用高通量技术对大鲵(Andrias davidianus)的转录组进行测序,共132 912条unigenes,其中,39 672条在至少1个数据库上被注释,占了全部数据的29.85%。N50长度对评估de novo组合的品质有很大影响,在本研究中,N50长度为1 255 bp,这一数据比文献报道的牙鲆(Paralichthys olivaceus) (809 bp) (Fan et al, 2014)、大口黑鲈(1 052 bp)(黄勇等, 2019)和大鲵(1 263bp)(黄勇等, 2018)的性腺组装数据基因高,且注释比例不低,因此,测序质量好、可信度高。
4.1 绿鳍马面鲀雌雄差异表达基因本研究以绿鳍马面鲀卵巢和精巢为实验材料,采用生物信息学方法在卵巢和精巢筛选到多个与配子发生及发育相关的基因,隶属于类固醇激素、TGF-β超家族和转录因子等类群。
类固醇激素其主要功能是通过影响性腺的发育及性行为来实现对脊椎动物的性别分化及性行为的调控。类固醇激素对鱼类生殖细胞的产生及维持起到重要作用(Svechnikov et al, 2008)。本研究筛选到的类固醇激素基因包括cyp17、cyp19a和star。cyp17 (cytochrome P450, family 17)是一种裂解酶,在性类固醇激素的生物合成途径中发挥关键作用(Shen et al, 2014)。陈孝红等(2015)研究发现,性成熟斑马鱼(Danio rerio) cyp17a1基因在精巢中表达量显著高于卵巢。cyp17a1基因在金钱鱼(Scatophagus argus)精巢发育后期高表达(翟毅等, 2018)。cyp19a为编码性腺型芳香化酶,张冬茜等(2013)在绿鳍马面鲀cyp19a基因克隆鱼表达特征分析中表明,cyp19a在卵巢中特异性表达,与黄颡鱼(Pelteobagrus fulvidraco)(徐跑等, 2005)、鲑鱼(Salmo salar)(Woram et al, 2003)、翘嘴鳜(Siniperca chuatsi)(邹立军等, 2017)、条班星蝶(Verasper moseri)(金国雄等, 2010)和南方鲇(Silurus meridionalis) (Liu et al, 2007)组织表达情况一致,这些鱼类在维持雌性性腺的分化和功能方面扮演着至关重要的角色。star是类固醇激素合成的重要调控蛋白,在多种类固醇激素合成中发挥着重要作用。朱颖等(2014)研究发现,star基因在半滑舌鳎的精子细胞中显著表达,表明star可能参与精巢发育和精子形成过程。蔡静(2018)研究发现,尼罗罗非鱼(Oreochromis niloticus)中存在2个与其雄性激素合成相关的基因,star1和star2,它们都在精巢基质细胞中表达,且与雄性激素合成有关。
TGF-β超家族的许多成员在鱼类的配子发生、维持及增殖等过程中发挥着关键的作用(董忠典等, 2021)。其中,Gsdf1、amh和bmp2等具有促进鱼类配子发生与发育的作用。在本研究中,amh在精巢中表达上调,bmp2在卵巢中表达上调,且amh和bmp2在雌雄腺组织中的表达量与转录组相吻合。amh (抗缪勒氏管激素)是高等脊椎动物性腺发育中的一个非常重要的激素。它主要通过调节雌雄生殖细胞的分化和发育来实现其功能(Visser et al, 2005)。在大黄鱼(Larimichthys crocea)(林爱强, 2017)、大口黑鲈(李兵部, 2023)和半滑舌鳎(Cynoglossus semilaevis)(刘姗姗等, 2013)等鱼类研究中发现,amh基因在精巢的表达量均明显高于卵巢。此外,Kwan等(2019)研究发现,在霍氏食蚊鱼(Gambusia holbrooki)雄胚发育的早期,amh基因的表达量很高,并与原始生殖细胞的发育密切相关。
本研究筛选到的与配子发生及发育相关的转录因子包括foxl2和figla。foxl2 (forkhead transcription factor 2)是翼状螺旋或叉头转录因子超家族中的转录调节核蛋白。它是在哺乳动物雌性卵巢中发现的第一个标志性启动子基因,启动了卵巢的性别决定和分化过程(Joshi et al, 2007)。董忠典等(2021)指出,湖栖鳍虾虎鱼(Gobiopterus lacustris)的foxl2基因在卵巢中表现出高水平的表达。figla (factor in thegermline alpha)是一种转录因子,参与哺乳动物的卵子形成和受精过程。在硬骨鱼中,figla通常被认为是卵巢发育或早期卵母细胞分化的标记基因。在稀有
本研究通过雌雄差异表达基因的GO分析,获得部分与生殖过程(GO: 0022414, reproductive process)、有性生殖(GO: 0019953, sexual reproduction)、配子形成(GO: 0007276, gamete generation)、性别分化(GO: 0007548, sex differentiation)和性腺发育(GO: 0008406, gonad development)相关的注释信息。在这些生物过程中,精子发生和卵子发育是2个关键的生物过程(Tsakogiannis et al, 2018)。从KEGG数据库中筛选到大量性别分化和性腺发育相关功能通路,包括FoxO信号通路、胰岛素信号通路、黄体酮介导的卵母细胞成熟和卵巢类固醇合成通路。FoxO信号通路调节基因可以在细胞周期控制、细胞凋亡和糖代谢等多个过程中表达(Lehtinen et al, 2006)。Meng等(2015)研究发现,胰岛素信号通路对调节发育、代谢和寿命生理过程发挥重要作用,且胰岛素信号通路参与性腺发育和成熟过程。
本研究利用转录组技术构建了绿鳍马面鲀的精巢与卵巢cDNA文库,并利用Illumina技术对其进行了RNA-Seq测序,初步阐明了性腺相关基因的表达模式,为绿鳍马面鲀性腺发育相关基因的研究奠定了基础,为优化生殖调控技术提供了理论支持。
ANDERS S, HUBER W. Differential expression analysis for sequence count data. Genome Biology, 2010, 11(10): R106 DOI:10.1186/gb-2010-11-10-r106 |
CAI J. Functional studies of StAR during gonadal differentiation and gametogenesis in Nile tilapia. Master´s Thesis of Southwest University, 2018 [蔡静. StAR在尼罗罗非鱼性腺分化和配子发生过程中的功能研究. 西南大学硕士研究生学位论文, 2018]
|
CHEN X H, QIU X M, HAO W W, et al. Expression of CYP11a1 in different developmental phases of gonad in zebrafish Danio rerio. Journal of Dalian Ocean University, 2015, 30(1): 13-17 [陈孝红, 仇雪梅, 郝薇薇, 等. 斑马鱼CYP11a1基因在不同性腺发育时期的表达. 大连海洋大学学报, 2015, 30(1): 13-17 DOI:10.3969/J.ISSN.2095-1388.2015.01.003] |
DONG Z D, LI X Y, HUANG C Q, et al. Comparative transcriptome analysis of the gonad of the lacustrine goby (Gobiopterus lacustris). Journal of Fisheries of China, 2021, 45(3): 365-380 [董忠典, 黎学友, 黄承勤, 等. 湖栖鳍虾虎鱼性腺转录组比较分析. 水产学报, 2021, 45(3): 365-380] |
FAN Z F, YOU F, WANG L J, et al. Gonadal transcriptome analysis of male and female olive flounder (Paralichthys olivaceus). BioMed Research International, 2014, 2014: 291067 |
GRABHERR M G, HAAS B J, MORAN Y, et al. Full-length transcriptome assembly from RNA-Seq data without a reference genome. Nature Biotechnology, 2011, 29(7): 644-652 DOI:10.1038/nbt.1883 |
HOCHLEITHNER M, GESSNER J. The sturgeons and paddlefishes of the world: Biology and aquaculture. Australia: Aqua Tech Publications, 1999, 81-82 |
HUANG Y, GAO X C, SUN X H. Transcriptome analysis of Chinese giant salamander (Andrias davidianus) based on RNA-seq high-throughput sequencing technology. Genomics and Applied Biology, 2018, 37(9): 3759-3768 [黄勇, 高小蝉, 孙西红. 基于RNA-Seq高通量测序技术的大鲵转录组分析. 基因组学与应用生物学, 2018, 37(9): 3759-3768] |
HUANG Y, GONG W B, CHEN H G, et al. Sequencing and bioinformatic analysis for transcriptome of Micropterus salmoides based on RNA-seq. South China Fisheries Science, 2019, 15(1): 106-112 [黄勇, 龚望宝, 陈海刚, 等. 基于RNA-Seq高通量测序技术的大口黑鲈转录组分析. 南方水产科学, 2019, 15(1): 106-112] |
JIN G X, WEN H S, LIU X Z, et al. Cloning of CYP19a gene and expression analysis during the reproductive cycle in males of Verasper moseri. Journal of Fisheries of China, 2010, 34(2): 194-203 [金国雄, 温海深, 柳学周, 等. 条斑星鲽CYP19a基因克隆及其在雄鱼生殖周期中的表达. 水产学报, 2010, 34(2): 194-203] |
JOSHI S, DAVIES H, SIMS L P, et al. Ovarian gene expression in the absence of FIGLA, an oocyte-specific transcription factor. BMC Developmental Biology, 2007, 7(1): 67 DOI:10.1186/1471-213X-7-67 |
KLEPPE L, EDVARDSEN RB, FURMANEK T, et al. Bmp15, Figla, Smc1bl, and Larp6l are preferentially expressed in germ cells in Atlantic salmon (Salmo salar). Molecular and Reproductive Development, 2017, 84(1): 76-87 DOI:10.1002/mrd.22755 |
KWAN T N, PATIL J G. Sex biased expression of anti-Mullerian hormone (amh) gene in a live bearing fish, Gambusia holbrooki: Evolutionary implications and potential role in sex differentiation. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2019, 231: 59-66 DOI:10.1016/j.cbpb.2019.02.004 |
LEHTINEN M K, YUAN Z, BOAG P R, et al. A conserved MST-FOXO signaling pathway mediates oxidative-stress responses and extends life span. Cell, 2006, 125(5): 987-1001 DOI:10.1016/j.cell.2006.03.046 |
LI B, DEWEY C N. RSEM: Accurate transcript quantification from RNA-Seq data with or without a reference genome. BMC Bioinformatics, 2011, 12(1): 323-323 DOI:10.1186/1471-2105-12-323 |
LI Y, RUAN R, AI C, et al. Characteristics of the gonadal transcriptome of amur sturgeon (Acipenser schrenckii) under artificial culture. Acta Hydrobiologica Sinica, 2020, 44(2): 310-318 [李营, 阮瑞, 艾成, 等. 养殖施氏鲟的性腺转录组特征分析. 水生生物学报, 2020, 44(2): 310-318] |
LIN A Q, XIE Y J, XU S B, et al. Cloning and expression profiling of gsdf and amh genes in large yellow croaker (Larimichthys crocea). South China Fisheries Science, 2017, 13(6): 1-13 [林爱强, 谢仰杰, 徐双斌, 等. 大黄鱼gsdf和amh基因的克隆及表达分析. 南方水产科学, 2017, 13(6): 1-13 DOI:10.3969/j.issn.2095-0780.2017.06.001] |
LIU B B, CAO Z M, TAO Y F, et al. Molecular cloning, expression analysis and polyclonal antibody preparation of anti-müllerian hormone (amh) gene in largemouth bass Micropterus salmoides. Acta Hydrobiologica Sinica, 2023, 47(5): 775-785 [李兵部, 曹哲明, 陶易凡, 等. 大口黑鲈amh基因全长cDNA克隆、表达及多克隆抗体制备. 水生生物学报, 2023, 47(5): 775-785] |
LIU S S, SUN B, LIANG Z, et al. Cloning and expression of anti-Müllerian hormone gene in half smooth tongue-sole, Cynoglossus semilaevis. Journal of Fishery Sciences of China, 2013, 20(1): 35-43 [刘姗姗, 孙冰, 梁卓, 等. 半滑舌鳎抗缪勒氏管激素(AMH)基因的克隆及组织表达分析. 中国水产科学, 2013, 20(1): 35-43] |
LIU Z, WU FENG R, JIAO B, et al. Molecular cloning of doublesex and mab-3-related transcription factor 1, forkhead transcription factor gene 2, and two types of cytochrome P450 aromatase in southern catfish and their possible roles in sex differentiation. Journal of Endocrinology, 2007, 194: 223-241 DOI:10.1677/JOE-07-0135 |
MENG X, LIU P, JIA F, et al. De novo transcriptome analysis of am ovary and testis by RNA-Seq: Identification of genes involved in gonadal development. PLoS One, 2015, 10(6): e0128659 DOI:10.1371/journal.pone.0128659 |
SHEN Z G, WANG H P. Molecular players involved in temperature-dependent sex determination and sex differentiation in teleost fish. Genetics Selection Evolution, 2014, 46(1): 26 DOI:10.1186/1297-9686-46-26 |
SU J X, LI C S. Zoology of China: Osteichthyes (Tetraodontiformes, Pegasiformes, Gobiesociformes, and Lophiiformes). Beijing: Sciences Press, 2002: 125-132 [苏锦祥, 李春生. 中国动物志: 硬骨鱼纲——鲀形目、海蛾鱼目、喉盘鱼目、  目. 北京: 科学出版社, 2002: 125-132] 目. 北京: 科学出版社, 2002: 125-132]
|
SUN C X, DONG J J, SUN C F, et al. Transcriptome characteristics analysis of the male and female gonads of largemouth bass Micropterus salmoides. Genomics and Applied Biology, 2022, 41(5): 946-959 [孙承熙, 董浚键, 孙成飞, 等. 大口黑鲈雌雄性腺转录组特征分析. 基因组学与应用生物学, 2022, 41(5): 946-959] |
SVECHNIKOV K, SÖDER O. Ontogeny of gonadal sex steroids. Best Practice & Research Clinical Endocrinology & Metabolism, 2008, 22(1): 95-106 |
TSAKOGIANNIS A, MANOUSAKI T, LAGNEL J, et al. The transcriptomic signature of different sexes in two protogynous hermaphrodites: Insights into the molecular network underlying sex phenotype in fish. Scientific Reports, 2018, 8(1): 3564 DOI:10.1038/s41598-018-21992-9 |
VISSER J A, THEMMEN A P N. Anti-müllerian hormone and folliculogenesis. Molecular and Cellular Endocrinology, 2005, 234(1/2): 81-86 |
WANG X, LIU Q, XU S, et al. Transcriptome dynamics during turbot spermatogenesis predicting the potential key genes regulating male germ cell proliferation and maturation. Scientific Reports, 2018, 8(1): 1-12 |
WEN H S, YANG Y P, CHEN C F, et al. Histological observation of gonad structure and its repeated development in male Navodon septentrionalis. Advances in Marine Science, 2010a, 28(2): 209-215 [温海深, 杨艳平, 陈彩芳, 等. 绿鳍马面鲀重复发育雄性生殖腺结构与发育组织学观察. 海洋科学进展, 2010a, 28(2): 209-215] |
WEN H S, ZHANG J N, YUAN Y R, et al. A study on domestication and reproduction biology in wild Navodon septentrionalis. Modern Fisheries Information, 2010b, 25(11): 13-16 [温海深, 张家男, 袁玉仁, 等. 野生绿鳍马面鲀人工驯养与繁殖生物学的初步研究. 现代渔业信息, 2010b, 25(11): 13-16 DOI:10.3969/j.issn.1004-8340.2010.11.004] |
WEN H S, REN Y Y, ZHANG D Q, et al. Molecular cloning and expression patterns of the cytochrome CYP17-I gene during the reproductive cycle in Navodon septentrionalis. Journal of Fisheries of China, 2014, 38(12): 1945-1955 [温海深, 任源远, 张冬茜, 等. 绿鳍马面鲀CYP17-I基因克隆及其在繁殖周期中的表达. 水产学报, 2014, 38(12): 1945-1955] |
WORAM R A, GHARBI K, SAKAMOTO T, et al. Comparative genome analysis of the primary sex-determining locus in salmonid fishes. Genome Research, 2003, 13(2): 272-280 DOI:10.1101/gr.578503 |
XU P, YU J H, TANG Y K, et al. Olecular cloning of ovarian P-450arom gene and its expression in male and female yellow catfish Pelteobagrus fulvidraco. Journal of Fishery Sciences of China, 2005, 12(5): 541-548 [徐跑, 俞菊华, 唐永凯, 等. 黄颡鱼卵巢P-450arom基因的克隆及组织表达. 中国水产科学, 2005, 12(5): 541-548 DOI:10.3321/j.issn:1005-8737.2005.05.003] |
XU Z X, ZHANG P F, CHEN S Q, et al. Effects of feeding frequency on the growth, physiology, and expression abundance of hsp70 mRNA in juvenile Thamnaconus septentrionalis. Progress in Fishery Sciences, 2021, 42(2): 55-62 [徐郑鑫, 张鹏飞, 陈四清, 等. 投喂频率对绿鳍马面鲀幼鱼生长、生理指标及肝脏hsp70基因表达丰度的影响. 渔业科学进展, 2021, 42(2): 55-62 DOI:10.19663/j.issn2095-9869.20200724001] |
YUAN C, WU T, ZHANG Y, et al. Responsiveness of four gender-specific genes, figla, foxl2, scp3 and sox9a to 17α-ethinylestradiol in adult rare minnow Gobiocypris rarus. General and Comparative Endocrinology, 2014, 200: 44-53 DOI:10.1016/j.ygcen.2014.02.018 |
ZHAI Y, LIU J Y, JIA L Y, et al. Cloning, tissue distribution and expression of cyp17a1 at different ovarian development stages in spotted scat (Scatophagus argus). Journal of Guangdong Ocean University, 2018, 38(5): 1-7 [翟毅, 刘建业, 贾丽英, 等. 金钱鱼cyp17a1基因克隆、组织分布及在卵巢发育中的表达. 广东海洋大学学报, 2018, 38(5): 1-7 DOI:10.3969/j.issn.1673-9159.2018.05.001] |
ZHANG D Q, WEN H S, QIAN C, et al. The gene cloning of cyp19a and its expression characterization analysis in Navodon septentrionalis. Oceanologia et Limnologia Sinica, 2013, 44(4): 1086-1094 [张冬茜, 温海深, 钱迟, 等. 绿鳍马面鲀cyp19a基因克隆与表达特征分析. 海洋与湖沼, 2013, 44(4): 1086-1094] |
ZHANG J N. Reproductive regulation and fry breeding technology of Thamnaconus septentrionalis Günther. Master´s Thesis of Ocean University of China, 2010 [张家男. 绿鳍马面鲀的生殖调控与苗种繁育技术. 中国海洋大学硕士研究生学位论文, 2010]
|
ZHAO M L, WEN H S, ZHANG D Q, et al. Cloning of partial cDNA of estrogen receptor α and expression analysis during the reproductive cycle in Navodon Septentrionalis. Marine Sciences, 2014, 38(5): 81-88 [赵梅琳, 温海深, 张冬茜, 等. 绿鳍马面鲀ERα基因部分cDNA序列克隆及其表达研究. 海洋科学, 2014, 38(5): 81-88] |
ZHU Y, MENG L, HU Q M, et al. Molecular cloning and temporal expression analysis of star gene in different tissues of half-smooth tongue sole Cynoglossus semilaevis. Journal of Fisheries of China, 2014, 38(9): 1221-1229 [朱颖, 孟亮, 胡乔木, 等. 半滑舌鳎star基因克隆及其在不同组织的时空表达分析. 水产学报, 2014, 38(9): 1221-1229] |
ZOU L J, GONG J, JI L, et al. Cloning and expression analysis of CYP19a gene in mandarin fish Siniperca chuatsi. Life Science Research, 2017, 21(4): 295-301 [邹立军, 龚婧, 吉璐, 等. 翘嘴鳜性腺型芳香化酶基因CYP19a的克隆及表达研究. 生命科学研究, 2017, 21(4): 295-301] |



