2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业与可持续发展重点实验室 山东 青岛 266071;
3. 大连海洋大学水产与生命学院 辽宁 大连 116023
2. Key Laboratory of Marine Fisheries and Sustainable Development, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116000, China
我国约有4 600万hm2的低洼盐碱水域,遍及我国19个省市和自治区(陈学洲等, 2020)。盐碱水中的碱度主要来源于水体中的
中国对虾(Penaeus chinensis)为广盐性物种,可在盐度为15~40的范围内存活,盐度15~30适宜生存,其养殖最佳盐度为23 (张瑞标等, 2013),48 h半致死碳酸盐碱度为10.33 mmol/L (周玉洁, 2023)。2010年,河北省水产技术推广站率先将中国对虾快速生长新品种“黄海1号”引进盐碱水养殖并获得成功,开辟了中国对虾养殖新途径,但由于缺乏优质抗逆良种,养殖经济效益有待提高,针对中国对虾应对盐碱胁迫的相关研究亟待开展。
ABC转运蛋白(ATP-binding cassette transporter)是目前已知的最大蛋白家族之一,广泛存在于各生物体内。该类蛋白的主要功能是依赖水解ATP跨膜运输各种底物(如糖类、氨基酸、脂类、维生素、激素和金属离子等)(Higgins, 1992)。ABC转运蛋白通常由NBD (nucleotide binding domains)和TMD (trans-membrane domain)组成(Liu et al, 2021)。其中,NBD在各级生物内高度保守,可以通过鉴定该结构域来确定是否为ABC转运蛋白家族成员(Rees et al, 2009)。而TMDs结构及序列具有多样性,通常由4~6个疏水的α-螺旋组成(Sánchez-Fernández et al, 2001),α-螺旋可以耦合形成通道,参与底物的识别并转运不同底物通过脂双层膜(Verrier et al, 2008)。ABCG亚家族是ABC家族中最大的亚家族,其最初在酿酒酵母(Saccharomyces cerevisiae)和真菌中被鉴定并被描述为多效性耐药性(PDR)蛋白,通过充当外排泵,在单细胞生物中排出各种分子,包括用于药物治疗的外源性药物,从而提高细胞对化学物质的耐药性(Prasad et al, 2012)。在多种生物体内鉴定到的ABCG转运蛋白参与跨细胞膜转运底物,负责细胞内稳态,如在激素运输、脂质代谢等中发挥作用,使植物适应多变的环境,并参与信号转导、病毒防御与抗原呈递等(刘艳青等, 2017),在维持如干旱、农药、重金属和盐碱等胁迫过程中的正常生理状态中发挥重要作用(王晓珠等, 2017)。
本课题组利用多组学技术,对中国对虾盐碱胁迫响应基因及通路进行筛选和鉴定,发现在盐碱胁迫下,大量差异表达基因集中于物质转运和能量代谢通路(Li et al, 2019),ABC转运蛋白家族的多个成员被多次检出。为了进一步验证其功能,本研究克隆中国对虾PcABCG5基因全长,明确该基因的序列特征及组织表达模式,采用qPCR技术分析其在盐碱胁迫下的时空表达特征,并利用基因敲降技术进行功能验证,以期为中国对虾优异抗逆种质创制以及拓展养殖新空间提供理论依据。
1 材料与方法 1.1 实验材料健康中国对虾取自山东省昌邑市海丰水产养殖公司,其平均体长为(7.92±0.74) cm,平均体重为(7.23±1.37) g。实验开始前暂养3 d,暂养池规格为4 m ×2 m ×1.5 m,水深30 cm,养殖密度为60尾/m3,水温23.4~26.3 ℃,盐度30.39~30.47,pH 7.83~7.88。暂养期间,每日更换1/3的水,每日按时投喂,持续充氧,适应环境后进行实验。
1.2 实验方法 1.2.1 急性高碳酸碱度胁迫从暂养池中随机选取健康中国对虾180尾,平均分成2组。根据前期预实验结果,实验组设置盐度为20、碱度为10 mmol/L,pH控制在7.79~7.85,在规格为66.5 cm× 46.5 cm × 36.0 cm塑料水箱进行胁迫实验,胁迫水体为100 L。对照组盐度为30,碱度为3 mmol/L,每组设置3个平行,每个平行30尾。用淡水调节盐度;通过滴定泵滴定NaHCO3预制标准液调节碱度(魏威等, 2022),每隔6 h对盐度与碱度校正一次,分别在实验开始后的0、3、6、12、24、48、72和96 h时取9尾对虾鳃组织,保存于液氮中备用。
1.2.2 总RNA的提取及cDNA第一链的合成采用TransZol法提取RNA,核酸定量仪(NanoDrop 2000,美国)测定RNA的质量和浓度,琼脂糖凝胶电泳进行完整性检测。利用反转录试剂盒(艾克瑞,湖南)进行反转录得到cDNA,–80 ℃保存,用于PcABCG5基因的定量分析。
1.2.3 中国对虾PcABCG5基因克隆随机抽取暂养3 d的中国对虾9尾,采集眼柄、鳃、心脏、肌肉、肠道、肝胰腺、胃和血淋巴细胞,使用SMARTer® RACE 5′/3′试剂盒(宝生物,大连),合成中国对虾3′、5′RACE模板。使用Primer Premier 5.0软件设计特异性引物(表 1),PcABCG5的中间片段经PCR扩增获得。设计RACE引物,用于3′和5′的扩增,对RACE产物进行切胶回收和连接转化,挑取单克隆菌株,对菌液PCR产物进行凝胶电泳检测,筛选阳性菌液并测序。利用软件Contig Express拼接菌液测序结果,获得完整的基因序列。
|
|
表 1 实验所用引物 Tab.1 The primers used for experiments |
PcABCG5的理化性质、等电点及分子质量由ExPASy分析,结构域通过InterPro搜索,信号肽由SignalP-5.0预测。使用PSORTⅡPrediction进行亚细胞定位。利用ExPASy中的ProtScale推测蛋白质亲水性。采用DeepTMHMM进行跨膜结构分析。通过SOPMA预测编码蛋白的二级结构。利用DNAman软件进行多生物氨基酸序列对比。最后通过MEGA 11软件构建Neighbor-Joining进化树。
1.2.5 PcABCG5基因表达的实时定量分析使用qPCR试剂盒(诺唯赞,南京)和7500 Real Time PCR System仪器(ABI,美国)对各组实验样品进行定量分析。内参基因选用β-actin对盐碱胁迫ABC转运蛋白的表达量进行校正,基于单内参算法2–ΔΔCt计算ABC转运蛋白的相对表达量,运用SPSS 17.0软件对数据进行统计分析,显著性检验用Duncan法进行多重比较,GraphPad Prism 8.0软件作图。
1.2.6 PcABCG5基因dsRNA干扰实验根据PcABCG5 cDNA序列,设计3个干扰靶点,分别为ABCG5-1-F(CCAAGAAATACAACCGCAT)、ABCG5-2-F(CATCCAGCAGCTGTTTTTCA)和ABCG5-3-F (CGGCTACGTGACTCACAAGA)。设计引物时,在每对引物的5′端各加一段T7启动子序列(GATCACTAATACGACTCACTATAGGG),用于合成ABCG5 dsRNA。合成模板后,通过凝胶电泳检测产物质量,并进行切胶回收,磁珠纯化产物,并在–80 ℃保存。干扰预实验以分别注射ABCG5-1、ABCG5-2和ABCG5-3 dsRNA作为干扰组,注射双链dsRNA-NC (诺唯赞)为阴性对照组。根据对虾体重调整注射量(1 μg/g),注射部位为第2腹节肌肉,注射24 h后,各组中随机取3尾虾,检测干扰后PcABCG5基因在鳃中的表达变化,选出干扰效果最好的靶点,并开展正式实验。实验设置阴性对照组和干扰实验组,每个实验组3个平行,每个平行20尾中国对虾。盐度为20,碳酸盐碱度为10,pH为7.84,实验开始后于0、24和48 h取鳃组织并统计胁迫死亡率。
2 结果与分析 2.1 PcABCG5基因序列分析通过RACE技术获得中国对虾PcABCG5基因(GenBank登录号OQ318160),其cDNA全长为2 718 bp,开放阅读框为1 923 bp,共编码640个氨基酸,预测理论等电点为9.12,蛋白分子量为71.39 kDa,预测基因位于内质网。结构域分析显示,PcABCG5包含1个NBD保守结构域和1个TMD结构域(图 1)。利用TMHMM 2.0预测跨膜结构域,发现PcABCG5存在5个显著的跨膜区,是一个多次跨膜蛋白,总平均亲水性为0.173,不含信号肽。PcABCG5二级结构经SOPMA软件分析发现,α-螺旋占比51.09%,延伸链占比为12.97%,β-转角占比为4.22%,无规卷曲占比为31.72%。

|
图 1 PcABCG5基因cDNA序列和预测的氨基酸序列 Fig.1 cDNA sequence and predicted amino acid sequence of PcABCG5 gene 黑色方框内ATG为起始密码子,TGA为终止密码;阴影部分为NBD,虚线框为TMD。 The initiation codon (ATG) and the stop codon(TAA) were boxed. The NBD was in grey shadow. The TMD was boxed with dotted lines. |
多序列比较发现,中国对虾PcABCG5蛋白与斑节对虾(Penaeus monodon) ABCG5蛋白的相似性最高,达98.91%,其次为日本对虾(Penaeus japonicus),约为97.97%,凡纳对虾(Penaeus vannamei)和克氏原螯虾(Procambarus clarkii)分别为95.34%和87.97%。使用软件MEGA11.0构建的Neighbor-Joining进化树显示(图 2),中国对虾ABC转运蛋白与凡纳对虾和斑节对虾的ABC转运蛋白亲缘关系最近,与中华绒螯蟹(Eriocheir sinensis)和三疣梭子蟹(Portunus trituberculatus)的蛋白亲缘关系较远。
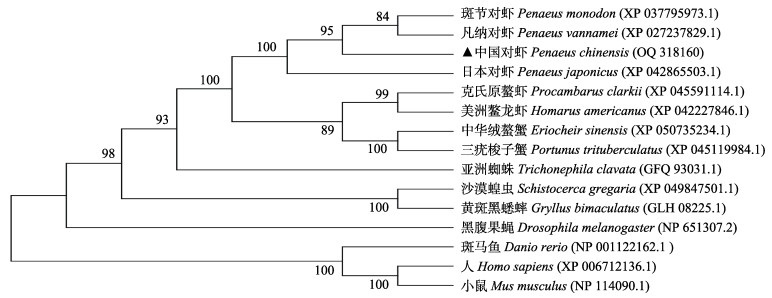
|
图 2 中国对虾PcABCG5的系统进化树 Fig.2 NJ tree based on PcABCG5 gene amino acid sequences of P. chinensis |
采用qPCR方法分析了PcABCG5基因在中国对虾不同组织中的表达水平。结果显示,PcABCG5基因在对虾的鳃、血淋巴细胞、心脏、肌肉、肝胰腺和眼柄中均有表达,其中,在鳃中的表达量明显高于其他组织(P < 0.05),其次是血淋巴细胞中,心脏、肌肉和肝胰腺中的表达水平相近,眼柄组织中的表达量最低(P < 0.05)(图 3)。后续实验选择中国对虾鳃组织进行胁迫后基因差异表达分析。
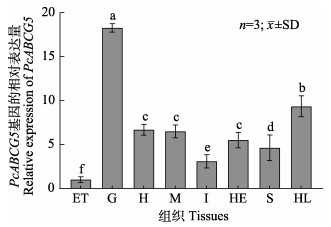
|
图 3 中国对虾PcABCG5的组织特异性表达分析 Fig.3 The expression level of PcABCG5 in different tissues of P. chinensis ET:眼柄;G:鳃;H:心脏;M:肌肉;I:肠;HE:肝胰腺;S:胃;HL:血淋巴。柱上不同小写字母代表表示差异显著(P < 0.05)。图 5同。 ET: Eyestalk; G: Gill; H: Heart; M: Muscle; I: Intestines; HE: Hepatopancreas; S: Stomach; HL: Hemolymph. Different lowercase letters indicate significant difference (P < 0.05). The same in Fig.5. |
盐碱胁迫下,PcABCG5基因在中国对虾鳃组织中的表达量呈先上升后下降的趋势。胁迫后6 h,PcABCG5基因表达量显著提升,为对照组的3.12倍(图 4)。随着胁迫处理时间的延长,基因的表达量呈逐渐下降趋势,当胁迫时间达96 h时,基因的表达量达最低,但仍比对照组有所增加。
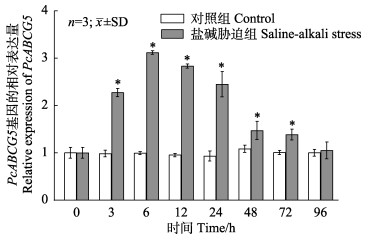
|
图 4 盐碱胁迫下PcABCG5基因在鳃中的表达 Fig.4 The expression level of the PcABCG5 gene in gills after saline-alkali stress *:实验组与对照组差异显著(P < 0.05)。图 6同。 *: Significant difference between control and treatment (P < 0.05). The same in Fig.6. |
与对照组相比,注射不同位点干扰试剂24 h时,PcABCG5基因在鳃中的表达量均显著降低(P < 0.05)。注射ABCG5-1后24 h,目的基因表达量降低为对照组的0.171倍;注射ABCG5-2和ABCG5-3后表达量分别降低为对照组的0.417倍和0.630倍。ABCG5-1干扰效果最好,干扰效果达到82.9% (图 5),选择干扰靶点ABCG5-1进行后续实验。
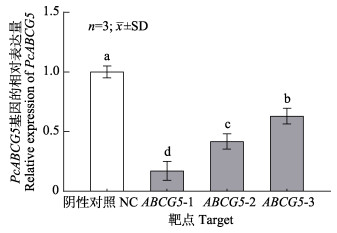
|
图 5 注射ABCG5-1、ABCG5-2和ABCG5-3 24 h后PcABCG5基因在鳃中的表达 Fig.5 The expression level of PcABCG5 gene in gills after 24 h injection of ABCG5-1, ABCG5-2 and ABCG5-3 |
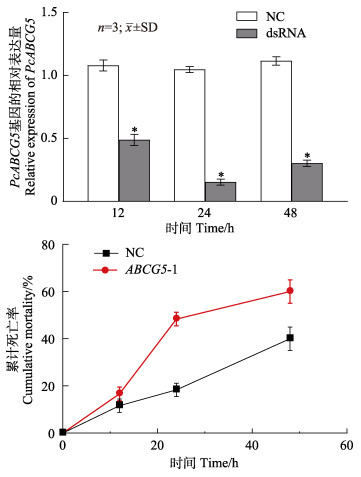
正式实验中,中国对虾注射ABCG5基因dsRNA干扰试剂ABCG5-1,并同时进行盐碱胁迫,干扰PcABCG5后12、24和48 h取鳃组织进行定量检测并统计其死亡率。结果显示,24 h时干扰效果最好,干扰后表达量为对照组的15% (P < 0.05)(图 6A)。干扰组在0~48 h的累计死亡率为60%,比对照组死亡率高40% (P < 0.05),其中,0~12 h干扰组死亡率为16.67%,对照组为11.67%;12~24 h干扰组死亡率为48.33%,对照组为18.33% (图 6B)。
|
图 6 PcABCG5基因干扰后的表达分析(A)和中国对虾死亡率(B) Fig.6 Expression analysis after PcABCG5 gene interference (A) and mortality of P. chinensis (B) |
复杂的盐碱水水质会影响生物体的代谢和基本的生理功能,从分子层面鉴定差异表达基因并分析其蛋白功能有助于解释中国对虾抗逆机制。许多研究揭示,ABCG成员参与脂质、激素、重金属和次生代谢物等运输来应对各种环境胁迫(干旱、农药、重金属、氨氮、pH和盐碱等) (Stukkens et al, 2005)。ABC基因家族在植物应对各类胁迫中的作用已有大量研究。比如在感染真菌后,植物ABCG转运蛋白参与DNA损伤修复、蛋白质延伸和代谢进行解毒(Yan et al, 2021);在面临干旱与高盐胁迫时,角质层基质会交联形成具有高保水能力的角质层结构来改变水扩散途径,以减少细胞失水(Chen et al, 2018)。近年来,该亚家族成员及其参与的通路在海洋生物应对环境胁迫中的机制被广泛探究。如在农药胁迫下,斑马鱼(Danio rerio)通过上调ABCG5减少有机氯在体内的积累,可显著提高成活率(Zhang et al, 2020);在重金属污染时,凡纳对虾ABCG转运蛋白可能参与排毒阶段代谢产物的转运(Zhou et al, 2009);低盐可诱导克氏原螯虾产生神经内分泌因子,引发鳃细胞膜上的Na+-K+-ATPase从外界转运Na+进入体内等渗透压调节过程以适应环境变化(金彩霞等, 2008);pH胁迫导致脊尾白虾(Exopalaemon carincauda)机体产生质子、羟基和有毒底物,EcABCG利用ATP水解的能量排泄氧化应激产物,降低对细胞的毒性作用(Zhai et al, 2017)。本研究发现,盐碱胁迫诱导中国对虾PcABCG5显著上调,且鳃中表达量较其他组织高且差异显著(图 3和图 4)。实验结果中的PcABCG5高表达,可能是由于中国对虾在接触高盐碱水环境后,首先通过鳃中PcABCG5介导的物质转运启动渗透压调节以应对渗透压失衡。同时,PcABCG5的干扰实验发现,该基因的敲降会提高中国对虾在盐碱胁迫下的死亡率(图 6A、B),验证了其在应对盐碱胁迫中的重要作用。研究发现,除ABCG2外,ABCG亚家族的其他成员均参与脂质转运(Bienert et al, 2014),且在哺乳动物中已有证据证明,ABCG5基因可以与ABCG8形成二聚体,通过水解ATP产生能量来转移脂质,并通过调节膜脂质的不对称性来调节细胞膜的通透性(López-Marqués et al, 2015),从而影响内环境平衡和物质的转运方式。因此,推测中国对虾PcABCG5转运蛋白作为离子转运上游调节分子,可能通过水解ATP供能及改变膜脂通透性加快物质转运,维持渗透压平衡。
综上所述,本研究利用生物信息学和实时定量方法对中国对虾PcABCG5理化性质以及盐碱胁迫下的表达模式进行了分析,该结论可为解析中国对虾应对盐碱胁迫的机制提供依据。
BIENERT M D, BAIJOT A, BOUTRY M. ABCG transporters and their role in the biotic stress response. Plant ABC Transporters, 2014, 22: 137-162 |
CHEN N, SONG B, TANG S, et al. Overexpression of the ABC transporter gene TsABCG11 increases cuticle lipids and abiotic stress tolerance in Arabidopsis. Plant Biotechnology Reports, 2018, 12: 303-313 DOI:10.1007/s11816-018-0495-6 |
CHEN X Z, LAI Q F, YAO Z L, et al. Green culture technology model of saline-alkali water. China Fisheries, 2020(9): 61-63 [陈学洲, 来琦芳, 么宗利, 等. 盐碱水绿色养殖技术模式. 中国水产, 2020(9): 61-63] |
FANG W H, WANG H, LAI Q F. Toxicity of carbonate-alkalinity and pH to larval Penaeus chinensis. Journal of Fishery Sciences of China, 2000, 7(4): 78-81 [房文红, 王慧, 来琦芳. 碳酸盐碱度、pH对中国对虾幼虾的致毒效应. 中国水产科学, 2000, 7(4): 78-81] |
HIGGINS C F. ABC transporters: From microorganisms to man. Annual Review of Cell Biology, 1992, 8(1): 67-113 DOI:10.1146/annurev.cb.08.110192.000435 |
JIN C X, PAN L Q. Preliminary studies on physiological adaptive mechanism of Procambarus clarkiiosm regulation under different ambient salinities. Acta Hydrobiologica Sinica, 2008, 32(6): 894-899 [金彩霞, 潘鲁青. 盐度变化对克氏原螯虾渗透调节影响机制的初步研究. 水生生物学报, 2008, 32(6): 894-899] |
LI Z X, WANG J J, HE Y Y, et al. Comprehensive identification and profiling of Chinese shrimp (Fenneropenaeus chinensis) microRNAs in response to high pH stress using Hiseq2000 sequencing. Aquaculture Research, 2019, 50(11): 3154-3162 DOI:10.1111/are.14269 |
LIU W, SUN X, SUN W, et al. Genome-wide analyses of ATP-binding cassette (ABC) transporter gene family and its expression profile related to deltamethrin tolerance in non-biting midge Propsilocerus akamusi. Aquatic Toxicology, 2021, 239: 105940 DOI:10.1016/j.aquatox.2021.105940 |
LIU Y Q, ZHAO Y F. Structure and mechanism of ABC transporter. Chinese Bulletin of Life Sciences, 2017, 29(3): 223-229 [刘艳青, 赵永芳. ABC转运蛋白结构与转运机制的研究进展. 生命科学, 2017, 29(3): 223-229] |
LÓPEZ-MARQUÉS R L, POULSEN L R, BAILLY A, et al. Structure and mechanism of ATP-dependent phospholipid transporters. Biochimica et Biophysica Acta (BBA)-General Subjects, 2015, 1850(3): 461-475 DOI:10.1016/j.bbagen.2014.04.008 |
PRASAD R, GOFFEAU A. Yeast ATP-binding cassette transporters conferring multidrug resistance. Annual Review of Microbiology, 2012, 66: 39-63 DOI:10.1146/annurev-micro-092611-150111 |
REES D C, JOHNSON E, LEWINSON O. ABC transporters: The power to change. Nature Reviews Molecular Cell Biology, 2009, 10(3): 218-227 DOI:10.1038/nrm2646 |
SÁNCHEZ-FERNÁNDEZ R, DAVIES T G, COLEMAN J O, et al. The Arabidopsis thaliana ABC protein superfamily, a complete inventory. Journal of Biological Chemistry, 2001, 276(32): 30231-30244 |
STUKKENS Y, BULTREYS A, GREC S, et al. NpPDR1, a pleiotropic drug resistance-type ATP-binding cassette transporter from Nicotiana plumbaginifolia, plays a major role in plant pathogen defense. Plant Physiology, 2005, 139: 341-352 |
VERRIER P J, BIRD D, BURLA B, et al. Plant ABC proteins-a unified nomenclature and updated inventory. Trends in Plant Science, 2008, 13(4): 151-159 |
WANG H, LAI Q F, FANG W H. Effects of saline-alkali water resources on fishery development in Yundong area of Cangzhou. Hebei Fishery, 2003(5): 16-18 [王慧, 来琦芳, 房文红. 沧州运东地区盐碱水资源对开展渔业的影响. 河北渔业, 2003(5): 16-18] |
WANG H, FANG W H, LAI Q F. Effects of concentrations of Ca2+ and Mg2+ on survival and growth of Penaeus chinensis. Journal of Fishery Sciences of China, 2000, 7(1): 82-86 [王慧, 房文红, 来琦芳. 水环境中Ca2+、Mg2+对中国对虾生存及生长的影响. 中国水产科学, 2000, 7(1): 82-86] |
WANG W. Effects of salinity on morphologyical structure and osmoregulation function of gill mitochondrion-rich cells of Epinephelus coioides juveniles. Master´s Thesis of Shanghai Ocean University, 2016 [王雯. 盐度对斜带石斑鱼(Epinephelus coioides)幼鱼鳃线粒体丰富细胞形态结构和渗透调节功能的影响. 上海海洋大学硕士研究生学位论文, 2016]
|
WANG X Z, SUN W M, MA Y F, et al. Research progress of ABC transporters in Arabidopsis thaliana. Plant Physiology Journal, 2017, 53(2): 133-144 [王晓珠, 孙万梅, 马义峰, 等. 拟南芥ABC转运蛋白研究进展. 植物生理学报, 2017, 53(2): 133-144] |
WEI W, HE Y Y, LI Z X, et al. Cloning of ATG5 gene of Fenneropenaeus chinensis and expression analysis under pH and carbonate alkalinity stress. Progress in Fishery Sciences, 2022, 43(3): 84-94 [魏威, 何玉英, 李朝霞, 等. 中国对虾ATG5基因的克隆及其在pH、碳酸盐碱度胁迫下的表达分析. 渔业科学进展, 2022, 43(3): 84-94] |
WILKIE M P, WOOD C M. The adaptations of fish to extremely alkaline environments. Comparative Biochemistry and Physiology Part B, Comparative Biochemistry, 1996, 113(4): 665-673 |
YAN L, ZHANG J, CHEN H, et al. Genome-wide analysis of ATP-binding cassette transporter provides insight to genes related to bioactive metabolite transportation in Salvia miltiorrhiza. BMC Genomics, 2021, 22(1): 315 |
ZHAI Q Q, LI J, CHANG Z Q. cDNA cloning, characterization and expression analysis of ATP-binding cassette transmembrane transporter in Exopalaemon carinicauda. Aquaculture Research, 2017, 48: 4143-4154 |
ZHANG L, FANG Y, LU X, et al. Transcriptional response of zebrafish larvae exposed to lindane reveals two detoxification genes of ABC transporter family (abcg5 and abcg8). Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2020, 232: 108755 |
ZHANG R B, LUO K, WANG H, et al. Effects of salinity on growth and survival in strain "Huanghai No. 2" juveniles of Chinese shrimp Fenneropenaeus chinensis. Journal of Dalian Ocean University, 2013, 28(4): 347-349 [张瑞标, 罗坤, 王浩, 等. 盐度对中国对虾"黄海2号"幼虾生长与存活的影响. 大连海洋大学学报, 2013, 28(4): 347-349] |
ZHOU J, HE W, WANG W, et al. Molecular cloning and characterization of an ATP-binding cassette (ABC) transmembrane transporter from the white shrimp Litopenaeus vannamei. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2009, 150(4): 450-458 |
ZHOU Y J. Effects of saline-alkali stress on growth, reproduction and immune function of Fenneropenaeus chinensis. Master´s Thesis of Dalian Ocean University, 2023 [周玉洁. 盐碱胁迫对中国对虾生长、繁殖及免疫功能的影响. 大连海洋大学硕士研究生学位论文, 2023]
|



