 基础生物学特征研究
基础生物学特征研究
2. 上海海洋大学海洋科学学院 上海 201306
 (Sphyraena guachancho)是塞拉利昂近海重要的经济鱼种,为全面了解其基础生物学特征,本研究根据2019—2021年共6个科学调查航次(9月、10月、12月、1月、4月和5月)采样的2 135尾黄条
(Sphyraena guachancho)是塞拉利昂近海重要的经济鱼种,为全面了解其基础生物学特征,本研究根据2019—2021年共6个科学调查航次(9月、10月、12月、1月、4月和5月)采样的2 135尾黄条 样品,对其体长和体质量组成及关系、性比、性腺成熟度、初次性成熟体长、摄食等级和肥满度等基础生物学特征进行了研究。结果显示,黄条
样品,对其体长和体质量组成及关系、性比、性腺成熟度、初次性成熟体长、摄食等级和肥满度等基础生物学特征进行了研究。结果显示,黄条 体长范围为50~845 mm,优势组为175~345 mm (占比74.52%);体质量范围为0.9~4 000.8 g,优势组为25~225 g (占比71.33%)。体长–体质量关系式为W=3.339×10–5L2.758,呈负向异速生长。雌雄比例为0.56∶1,雄性明显多于雌性。性腺成熟度以Ⅱ期和Ⅲ期为主,Ⅴ期和Ⅵ期个体占比均较少。雌雄初次性成熟体长分别为(269.982±2.340) mm、(259.846±3.397) mm。摄食等级以0级为主,随体长增加,空胃比例基本呈逐渐增大的趋势,繁殖个体的摄食强度较低。肥满度范围为0.59~1.25,随体长增加,肥满度基本呈先增加后降低的趋势。统计分析结果显示,旱雨季体长、体质量分布呈现明显差异,且在旱季有较多补充群体组成,不同月份黄条
体长范围为50~845 mm,优势组为175~345 mm (占比74.52%);体质量范围为0.9~4 000.8 g,优势组为25~225 g (占比71.33%)。体长–体质量关系式为W=3.339×10–5L2.758,呈负向异速生长。雌雄比例为0.56∶1,雄性明显多于雌性。性腺成熟度以Ⅱ期和Ⅲ期为主,Ⅴ期和Ⅵ期个体占比均较少。雌雄初次性成熟体长分别为(269.982±2.340) mm、(259.846±3.397) mm。摄食等级以0级为主,随体长增加,空胃比例基本呈逐渐增大的趋势,繁殖个体的摄食强度较低。肥满度范围为0.59~1.25,随体长增加,肥满度基本呈先增加后降低的趋势。统计分析结果显示,旱雨季体长、体质量分布呈现明显差异,且在旱季有较多补充群体组成,不同月份黄条 体长、体质量分布和体长–体质量关系具有极显著性差异(P < 0.01),体长极显著影响性腺成熟度、摄食强度(P < 0.01),不同月份性腺成熟度和摄食强度差异性不显著(P > 0.05)。本研究丰富了西非塞拉利昂沿岸海域黄条
体长、体质量分布和体长–体质量关系具有极显著性差异(P < 0.01),体长极显著影响性腺成熟度、摄食强度(P < 0.01),不同月份性腺成熟度和摄食强度差异性不显著(P > 0.05)。本研究丰富了西非塞拉利昂沿岸海域黄条 生物学特征资料,可为该海域黄条
生物学特征资料,可为该海域黄条 资源评估、开发利用和资源管理提供科学支撑。
资源评估、开发利用和资源管理提供科学支撑。 塞拉利昂 生物学特征 初次性成熟体长
塞拉利昂 生物学特征 初次性成熟体长 2. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China
塞拉利昂位于非洲西海岸,濒临中东大西洋,地势东高西低,河流众多。气候分旱雨两季,5—10月为雨季,11—4月为旱季,特点为高温、高湿度且降雨较多,全年天气较平稳,造就了较适宜的大陆架水文条件。其饵料资源丰富,是多种经济鱼、虾类索饵、栖息、产卵、洄游的良好场所,是我国最早开辟的西非渔场之一(柴秀芳等, 2006)。作为西非优良的渔场之一,其丰富的渔业资源为当地提供了超过50%的动物蛋白摄入量(Agnew et al, 2010),为当地人们的食物安全和保障做出了较大贡献。从1985年开始,我国与塞拉利昂开展渔业合作,不仅丰富了两国水产品市场供给,加深了两国人民的友好往来,也为促进塞国人员就业、人民生活富裕和经济社会发展发挥了重要作用。近年来,通过合作共建“一带一路”倡议,中塞之间的贸易关系更加紧密,同时,为双方渔业发展提供了新平台,深化了两国之间的经贸关系。
黄条



目前,有学者对黄条


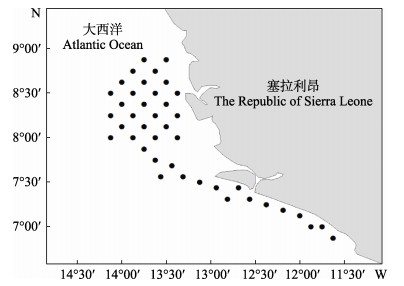
数据来源于塞拉利昂近海底层渔业资源调查,调查海域范围为6°52′~8°53′N、11°37′~13°45′W,调查站点如图 1所示。共开展6个航次现场调查,调查时间分别为2019年9月和10月,2020年12月,2021年1、4和5月,覆盖了当地主要特征季节(雨季、旱季和季节转换期)。调查网具为单船有袖单囊拖网,网具主尺度为144.00 m× 90.13 m,下纲为50.04 m,网囊网目为20 mm。每个站位有效拖网次数不少于1次,有效拖曳时间不少于1 h (下纲贴底至曳纲绞收之间的时间间隔),拖曳速度为3~3.5 kn。
|
图 1 调查站点 Fig.1 The survey stations |
参照《海洋调查规范》进行黄条
|
|
表 1 黄条黄条 |
用频率分布来分析不同月份航次体长、体质量分布状况,体长频率组距为10 mm,体质量组距为50.0 g。采用非参数检验方法对不同月份航次体长、体质量分布进行分析。
1.2.2 体长–体质量关系本研究利用幂函数来拟合黄条
| $ W = a{L^b} $ | (1) |
式中,W为体重(g),L为体长(mm);a、b为常数,分别代表生长条件因子和异速生长因子。b值通常在2.5~4.0之间,如果鱼类等速生长,则b=3或接近3;b > 3和b < 3分别代表正异速生长和负异速生长(Erguden et al, 2009; Radhi et al, 2018)。同时,利用偏相关分析检验性别对体长–体重关系的影响。
1.2.3 性别比例、性腺成熟度和初次性成熟体长应用雌雄频率分布和性腺成熟度频率分布数据,分析不同月份航次、体长组之间的性别比例和性腺成熟度差异。使用Logisitic方程估算黄条
| $ {P_i} = \frac{1}{{1 + \exp [ - c({L_i} - {L_{50}})]}} $ | (2) |
式中,Pi为黄条
统计分析各月份航次中黄条

| $ K = \frac{{W \times 100}}{{{L^3}}} $ | (3) |
式中,K为肥满度系数,W为体质量(g),L为体长(cm)。采用偏相关分析验证体长与肥满度的差异显著性。
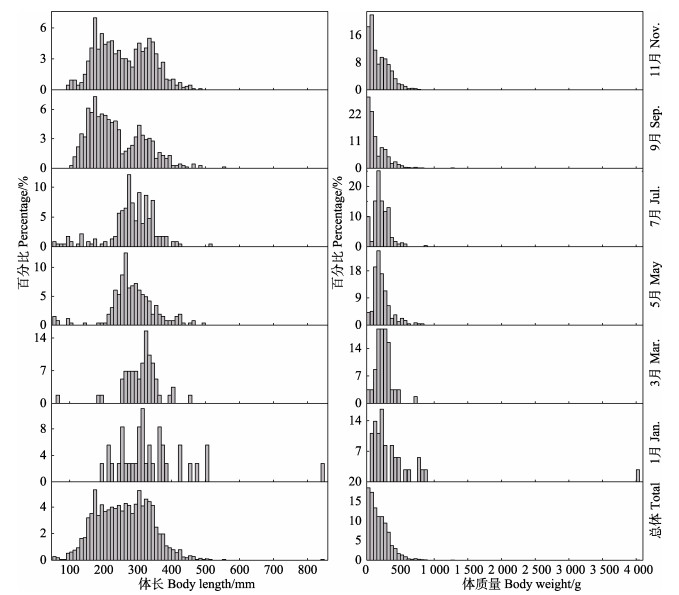
2 结果 2.1 体长、体质量组成本研究共测定2 135尾黄条
体质量范围为0.9~4 000.8 g,平均体质量为(187.11±3.64) g。优势体质量组25~225 g,占比71.33%;10月、12月和1月航次体质量组占比先增加后降低,其他月份均逐渐下降(图 2)。
|
图 2 黄条黄条 |
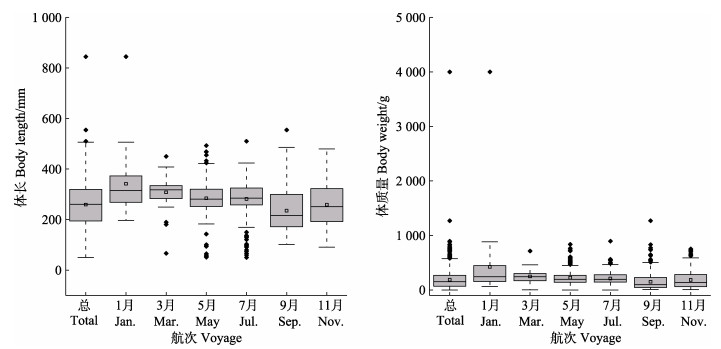
不同月份的体长和体质量分布有一定差异性,体质量差异性强于体长。9月的体长和体质量分布差异性均最强;平均体长为(259.50±1.73) mm,平均体质量为(187.11±3.64) g;体长和体质量均值的最高值和最低值发生在相同月,分别为9月[(341.78±19.48) mm]和4月[(235.04±3.02) mm] (图 3)。
|
图 3 黄条黄条 |
K-S检验显示,渐进显著性P < 0.01,体长、体质量不符合正态分布,因此,使用非参数检验方法检验性别、月份和季节是否显著影响黄条
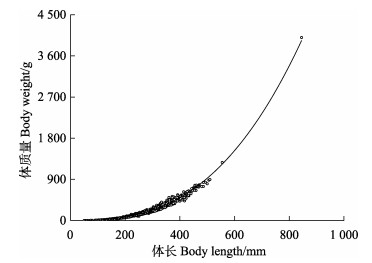
采用幂指数回归对黄条
|
图 4 黄条黄条 |
对不同月份的黄条


|
|
表 2 黄条黄条 |
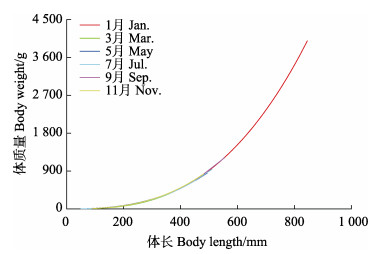
|
图 5 黄条黄条 |
本研究共鉴定1 684尾黄条
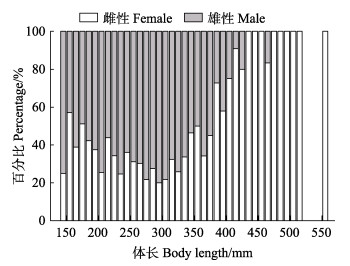
|
图 6 黄条黄条 |
总体上,性腺成熟度以Ⅱ期和Ⅲ期为主,Ⅴ期和Ⅵ期个体均较少;除1月航次中性腺成熟度以Ⅲ期占比最高外,其他月份航次的成熟度占比最高值均出现在Ⅱ期(图 7)。随体长增大,达到性成熟的个体(Ⅲ、Ⅳ、Ⅴ和Ⅵ期)随之增加,当体长达到170 mm时,开始出现性成熟个体(Ⅲ期个体出现)(图 8)。偏相关分析显示,体长显著影响性腺成熟度(P < 0.01),在体长一定情况下,月份与性腺成熟度不存在显著线性相关关系(P > 0.05)。
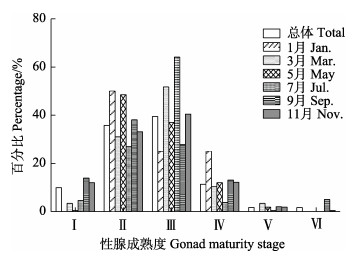
|
图 7 黄条黄条 |
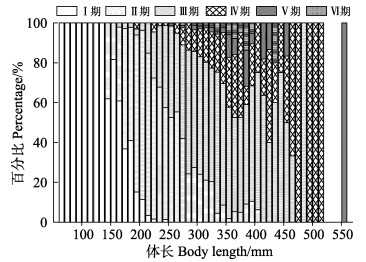
|
图 8 黄条黄条 |
根据不同体长黄条


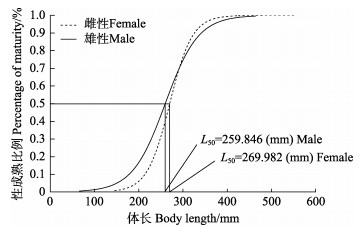
|
图 9 黄条黄条 |
| $ \begin{aligned} & P_i=\frac{1}{1+\exp \left[-0.039\left(L_i-269.982\right)\right]}\left(R^2=0.979, P<0.05\right), \\ & P_i=\frac{1}{1+\exp \left[-0.027\left(L_i-259.846\right)\right]}\left(R^2=0.962, P<0.05\right) \end{aligned} $ |
本研究共鉴别1 712尾黄条

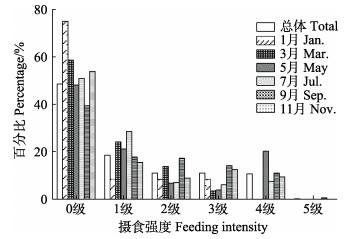
|
图 10 黄条黄条 |
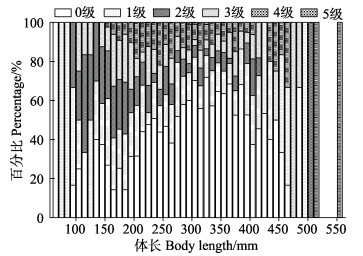
|
图 11 黄条黄条 |
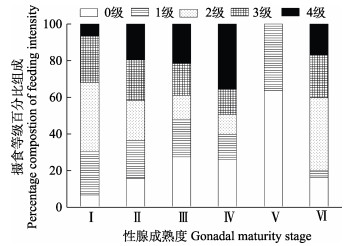
|
图 12 黄条黄条 |
本研究中,肥满度范围为0.59~1.25,随体长增加,基本上呈先增加后降低的趋势;各月份肥满度除9月和10月航次外,随体长的变化趋势基本与总体变化趋势一致,9月和10月航次捕获样品数量较少,肥满度波动幅度较大,但基本呈波动降低的趋势(图 13)。不同月份肥满度具有一定差异性,总体上肥满度均值为0.86±0.02;各月份平均肥满度最高值和最低值分别出现在10月(0.78±0.07)和1月(0.89±0.09)(图 14)。偏相关分析显示,体长显著影响肥满度水平(P < 0.05),月份对其影响不显著(P > 0.05)。
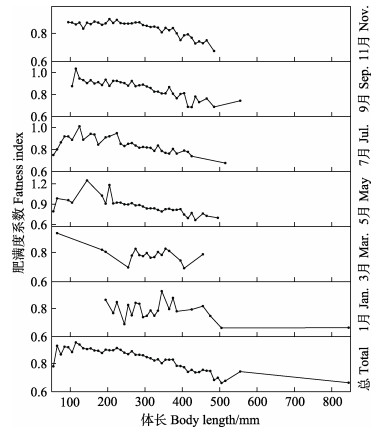
|
图 13 黄条黄条 |
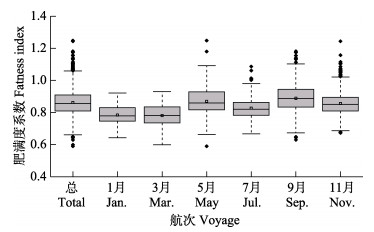
|
图 14 黄条黄条 |
体长–体质量关系是研究鱼类生物学特征的重要内容,探讨体长–体质量的关系以及相关系数,对于鱼类生物学基础研究、鱼类生长的表达和发展渔业生产具有重要意义。另外,对比不同地区同一种鱼的生长状况,还可以用来侧面分析不同地区营养状况,如食物、温度以及种内和种间关系的差异(Erguden et al, 2009)。一般用W=aLb来表示鱼类体长–体质量关系,其中,b为异速生长因子,通常在2.5~4.0之间,如果鱼的体长、体高和体宽为等速生长,比重不变,则b=3,或接近于3,若为异速生长,b < 3或b > 3 (Froese et al, 2006)。
体长–体质量关系受多种因素影响,诸如季节、种群、环境条件的年差异等(Sánchez et al, 2011)。本研究中,黄条




|
|
表 3 不同季节黄条黄条 |
性比是用来描述鱼群内雌雄组成状况,能够表现出种群内性别优势特点,了解鱼类繁殖情况及种群评估的重要信息(Agbugui, 2013; Morgan, 2008)。在渔业资源评估中,性比往往被用来衡量鱼类种群群体的繁殖力,估算繁殖群体生物量(李建生等, 2015)。本次调查中,塞拉利昂黄条


Akadjecm等(2019)对西非科特迪瓦沿海黄条


鱼类摄食生态中,摄食强度随体长的增加存在多种关系:正相关、负相关或无显著差异。黑尾
基于体长相同的情况下,体质量与个体健康状况呈正相关的假设,肥满度是表征鱼类肥瘦程度和健康状况的指标,可用来分析鱼类生长速度、成活率和总体增重程度,同时,可用来间接评价生活环境状况(Jones et al, 1999)。本研究中黄条
AGBUGUI M O. The sex ratio, gonadosomatic index, stages of gonadal development and fecundity of the grunt, Pomadasys jubelini (Cuvier, 1830) in the New Calabar-Bonny River. Report and Opinion, 2013, 5(11): 31-37 |
AGNEW D J, WALMSLEY S F, LEOTTE F, et al. MRAG: Estimation of the cost of illegal fishing in West Africa. World Bank West Africa Regional Fisheries Project ZO0906–IUU West Africa, 2010
|
AKADJECM A, AMON Y N, N'DA K, et al. Reproductive biology of barracuda, Sphyraena guachancho, on Ivorian coasts (Eastern Central Atlantic). Vie Milieu, 2019, 69(2/3): 177-185 |
CHAI X F, SHI J G, TANG Z M, et al. The current situation and development suggestions of marine fisheries in Sierra Leone. Modern Fishery Information, 2006, 21(4): 21–23, 36 [柴秀芳, 石建高, 汤振明. 塞拉利昂的海洋渔业现状及发展建议. 现代渔业信息, 2006, 21(4): 21–23, 36] |
CROZIER W W. Observation on the food and feeding of the anglerfish, Lophius piscatorius, in the northern Irish Sea. Journal of Fish Biology, 1985, 27: 655-665 DOI:10.1111/j.1095-8649.1985.tb03210.x |
DE GIOSA M, CZERNIEJEWSKI P, RYBCZYK A. Seasonal changes in condition factor and weight-length relationship of invasive Carassius gibelio (Bloch, 1782) from Leszczynskie Lakeland, Poland. Advances in Zoology, 2014 |
ERGUDEN D, TURAN C, GURLEK M. Weight-length relationships for 20 lessepsian fish species caught by bottom trawl on the coast of Iskenderun Bay (Ne Mediterranean Sea, Turkey). Journal of Applied Ichthyolo, 2009, 25(1): 133-135 DOI:10.1111/j.1439-0426.2008.01198.x |
FENG, C L HUANG H L, QU T C, et al. Temporal and spatial patterns of demersal fish assemblages in the coastal water of Sierra Leone. Regional Studies in Marine Science, 2022, 56: 102674 DOI:10.1016/j.rsma.2022.102674 |
FROESE R. Cube law, condition factor and length-weight relationships history, meta-analysis and recommendations. Journal of Applied Ichthyology, 2006, 22: 241-253 DOI:10.1111/j.1439-0426.2006.00805.x |
GOMIERO L M, BRAGA F M S. The condition factor of fishes from two river basins in Sao Paulo State, Southeast of Brazil. Acta Scientiarum, 2005, 27: 73-78 |
HOVDE S C, ALBERT O T, NILSSEN E M. Spational, seasonal and ontogenetic variation in diet of Northeast Arctic Greenland halibut (Reinhardtius hippoglossoides). Journal of Marine Science, 2002, 59(2): 421-437 |
HOVEL R A, CARLSON S M, QUINN T P. Climate change alters the reproductive phenology and investment of a lacustrine fish, the three spine stickleback. Global Change Biology, 2017, 23(6): 2308-2320 DOI:10.1111/gcb.13531 |
JONES R E, PETRELL R J, PAULY D. Using modified length-weight relationships to assess the condition of fish. Aquacultural Engineering, 1999, 20(4): 261-276 DOI:10.1016/S0144-8609(99)00020-5 |
LI J S, YAN L P, HU F, et al. The reproductive biology of chub mackerel (Scomber japonicus) in Wen-Tai fishing ground. Journal of Fishery Sciences of China, 2015, 22(1): 99-105 [李建生, 严利平, 胡芬, 等. 温台渔场日本鲭的繁殖生物学特征. 中国水产科学, 2015, 22(1): 99-105] |
LIMA J S, DA COSTA I D, ZALMON I R. Length-weight relationship of fish species captured around an artificial offshore reef (Northern Rio de Janeiro, Brazil). Applied Ichthyology, 2021, 37(2): 337-341 DOI:10.1111/jai.14109 |
LUKOSCHEK V, MCCORMICK M I. Ontogeny of diet changes in a tropical benthic carnivorous fish, Parupeneus barberinus (Mullidae): Relationship between foraging behavior, habitat use, jaw size, and prey selection. Marine Biology, 2001, 138(6): 1099-1113 DOI:10.1007/s002270000530 |
MORATO T, SANTOS R S, ANDRADE J P. Feeding habits, seasonal and ontogenetic diet shift of black comber, Serranus atricauda (Pisces: Serranidae), from the Azorees, north- eastern Atlantic. Fisheries Research, 2000, 49(1): 51-59 DOI:10.1016/S0165-7836(00)00189-2 |
MORGAN M J. Integrating reproductive biology into scientific advice for fisheries management. Journal of Northwest Atlantic Fishery Science, 2008, 41: 37-51 DOI:10.2960/J.v41.m615 |
QIU S Y, YE M Z. Study on the reproductive biology of Scomberomorus niphonius in the Yellow Sea and Bohai Sea. Oceanologia et Limnologia Sinica, 1996, 27(5): 463–470, T001 [邱盛尧, 叶懋中. 黄渤海蓝点马鲛繁殖生物学的研究. 海洋与湖沼, 1996, 27(5): 463–470, T001] |
RADHI A M, FAZLINDA M N, AMAL M, et al. A review of length-weight relationships of freshwater fishes in Malaysia. Transylvanian Review of Systematical and Ecological Research, 2018, 20(1): 55-68 DOI:10.1515/trser-2018-0005 |
SÁNCHEZ C B, LÓPEZ J F, ESCORCIA H B. Análisis de la relación peso-longitud, alimentación y maduración gonádica de Sphyraena guachancho Cuvier, 1829 (Sphyraenidae) en Playa Barrancas, Municipio de Alvarado, Veracruz. Revista de Zoología, 2011(22): 23-32 |
SCHRECK C B. Stress and fish reproduction: The roles of allostasis and hormesis. General and Comparative Endocrinology, 2010, 165(3): 549-556 DOI:10.1016/j.ygcen.2009.07.004 |
VELDE T D, GRIFFITHS S P, FRY G C. Reproductive biology of the commercially and recreationally important cobia Rachycentron canadum in northeastern Australia. Fisheries Science, 2010, 76(1): 33-43 DOI:10.1007/s12562-009-0177-y |
VILA Y, SILVA L, TORRES M A, et al. Fishery, distribution pattern and biological aspects of the common European squid Loligo vulgaris in the Gulf of Cadiz. Fisheries Research, 2010, 106(2): 222-228 DOI:10.1016/j.fishres.2010.06.007 |
ZHANG B. Diet composition and ontogenetic variation in feeding habits of Cleithenes herzensteini in central Yellow Sea. Chinese Journal of Applied Ecology, 2007(8): 1849-1854 [张波. 黄海中部高眼鲽的摄食及随体长的变化. 应用生态学报, 2007(8): 1849-1854] |
ZHANG X J, CHENG J H, SHEN W, et al. Reproductive biology of yellow goosefish Lophius litulon. Journal of Fishery Sciences of China, 2011, 18(2): 290-298 [张学健, 程家骅, 沈伟, 等. 黄  繁殖生物学研究. 中国水产科学, 2011, 18(2): 290-298] 繁殖生物学研究. 中国水产科学, 2011, 18(2): 290-298] |



