2. 青岛市海水鱼类种子工程与生物技术重点实验室 中国水产科学研究院黄海水产研究所 山东 青岛 266071;
3. 烟台开发区天源水产有限公司山东 烟台 264001;
4. 乳山龙汇海产养殖有限公司 山东 威海 264511
2. Qingdao Key Laboratory of Marine Fish Seed Engineering and Biotechnology, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Yantai Development Zone Tianyuan Aquatic Products Co., Ltd., Yantai 264001, China;
4. Rushan Longhui seafood breeding Co., LTD, Weihai 264511, China
鱼类生物能量学研究主要基于能量收支方程,探究食物中的能量和营养物质在鱼体内的分配流程对鱼体生长和繁殖的影响(Warren et al, 1967; Dumas et al, 2010)。通过预测鱼体能量收支中摄食、生长、排粪、排泄和代谢等过程的能量分配以及不同生理生态因子对能量收支各组分的影响,研究结果可为鱼类饵料选择、投饲管理、提高饲料效率、养殖条件优化和减少渔业污染提供数据基础与理论依据(崔奕波, 1989; Sun et al, 2014; Khairnar et al, 2015; 史东杰等, 2022)。
温度对鱼类生长和能量代谢的影响已有广泛的研究,温度通过影响机体不同生理过程和生长潜力,进而影响饲料需求和利用效率,决定摄食能量在生长能、粪便能、排泄能和代谢能之间的分配(邱炜韬, 2004; 王书磊等, 2012)。温度与能量收支分配模式的关系可概述为无相关性(Cui et al, 1988; 谢小军等, 1993; 崔奕波等, 1995)、线性(Fang et al, 2010)和非线性关系(贾海波等, 2008; Zhang et al, 2017) 3种模式。此外,对大西洋鲑(Salmo salar) (Koskela et al, 1997)和军曹鱼(Rachycentron canadum) (Sun et al, 2006)的研究发现,适温范围内,鱼体摄食量一般会随温度升高而增加,然而,温度升高使得代谢能不成比例的增加引发了营养损失,导致最佳饲料效益温度低于最大生长温度。因此,研究温度对鱼类生长和能量收支的影响,有助于在实际养殖生产中实现最佳生长速率、饲料利用效率和经济效益。
大菱鲆(Scophthalmus maximus)是欧洲、中国和智利海水养殖的重要鱼类品种,中国养殖年产量可达5万余t,约占世界养殖总产量的80% (雷霁霖等, 2012; 孟振等, 2020)。由于三倍体的不育性,其生长速度和抗逆性均优于普通二倍体,研究显示,24~48月龄,三倍体生长速度可较二倍体快约23% (Cal et al, 2006)。推动三倍体规模化生产和产业化推广,有助于发展大规格商品鱼的养殖,从而提高大菱鲆养殖产业经济效益,实现绿色发展。当前对大菱鲆三倍体的研究主要关注诱导方法(Piferrer et al, 2000、2003; Meng et al, 2023)、生长速度、性腺发育(Cal et al, 2006)、肌肉品质(Hernández-Urcera et al, 2017)和消化酶(Domingues et al, 2019)等领域。对比研究发现,温度对大菱鲆三倍体和二倍体的生长和饲料转化率均有显著影响,二者间存在差异,即最佳生长和饲料转化率所需温度不同,相较于初始均重约为45 g的二倍体,其最佳生长温度为18.7 ℃,最佳饲料转化率温度为15.8 ℃,然而,在相同规格下,三倍体的最佳生长和饲料转化率温度均高于二倍体(分别为18.9 ℃和16.8 ℃) (Aydin et al, 2021、2022)。当前,大菱鲆三倍体在养殖管理方面基本遵循了二倍体的相关操作,针对其生长特性和养殖管理的专门研究相对匮乏,这提示三倍体的生长优势尚未被充分挖掘。
本研究以大菱鲆三倍体为实验对象,研究温度对三倍体的生长和能量收支的影响,探讨三倍体体成分组成、饲料转化效率和能量各组分随温度的变化规律,获得大菱鲆三倍体最适生长和饲料利用率的温度,以期为建立三倍体养殖技术规范提供指导。
1 材料与方法 1.1 实验鱼实验鱼为静水压方法诱导的7月龄大菱鲆三倍体幼鱼,幼鱼初始平均体质量为(120.24±17.20) g,由山东烟台开发区天源水产有限公司培育,根据幼鱼规格投喂人工配合饲料(星元5#,青岛天乙吉星国际贸易有限公司)。三倍体诱导条件为(14.5±0.5)℃受精和孵化温度下,受精后5.5 min采用60 MPa的静水压压力持续处理6 min,三倍体率100% (Meng et al, 2023)。
1.2 实验设计与管理根据已报道的大菱鲆生长适温范围和摄食温度范围(Imsland et al, 1996; Árnason et al, 2009),温度设置13 ℃、16 ℃、19 ℃、22 ℃和25 ℃共5个水平,每个温度设置3个平行样,温度采用控温仪(亚美光一Model 611-H,青岛市北区亚美光一商社)控制,波动范围为±0.5 ℃。每个平行样养殖水槽水体体积为130 L,每个水槽随机放入15尾体表无损伤、体质健康、规格相近的幼鱼,流水养殖,暂养驯化1周,海水为经过滤、紫外消毒和曝气的深井海水,温度为13~14 ℃,驯化过程中各实验水槽以1~2 ℃/d的速度调整到设计温度,每天早晚2次投喂配合饲料,饲料主要成分组成见表 1。温度实验启动前,实验鱼饥饿24 h,使其胃肠道排空。
|
|
表 1 饲料的能值和化学组成 Tab.1 The energy content and composition of the artificial pellet /% |
实验期间每天08:00和18:00分2次饱食投喂,并记录投喂量,每10天测量一次鱼体体重,根据鱼体体重和摄食情况适当调整投喂量。投喂后30 min收集残饵,并烘干校正投喂量。投喂前1 h及投喂后2 h以虹吸方式收集粪便,于70 ℃烘干称重,–80 ℃保存备用。所用海水经沉淀、砂滤和紫外消毒处理,海水盐度为28.6、pH 7.8、溶解氧含量 > 7.8 mg/L,光照强度为300 lx,光照周期为16 L∶8 D。实验周期为49 d。
1.3 样品采集及检测实验开始前取同批次幼鱼6尾(空腹)作为初始样本。实验结束后,幼鱼饥饿24 h,随机从各养殖水槽选取3尾作为终末样本,称量,并于70 ℃烘干,保存于–80 ℃冰箱用于体成分和能量测定。鱼体、饲料、粪便总氮含量由元素分析仪(Vario ELⅢ型,德国Elementar公司)测定,蛋白质含量由氮含量×6.25所得,脂肪含量测定采用乙醚抽提法,灰分采用马弗炉焚烧法(SX2-12-10,山东龙口市电炉制造厂)在550 ℃灼烧6 h至恒重后测得,鱼体、饲料和粪便能值采用氧弹式热量计(PARR1281型,美国Parr仪器公司)测定。
1.4 实验检测指标和计算公式 1.4.1 摄食和生长指标大菱鲆三倍体摄食率(feeding rate, FR)、增重率(weight gain rate, WG)、肥满度(condition factor, CF)、肝体比(hepatosomatic index, HSI)、脏体比(viscerosomatic index, VSI)、特定生长率(specific growth rate, SGR)、饲料转化效率(feed conversion efficiency, FCE)计算公式如下:
摄食率FR /(%/d)= 100 × FI/[t (Wt + Wo)/2]
增重率WG /% = 100 × (Wt – Wo)/Wo
肥满度CF =100 × Wt/L3
肝体比HSI /% =100 × WH/Wt
脏体比VSI/% =100 × Wv/Wt
湿重特定生长率SGRw /(%/d) = 100 × (lnWt – ln Wo)/t
干重特定生长率SGRd /(%/d) = 100 × [ln(Wt × CDt) – In(Wo × CDo)]/t
蛋白特定生长率SGRp /(%/d) = 100 × [ln(Wt × CPt) – ln(Wo × CPo)]/t
能量特定生长率SGRe /(%/d) = 100 × [ln(Wt × CEt) – ln(Wo × CEo)]/t
饲料湿重转化效率FCEw /% = 100 × (Wt– Wo)/FI
饲料干重转化效率FCEd /% = 100 × (Wt × CDt – Wo × CDo)/(FI × CD)
饲料蛋白转化效率FCEp /%= 100 × (Wt × CPt – Wo × CPo)/(FI × CP)
饲料能量转换效率FCEe/% = 100 × (Wt × CEt – Wo × CEo)/(FI × CE)
式中,FI为平均每尾鱼饲料摄食总量(g),Wo和Wt表示为实验开始和结束时鱼体的湿重(g),t为实验总天数(d),WH和Wv为鱼体肝脏质量和内脏团质量(g),L为鱼体体长(cm),CDo和CDt为实验开始和结束时鱼体平均干物质含量(%),CPo和CPt为实验开始和结束时鱼体平均蛋白质含量(%),CEo和CEt为实验开始和结束时鱼体平均能量含量(kJ/g),CD、CP和CE分别为饲料的干物质、蛋白质和能量含量(%、%、kJ/g)。
1.4.2 消化率指标排泄率(nitrogenous excretion rate, u)、排粪率(faecal production rate, f)、表观消化率(apparent digestibility coefficients, ADC)计算公式如下:
排泄率u /[(mg/g)/d]= 1 000 × (NI-NF-NR)/[t (Wt + Wo)/2]
排粪率f /[(mg/g)/d] = FF/[t (Wt + Wo)/2]
干物质表观消化率ADCd (%) = 100 × (C1-C2)/C1
蛋白质表观消化率ADCp (%) = 100 × (P1-P2)/P1
能量表观消化率ADCe (%) = 100 × (E1-E2)/E1
式中,NI、NF和NR分别为食物氮、粪便氮和鱼体储存氮(g),FF为平均每尾鱼排出的粪便干重(mg),C1和C2分别为饲料和粪便的干物质含量(%),P1和P2分别为饲料和粪便中的蛋白质含量(%),E1和E2分别为饲料和粪便中的能量含量(kJ/g)。
1.4.3 能量收支指标大菱鲆三倍体幼鱼的能量收支模型采用Warren等(1967)提出的能量在鱼体内转换的基本模型C=F+U+R+G或A=R+G,其中,C为摄食能(feeding intake energy)、F为粪便能(faecal energy)、U为排泄能(excretion energy)、R为代谢能(metabolism energy)、G为生长能(growth energy)、A为同化能(assimilated energy),计算公式如下:
摄食能C /kJ = FI × CE
粪便能F /kJ = FF × FE
排泄能U /kJ = [(NI-NF-NR) × 17/14] × 24.83
生长能G /kJ = Wt × CEt-Wo × CEo
代谢能R /kJ = C-F-U-G
式中,CE和FE分别为饲料能含量(kJ/g)和粪便能量含量(kJ/g),NI、NF和NR分别为食物氮、粪便氮和鱼体储存氮(g),24.83为每g氨氮的能值(Zhang et al, 2017) (kJ/g,大菱鲆主要排泄物为氨氮,尿素忽略不计),CEo和CEt分别为实验开始和结束时鱼体平均能量含量(kJ/g)。
1.5 数据分析数据以3个重复组的平均值±标准差(Mean±SD)表示,采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),以Duncan多重比较分析组间差异,以P < 0.05作为差异显著性水平。采用二次回归曲线分析拟合特定生长率、饲料转化效率、能量收支与温度的关系,R2表示相关系数。
2 结果 2.1 温度对大菱鲆三倍体形态学指标、体成分和能量含量的影响实验期间,各温度处理组平行样均未发生死亡现象,幼鱼成活率为100%。温度对大菱鲆三倍体幼鱼形态学指标、干物质、蛋白、脂肪、粗灰分的含量和湿重能量的影响结果见表 2。其中,CF、HSI和VSI随温度升高整体呈现逐渐降低的趋势,13 ℃时CF和HSI最高,显著高于其他温度组(P < 0.05),VSI在16 ℃时最高,显著高于除13 ℃外的其他温度组(P < 0.05);温度对干物质、蛋白质含量无显著性影响,对脂肪、灰分含量和湿重能量有显著性影响(P < 0.05),25 ℃时脂肪含量低于13 ℃、16 ℃和19 ℃实验组(P < 0.05),其他组间无显著性差异;灰分含量则与脂肪含量呈现相反的变化趋势,25 ℃时灰分含量最高;19 ℃湿重能量最高,显著高于除22 ℃外的其他温度组(P < 0.05)。
|
|
表 2 温度对大菱鲆三倍体幼鱼体成分的影响 Tab.2 The effect of temperature on the body chemical compositions in triploid turbot juveniles |
大菱鲆三倍体FR和WG均随温度升高呈先升高后降低的趋势,其中,19 ℃和22 ℃时FR最高,13 ℃、16 ℃和25 ℃时FR低于19 ℃ (P < 0.05);19 ℃时WG可达(62.17±3.10)%,高于其他温度组(P < 0.05),而25 ℃时WG仅(20.33±4.61)%,低于其他组(P < 0.05)。
实验温度范围内,以幼鱼湿重、干重、蛋白和能量计算的特定生长率均随温度升高总体呈现倒“U”型变化趋势,其中,19 ℃时SGR均为最高,SGRw在25 ℃时低于其他组(P < 0.05, n=45) (图 1A),SGRd、SGRp和SGRe在25 ℃和13 ℃时没有显著差异,但低于其他组(P < 0.05) (图 1B、C、D),SGRw、SGRd、SGRp和SGRe在16 ℃和22 ℃时均无显著差异。通过二次回归曲线分析大菱鲆三倍体幼鱼SGR与温度(T)的关系,(120.24±17.20) g的三倍体幼鱼最佳SGRw、SGRd、SGRp和SGRe对应温度分别为18.4 ℃、18.7 ℃、18.9 ℃和18.5 ℃。
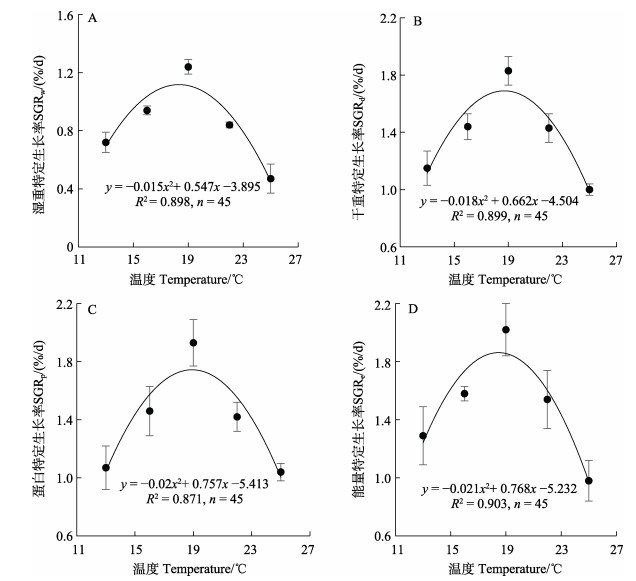
|
图 1 大菱鲆三倍体幼鱼特定生长率与温度的关系 Fig.1 The relationship between specific growth rates (SGR) and temperatures in triploid turbot juveniles |
实验温度范围内,以饲料和幼鱼湿重、干重、蛋白和能量计算的饲料转化率均随温度升高总体呈现先升高后降低的倒“U”型变化趋势,19 ℃时FCE均达最高值且高于其他组(P < 0.05, n=45),分别为(121.82± 4.63)%、(41.89±2.12)%、(55.03±2.85)%和(34.58± 1.83)%,25 ℃时FCEw和FCEe低于其他组(P < 0.05) (图 2A、D),FCEd和FCEp与13 ℃无显著差异(图 2B、C),但低于其他组(P < 0.05),16 ℃和22 ℃时FCEw、FCEd、FCEp和FCEe间无显著性差异。采用二次回归曲线分析大菱鲆三倍体幼鱼FCE与T间的关系,(120.24±17.20) g的三倍体幼鱼最佳FCEw、FCEd、FCEp和FCEe的对应温度分别为18.1 ℃、18.6 ℃、18.9 ℃和18.2 ℃。
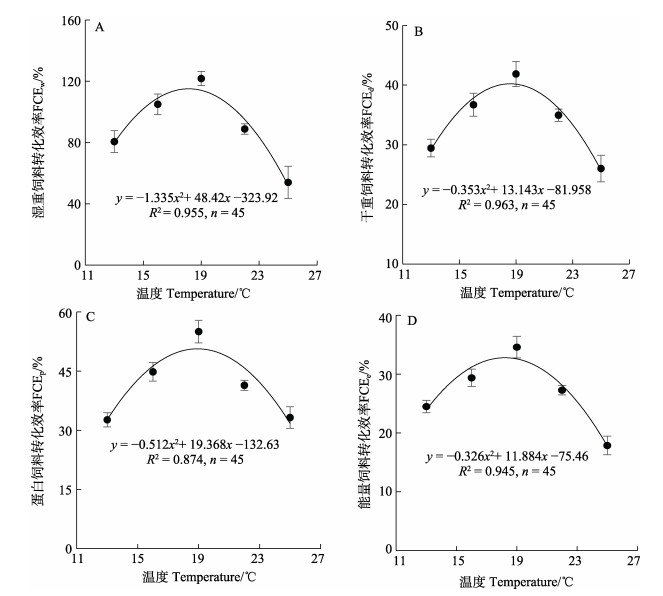
|
图 2 大菱鲆三倍体幼鱼饲料转化效率与温度的关系 Fig.2 The relationship between feed conversion efficiencies (FCE) and temperatures in triploid turbot juveniles |
|
|
表 3 温度对大菱鲆三倍体幼鱼的摄食率和增重率的影响 Tab.3 The effect of temperature on the feeding rate (FR) and weight gain (WG) in triploid turbot juveniles |
大菱鲆三倍体排泄率随温度升高呈先降低后升高的变化趋势,16 ℃和19 ℃低于其他温度组(表 4,P < 0.05);排粪率呈现相似的变化趋势,25 ℃时排粪率最高,高于其他温度组(P < 0.05),16 ℃和19 ℃组排粪率低于13 ℃和22 ℃组,但差异不显著;干物质表观消化率、蛋白表观消化率和能量表观消化率在13~22 ℃时差异不显著,在25 ℃时低于其他温度组(P < 0.05)。
|
|
表 4 温度对大菱鲆三倍体幼鱼的排泄率、排粪率以及表观消化率 Tab.4 The effect of temperature on nitrogenous excretion (u), faecal production (f) and apparent digestibility coefficients (ADC) in triploid turbot juveniles |
温度对大菱鲆三倍体幼鱼的能量收支各组分分配比例具有显著性影响(P < 0.05),不同温度下能量收支方程见表 5。其中,摄食能随温度升高呈先升高后降低的趋势,19 ℃时摄食能最高,25 ℃时最低;生长能占摄食能的比例为17.86%~34.58%,随温度升高呈先升高后降低的趋势,19 ℃时生长能占比最高,其次为16 ℃和22 ℃组,25 ℃时最低;粪便能占摄食能的4.12%~5.57%,25 ℃时最高,其他温度组间差异不显著;排泄能占摄食能比例为6.61%~9.19%,随温度升高呈先降低后升高的趋势,25 ℃、13 ℃和22 ℃组排泄能占比最高,显著高于其他2组,19 ℃时排泄能占比最低;代谢能占摄食能的54.69%~67.38%,随温度升高呈先降低后升高的趋势,19 ℃时占比最低,25 ℃时最高,13 ℃、16 ℃和22 ℃组间无显著性差异。当能量收支以同化能的比例表示时,生长能占同化能的比例为20.95%~38.74%,生长能占同化能的比例与温度的关系和其占摄食能的比例与温度的关系相同,19 ℃时达到最大,25 ℃时最小;代谢能占同化能的比例为61.26%~79.05%,代谢能占比与温度的关系和生长能占同化能的比例与温度关系正好相反。
|
|
表 5 温度对大菱鲆三倍体幼鱼能量收支的影响 Tab.5 The effect of temperature on energy budgets in triploid turbot juveniles |
鱼类属于变温动物,温度是影响其生长性能和饲料利用效率的最重要因素之一,最佳生长温度通常介于在其耐受温度的上下限之间(Viadero, 2005)。对二倍体大菱鲆的研究显示,其最佳生长温度与幼鱼种群、规格、投饲水平和盐度密切相关。例如,挪威大菱鲆幼鱼25~75 g时最适生长温度为16~19 ℃,而100 g时降至13~16 ℃ (Imsland et al, 1996);法国大菱鲆体重在35~140 g时最适生长温度为16~20 ℃ (Burel et al, 1996);Imsland等(2000)对挪威、法国和苏格兰种群大菱鲆幼鱼(7~8 g)确定的最适生长温度范围较高,分别为23.0 ℃、21.1 ℃和19.6 ℃;Şahin (2001)等研究表明,黑海大菱鲆幼鱼(34.4 g)最佳生长温度为15.2 ℃,且不应超过18 ℃;Árnason等(2009)根据生长与温度的对数模拟曲线,推测冰岛大菱鲆体重为10 g和100 g时的最适生长温度分别为20.8 ℃和19.1 ℃;Huang等(2014)利用响应面方法预测的大菱鲆(10~500 g)最佳生长温度为20.88 ℃。对于鱼类的生长和温度的关系,一般采用特定生长率与温度的回归曲线模型来描述(Sun et al, 2006),本研究中,所涉及的温度范围基本涵盖了大菱鲆养殖生产使用的温度,对于大规格大菱鲆三倍体(体质量120 g),温度对其特定生长率具有显著影响,特定生长率与温度的关系符合二次曲线回归模型,由回归方程得出的特定生长率(SGRw、SGRd、SGRp和SGRe)最佳生长温度分别为18.4 ℃、18.7 ℃、18.9 ℃和18.5 ℃。Imsland等(2001)研究表明,温度和盐度对大菱鲆特定生长率具有交互作用,随着盐度的降低(33.5到15),最佳生长温度由19.6 ℃上升至22.9 ℃。本研究中,湿重特定生长率对应最佳生长温度为18.4 ℃,低于Aydin等(2021)报道的三倍体最佳生长温度(18.9 ℃),其使用的三倍体大菱鲆体质量[(43.98±7.67) g]及盐度(16.9)均低于本实验,推测最佳生长温度的差异与规格大小和盐度等因素有关。
温度主要通过调节摄食量和饲料转化率,对鱼类生长产生影响。对多种鱼类的研究表明,最佳饲料转化效率(FCE)所需的温度通常低于获得最大生长速率的温度(Handeland et al, 2008; Pérez-Casanova et al, 2009; Hashem et al, 2015)。对大菱鲆普通二倍体和三倍体的研究,也证实了这一观点,如对挪威、法国和苏格兰种群大菱鲆幼鱼(7~8 g)的最佳饲料转化效率预测的对应温度分别为17.5 ℃、16.7 ℃和16.5 ℃,明显低于其最佳生长温度(Imsland et al, 2000);10 g和100 g的大菱鲆最佳饲料转化率对应温度比其最佳生长温度约低2 ℃ (Árnason et al, 2009);对均重45 g左右的大菱鲆二倍体和三倍体的研究也表明(Aydin et al, 2021),其最佳饲料转化率对应温度均比其最佳生长温度约低3 ℃,但三倍体最佳饲料转化率对应温度(16.8 ℃)比二倍体(15.8 ℃)高1 ℃,这预示在养殖生产管理中,三倍体与二倍体需要采取不同的策略。本研究的温度范围内,大菱鲆三倍体的饲料转化率随温度升高表现为先升高后降低的趋势,最佳饲料转化率对应温度为18.1 ℃,与最佳生长温度(18.4 ℃)间的差异较小,低于Aydin(2021)等报道的二者间差异(约3 ℃),这可能与过量投喂方式有关。饲料转化率取决于鱼体增重量和摄食量,在限制投饲水平的条件下,通常在未达到饱食投喂水平时可以获得更好的饲料转化效率(FCE) (Meyer-Burgdorff et al, 1989; Zoccarato et al, 1994),本实验采用饱食投喂的方式可能影响了对最佳饲料转化率对应温度的判断。本研究中,温度对摄食量影响的实验结果也显示,在饱食投喂状态下,13 ℃、16 ℃、22 ℃和25 ℃组摄食量和摄食率间无显著性差异,仅19 ℃组显著升高,但25 ℃时的饲料转化效率显著低于13 ℃,也证实了这一点。综合不同温度条件下大菱鲆三倍体大规格幼鱼(120 g)的特定生长率、摄食率和饲料转化率,可以确定其适宜的养殖温度范围为18.1~18.4 ℃。
3.2 温度对大菱鲆三倍体表观消化率的影响温度对鱼类表观消化率(ADC)的影响存在多种研究结果(Beamish, 1972; Peres et al, 1999; Amin et al, 2014; Zhang et al, 2017)。在本研究中,大菱鲆三倍体幼鱼的表观消化率随着温度升高呈现先升高后降低的趋势,25 ℃时消化率显著降低。消化率的变化与消化酶活性密切相关,随着温度上升,食物在消化道中的运动速度加快,并通过增强消化酶的活性以促进消化,然而,超过最佳温度,消化酶活性会显著下降,从而导致消化率降低(Bermudes et al, 2010; Xue et al, 2021)。同时,随着鱼体温度升高,食物在肠道中的推进速度会加快,缩短了其停留时间,增加粪便产量,这也有可能降低消化率(Zhang et al, 2017)。本研究发现,22 ℃和25 ℃时排泄率和排粪率显著增加,尤其是25 ℃,这可能是导致其消化率显著降低的主要原因。此外,本研究中采用氮收支的方法统计表观消化率,未使用消化率观测的标志物,粪便在水中的溶蚀情况可能会影响消化率的计算。未来研究应从胃肠道消化酶、蛋白水解相关酶活性和基因表达变化,深入探讨温度对大菱鲆三倍体表观消化率的影响。
3.3 温度对大菱鲆三倍体能量收支的影响鱼类能量学的核心问题在于探讨能量收支各组分之间的定量关系及其对生态因子的响应规律,并研究鱼类调节能量分配的生理生态学机制(崔亦波, 1989; 徐涛等, 2007)。本研究中,温度(13~25 ℃)对大菱鲆能量收支具有显著影响,生长能占摄食能的比例随温度升高呈倒“U”形变化趋势,而代谢能、排泄能、粪便能占摄食能比例与之相反。Cui等(1988)曾提出了一个假设,即在摄食不受限制时,温度对鱼类食物能量分配比例没有影响,并在几种淡水鱼类的研究中证实了该假设(谢小军等, 1993; 崔奕波等, 1995)。然而,后续在多种鱼类的研究中,结果表明即使在饱食投喂状态下,温度对鱼类能量分配仍具有显著性影响(孙耀等, 2001; Tang et al, 2007; 周小敏等, 2008; 房景辉等, 2010; Oliveira et al, 2023),与本研究结果相符。大菱鲆三倍体幼鱼在不同温度下的摄食率、饲料转化率和能量收支存在差异,这些差异可能是导致温度对大菱鲆三倍体幼鱼生长产生影响的主要生理生态学机制。
同化能可以体现消化道吸收的能量(即生长能)和呼吸代谢消耗的能量总和。本研究中,能量收支以占同化能的比例表示时,生长能占比为20.95%~38.74%。据Cui等(1990)基于13种淡水鱼类最大摄食水平的能量收支,推导出鱼类能量收支方程模型100 A = 60 R + 40 G。唐启升等(2003)对7种海洋鱼类能量收支的研究,得出相应的能量收支方程模型为100 A = 71.5 R + 28.5 G。与之相比,在适宜生长温度条件下(16~22 ℃)的大菱鲆三倍体,其生长能占比高,表现出高生长效率和低代谢消耗的特点。
综上,在盐度28.6、pH 7.8、溶解氧含量7.8 mg/L,光照强度为300 lx,光照周期为16 L∶8 D条件下,温度对大菱鲆三倍体大规格幼鱼[初始体质量(120.24±17.20) g]生长和能量收支各组分具有显著性影响,三倍体幼鱼摄食率、增重率、特定生长率、饲料转化率摄食能和生长能均随温度升高呈先升高后降低的趋势,19 ℃时达最高值,而排泄率和排粪率在19 ℃最低,通过二次回归曲线分析特定生长率、饲料转化率与温度的关系,并参考其不同温度下的能量收支方程,均重120 g的大菱鲆三倍体适宜养殖温度为18.1~18.9 ℃。实验结果可为大菱鲆三倍体的养殖条件优化、提高饲料效率和控制水环境污染提供指导。
AMIN M N, BARNES R K, ADAMS L R. Effect of temperature and varying level of carbohydrate and lipid on growth, feed efficiency and nutrient digestibility of brook trout, Salvelinus fontinalis (Mitchill, 1814). Animal Feed Science and Technology, 2014, 193: 111-123 DOI:10.1016/j.anifeedsci.2014.04.016 |
ÁRNASON T, BJÖRNSSON B, STEINARSSON A, et al. Effects of temperature and body weight on growth rate and feed conversion ratio in turbot (Scophthalmus maximus). Aquaculture, 2009, 295(3/4): 218-225 |
AYDIN I, KÜÇÜK E, POLAT H, et al. Growth and feed conversion ratio of diploid and triploid induced juvenile turbot reared at different water temperatures. Aquaculture, 2021, 543: 736981 DOI:10.1016/j.aquaculture.2021.736981 |
AYDIN I, ÖZTÜRK R Ç, KÜÇÜK E, et al. Temperature appeared to be an effective factor on growth performance of diploid and triploid turbot, Scophthalmus maximus, during the early life stage. Aquaculture, 2022, 546: 737316 DOI:10.1016/j.aquaculture.2021.737316 |
BEAMISH F W H. Ration size and digestion in largemouth bass, Micropterus salmoides Lacépède. Canadian Journal of Zoology, 1972, 50(2): 153-164 DOI:10.1139/z72-024 |
BERMUDES M, GLENCROSS B, AUSTEN K, et al. The effects of temperature and size on the growth, energy budget and waste outputs of barramundi (Lates calcarifer). Aquaculture, 2010, 306(1/2/3/4): 160-166 |
BUREL C, PERSON-LE RUYET J, GAUMET F, et al. Effects of temperature on growth and metabolism in juvenile turbot. Journal of Fish Biology, 1996, 49(4): 678-692 DOI:10.1111/j.1095-8649.1996.tb00064.x |
CAL R M, VIDAL S, GÓMEZ C, et al. Growth and gonadal development in diploid and triploid turbot (Scophthalmus mximus). Aquaculture, 2006, 251(1): 99-108 DOI:10.1016/j.aquaculture.2005.05.010 |
CUI Y B. Bioenergetics of fishes: Theory and methods. Acta Hydrobiologica Sinica, 1989, 13(4): 369-383 [崔奕波. 鱼类生物能量学的理论与方法. 水生生物学报, 1989, 13(4): 369-383 DOI:10.3321/j.issn:1000-3207.1989.04.003] |
CUI Y B, CHEN S L, WANG S M. Effect of temperature on the energy budget of the grass carp, Ctenopharyngodon idellus val. Oceanologia et Limnologia Sinica, 1995, 26(2): 169-174 [崔奕波, 陈少莲, 王少梅. 温度对草鱼能量收的影响. 海洋与湖沼, 1995, 26(2): 169-174 DOI:10.3321/j.issn:0029-814X.1995.02.008] |
CUI Y B, LIU J K. Comparison of energy budget among six teleosts. 3. Growth rate and energy budget. Comparative Biochemistry and Physiology, Part A, Comparative Physiology, 1990, 97(3): 381-384 DOI:10.1016/0300-9629(90)90627-5 |
CUI Y B, WOOTTON R J. Bioenergetics of growth of a cyprinid, Phoxinus phoxinus: The effect of ration, temperature and body size on food consumption, faecal production and nitrogenous excretion. Journal of Fish Biology, 1988, 33(3): 431-443 DOI:10.1111/j.1095-8649.1988.tb05484.x |
DOMINGUES P, HERNNDEZ-URCERA J, CAL R, et al. Effect of triploidy on digestive enzyme activity of early stages of turbot (Scophthalmus maximus). Fish Physiology and Biochemistry, 2019, 45(2): 573-582 DOI:10.1007/s10695-019-00610-z |
DUMAS A, FRANCE J, BUREAU D. Modelling growth and body composition in fish nutrition: Where have we been and where are we going?. Aquaculture Research, 2010, 41(2): 161-181 DOI:10.1111/j.1365-2109.2009.02323.x |
FANG J H, TIAN X L, DONG S L, et al. Effects of temperature on the growth, biochemical composition and energy budget of tongue sole, Cynoglossus semilaevis Günther. Periodical of Ocean University of China, 2010, 40(1): 25-30, 46 [房景辉, 田相利, 董双林, 等. 温度对半滑舌鳎的生长、生化组成和能量收支的影响. 中国海洋大学学报(自然科学版), 2010, 40(1): 25-30, 46] |
FANG J, TIAN X, DONG S. The influence of water temperature and ration on the growth, body composition and energy budget of tongue sole (Cynoglossus semilaevis). Aquaculture, 2010, 299(1/2/3/4): 106-114 |
HANDELAND S O, IMSLAND A K, STEFANSSON S O. The effect of temperature and fish size on growth, feed intake, food conversion efficiency and stomach evacuation rate of Atlantic salmon post-smolts. Aquaculture, 2008, 283(1/2/3/4): 36-42 |
HASHEM A M, AL-BATTAL A A, KORA M F. Effect of temperature on growth hormone-secreting cells' immunoreactivity and larval growth during development of Nile tilapia, Oreochromis niloticus. Egyptian Journal of Histology, 2015, 38(1): 93-101 DOI:10.1097/01.EHX.0000460081.10666.21 |
OLIVEIRA H, MAULVAULT A L, CASTANHO S, et al. Lack of detrimental effects of ocean acidification and warming on proximate composition, fitness and energy budget of juvenile senegalese sole (Solea senegalensis). Science of The Total Environment, 2023, 857: 159491 DOI:10.1016/j.scitotenv.2022.159491 |
HERNÁNDEZ-URCERA J, AYALA M D, SANTAELLA M, et al. Effect of triploidy on muscle cellularity and flesh quality of turbot (Scophthalmus maximus). Aquaculture Research, 2017, 48(7): 3606-3617 DOI:10.1111/are.13186 |
HUANG Z H, MA A J, WANG X A, et al. The interaction of temperature, salinity and body weight on growth rate and feed conversion rate in turbot (Scophthalmus maximus). Aquaculture, 2014, 432(3/4): 237-242 |
IMSLAND A K, FOSS A, NÉVDAL G, et al. Countergradient variation in growth and food conversion efficiency of juvenile turbot. Journal of Fish Biology, 2000, 57(5): 1213-1226 DOI:10.1111/j.1095-8649.2000.tb00482.x |
IMSLAND A K, SUNDE L M, FOLKVORD A, et al. The interaction of temperature and fish size on growth of juvenile turbot. Journal of Fish Biology, 1996, 49(5): 926-940 DOI:10.1111/j.1095-8649.1996.tb00090.x |
IMSLAND A K, FOSS A, GUNNARSSON S, et al. The interaction of temperature and salinity on growth and food conversion in juvenile turbot (Scophthalmus maximus). Aquaculture, 2001, 198: 353-367 DOI:10.1016/S0044-8486(01)00507-5 |
JIA H B, SUN Y, TANG Q S. Effects of temperature on energy budget and ecological conversion efficiency of tiger puffer Takifugu rubripes. Marine Fisheries Research, 2008, 29(5): 39-46 [贾海波, 孙耀, 唐启升. 温度对红鳍东方鲀能量收支和生态转化效率的影响. 海洋水产研究, 2008, 29(5): 39-46] |
KHAIRNAR S O, TIAN X L, FANG Z H, et al. Effects of the amplitude and frequency of salinity fluctuation on the body cmposition and energy budget of juvenile tongue sole (Cynoglossus semilaevis). Journal of Ocean University of China, 2015, 14(1): 127-134 DOI:10.1007/s11802-015-2400-z |
KOSKELA J, PIRHONEN J, OBLING M. Feed intake, growth rate and body composition of juvenile Baltic salmon exposed to different constant temperatures. Aquaculture International, 1997, 5: 351-360 |
LEI J L, LIU X F, GUAN C T. Turbot culture in China for two decades: Achievements and prospect. Progress in Fishery Sciences, 2012, 33(4): 123-130 [雷霁霖, 刘新富, 关长涛. 中国大菱鲆养殖20年成就和展望——庆祝大菱鲆引进中国20周年. 渔业科学进展, 2012, 33(4): 123-130 DOI:10.3969/j.issn.1000-7075.2012.04.016] |
MENG Z, ZHANG B Y, SONG C E, et al. Optimal conditions for pressure shock induction of triploidy in turbot and a comparison of induction efficiency with cold shock. Aquaculture Reports, 2023, 33: 101775 |
MENG Z, ZHANG H L, LIU X F, et al. Toxic effects of acute ammonia stress on young turbot Scophthalmus maximus. Progress in Fishery Sciences, 2020, 41(2): 51-60 [孟振, 张鸿丽, 刘新富, 等. 氨氮急性胁迫对大菱鲆幼鱼的毒性效应. 渔业科学进展, 2020, 41(2): 51-60] |
MEYER-BURGDORFF K H, OSMAN M F, GÜNTHER K D. Energy metabolism in Oreochromis niloticus. Aquaculture, 1989, 79(1/2/3/4): 283-291 |
PERES H, OLIVA-TELES A. Influence of temperature on protein utilization in juvenile European seabass (Dicentrarchus labrax). Aquaculture, 1999, 170(3/4): 337-348 |
PÉREZ-CASANOVA J C, LALL S P, GAMPERL A K. Effect of feed composition and temperature on food consumption, growth and gastric evacuation of juvenile Atlantic cod (Gadus morhua L.) and haddock (Melanogrammus aeglefinus L.). Aquaculture, 2009, 294(3/4): 228-235 |
PIFERRER F, CAL R M, ÁLVAREZ-BLÁZQUEZ B, et al. Induction of triploidy in the turbot (Scophthalmus maximus): I. Ploidy determination and the effects of cold shocks. Aquaculture, 2000, 188(1/2): 79-90 |
PIFERRER F, CAL R M, GÓMEZ C, et al. Induction of triploidy in the turbot (Scophthalmus maximus): Ⅱ. Effects of cold shock timing and induction of triploidy in a large volume of eggs. Aquaculture, 2003, 220(1/2/3/4): 821-831 |
QIU W T. Effect of temperature on the energy budget of young Spinibarbus dneticulatus. Master′s Thesis of Jinan University, 2004 [邱炜韬. 温度对倒刺鲃幼鱼能量收支的影响. 暨南大学硕士研究生学位论文, 2004]
|
ŞAHIN T. Effect of water temperature on growth of hatchery reared black sea turbot, Scophthalmus maximus (Linnaeus, 1758). Turkish Journal of Zoology, 2001, 25(3): 183-186 |
SHI D J, WANG W F, LI W T, et al. Various photoperiods on growth, energy budgets and gene expression of circadian clock in koi carp (Cyprinus carpio). Acta Hydrobiologica Sinica, 2022, 46(5): 664-670 [史东杰, 王文峰, 李文通, 等. 5种光周期对锦鲤生长、能量收支及生物钟基因表达的影响. 水生生物学报, 2022, 46(5): 664-670] |
SUN L H, CHEN H. Effects of water temperature and fish size on growth and bioenergetics of cobia (Rachycentron canadum). Aquaculture, 2014, 426/427: 172-180 |
SUN L H, CHEN H, HUANG L M. Effect of temperature on growth and energy budget of juvenile cobia (Rachycentron canadum). Aquaculture, 2006, 261(3): 872-878 |
SUN Y, ZHANG B, GUO X W, et al. Effects of temperature on energy budget of Sparus macrocephalus. Acta Ecologica Sinica, 2001, 21(2): 186-190 [孙耀, 张波, 郭学武, 等. 温度对黑鲷(Sparus macrocephalus)能量收支的影响. 生态学报, 2001, 21(2): 186-190] |
XUE S Y, MAO Y Z, LI J B, et al. Effects of rising temperature on growth and energy budget of juvenile Eogammarus possjeticus (Amphipoda: Anisogammaridae). Acta Oceanologica Sinica, 2021, 40(9): 82-89 |
TANG Q S, GUO X W, SUN Y, et al. Ecological conversion efficiency and its influencers in twelve species of fish in the Yellow Sea ecosystem. Journal of Marine Systems, 2007, 67(3/4): 282-291 |
TANG Q S, SUN Y, ZHANG B. Bioenergetics models for seven species of marine fish. Journal of Fisheries of China, 2003, 27(5): 443-449 [唐启升, 孙耀, 张波. 7种海洋鱼类的生物能量学模式. 水产学报, 2003, 27(5): 443-449] |
VIADERO R C. Factors affecting fish growth and production. In: LEHR J H, KEELEY J, eds. Water Encyclopedia. Wiley- Interscience, 2005, 129-133 |
WARREN C E, DAVIS G E. Laboratory studies on the feeding, bioenergetics, and growth of fish. Corvallis, Or. Pacific Cooperative Water Pollution and Fisheries Research Laboratories, Agricultural Experiment Station, Corvallis: Oregon State University, 1967
|
WANG S L, ZHOU Y, ZHU X M. Research advances on several factors affecting energy budget of fish. Chinese Fishery Quality and Standard, 2012, 2(4): 61-67 [王书磊, 周宇, 朱雪梅. 几种因子对鱼类能量收支影响的研究进展. 中国渔业质量与标准, 2012, 2(4): 61-67] |
XIE X J, SUN R Y. The faecal production and digestibility of the southern catfish (Silurus meridian alis chen), in relation to ration level, body weight and temperature. Oceanologia et Limnologia Sinica, 1993, 24(6): 627-633 [谢小军, 孙儒泳. 南方鲇的排粪量及消化率同日粮水平、体重和温度的关系. 海洋与湖沼, 1993, 24(6): 627-633] |
XU T, MA S, WANG Z J, et al. The influence of low temperature on the growth and energy budget of Centropristis striata. Marine Sciences, 2007(4): 9-12 [徐涛, 马甡, 王志军, 等. 低温对条纹锯  生长及能量收支的影响. 海洋科学, 2007(4): 9-12] 生长及能量收支的影响. 海洋科学, 2007(4): 9-12] |
ZHANG L, ZHAO Z G, FAN Q X. Effects of water temperature and initial weight on growth, digestion and energy budget of yellow catfish Pelteobagrus fulvidraco (Richardson, 1846). Journal of Applied Ichthyology, 2017, 33(6): 1108-1117 |
ZHOU X M, WU C W, ZHANG Y X. Effect of temperature and body weight on bioenergetics of cultured Pseudosciaena crocea. Journal of Zhejiang Ocean University (Natural Science), 2008, 27(3): 291-296 [周小敏, 吴常文, 张元兴. 温度和体重对养殖大黄鱼能量收支的影响. 浙江海洋学院学报(自然科学版), 2008, 27(3): 291-296] |
ZOCCARATO I, BENATTI G, BIANCHINI M L, et al. Differences in performance, flesh composition and water output quality in relation to density and feeding levels in rainbow trout, Oncorhynchus mykiss (Walbaum), farming. Aquaculture Research, 1994, 25(6): 639-647 |



