2. 中国农业科学院研究生院 北京 100081;
3. 青岛海洋科技中心海洋生物学与生物技术功能实验室 山东 青岛 266071;
4. 烟台开发区天源水产有限公司 山东 烟台 264006
2. Graduate School of the Chinese Academy of Agricultural Sciences, Beijing 100081, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao Marine Science and Technology Center, Qingdao 266071, China;
4. Yantai Development Zone Tianyuan Aquatic Products Co., Ltd., Yantai 264006, China
鱼类是变温脊椎动物,自身不具备调节体温的机制,水温是影响其生存生长的重要因素之一(Zhang et al, 2023),长期和过度的高温环境会引起鱼类应激,直接或间接影响其各种生理状态(杨铭宣等, 2024),引起代谢紊乱、氧化应激、免疫力和抗病力急剧下降等不良后果(孟振等, 2020),甚至引起鱼类死亡。大菱鲆(Scophthalmus maximus)是一种冷水性鱼类,其生长温度范围为13~22 ℃,最高致死温度为28~30 ℃ (Ji et al, 2016; 郭晓丽等, 2022)。近年来,全球气候变暖,夏季持续高温,工厂化养殖条件下养殖密度大,热应激更易发生,从而造成水生经济物种养殖推广地域受限,而养殖周期短、环境抗压能力差等问题日趋严重,因此,对耐温性状进行遗传改良,选育出生长性能优良的耐高温新品种已成为节能环保、提高养殖效益和健康化养殖水平的当务之急。但在鱼类抗逆选育工作中,耐热性能评估指标较单一,耐高温选育评价体系不完善,优异种质资源鉴定不精准、效率低等问题严重制约抗逆选育工作的推进。因此,亟需探索影响鱼类耐热性能的关键因子,阐明鱼类热响应分子机制,确定高效、精准的评估指标,从而解决耐温选育的核心问题。
心脏是脊椎动物胚胎发育过程中第一个形成并发挥作用的器官,是机体循环系统重要组成和主要动力来源,在维持机体稳态中发挥关键作用(郭晓丽, 2021; 侯元华, 2022),心脏功能的正常与否直接影响生物的生存、发育及繁殖。Iftikar等(2015)认为,鱼类的心脏对热应激非常敏感,心脏功能可能是决定鱼类热上限的重要因素。心肌细胞的凋亡是造成心脏损伤、影响心脏功能的主要原因。郭晓丽等(2022)研究发现,严重的高温环境会使大菱鲆心肌线粒体结构被破坏,导致心肌细胞受损,进而影响身体各器官的供氧供血,甚至引起机体死亡。综上所述,心脏在机体应对高温胁迫中有重要作用,开展热应激条件下心脏组织的分子调控机制研究,对于抗逆选育工作具有重要意义。
定量蛋白质组学可以很详细地研究胁迫条件下蛋白质水平的变化(Jia et al, 2020),串联质谱标签(tandem mass tag, TMT)是一种多肽体外标记技术,该技术采用同位素标签,通过标记肽段特异氨基酸位点,然后进行串联质谱分析,具有高通量、高准确性和高分辨率等优点,为蛋白质定量分析的主流方法(杨铭宣等, 2023; 赵月涵等, 2023)。该技术在与养殖动物应激机制相关的研究中已有较为广泛的应用,科研人员通过利用TMT技术研究细胞、组织或器官总蛋白质的变化规律,可以揭示应激条件下差异表达蛋白质和信号转导通路,进而探究其调控机制。张兰等(2022)对低氧和常氧组的牦牛(Bos mutus)肺动脉平滑肌细胞采用TMT分析,发现差异表达蛋白主要富集在代谢、酶活、低氧适应性等通路中,并筛选出7个重要的差异表达蛋白;邝良德等(2021)利用TMT技术在适温组和高温胁迫组齐兴肉兔(Leporidae)母兔的卵巢组织中筛选出了与热应激和繁殖相关的270个差异表达蛋白,主要富集到生热作用、氧化磷酸化、脂肪酸代谢、胆固醇代谢等代谢通路;章孝颖等(2021)利用TMT技术对不耐高温和耐高温组的大黄鱼(Larimichthys crocea)的肝脏组织进行蛋白组学分析,发现高温胁迫对大黄鱼的蛋白质折叠、能量代谢有显著影响,并推测HSP70、CRT、GRP和PK在大黄鱼应对高温胁迫时发挥着重要作用。贾银海等(2022)应用TMT技术对牦牛抗冻蛋白进行筛选,最终筛选鉴定到CIRP和HSP70等抗寒性候选功能蛋白。
本研究利用TMT技术分析高温胁迫下大菱鲆心脏差异表达蛋白谱,探究与大菱鲆耐高温性状相关的关键蛋白或代谢通路,对于阐明心脏热胁迫响应机制解析以及大菱鲆耐高温新品种的选育具有重要意义。
1 材料与方法 1.1 实验材料实验用鱼均来自山东烟台天源水产有限公司,鱼体体长为(10.34±0.76) cm,体重为(23.01±3.63) g。将实验鱼放入自主研发的可恒定控温的“水产生物环境胁迫封闭式循环水养殖实验系统”(黄智慧等, 2023)中,暂养10 d,暂养期间,采用自然光周期,温度为(14.0±0.5) ℃、盐度为30.0±0.5的水环境。期间每日投喂2次(08:00、16:00),少量投喂,喂食30 min后清理残饵和粪便。根据预实验结果,共设计3个热应激实验温度点:control组(14.0±0.5) ℃(常温),HT1组(20.0±0.5) ℃(高温),HT2组(28.0±0.5) ℃(极高温)。根据Ndong等(2007)的升温方法,稍作改动:即从正常水温(14.0±0.5) ℃按每12 h增加1 ℃的速度升高至各组实验水温,每个温度组设置3个平行实验缸,每缸投放10尾大菱鲆幼鱼,实验期间正常投饵,直至不再摄食。水温达到目标温度后维持12 h进行取样,每个温度组每个平行取3尾鱼样,使用100 mg/L MS-222 (Sigma, 美国)麻醉,取心脏组织放入液氮中,于–80 ℃储存,以备后续开展蛋白组学分析。
甲酸、TMT分子标记试剂盒、1 mol/L TEAB溶液购自ThermoFisher公司,BCA试剂盒、SDS-PAGE蛋白上样缓冲液购自上海碧云天生物技术有限公司,乙腈购自Merck公司,SDS、Tris和BSA试剂购自生工生物工程(上海)股份有限公司,碳酸氢铵、甲酸铵、三氟乙酸、碘乙酰胺、二硫苏糖醇(DTT)等试剂购自Sigma公司,30 kDa超滤离心管购自Sartorius公司,0.22 μm超滤离心管购自Corning。
1.2 蛋白提取和肽段酶解采用SDT裂解法提取蛋白,取上清液,采用BCA法进行蛋白质测定和SDS-PAGE电泳检测。分别取3个实验组样本各200 μg蛋白溶液,使用FASP (filter-aided proteome preparation)进行胰蛋白酶酶解,即分别加入二硫苏糖醇(DTT)至终浓度为100 mmol/L,沸水浴5 min,冷却至室温;加入200 μL UA缓冲液(8 mol/L尿素,150 mmol/L Tris-HCl,pH 8.5)混匀,转入30 kDa超滤离心管中,12 500 g离心25 min,弃滤液,重复该步骤2次;加入100 μL碘乙酰胺(IAA)缓冲液(100 mmol/L IAA in UA),600 r/min振荡1 min,室温避光反应30 min,12 500 g离心25 min;加入100 μL UA缓冲液,12 500 g离心15 min,重复该步骤2次;加入100 μL 0.1 mol/L TEAB溶液,12 500 g离心15 min,重复该步骤2次;加入40 μL Trypsin缓冲液(4 μg Trypsin in 40 μL 0.1 mol/L TEAB溶液),600 r/min振荡1 min,37 ℃放置16~18 h;换新收集管,12 500 g离心15 min;再加入20 μL 0.1 mol/L TEAB溶液,12 500 g离心15 min,收集滤液(Wiśniewski et al, 2009)。
1.3 TMT分子标记及High PH RP分级各样品分别取100 μg肽段,按照Thermo公司TMT标记试剂盒说明书进行标记。标记后进行High PH RP分级,操作如下:将每组标记后的肽段混合,采用Agilent 1260 infinity Ⅱ HPLC系统进行分级;色谱柱以100% A液[10 mmol/L甲酸铵(HCOONH4), 5%乙腈(CAN), pH 10.0]平衡,样品由色谱柱进行分离,流速为1 mL/min。液相梯度:0~25 min,B液(10 mmol/L HCOONH4, 85% ACN, pH 10.0) 0%;25~30 min,B液线性梯度0%~7%;30~65 min,B液线性梯度7%~40%;65~70 min,B液线性梯度40%~100%;70~85 min,B液维持在100%。洗脱过程中在214 nm监测吸光度值,每隔1 min收集洗脱组分,共计收集洗脱组分约40份。将样品冻干后用0.1%甲酸(FA)复溶合并为10份。
1.4 质谱分析及鉴定每份样品采用纳升流速Easy nLC系统进行分离。色谱柱以100%的A液平衡(0.1%甲酸水溶液),样品上样到分析柱进行分离,流速为300 nL/min。B液为0.1%甲酸–乙腈水溶液(乙腈为80%),液相梯度如下:
ⅰ. 1 h梯度:0~3 min,B液6%;3~45 min,B液线性梯度6%~28%;45~50 min,B液线性梯度28%~38%;55~60 min,B液维持在100%。
ⅱ. 1.5 h梯度:0~3 min,B液6%;3~68 min,B液线性梯度6%~28%;68~78 min,B液线性梯度28%~38%;78~85 min,B液线性梯度38%~100%;85~90 min,B液维持在100%。
1.5 质谱鉴定及定量分析使用高分辨质谱仪Q Exactive plus进行TMT定量蛋白质组学分析。采用软件Mascot 2.6和Proteome Discoverer 2.1进行蛋白质鉴定及定量分析。
1.6 生物信息学分析对差异蛋白集合的定量信息进行归一化处理,使用matplotlib软件对样品和蛋白质的表达量两个维度进行分类并生成层次聚类热图,进行蛋白质聚类分析。以差异倍数(fold change, FC)≥1.20或≤0.83,且P < 0.05为条件对所获得的蛋白质筛选差异表达蛋白。利用Blast2GO、KOALA(KEGG Orthology and Links Annotation)软件(Kanehisa et al, 2016),对鉴定的差异蛋白(differentially expressed proteins, DEPs)进行GO、KEGG数据库注释,分析其生物学功能,并进行差异富集分析。依据STRING数据库预测蛋白与蛋白间的互作关系,利用CytoScape 3.2.1绘制蛋白互作网络结构图。
2 结果与分析 2.1 蛋白鉴定PCA图显示,样本质量良好,control、HT1、HT2 3组间样本分散,组内样本聚类良好,组间差异显著(图 1)。经Mascot 2.6和Proteome Discoverer 2.1定量分析共获得291 932张总谱图(total spectra)。其中,鉴定肽段匹配到的谱图(spectra)数量为85 731个;肽段(peptide)数量为35 434个,其中,特有肽段(unique peptide)数量为31 704个;鉴定到的蛋白质总数(protein groups)为4 765个。
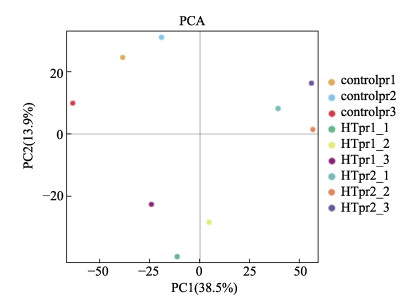
|
图 1 PCA分析结果 Fig.1 Result of PCA analysis |
3个实验组间两两比较形成3个比较组HT1/control、HT2/control和HT2/HT1,对大菱鲆热响应差异蛋白进行筛选,符合FC≥1.20 (上下调)且P < 0.05筛选标准的差异蛋白结果,其中,HT1/control共筛选到87个DEPs,其中,上调蛋白77个,下调蛋白10个;HT2/control共筛选到171个DEPs,其中,上调蛋白149个,下调蛋白22个;HT2/HT1共筛选到188个DEPs,其中,上调蛋白130个,下调蛋白58个(表 1)。对各组间差异表达蛋白的分布绘制火山图,如图 2所示。对3个比较组的差异蛋白定量数据进行分层聚类分析(图 3),结果显示,control组(control1、control2和control3)、HT1高温组(HT1_1、HT1_2和HT1_3)和HT2高温组(HT2_1、HT2_2和HT2_3) 3个组内的热响应差异蛋白表达量的上调和下调趋势较一致,最终3个组间形成明显的不同簇。
|
|
表 1 差异蛋白数目统计 Tab.1 Statistics of differential protein numbers |

|
图 2 大菱鲆心脏高温胁迫差异蛋白火山图 Fig.2 Volcano plot of differential protein in turbot heart under upper thermal stress A、B和C分别表示HT1/control、HT2/control和HT2/HT1组差异蛋白火山图。 A, B and C represent the differential protein volcano maps of HT1/control, HT2/control andHT2/HT1 groups, respectively. |

|
图 3 大菱鲆心脏热响应差异蛋白的分层聚类分析 Fig.3 Hierarchical cluster analysis of differential protein in heat response of turbot heart A、B和C分别表示HT1/control、HT2/control和HT2/HT1组热响应差异蛋白聚类分析。 A, B and C represent the hierarchical cluster analysis of differential protein in HT1/control, HT2/control and HT2/HT1 groups of heat response of turbot, respectively. |
对GO数据库进行比对搜索,将HT1/control、HT2/control、HT2/HT1 3个比较组DEPs进行功能注释,从细胞组成(cellular component, CC)、分子功能(molecular function, MF)和生物学过程(biological process, BP) 3个部分对这些蛋白质进行分类(图 4)。结果显示,各组差异蛋白的GO功能富集基本相似,在生物学过程中,主要富集在生物调节、对刺激的反应、细胞过程、代谢过程、定位等;在分子功能中,主要富集在结合、催化活性、分子功能调节器等;在细胞成分中,主要富集在细胞部分、细胞膜、蛋白复合体、细胞器等。

|
图 4 大菱鲆心脏高温胁迫差异蛋白GO富集分析 Fig.4 GO enrichment analysis of differentially expressed proteins in turbot heart under upper thermal stress A、B和C分别表示HT1/control、HT2/control和HT2/HT1 3个对比组差异蛋白GO富集分析。 A, B and C represent GO enrichment analysis of differential protein in HT1/control, HT2/control and HT2/HT1 groups, respectively. |
根据KEGG数据库对大菱鲆高温胁迫差异蛋白进行注释,各组间的富集分析结果以散点图的形式呈现(图 5)。结果显示,HT2/control、HT2/HT1 2个比较组之间的差异蛋白的KEGG功能富集情况基本相似,主要富集于与炎症和免疫防御相关的通路,如抗原处理和呈递(antigen processing and presentation)、补体和凝血级联(complement and coagulation cascades),PPAR通路(PPAR signaling pathway)等;与信号传递相关的通路,如多物种长寿调节途径(longevity regulating pathway-multiple species)、雌激素信号通路(estrogen signaling pathway)等;与蛋白质合成相关的通路,如内质网中的蛋白质加工(protein processing in endoplasmic reticulum);与脂肪酸代谢有关的通路,如不饱和脂肪酸的生物合成(biosynthesis of unsaturated fatty acids);以及与氧化还原相关的通路,如过氧化物酶体(peroxisome)等。HT1/control比较组则主要富集在造血细胞系(hematopoietic cell lineage),脂肪酸降解(fatty acid degradation)、脂肪酸代谢(fatty acid metabolism)、亚油酸代谢(linoleic acid metabolism)等通路中,而且在常温(control)与高温组(HT2和HT1)的各组间差异蛋白富集通路中均包含溶酶体(lysosome)。

|
图 5 大菱鲆高温胁迫差异蛋白KEGG富集分析 Fig.5 KEGG enrichment analysis of differentially expressed proteins in turbot heart under upper thermal stress A、B和C分别表示HT1/control、HT2/control和HT2/HT1 3个对比组差异蛋白KEGG富集分析。 A, B and C represent KEGG enrichment analysis of differential protein in HT1/control, HT2/control and HT2/HT1 groups, respectively. |
对3个对比组的DEPs进行综合分析,筛选在不同的温度条件具有连续表达差异趋势,即在极高温28 ℃表达量最高,高温20 ℃表达量较低,常温14 ℃表达量最低,说明这些蛋白在极高温28 ℃状态下表达量显著高于常温,据此推测这些蛋白是参与高温胁迫下机体调节过程中发挥重要生物学作用的关键蛋白。文中整理了部分重要的DEPs的筛选信息(表 2),同时绘制这些关键蛋白相互作用网络结构图(图 6),结果显示,关联度最高的是HSP90B (94 kDa glucose-regulated protein),其次是HYOU1 (hypoxia up-regulated protein 1)、HSPA5 (78 kDa glucose-regulated protein)以及HSP90A (heat shock protein HSP 90-alpha 1)。热休克蛋白(HSP90B、HSPA5、HSP70、HSP90和HSP47)以及缺氧上调蛋白(HYOU1)在热胁迫条件下均呈上调趋势,预测其可作为大菱鲆耐高温育种的候选蛋白。
|
|
表 2 部分重要DEPs筛选信息 Tab.2 The screening information for important DEPs |

|
图 6 大菱鲆热胁迫响应蛋白互作网络分析 Fig.6 Network interaction analysis of differential protein in upper-thermal stress of turbot |
蛋白组学是通过系统、定量地研究蛋白质在不同细胞、组织中的表达水平来探究基因的功能、蛋白质之间的相互作用以及生命过程的作用机制,被当作解释生物系统的最有力的数据集(Lόpez, 2007; 乔彦涛等, 2010)。蛋白组学的研究对象不仅包含基因组编码的所有蛋白质,还包括蛋白组内部的动态变化,如响应各种刺激而发生的翻译后修饰(闵力, 2017; 田大龙, 2019)。本研究利用TMT联合LC-MS/MS技术对大菱鲆热胁迫条件下开展蛋白组学分析,共鉴定4 765个蛋白质,按照表达差异倍数大于1.2倍(上下调)且P<0.05筛选标准,筛选出了359个差异表达蛋白。
对各组间差异表达蛋白进行KEGG富集分析,发现极高温组HT2/对照组control和极高温组HT2/高温组HT1间的富集情况基本相似,主要富集在与炎症和免疫防御相关的通路上。炎症反应是机体产生的一种自身保护性反应,目的是修复受损组织、消除有害刺激(郭勋等, 2020),也是检测健康状态的重要指标之一,本研究结果也证实了高温胁迫会导致大菱鲆心脏组织发生炎症反应,该结果与虹鳟(Oncorhynchus mykiss)热应激结果相似(董福霖, 2022)。研究表明,机体受到热应激后,其免疫机制会启动从而维持机体内稳态(Wang et al, 2021),补体系统、抗原处理和呈递通路等在本研究中被富集,说明大菱鲆面对高温胁迫时会启动自身免疫系统,有效抵御外界环境的压力。PPAR信号通路和过氧化物酶体也被显著富集,这2个通路在能量代谢调节、维持葡萄糖稳态和脂质代谢中发挥着关键作用。通过极高温组与其他组的KEGG富集分析,我们推测,极高温胁迫会引起大菱鲆脂质代谢紊乱,诱导炎症反应、免疫系统启动保护机制以及氧化应激的系统性变化,并持续影响这些代谢路径。
对3个实验组的比较分析,筛选在不同温度条件具有连续表达差异趋势的蛋白,结果显示,热休克蛋白HSP70基因家族的3个成员(HSP70、HSPA4、HSPA5 (GRP78))均显著表达上调,这与虹鳟鱼热胁迫结果相似(Li et al, 2017; Xia et al, 2018; 李永娟, 2018)。Wang等(2021)对鲤鱼(Cyprinus carpio)热应激的研究发现,轻度和中度热应激都会导致心脏和肾脏中HSP70表达上调。HSP70蛋白功能至关重要,其可与效应因子结合应对应激引起的细胞凋亡,也是最保守的HSP家族之一。HSP90是一种分子伴侣,参与细胞免疫应答,其中,HSP90α是HSP90的诱导形式,它参与蛋白折叠、稳定并调节细胞蛋白,本研究中HSP90α显著上调,并富集到多条免疫路径中,表明其表达水平升高是一种机体的一种保护途径。由于热应激可能导致机体细胞内质网腔内错误折叠蛋白与未折叠蛋白聚集,从而引起鱼体内质网应激,激活未折叠蛋白反应来维持内质网的正常功能,而这其中HSP家族蛋白中的HSPA5(GRP74)、HSP90B(GRP94)的表达上调至关重要,这也提示,大菱鲆心脏细胞在热胁迫条件下可能发生了内质网应激响应,这一结果与前期研究相似(Mao et al, 2019; 康玉军, 2020)。HSP47是一种驻留在内质网的分子伴侣,能特异性识别胶原蛋白的三螺旋部分,在内质网中,可促进胶原的组装与输出,HSP47的表达模式与胶原表达密切相关(Chu et al, 2019)。本研究结果显示,其蛋白含量呈上调趋势,这表明热应激后,心脏组织受损,需要分泌HSP47蛋白促进胶原蛋白的表达,从而维持心肌功能。
值得注意的是,本研究发现纤维蛋白原相关蛋白(FGA、FGB和FGG)表达水平呈上升趋势,这在以往有关水产动物热响应研究中未被发现,由于本研究是对心脏组织开展,可能这属于组织特异性响应蛋白。纤维蛋白原(fibrinogen, Fib)即凝血因子Ⅰ,其作为凝血因子在凝血酶的作用下形成纤维蛋白单体,最终交联为纤维蛋白网,参与血液凝固。目前研究已表明,Fib水平升高是人类心脑血管疾病发病的独立危险因素(吴文法等, 2011)。我们推测,鱼类在高温胁迫诱导下,心脏发生了凝血现象,导致携氧能力降低,从而造成氧化损伤。这一研究还需要进一步探究和验证。
4 结论本研究利用TMT联合LC-MS/MS技术开展了高温胁迫下大菱鲆心脏差异表达蛋白谱分析,以此探究与大菱鲆耐高温性状相关的关键蛋白或代谢通路。研究结果显示,高温会影响大菱鲆的脂质代谢,引起炎症反应并使大菱鲆启动自身免疫防御。热休克蛋白家族多个蛋白(HSP90B、HSP70等)在高温条件下表达显著上调,推测其对大菱鲆应对热胁迫有积极作用。另外,一个新的发现是,随温度升高,纤维蛋白原相关蛋白(FGA、FGB和FGG)表达水平呈上升趋势,推测高温可能使鱼类心脏发生凝血,但其具体机制仍需进一步研究。预测HSP90B、HSPA5和HYOU1可以作为大菱鲆耐高温育种的候选蛋白,但还需要进一步验证。本研究对于阐明心脏热胁迫响应机制解析以及大菱鲆耐高温新品种的选育具有重要意义。
CHU H, JIN L, WANG J. HSP47 and its involvement in fibrotic disorders. Heat Shock Proteins, 2019, 16: 299-312 |
DONG F L. Physio-biochemical and transcript to me analysis of Oncorhynchus mykiss in response to high temperature stress. Master's Thesis of Shanghai Ocean University, 2022 [董福霖. 虹鳟高温胁迫条件下生理生化响应和转录组分析. 上海海洋大学硕士研究生学位论文, 2022]
|
GUO X L, HUANG Z H, MA A J, et al. Effects of thermal stress on turbot (Scophthalmus maximus) myocardial injury and apoptosis. Journal of Fisheries of China, 2022, 46(6): 1074-1084 [郭晓丽, 黄智慧, 马爱军, 等. 热应激对大菱鲆心肌损伤及细胞凋亡的影响. 水产学报, 2022, 46(6): 1074-1084] |
GUO X L. Study on turbot (Scophthalmus maximus) myocardial injury and function of p53 signaling pathway related regulatory genes under thermal stress. Master's Thesis of Shanghai Ocean University, 2021 [郭晓丽. 热应激条件下大菱鲆心肌损伤及p53信号通路相关调控基因的功能研究. 上海海洋大学硕士研究生学位论文, 2021]
|
GUO X, CHENG K, MA C S, et al. Effects of dietary vitamin D3 on the growth and expression of TLR18, TLR19 and TLR21 in the juvenile yellow catfish Pelteobagrus fulvidraco. Acta Hydrobiologica Sinica, 2020, 44(3): 461-469 [郭勋, 程珂, 马春松, 等. 饲料中维生素D3的添加水平对黄颡鱼幼鱼生长和Toll样受体TLR18、TLR19和TLR21的影响. 水生生物学报, 2020, 44(3): 461-469] |
HOU Y H. Study on the protective effect of taurine on heart injury in broiler chickens infected with E. coli. Master's Thesis of Shenyang Agricultural University, 2022 [侯元华. 牛磺酸对大肠杆菌感染肉鸡心脏损伤的保护作用研究. 沈阳农业大学硕士研究生学位论文, 2022]
|
HUANG Z H, MA A J, WANG Q M, et al. Experimental system and usage methods for closed loop aquaculture of fish under hypoxia stress. Shandong Province: CN115226665B, 2023-05-26 [黄智慧, 马爱军, 王庆敏, 等. 鱼类低氧胁迫封闭式循环水养殖实验系统及使用方法. 山东省: CN115226665B, 2023-05-26]
|
IFTIKAR F, MORASH, A, COOK D, et al. Temperature acclimation of mitochondria function from the hearts of a temperate wrasse (Notolabrus celidotus). Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2015, 184: 46-55 DOI:10.1016/j.cbpa.2015.01.017 |
JI L Q, JIANG K Y, LIU M, et al. Low temperature stress on the hematological parameters and HSP gene expression in the turbot Scophthalmus maximus. Chinese Journal of Marine and Limnology, 2016, 34(3): 430-440 |
JIA S, HONG H, YANG Q, et al. TMT-based proteomic analysis of the fish-borne spoiler Pseudomonas psychrophila subjected to chitosan oligosaccharides in fish juice system. Food Microbiology, 2020, 90: 103494 DOI:10.1016/j.fm.2020.103494 |
JIA Y H, ZHANG C F, ZHANG Q, et al. TMT proteomics and bioinformatics to analyze differential proteins in cold resistance of yaks. Journal of Southern Agriculture, 2022, 53(1): 1-11 [贾银海, 张成福, 张强, 等. 基于TMT蛋白组学及生物信息学分析牦牛抗冻差异蛋白. 南方农业学报, 2022, 53(1): 1-11] |
KANEHISA M, GOTO S, SATO Y, et al. KEGG for integration and interpretation of large-scale molecular data sets. Nucleic Acids Research, 2012, 40: D109-114 DOI:10.1093/nar/gkr988 |
KANG Y J. Proteomics and metabolomics analysis of rainbow trout (Oncorhynchus mykiss) liver responses to heat stress. Doctoral Dissertation of Gansu Agricultural University, 2020 [康玉军. 虹鳟肝脏响应高温胁迫的蛋白质组学与代谢组学研究. 甘肃农业大学博士研究生学位论文, 2020]
|
KUANG L D, DONG Y X, LI C Y, et al. Analysis of the effect of heat stress on protein expression in female rabbit ovarian tissue based on TMT technology. Chinese Journal of Animal Husbandry, 2021, 57(9): 84-90 [邝良德, 董宜萱, 李丛艳, 等. 基于TMT技术分析热应激对母兔卵巢组织蛋白表达的影响. 中国畜牧杂志, 2021, 57(9): 84-90] |
LI Y J. Transcriptome analysis of liver and head kidney in rainbow trout (Oncorhynchus mykiss) reveals the response to heat stress by RNA-seq. Doctoral Dissertations of Gansu Agricultural University, 2018 [李永娟. 基于RNA-seq的热应激条件下虹鳟肝脏和头肾转录组分析. 甘肃农业大学博士研究生学位论文, 2018]
|
LI Y, HUANG J, LIU Z, et al. Transcriptome analysis provides insights into hepatic responses to moderate heat stress in the rainbow trout (Oncorhynchus mykiss). Gene, 2017, 619: 1-9 |
LÓPEZ J L. Applications of proteomics in marine ecology. Marine Ecology Progress Series, 2007, 332: 275-279 |
MAO J, HU Y, RUAN L, et al. Role of endoplasmic reticulum stress in depression (review). Molecular Medicine Reports, 2019, 20(6): 4774-4780 |
MENG Z, ZHANG H L, LIU X F, et al. Effect of acute heat stress on plasma biochemical indexes in turbot Scophthalmus maximus. Marine Sciences, 2020, 44(1): 122-131 [孟振, 张鸿丽, 刘新富, 等. 急性热应激对大菱鲆血液生化指标的影响. 海洋科学, 2020, 44(1): 122-131] |
MIN L. Based on metabolic response, proteomics and bacterial diversity for elucidating the effects of heat stress in lactating dairy cows. Doctoral Dissertation of China Agricultural University, 2017 [闵力. 基于生理代谢、蛋白组学和菌群多样性解析热应激对泌乳奶牛的影响. 中国农业大学博士研究生学位论文, 2017]
|
NDONG D, CHEN Y, LIN Y, et al. The immune response of tilapia Oreochromis mossambicus and its susceptibility to Streptococcus iniae under stress in low and high temperatures. Fish and Shellfish Immunology, 2007, 22: 686-694 |
QIAO Y T, MIAO J Z, SUN S W, et al. Review on protein identification approaches based on tandem mass spectrometry. Journal of Frontiers of Computer Science and Technology, 2010, 4(2): 97-107 [乔彦涛, 缪佳铮, 孙世伟, 等. 串联质谱的蛋白质序列鉴定技术综述. 计算机科学与探索, 2010, 4(2): 97-107] |
TIAN D L. The study on the molecular mechanism of dietary lysine in the growth and development of broiler based on proteomics analysis. Master's Thesis of Northwest A & F University, 2019 [田大龙. 基于蛋白组学分析的日粮赖氨酸对肉鸡生长发育影响的分子机制. 西北农林科技大学硕士研究生学位论文, 2019]
|
WANG B, MA G, LIU Y, et al. Effects of different temperatures on the antibacterial, immune and growth performance of crucian carp epidermal mucus. Fishes, 2021, 6(4): 66-77 |
WIŚNIEWSKI J R, ZOUGMAN A, NAGARAJ N, et al. Universal sample preparation method for proteome analysis. Nature Methods, 2009, 6: 359-362 |
WU W F, LING L, ZHANG S P. Research progress on the relationship between fibrinogen and cardiovascular and cerebrovascular diseases. Chinese Journal of Geriatric Heart Brain and Vessel Diseases, 2011, 13(12): 1145-1146 [吴文法, 凌莉, 张素平. 纤维蛋白原与心脑血管疾病关系的研究进展. 中华老年心脑血管病杂志, 2011, 13(12): 1145-1146] |
XIA B, LIU Z, ZHOU Y, et al. Effects of heat stress on biochemical parameters and heat shock protein family a (hsp70) member 5 (hspa5) mRNA expression in rainbow trout (Oncorhynchus mykiss). Marine and Freshwater Research, 2018, 69: 1674-1680 |
YANG M X, LIU M J, WANG J, et al. Effects of curcumin on the antioxidative properties of the liver of heat-stressed laying hens based on TMT proteomics. Journal of Nanjing Agricultural University, 2024, 47(1): 96-104 [杨铭宣, 刘梦杰, 王晋, 等. 基于TMT蛋白组学分析姜黄素对热应激蛋鸡肝脏抗氧化性能的影响. 南京农业大学学报, 2024, 47(1): 96-104] |
ZHANG L, YAO Y F, QIN A Q, et al. Proteomic analysis for yaks PASMCs under hypoxia and normoxia conditions based on TMT technique. Acta Veterinaria et Zootechnica Sinica, 2022, 53(7): 2182-2193 [张兰, 姚一凡, 覃安琪, 等. 基于TMT技术对低氧与常氧条件下牦牛PASMCs的蛋白组学分析. 畜牧兽医学报, 2022, 53(7): 2182-2193] |
ZHANG X Y, CAI X F, LIU X D, et al. Proteomics of liver tissue of large yellow croaker (Larimichthys crocea) under high temperature stress. Journal of Fisheries of China, 2021, 45(6): 862-870 [章孝颖, 蔡晓芳, 刘贤德, 等. 高温胁迫下大黄鱼肝脏的蛋白质组学. 水产学报, 2021, 45(6): 862-870] |
ZHANG X, JIANG M, CAI X, et al. iTRAQ-based quantitative proteome analysis in liver of large yellow croaker Larimichthys crocea under high temperature stress. Aquaculture Reports, 2023, 28: 101444 |
ZHAO Y H, MEI G M, ZHANG X J, et al. Tandem mass tag-based proteomics technology analyzing the effects of seawater slurry ice-assisted preservation on muscle proteins of Larimichthys crocea. Journal of Zhejiang University (Agriculture and Life Sciences), 2023, 49(4): 566-577 [赵月涵, 梅光明, 张小军, 等. 基于串联质谱标签的蛋白质组学技术分析海水流化冰辅助保鲜对大黄鱼肌肉蛋白质的影响. 浙江大学学报(农业与生命科学版), 2023, 49(4): 566-577] |



