2. 中国水产科学研究院黄海水产研究所 海水养殖生物育种与可持续产出全国重点实验室 山东省海洋渔业生物技术与遗传育种重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室 山东 青岛 266071;
3. 青岛海洋科技中心海洋生物学与生物技术功能实验室 山东 青岛 266071;
4. 烟台开发区天源水产有限公司 山东 烟台 264006
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, State Key Laboratory of Mariculture Biobreeding and Sustainable Goods, Shandong Provincial Key Laboratory of Marine Fisheries Biotechnology and Genetic Breeding, Qingdao Key Laboratory of Marine Fish Seed Engineering and Biotechnology, Qingdao 266071, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao Marine Science and Technology Center, Qingdao 266071, China;
4. Yantai Development Zone Tianyuan Aquatic Products Co., Ltd., Yantai 264006, China
盐度是影响鱼类分布和生存的重要环境因子,能直接影响鱼类的生长、代谢和繁殖等生理过程(Bowden, 2008)。大多数鱼类具有一定的耐盐性,可通过渗透调节在一定的盐度范围内生存(Anni et al, 2016),但当盐度变化超过鱼体自身的调节能力时,会破坏鱼体内环境稳态,造成机体渗透压失衡,引起鱼体的应激反应,导致生长减慢、免疫机能下降、器官损伤、代谢紊乱等,甚至会导致其死亡(Qiang et al, 2013; Khairnar et al, 2015; 黄屾等, 2022)。对鱼类抗逆选育来说,逆境下存活并不是唯一的关注点,逆境下正常生长才是更重要的目标,而生长与能量代谢息息相关。目前,关于盐度胁迫因子的研究大多集中在渗透调节方面(Li et al, 2020; 刘龙龙等, 2020),现有关于盐度与能量代谢的研究仅通过检测酶活的变化来阐述二者的关联性(Abdel-Latif et al, 2023; 张宇婷等, 2021)。本课题组前期研究发现,低盐胁迫下的大菱鲆(Scophthalmus maximus)肝脏中大量脂质代谢相关基因参与了对低盐胁迫的响应,暗示脂质代谢调节可能是鱼类应对低盐胁迫的重要途径(Liu et al, 2020)。
脂质代谢是维持机体正常基本生命活动的基础代谢,主要在肝脏中进行,涉及到多种物质的协同代谢,主要包括脂质的摄取、转运、合成和氧化分解,并涉及到具有关键酶和转录因子的几种生化途径(Cho et al, 2015)。饲料中不同的脂质含量和组成会影响肝脏脂质代谢途径中的主要关键基因以及控制调节这些基因表达的主要转录因子及核受体的表达,对这些基因表达的研究结果能反映鱼体脂质代谢的稳态。有研究报道,饲料中脂质的含量和组成对鱼类的脂质代谢相关基因的表达有显著影响,例如,对半滑舌鳎(Cynoglossus semilaevis)投喂高脂肪饲料(21.88%)显著抑制了acc-2和fas的相对表达(Yuan et al, 2017);在大菱鲆中,随着饲料豆油水平的增加,其肝脏中fas、lpl、pparα和mtp基因的相对表达量显著增加,cpt-1和lxr的相对表达量显著降低(Peng et al, 2014);在大西洋鲑鱼(Salmo salar)中,饲料中的长链多不饱和脂肪酸水平显著降低了srebp-1的表达(Hixson et al, 2017)。然而,关于不同脂肪含量饲料在不同盐度下对鱼类脂质代谢基因表达的影响还未见报道。
大菱鲆自1992年引入我国后,逐渐成为沿海地区尤其是北方沿海的主要经济养殖品种(雷霁霖等, 1998)。大菱鲆盐度耐受范围较广,成鱼能在盐度12~40范围内较好地生长,甚至能在盐度5的环境下生存(雷霁霖等, 1998)。近年来,港口建设、深井海水过度开采等导致适宜大菱鲆养殖的水资源和区域不断减少,养殖区域向滩涂地区拓展,对大菱鲆的耐低盐性状提出了更高的要求。因此,基于课题组前期关于低盐胁迫导致大菱鲆脂质代谢紊乱的研究结果,本研究以大菱鲆幼鱼为研究对象,设置3个盐度梯度、4种脂肪含量饲料,探求在不同盐度环境下不同脂肪含量饲料对大菱鲆幼鱼生长性能、脂质代谢相关基因表达的影响。研究结果将从盐度影响脂质代谢的角度探索鱼类对低盐的适应性,旨在为大菱鲆耐低盐良种选育提供理论和技术支撑。
1 材料与方法 1.1 实验饲料以鱼粉、虾粉等为主要蛋白源,鱼油为脂肪源,通过调整饲料中鱼油的含量,配制4种不同脂肪含量的等蛋白饲料,送至青岛菲优特检测有限公司验证检测,脂肪含量分别为8%、12%、16%和20%,粗蛋白含量均为43.02%,粗灰分含量均为11.7%,水分含量均为8%。实验基础饲料配方及成分见表 1。
|
|
表 1 实验饲料组成 Tab.1 Composition of the experimental diets |
实验用大菱鲆幼鱼购自山东科合海洋高技术有限公司,选择1 800尾大菱鲆健康幼鱼,平均分配到36个循环水养殖桶(50 L)中暂养7 d,养殖用水为天然海水,盐度为30,水温为(14.0±0.5) ℃,溶氧为(8.0±0.5) mg/L,pH为8.0±0.2,光照周期12L∶12D。暂养期间不进行投喂,每天测量1次温度、盐度、pH及溶解氧等水质指标,保持养殖条件的稳定。
实验分为12个组,3个盐度梯度(10、20和30),每个盐度对应4种脂肪含量(8%、12%、16%和20%),每组3个重复。盐度30组直接使用天然海水,盐度10和20组养殖用水由天然海水和淡水勾兑稀释而成,其他条件保持不变。实验开始前,测定初始体重、体长和全长,体重为(18.99±1.78) g,全长为(10.85± 0.71) cm,体长为(8.91±0.59) cm,实验期间,每天投喂2次(08:00和18:00),投喂量从体重的1%逐渐增加到体重的2%。按时定期清理粪便和残渣,定期监测养殖条件,实验周期为60 d。
1.3 样品采集与生长性状测定养殖实验结束后,停食24 h,称量记录终末体重、体长和全长。各组随机选9尾鱼,使用200 mg/L的MS-222麻醉后,冰上迅速解剖取出肝脏,放入冻存管后立即在液氮中速冻,–80 ℃保存备用。每组再随机选取9尾鱼,MS-222麻醉后冰上迅速解剖取出肝脏并称重,计算肝体比(HSI),计算公式:
| $ \text{PHSI}=W_\text{I}/W_\text{b}×100% $ |
式中,WI为肝脏质量(g);Wb为鱼体质量(g)。
1.4 总RNA提取与cDNA的合成使用天根生化科技(北京)有限公司总RNA提取试剂盒提取肝脏组织总RNA,使用Thermo NanoDrop 2000/2000C超微量分光光度计检测RNA的浓度和纯度,用1%琼脂糖凝胶电泳检测RNA的完整度,RNA原液于–80 ℃保存。使用北京全式金生物技术股份有限公司(TransGen Biotech) TransScript一步法gDNA去除及cDNA合成试剂盒合成cDNA,–20 ℃保存备用。
1.5 实时荧光定量PCR以反转录得到的cDNA为模板,使用天罗诊断集团TOROGreen qPCR Master Mix试剂盒,在Applied Biosystems StepOnePlus PCR仪上进行实时荧光定量PCR(qRT-PCR)。反应体系为20 μL:Master Mix 10.0 μL,RNase-Free ddH2O 6.4 μL,引物F和引物R各0.8 μL,cDNA模板2.0 μL。反应程序:95 ℃、60 s;95 ℃、10 s;60 ℃、30 s,循环40次。以β-actin基因为内参基因,脂质代谢相关基因(肝X受体α,lxrα;脂肪酸合成酶,fas;胆固醇7α-羟化酶,cyp7a1;载脂蛋白A-Ⅳ,apoa-Ⅳ;乙酰辅酶A羧化酶,acc;脂肪酸结合蛋白,fabp;固醇调节元件结合蛋白1,srebp-1)引物序列引自Liu等(2020),引物序列见表 2。引物均由生工生物工程(上海)股份有限公司合成,使用2–ΔΔCt法计算目的基因相对表达量。
|
|
表 2 脂质代谢相关基因及内参基因引物序列 Tab.2 Primer sequences of lipid metabolism-related genes and β-actin gene |
结果使用平均值±标准差(Mean±SD)表示,使用SPSS 18.0软件对所得数据进行统计和分析,使用GraphPad Prism 6软件进行图片绘制,采用双因素方差分析法(two-way ANOVA)对生长性能及脂质代谢相关基因进行显著性检验,使用Levene检验方差齐性,使用Duncan多重比较进行事后检验,P < 0.05为显著水平。
2 结果 2.1 不同盐度和脂肪含量处理对大菱鲆幼鱼生长性能的影响由表 3可知,盐度水平对大菱鲆幼鱼生长性能无显著影响(P > 0.05),但在特定脂肪含量下有显著影响,脂肪含量16%条件下,盐度30和20组的生长性能高于盐度10组的生长性能,且盐度30和20组的体重显著高于盐度10组的体重(P < 0.05);脂肪含量水平对大菱鲆幼鱼生长性能的影响显著(P < 0.05),随着脂肪含量的升高,大菱鲆体重呈先升高后降低的趋势(P < 0.05);盐度和脂肪含量的交互作用对大菱鲆幼鱼生长性能的影响显著(P < 0.05)。在盐度30和20条件下,随着脂肪含量的升高,大菱鲆幼鱼生长性能呈先升高后降低的趋势,最好的生长表现出现在16%组,且2个盐度之间生长性能差异不显著(P > 0.05);在盐度10养殖条件下,随着脂肪含量的升高,大菱鲆幼鱼生长性能呈现升高的趋势,最好的生长表现出现在20%组,并且盐度10下的20%组的生长性能高于盐度20及30下的20%组。盐度水平与脂肪含量水平对大菱鲆幼鱼肝体比的影响均不显著(P > 0.05),盐度和脂肪含量的交互作用对大菱鲆幼鱼肝体比的影响显著(P < 0.05)。在盐度10下,肝体比随脂肪含量的升高而升高,20%组的肝体比最高(P < 0.05),且盐度10下20%组的肝体比显著高于盐度30和20下20%组的肝体比(P < 0.05)。
|
|
表 3 不同盐度和脂肪含量处理下大菱鲆幼鱼生长性能 Tab.3 Growth performance of juvenile turbot under different salinities and lipid concentrations |
不同盐度水平下,不同脂肪含量水平对大菱鲆幼鱼脂质代谢相关基因表达的影响见表 4和图 1。由表 4可知,盐度水平对acc和srebp-1基因的表达量影响不显著(P > 0.05),对lxrα基因的表达量存在显著影响(P < 0.05),对fas、cyp7a1、fabp和apoa-IV基因的表达量存在极显著影响(P < 0.01)。脂肪含量水平对fas和srebp-1基因的表达量存在显著影响(P < 0.05),对acc、cyp7a1、lxrα、fabp和apoa-IV基因的表达量存在极显著影响(P < 0.01)。盐度和脂肪含量的交互作用对cyp7a1、fabp、apoa-IV、srebp-1、acc和fas基因的表达量存在极显著影响(P < 0.01),对lxrα基因的表达量无显著影响(P > 0.05)。在最佳脂肪含量为16%时,盐度的降低抑制了cyp7a1、apoa-IV、lxrα和srebp-1基因的表达量,上调了fabp和acc基因的表达量;在低脂肪(8%和12%)时,盐度的降低抑制了cyp7a1、apoa-IV和srebp-1基因的表达量,上调了fas和acc基因的表达量;在高脂肪20%下,盐度的降低上调了fabp和apoa-IV基因的表达量,抑制了lxrα、acc和cyp7a1基因的表达量。
|
|
表 4 不同盐度和脂肪含量处理下脂质代谢基因表达量的方差分析 Tab.4 ANOVA for expression of lipid metabolism-related genes of turbot under different salinities and lipid concentrations |
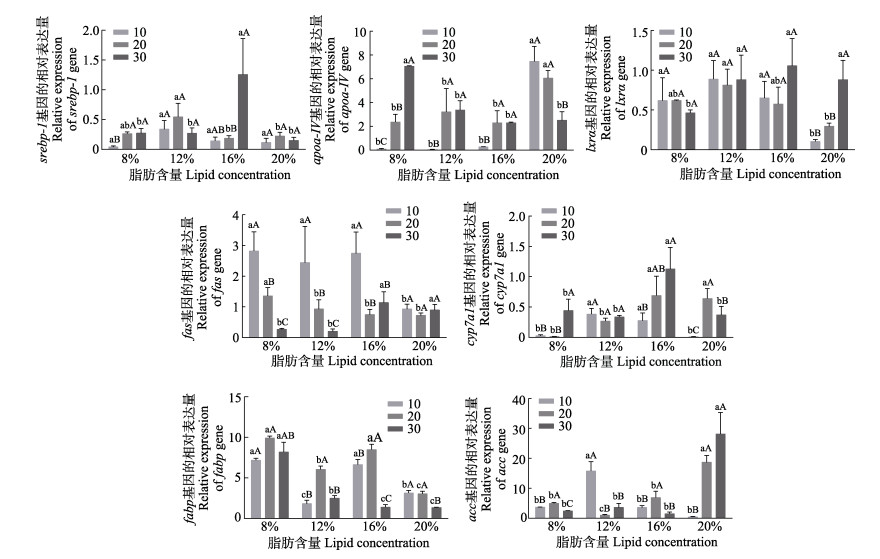
|
图 1 不同盐度和脂肪含量下脂质代谢相关基因表达量 Fig.1 Expression of lipid metabolism-related genes of turbot under different salinities and lipid concentrations 不同小写字母表示相同盐度、不同脂肪含量下脂质代谢相关基因表达量之间差异显著(P < 0.05);不同大写字母表示相同脂肪含量、不同盐度下脂质代谢相关基因表达量之间差异显著(P < 0.05)。 The different lowercase letters in the figure indicate significant difference in the expression levels of lipid metabolism-related genes under different lipid concentrations and same salinity (P < 0.05). The different capital letters indicate significant difference in the expression levels of lipid metabolism-related genes at different salinities and same lipid concentration (P < 0.05). |
在盐度30下,lxrα、fas、srebp-1和cyp7a1基因的表达量随脂肪含量的升高呈先升高后降低的趋势;16%组srebp-1和cyp7a1基因的表达量显著高于其他组(P < 0.05),lxrα和fas基因的表达量高于其他组(P > 0.05);20%组acc基因的表达量显著高于其他组(P < 0.05);apoa-IV和fabp基因表达量随脂肪含量的升高呈下降的趋势,其中,8%组显著高于其他各组(P < 0.05)。
在盐度20时,lxrα和srebp-1基因的表达量随脂肪含量的升高呈先升高后降低的趋势,12%组表达量最高,显著高于20%组(P < 0.05);acc基因的表达量随着脂肪含量的升高呈先降低后升高的趋势,20%组显著高于其他组(P < 0.05);fabp基因的表达量随脂肪含量的升高呈先下降后升高再下降的趋势(P < 0.05);apoa-IV基因的表达量在20%组最高,显著高于其他各组(P < 0.05);fas基因的表达量随脂肪含量的升高呈下降的趋势,8%组的表达量显著高于其他各组(P < 0.05)。
在盐度10时,lxrα、srebp-1、cyp7a1和acc基因的表达量随脂肪含量的升高呈先升高后降低的趋势;12%组acc基因的表达量显著高于其他组(P < 0.05),lxrα、srebp-1和cyp7a1基因的表达量高于其他组(P > 0.05);fabp基因的表达量随脂肪含量的升高呈先下降后升高再下降的趋势,20%组表达量最低,显著低于其他各组(P < 0.05);fas基因的表达量随脂肪含量的升高呈下降的趋势,20%组表达量最低,显著低于其他各组(P < 0.05);apoa-IV基因的表达量随脂肪含量的升高呈升高的趋势,20%组的表达量最高,显著高于其他各组(P < 0.05)。
3 讨论盐度作为水生生物重要的环境因子,盐度胁迫直接影响鱼类的生长、存活以及生理活动等(Wu et al, 2017),并且鱼类需要消耗更多的能量来维持内环境稳态。因此,在应对胁迫的过程中离不开能量代谢,脂质代谢是鱼类能量代谢中重要的组成部分。饲料中脂质的添加水平会直接影响水生生物的生长性能、脂质代谢以及消化酶活性等,在应对盐度胁迫的过程中至关重要(Li et al, 2022)。本研究通过不同盐度条件下不同脂肪含量饲料的双因素实验设计,探讨了不同脂肪含量对低盐胁迫下大菱鲆幼鱼的生长性能及脂质代谢相关基因表达的影响。
在本研究中,在盐度30与20时,随着脂肪含量的升高,大菱鲆幼鱼的生长呈先升高后降低的趋势,最好的生长表现出现在脂肪含量16%组,超过16%生长性能随之下降。这与刘迎隆等(2019)、向枭等(2013)、董晓慧等(2015)在军曹鱼(Rachycentron canadum L.)、白甲鱼(Onychostoma simus)、斜带石斑鱼(Epinephelus coioides)的结果一致,鱼类对饲料脂质水平的利用有一定的限制,超过该水平可能会导致饲料利用率下降从而抑制生长(卢正义等, 2021)。另外,盐度20与30下的大菱鲆幼鱼的生长性能无显著差异,尤其是在最佳脂肪含量(16%)的养殖条件下。说明盐度20对大菱鲆养殖来说并不会产生生长胁迫,可以进行正常养殖。在最佳脂肪含量(16%)时,盐度10组的大菱鲆幼鱼的生长性能要低于盐度20和30组,说明在此盐度下会给大菱鲆幼鱼产生一定的胁迫。然而,从盐度整体看来,各组生长表现无显著差异。这与盐度10条件下脂肪含量20%组的生长表现有关,在盐度10下大菱鲆幼鱼的生长性能随脂肪含量的增加而增加,最好的生长表现出现在20%组,且高于盐度30与20下的20%组,说明高脂肪在一定程度上缓解了低盐环境造成的生长胁迫。HSI是鱼类比对短期和长期营养方式都很敏感的指标(张慧晶等, 2009),许多研究表明,HSI与饲料中的脂质水平密切相关(Luo et al, 2005; López et al, 2006),在一定范围内,肝体比增加则说明机体代谢旺盛,鱼体生长情况良好(朱莉等, 2014),但也表明肝脏脂质沉积的增多,肝功能负担加剧。本研究发现,在盐度10的养殖条件下,肝体比随脂肪含量的增高而增高,且20%组的肝体比显著高于其他组,说明高脂肪在一定程度上缓解了低盐胁迫造成的不利影响,同时,也从侧面反映脂质累积增加,这也与本研究结果中脂质转运相关基因表达的结果相一致。
肝脏是脂质代谢发生的重要场所(廖春燕等, 2023),肝脏可通过改变脂质代谢来应对不利环境(Lai et al, 2021)。肝X受体(lxrs)是调节肝脏脂质代谢过程的关键基因,主要包括lxrα和lxrβ两种亚型,lxrβ没有表达特异性,lxrα在肝脏的表达量最高;lxrα在胆固醇转运、胆汁酸和脂肪酸合成等过程中发挥作用,维持胆固醇代谢的平衡,调控脂质稳态(韩汶润等, 2021)。CYP7A1是肝脏胆汁酸合成的重要限速酶(Li et al, 2009),srebp-1是调节肝脏脂质代谢过程的关键基因,几乎参与所有肝脏脂肪酸和甘油三酯合成的相关基因的表达调控(Shao et al, 2012),lxrα可通过调节cyp7a1、srebp-1参与调控脂质代谢(Wa et al, 2019; On et al, 2019; Jun et al, 2011)。本研究中,在正常养殖条件盐度30时,lxrα、fas、cyp7a1和srebp-1基因的表达量随饲料中脂肪含量的升高呈先升高后下降的趋势,超过最佳脂肪含量16%后,表达量下降,说明在正常养殖环境下高脂肪会抑制脂质代谢,这与Yin等(2021)在大口黑鲈(Micropterus salmoides)中的结果相似。课题组前期研究发现,低盐胁迫能够抑制脂质代谢(Liu et al, 2020),在本研究中也得到了验证,在低盐度(10和20)养殖环境下,大部分脂质代谢相关基因(lxrα、cyp7a1、srebp-1和apoa-IV)在最佳脂肪含量16%时的表达水平低于正常养殖环境盐度30下的表达水平,且盐度10的养殖环境对脂质代谢基因的抑制作用高于盐度20的养殖环境。
另外,结果还发现,在低盐度(10和20)养殖环境时,与脂质合成相关的基因lxrα、cyp7a1和srebp-1的表达量基本随脂肪含量升高呈先升高后降低的趋势,尤其在盐度10条件下,12%组的表达量高于其他各组,20%组显著低于其他各组,acc和fas基因的表达水平也表现出类似的情况,在高脂肪(20%)时均被抑制,在12%组的表达量最高。fas和acc是肝脏脂质合成的关键基因(蔡润佳等, 2021),FAS是脂肪酸从头合成的关键酶(孙志鹏等, 2017),ACC是脂肪酸合成第一步反应的限速酶(严媛等, 2018),lxrα还可通过srebp-1调控acc和fas的表达(On et al, 2019; Jun et al, 2011)。以上结果表明,在低盐胁迫下,脂质合成受到抑制,而低脂肪饲料能够在一定程度上刺激脂质的合成。因此,从脂质合成来看,低脂肪对低盐胁迫导致的脂代谢抑制有一定的缓解作用,但从本研究的生长相关数据来看,这种缓解作用并未直接体现在生长上。一般来说,高脂肪含量的饲料会造成肝脏中脂质的累积。Zhang等(2022)在大菱鲆中发现,饲料中过量的脂质可能通过抑制肝脏脂质分解的基因表达,同时增强肝脏脂质生成的基因表达,导致大菱鲆中的脂质沉积。在尼罗罗非鱼(Oreochromis niloticus)中,acc和fas基因在高脂肪饲料饲喂下呈现高表达水平(He et al, 2015)。在本研究中,fas和acc基因在高脂肪下的表达量,尤其是acc基因,显著高于其他脂肪含量组,说明这二者的高表达可能是导致大菱鲆肝脏脂质沉积的主要因素。
FABP是重要的脂肪酸转运蛋白,在脂质摄取、转运和整体脂质稳态中起着至关重要的作用(Glatz et al, 1996)。有研究报道,在罗氏沼虾(Macrobrachium rosenbergii)(Liu et al, 2022)、虹鳟(Oncorhynchus mykiss) (Meng et al, 2022)中发现,高脂肪饲料能够上调fabp的表达,这与本研究的结果并不一致。本研究发现,在正常盐度下,随着脂肪含量的升高,其表达量呈现下降的趋势,低盐胁迫下fabp基因的表达量随脂肪含量呈先降低后升高再降低的趋势,12%组表达量最低,从盐度方向来看,低盐组的表达量要高于盐度30组,在调整脂肪含量后并未出现明显的规律,因此,fabp基因不是低盐胁迫下不同脂肪含量饲料影响大菱鲆肝脏脂质吸收的主要因素。APOA-Ⅳ是一种脂蛋白,参与调节脂质转运、脂质吸收和胆固醇外排等脂质代谢途径(Qi et al, 2023)。本研究发现,低盐胁迫严重抑制了脂肪含量16%组apoa-IV基因的表达,这种抑制作用在2个低盐组中更加明显。然而,在盐度10时,20%组的表达量远高于相同盐度条件下其他各组,而且在20%条件下呈随盐度升高而降低的趋势,这与其他脂质组中的趋势完全相反。结果表明,apoa-IV基因是低盐胁迫下不同脂肪含量饲料影响大菱鲆肝脏脂质吸收的主要因素。这种表达模式也与上面提到的与脂质合成的基因表达模式不同,结合盐度10下20%脂肪含量组的生长表现,表明低盐胁迫影响脂质代谢后,通过不同脂肪含量的饲料可以从脂质合成和脂质吸收的角度来缓解胁迫带来的不利影响,且这种缓解作用更多的体现在apoa-IV基因主导的脂质吸收层面上。
ABDEL-LATIF H M R, AHMED H A, SHUKRY M, et al. Growth performance, physiological responses, and histoarchitectural changes in juvenile Pangasianodon hypophthalmus under different environmental salinities. Fishes, 2023, 8(6): 282 DOI:10.3390/fishes8060282 |
ANNI I S A, BIANCHINI A, BARCAROLLI I F, et al. Salinity influence on growth, osmoregulation and energy turnover in juvenile pompano Trachinotus marginatus Cuvier 1832. Aquaculture, 2016, 455: 63-72 DOI:10.1016/j.aquaculture.2016.01.010 |
BOWDEN T J. Modulation of the immune system of fish by their environment. Fish and Shellfish Immunology, 2008, 25(4): 373-383 DOI:10.1016/j.fsi.2008.03.017 |
CAI R J, ZHANG J, HUANG J S, et al. Effects of low temperature stress on the expression of genes related to lipid metabolism of juvenile cobia, Rachycentron canadum. Acta Oceanologica Sinica, 2021, 43(11): 116-122 [蔡润佳, 张静, 黄建盛, 等. 低温胁迫对军曹鱼幼鱼脂代谢相关基因表达的影响. 海洋学报, 2021, 43(11): 116-122] |
CHO S H, KIM H S, MYUNG S H, et al. Optimum dietary protein and lipid levels for juvenile rockfish (sebastes schlegeli, Hilgendorf 1880). Aquaculture Research, 46(12): 2954-2961 DOI:10.1111/are.12450 |
DONG X H, YANG J J, TAN B P, et al. Dietary lipid requirements of orange-spotted grouper (Epinephelus coioides) in juvenile and grow out stages. Chinese Journal of Animal Nutrition, 2015, 27(1): 133-146 [董晓慧, 杨俊江, 谭北平, 等. 幼鱼和养成阶段斜带石斑鱼对饲料中脂肪的需要量. 动物营养学报, 2015, 27(1): 133-146 DOI:10.3969/j.issn.1006-267x.2015.01.017] |
GLATZ J F, VUSSE G J V D. Cellular fatty acid-binding proteins: Their function and physiological significance. Progress in Lipid Research, 1996, 35(3): 243-282 DOI:10.1016/S0163-7827(96)00006-9 |
HAN W R, ZHANG D D, ZHU Y, et al. Research progress in regulation of lipid metabolism by liver X receptors. Chinese Journal of Pharmacology and Toxicology, 2021, 35(5): 391-400 [韩汶润, 张丹丹, 朱彦, 等. 肝X受体调控脂代谢研究进展. 中国药理学与毒理学杂志, 2021, 35(5): 391-400 DOI:10.3867/j.issn.1000-3002.2021.05.009] |
HE A Y, NING L J, CHEN L Q, et al. Systemic adaptation of lipid metabolism in response to low- and high-fat diet in Nile tilapia (Oreochromis niloticus). Physiological Reports, 2015, 3(8): 12485 DOI:10.14814/phy2.12485 |
HIXSON S M, PARRISH C C, XUE X, et al. Growth performance, tissue composition, and gene expression responses in Atlantic salmon (Salmo salar) fed varying levels of different lipid sources. Aquaculture, 2017, 467: 76-88 DOI:10.1016/j.aquaculture.2016.04.011 |
HUANG S, LI C Z, LI Z X, et al. Effects of different salinities on growth and osmotic regulation gene expression of Gymnocypris przewalskii. Fisheries Science, 2022, 41(4): 527-536 [黄屾, 李长忠, 李梓瑄, 等. 盐度对青海湖裸鲤生长及渗透调节基因的影响. 水产科学, 2022, 41(4): 527-536] |
JUN I, KOHEI Y, EMINA I, et al. Identification of MIG12 as a mediator for stimulation of lipogenesis by LXR activation. Molecular Endocrinology, 2011, 25(6): 995-1005 DOI:10.1210/me.2011-0070 |
KHAIRNAR S O, TIAN X L, FANG Z H, et al. Effects of the amplitude and frequency of salinity fluctuation on the body composition and energy budget of juvenile tongue sole (Cynoglossus semilaevis). Journal of Ocean University of China, 2015, 14(1): 127-134 DOI:10.1007/s11802-015-2400-z |
LAI W, XU D, LI J, et al. Dietary polystyrene nanoplastics exposure alters liver lipid metabolism and muscle nutritional quality in carnivorous marine fish large yellow croaker (Larimichthys crocea). Journal of Hazardous Materials, 2021, 419: 126454 DOI:10.1016/j.jhazmat.2021.126454 |
LEI J L, LIU X F, MA A J. The introduction and domestication of turbot in China. China Zoological Society, 1998, 408-413 [雷霁霖, 刘新富, 马爱军. 大菱鲆的引进与驯养实验. 中国动物学会编, 1998, 408-413] |
LI J, XUE L, CAO M, et al. Gill transcriptomes reveal expression changes of genes related with immune and ion transport under salinity stress in silvery pomfret (Pampus argenteus). Fish Physiology and Biochemistry, 2020, 46(4): 1255-1277 DOI:10.1007/s10695-020-00786-9 |
LI T, CHIANG J Y L. Regulation of bile acid and cholesterol metabolism by PPARs. PPAR Research, 2009, 501739 |
LI X, SHEN Y, BAO Y, et al. Physiological responses and adaptive strategies to acute low-salinity environmental stress of the euryhaline marine fish black seabream (Acanthopagrus schlegelii). Aquaculture, 2022, 554: 738117 DOI:10.1016/j.aquaculture.2022.738117 |
LIAO C Y, GAO W H, LI J H, et al. Effects of short-term high-fat stress on growth performance, liver health and lipid metabolism genes in Epinephelus fuscoguttatus ♀×E. lanceolatus ♂. Journal of Fishery Sciences of China, 2023, 30(9): 1080-1092 [廖春燕, 高文浩, 李嘉辉, 等. 短期高脂应激对珍珠龙胆石斑鱼幼鱼生长性能、肝脏健康和脂代谢基因的影响. 中国水产科学, 2023, 30(9): 1080-1092] |
LIU L L, LUO M, CHEN F X, et al. Influence of salinity on osmoregulation and oxygen consumption rate in juvenile hybrid grouper (Epinephelus lanceolatu ♂×Epinephelus fuscoguttatus ♀). Journal of Fishery Sciences of China, 2020, 27(6): 692-700 [刘龙龙, 罗鸣, 陈傅晓, 等. 盐度对珍珠龙胆石斑鱼幼鱼渗透调节与耗氧率的影响. 中国水产科学, 2020, 27(6): 692-700] |
LIU Y K, ZHOU X X, LIU B, et al. Effects of high fat in the diet on growth, antioxidant, immunity and fat deposition of Macrobrachium rosenbergii post-larvae. Fish and Shellfish Immunology, 2022, 129: 13-21 DOI:10.1016/j.fsi.2022.08.027 |
LIU Y L, MAI K S, XU W, et al. The effect of different lipid levels on the growth performance, body composition and plasma biochemical indices in cobia (Rachycentron canadum L.) at two different sizes. Acta Hydrobiologica Sinica, 2019, 43(2): 233-242 [刘迎隆, 麦康森, 徐玮, 等. 饲料脂肪含量对两种规格的军曹鱼生长、体组成和血清生化指标的影响. 水生生物学报, 2019, 43(2): 233-242] |
LIU Z F, MA A J, YUAN C H, et al. Transcriptome analysis of liver lipid metabolism disorders of the turbot Scophthalmus maximus in response to low salinity stress. Aquaculture, 2020, 534: 736273 |
LU Z Y, ZHANG Y Y, CUI P, et al. Effect of dietary lutein with different levels of lipid on growth performance and body colar of Yamabaki ogon. Feed Research, 2021, 44(20): 27-32 [卢正义, 张媛媛, 崔培, 等. 不同脂肪水平的叶黄素饲料对黄金锦鲤生长性能和体色的影响. 饲料研究, 2021, 44(20): 27-32] |
LUO Z, LIU Y J, MAI K S, et al. Effect of dietary lipid level on growth performance, feed utilization and body composition of grouper Epinephelus coioides juveniles fed isonitrogenous diets in floating netcages. Aquaculture International, 2005, 13(3): 257-269 DOI:10.1007/s10499-004-2478-6 |
LÓPEZ L, TORRES A, DURAZO E, et al. Effects of lipid on growth and feed utilization of white seabass (Atractoscion nobilis) fingerlings. Aquaculture, 2006, 253(1/2/3/4): 557-563 |
MENG Y Q, TIAN H N, HU X M, et al. Effects of dietary lipid levels on the lipid deposition and metabolism of subadult triploid rainbow trout (Oncorhynchus mykiss). Aquaculture Nutrition, 2022(12): 1-12 |
ON S, KIM H Y, KIM H S, et al. Involvement of G-protein-coupled receptor 40 in the inhibitory effects of docosahexaenoic acid on SREBP1-mediated lipogenic enzyme expression in primary hepatocytes. International Journal of Molecular Sciences, 2019, 20(11): 2625 DOI:10.3390/ijms20112625 |
PENG M, XU W, MAI K, et al. Growth performance, lipid deposition and hepatic lipid metabolism related gene expression in juvenile turbot (Scophthalmus maximus L.) fed diets with various fish oil substitution levels by soybean oil. Aquaculture, 2014, 433: 442-449 DOI:10.1016/j.aquaculture.2014.07.005 |
QI Z, JONATHAN W, MINQIAN S, et al. Apolipoprotein a-iv enhances fatty acid uptake by adipose tissues of male mice via sympathetic activation. Endocrinology, 2023, 161(4): 4 |
QIANG J, WANG H, KPUNDEH M D, et al. Effect of water temperature, salinity, and their interaction on growth, plasma osmolality, and gill Na+, K+-ATPase activity in juvenile GIFT tilapia Oreochromis niloticus (L.). Journal of Thermal Biology, 2013, 38(6): 331-338 DOI:10.1016/j.jtherbio.2013.04.002 |
SHAO W, ESPENSHADE P J. Expanding roles for SREBP in metabolism. Cell Metabolism, 2012, 16(4): 414-419 DOI:10.1016/j.cmet.2012.09.002 |
SUN Z P, LÜ W H, KUANG Y Y, et al. Cloning and expression of fatty acid synthase gene in common carp Cyprinus carpio. Chinese Journal of Fisheries, 2017, 30(4): 1-6 [孙志鹏, 吕伟华, 匡友谊, 等. 鲤脂肪酸合成酶基因的克隆与表达分析. 水产学杂志, 2017, 30(4): 1-6] |
WA Y, YIN B, HE Y, et al. Effects of single probiotic- and combined probiotic-fermented milk on lipid metabolism in hyperlipidemic rats. Frontiers in Microbiology, 2019, 10: 1312 |
WU H, LIU J, LU Z, et al. Metabolite and gene expression responses in juvenile flounder Paralichthys olivaceus exposed to reduced salinities. Fish and Shellfish Immunology, 2017, 63: 417-423 |
XIANG X, ZHOU X H, CHEN J, et al. Effects of dietary lipid level on growth performance, body composition and serum biochemical indices of juvenile Onychostoma sima. Chinese Journal of Animal Nutrition, 2013, 25(8): 1805-1816 [向枭, 周兴华, 陈建, 等. 饲料脂肪水平对白甲鱼幼鱼生长性能、体组成和血清生化指标的影响. 动物营养学报, 2013, 25(8): 1805-1816] |
YAN Y, CHENG H L, XU J H, et al. Molecular cloning of acetyl-CoA carboxylase β full-length cDNA from grass carp (Ctenopharyngodon idella) and expression analysis. Chinese Journal of Animal nutrition, 2018, 30(5): 1827-1836 [严媛, 程汉良, 许建和, 等. 草鱼乙酰辅酶A羧化酶β基因全长cDNA分子克隆与表达分析. 动物营养学报, 2018, 30(5): 1827-1836] |
YIN P, XIE S W, ZHUANG Z X, et al. Dietary supplementation of bile acid attenuate adverse effects of high-fat diet on growth performance, antioxidant ability, lipid accumulation and intestinal health in juvenile largemouth bass (Micropterus salmoides). Aquaculture, 2021, 531(1): 735864 |
YUAN Y, LI S, ZHANG L, et al. Influence of dietary lipid on growth performance and some lipogenesis-related gene expression of tongue sole (Cynoglossus semilaevis) larvae. Aquaculture Research, 2017, 48(3): 767-779 |
ZHANG H J, GUO S D. Tests on the growth characteristics of three kinds of growth promoters on tilapia. Feed Research, 2009(8): 1-3 [张慧晶, 过世东. 3种促生长剂对罗非鱼生长特性的试验. 饲料研究, 2009(8): 1-3] |
ZHANG W C, DAN Z J, ZHUANG Y W, et al. Effects of dietary lipid levels on growth, digestive enzyme activities, antioxidant capacity, and lipid metabolism in Turbot (Scophthalmus maximus L.) at three different stages. Aquaculture Nutrition, 2022, 28: 1-18 |
ZHANG Y T, YANG J, GENG L W, et al. Effects of salinity stress on antioxidant enzymes and serum cortisol in Luciobarbus capito. Progress in Fishery Sciences, 2021, 42(1): 56-62 [张宇婷, 杨建, 耿龙武, 等. 盐度胁迫对大鳞鲃抗氧化酶和血清皮质醇的影响. 渔业科学进展, 2021, 42(1): 56-62] |
ZHU L, LIU P, YIN S S, et al. Effects of Chinese herbal medicine on the growth and antioxidant function of tilapia. China Feed, 2014(23): 38-41 [朱莉, 刘磐, 银杉杉, 等. 中草药对罗非鱼生长性能和抗氧化指标的影响. 中国饲料, 2014(23): 38-41] |



