2. 青岛海洋科技中心海洋渔业科学与食物产出过程功能实验室 山东 青岛 266237;
3. 上海海洋大学水产科学国家级实验教学示范中心 上海 201306;
4. 邦普种业科技有限公司 山东 潍坊 261311;
5. 广东恒兴饲料实业股份有限公司 广东 湛江 524000
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao Marine Science and Technology Center, Qingdao 266237, China;
3. Shanghai Ocean University, National Aquatic Science Experimental Teaching Demonstration Center, Shanghai 201306, China;
4. BLUP Aquabreed Co., Ltd., Weifang 261311, China;
5. Guangdong Hengxing Feed Industry Co., Ltd., Zhanjiang 524000, China
凡纳对虾(Penaeus vannamei),又称南美白对虾,具有生长速度快、抗性强、可高密度养殖等优点,由中国科学院海洋研究所于1988年引进,并于1992年突破人工繁殖技术后逐渐形成了完整成熟的产业链(王伦等, 2022; 李晓等, 2018; 相建海等, 2017; Zhang et al, 2017)。2022年,我国凡纳对虾的养殖产量达209.86万t,约占全国水产品总产量的30.57% (农业农村部渔业渔政管理局等, 2023),具有重要的经济价值。丰富、优秀的种质资源是遗传育种的实施基础,由于我国凡纳对虾种虾长期依赖进口,加之国外采取“控种”策略,导致引种困难。我国从2012年左右开始进行凡纳对虾的自主选育,目前,已突破了大规模家系构建、多性状精准测试等关键技术,但作为一个引进的养殖物种,国内掌握的种质资源较少,遗传多样性低,在种质资源方面仍然存在明显的“卡脖子”问题(彭敏等, 2020; 孔杰等, 2020)。提高遗传多样性、改善种质资源对育种至关重要。
一直以来,利用诱变剂对物种胚胎进行诱变是选育新品种和改善种质资源的重要技术(常媚瑕, 2022)。常用的化学诱变剂包括甲基磺酸乙酯(EMS)和1-甲基-3-硝基-1-亚硝基胍(NTG),它们可以引发位点突变和小片段插入或缺失(王思雨, 2022)。物理诱变剂通过诱发染色体异位、缺失、重组或断裂等,引起性状产生变异(梁英等, 2020)。常见的物理诱变有辐射(例如γ射线、X射线、紫外线)、常压室温等离子体(atmospheric and room temperature plasma, ARTP)等(王思雨, 2022)。其中,ARTP是一种新型物理诱变技术,因其高突变率、易用性和操作安全等特点,被广泛应用于微生物育种(徐欢欢等, 2020; 戴剑漉等, 2018; 林晓琼等, 2016; Garcia et al, 1994)。其诱变原理是利用具有能量的氦气离子攻击细胞从而引起生物体基因层面的损伤,最终达到获得具有突变性状个体的目的(王思雨, 2022)。曹旭鹏等(2014)、吴晓英等(2016)和Fang等(2013)利用ARTP技术对藻株进行诱变处理,均发现了不同程度基因和性状的改变,诱变有效地提高了基因表达,使性状得到改良,并成功筛选出了诱变株。而在水产动物育种中,该技术的应用研究较少,目前,仅在红白锦鲤(Cyprinus carpiohaematopterus) (李泓等, 2021)、团头鲂(Megalobrama amblycephala) (Su et al, 2022)、牙鲆(Paralichthy solivaceus)(Hou et al, 2019)和斑马鱼(Danio rerio)(王思雨, 2022)等物种中有报道,尚未有对凡纳对虾进行ARTP诱变育种研究的报道。
凡纳对虾的生长性状虽然是非常重要的性状,抗逆等适应性性状也是与产业健康发展相关的重要性状,与产量等经济指标直接挂钩,比如抗应激、对抗温度、缺氧、氨氮胁迫下的成活率,然而对于诱变育种,现有研究多集中在幼虫阶段的发育和死亡率,对抗逆性状如低氧耐受性、氨氮胁迫等几乎无报道。
本研究拟利用ARTP技术对凡纳对虾受精卵进行诱变处理,比较不同诱变时间对受精卵胚胎孵化畸形率、孵化率及后期幼体培育过程中各期幼体变态率的影响,进一步比较不同诱变组的幼体在低氧、氨氮等胁迫条件下的抗逆性状表现,探讨ARTP诱变对凡纳对虾幼体发育及抗逆的影响,为ARTP技术在凡纳对虾诱变育种中的应用提供参考。
1 材料与方法 1.1 亲虾来源及诱变材料的获取本研究所用的凡纳对虾亲虾为来自于邦普种业科技有限公司(山东,潍坊)的“邦普1号”高抗品系。该群体的奠基者群体为2018年从美国引进的API高抗品系,于邦普种业科技有限公司经过4年规模化家系选育,遗传表现稳定。其G04代于2022年2月开始进行亲虾促熟,7月雌、雄亲本均性成熟后,挑选同一个家系性腺发育成熟的雌虾,放入另一个雄虾池中进行自然交配,交配成功的亲虾运至中国水产科学研究院黄海水产研究所实验室,将待产雌虾分别放入200 L海水桶中进行产卵,水温为28 ℃,盐度为31。用显微镜观察受精情况并统计各家系受精卵数量,共有4尾雌虾产卵量达到实验要求(不低于12万卵且镜检受精率 > 95%),分别命名为A、B、C和D家系。
1.2 ARTP诱变产卵5 h左右,镜检当受精卵处于原肠胚期时,开始诱变处理。根据预实验结果确定诱变基本参数:射频功率360 W,氦气流量15 L/min。
根据A、B、C和D家系内受精卵数分别进行设置,A家系内数量较多,设置5个组:1个对照组(0 min)和4个诱变处理组(辐射时间2、4、8和12 min);B、C和D家系则设置4个组:1个对照组(0 min)和3个诱变处理组(2、4和8 min)。每组设置3万粒受精卵。
1.3 幼体培育及数据统计ARTP诱变处理后,将受精卵移至位于山东青岛即墨的中国水产科学研究院黄海研究所水产遗传育种中心,每个家系的每个处理组均为3个平行进行养殖,每个平行于独立的200 L聚乙烯桶中进行统一养殖管理,水温为28 ℃,盐度为31。受精卵经孵化后,使用标准化的方法进行幼体的投喂、换水等管理(曾现英等, 2023);每天10:00观察幼体的生长和发育情况。在无节幼体/糠虾/仔虾时期分别对幼体数量进行抽样统计,幼体培育期从孵化至仔虾阶段,实验共持续15 d。
本研究统计了诱变后每个家系不同实验组肢芽期受精卵畸形数量和各个时期幼体数量,并进行了肢芽期孵化畸形率(incubation deformity rate, IDR)、孵化率(hatching rate, HR)、幼体存活率(survival rate, SR)和各期变态率(metamorphosis rate, MR)的计算,计算公式如下:
肢芽期孵化畸形率=(胚胎发育异常畸形数/受精卵数)×100%
孵化率=(无节幼体数/受精卵总数)×100%
幼体存活率=(仔虾数/无节幼体数)×100%
各期变态率=(该期幼体数/前一期幼体数)×100%
式中,肢芽期孵化畸形率统计的时间为诱变2 h后,轻轻搅动孵化桶水体,使受精卵均匀分布,每个平行随机捞取受精卵,统计在肢芽期异常发育、畸形等受精卵占取样数量的百分比。
1.4 抗逆性测试A家系的起始卵量较多,幼虫培育后存活数目较多,因此,选择此家系进行2个代表性性状的检测。
低氧耐受性测试选择P10阶段仔虾,将该家系每个不同诱变时间处理组中大小均一的P10阶段仔虾分为3组平行,每个平行100尾虾。将其放入装有30 mL海水的50 mL锥形瓶中,用塑料薄膜封口,记录虾苗放入瓶中时间,每隔0.5 h记录死亡个体数;同时,选取100尾个体设置空白对照组,养殖条件和实验组一致,充气。当测试实验组个体全部死亡时,停止实验。计算低氧存活率(hypoxia survival rate, HSR),计算公式如下:
低氧存活率=(幼体存活数量/幼体总数)×100%
氨氮胁迫测试选择平均体重约为0.3 g、平均体长为3.0 cm的幼虾个体,将该家系每个实验组中大小均一的幼虾分为3组平行,每个平行30尾虾,放入50 L的水体中,参考王华等(2013)的方法调整并确定氨氮浓度,根据预实验结果及实验要求将水中氨氮浓度调制为115 mg/L,每天10:00、16:00各测定一次水体氨氮浓度,换水三分之一,补充NH4Cl达到设定浓度。每隔3 h观察并记录死亡个体数,死亡高峰期过后,连续3 d没有死亡个体时,停止实验。在同一环境下每组选取30尾个体设置空白对照组,养殖条件和实验组一致。氨氮存活率(ammonia nitrogen survival rate, ANSR)的计算公式如下:
氨氮存活率=(幼体存活数量/幼体总数)×100%
1.5 数据分析通过SPSS 27.0软件对肢芽期孵化畸形率、孵化率、幼体存活率、变态率、低氧存活率和氨氮存活率6个指标数据进行单因素方差分析(one-way ANOVA)及线性回归分析,采用LSD进行组间多重比较,并进行差异显著性检验,P < 0.05为差异达到显著水平。
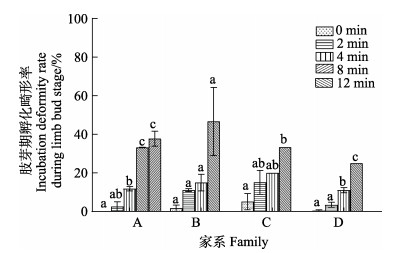
2 结果 2.1 ARTP不同诱变时间对孵化相关的影响凡纳对虾孵化5 h后,用于ARTP诱变时处于原肠胚期的受精卵见图 1,可见几乎所有的受精卵已发育,受精膜举起,胚胎形状规则。ARTP处理后,处理组镜检可见部分孵化异常的胚胎(图 2)。经ARTP照射不同时间的肢芽期孵化畸形率结果如图 3所示。A家系和D家系中,除诱变2 min组孵化畸形率与对照组相比无显著差异外,其余处理组的孵化畸形率均显著升高(P < 0.05);B家系各处理组的孵化畸形率与对照组相比均无显著差异;C家系中,诱变8 min组相比对照组畸形率显著升高,而2 min和4 min组则与对照组相比无显著差异。
|
图 1 用于ARTP处理的原肠胚期受精卵 Fig.1 Gastrul-stage fertilized eggs for ARTP treatment |

|
图 2 ARTP处理后在肢芽期正常孵化和孵化异常的受精卵 Fig.2 Fertilized eggs that hatch normally and hatch abnormally during the limb bud stage after ARTP treatment 红色箭头为诱变后在肢芽期异常发育的受精卵,其余均为诱变后在肢芽期正常发育的受精卵。 The red arrow points to the fertilized egg that underwent abnormal development during the limb bud stage after mutation, while the rest are fertilized eggs that developed normally during the limb bud stage after mutation. |
|
图 3 ARTP不同处理时间下对凡纳对虾胚胎在肢芽期孵化畸形率的影响 Fig.3 Effects of different ARTP treatment time on the hatching deformity rate of P. vannamei embryos during limb bud stage 同一家系不同小写字母表示差异显著(P < 0.05)。下同。 Different lowercase letters within the same family indicate significant differences (P < 0.05). The same below. |
对凡纳对虾的诱变时间(x)与在肢芽期孵化畸形率(y)进行线性回归分析发现,4个家系中诱变时间和肢芽期孵化畸形率之间均呈显著正相关,回归系数分别为:
| $ {y_a} = 3.528x - 1.270 $ |
| $ {y_b} = 5.571x - 0.888 $ |
| $ {y_c}{\text{ = 3}}{\text{.405 }}x + 6.{\text{472}} $ |
| $ {y_d} = 3.177x - 1.122 $ |
式中,a、b、c、d表示A、B、C、D家系,R2分别为0.932、0.772、0.895和0.972,A、C、D家系属于高度相关(R2 > 0.8),B家系属于中度相关(0.5 < R2 < 0.8)。
经ARTP照射不同时间的凡纳对虾受精卵孵化率如图 4所示。在4个家系中,受精卵孵化率均随诱变时间的增加而降低,当诱变时间≥4 min时,4个家系孵化率均低于15%。与对照组相比,除A家系诱变2 min组外,其余家系各处理组孵化率均显著降低(P < 0.05)。A、B、C和D家系诱变2 min组孵化率均显著高于诱变4、8和12 min组,B家系诱变4 min组孵化率显著高于诱变8 min组(P < 0.05)。

|
图 4 ARTP不同处理时间下对凡纳对虾受精卵孵化率的影响 Fig.4 Effects of different ARTP treatment time on the hatching rate of fertilized eggs of P. vannamei |
对凡纳对虾的诱变时间(x)与孵化率(y)进行线性回归分析发现,4个家系中诱变时间和孵化率之间均呈显著负相关,回归系数分别为:
| $ {y_a} = - 6.367x + 71.207 \text{;}\; {y_b}{\text{ = }} - {\text{10}}{\text{.672 }}x{\text{ + 76}}{\text{.399}} $ |
| $ {y_c}{\text{ = }} - {\text{9}}{\text{.790 }}x{\text{ + 67}}{\text{.343}} \text{;}\; {y_d}{\text{ = }} - {\text{10}}{\text{.379 }}x{\text{ + 76}}{\text{.036}} $ |
式中,a、b、c和d表示A、B、C和D家系,R2分别为0.669、0.797、0.691和0.719,属于中度相关(0.5 < R2 < 0.8)。
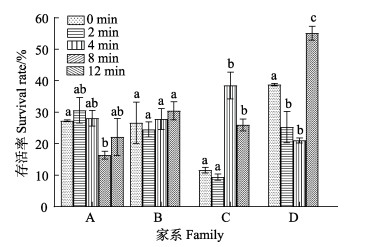
2.2 ARTP对无节幼体到仔虾的影响ARTP对凡纳对虾无节幼体到仔虾存活率的影响如图 5所示。A、B、C和D家系同一处理组在相同阶段的表现各不相同,与对照组相比,A家系诱变8 min组存活率显著降低(P < 0.05),而C家系诱变4 min和8 min组存活率显著升高,D家系诱变2 min和4 min组存活率显著降低,而诱变8 min组则显著升高。其余各家系内各处理组均无显著差异。
|
图 5 ARTP不同处理时间下对凡纳对虾幼体存活率的影响 Fig.5 Effects of different ARTP treatment time on the survival rate of P. vannamei larvae |
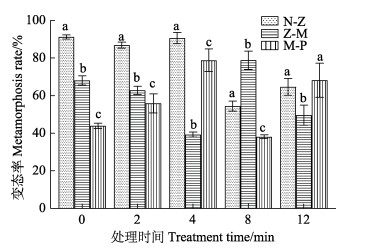
本研究进一步把幼体培养过程中的死亡淘汰分阶段进行统计:幼体死亡主要发生在无节幼体(N)→溞状幼体(Z)、溞状幼体(Z)→糠虾幼体(M)、糠虾幼体(M)→仔虾幼体(P)的变态过程中。对凡纳对虾从N到P各个阶段的变态情况进行分析,结果如图 6所示。以A家系为例,对照组和诱变2 min组3个时期的变态率均随着幼体发育呈显著降低的趋势(P < 0.05),并且M-P阶段变态率显著低于N-Z和Z-M阶段,诱变4 min组和12 min组Z-M阶段显著低于N-Z和M-P阶段,诱变8 min组N-Z阶段显著低于Z-M阶段。说明低剂量(0 min和2 min)诱变凡纳对虾受精卵后,其死亡高峰期主要发生在幼体发育后期;高剂量(4、8和12 min)诱变后幼体死亡高峰期主要发生在幼体发育中期或前期,且不同处理组死亡高峰期不一致。辐射处理造成的结果依然有不定向性,这种死亡高峰期特点的趋势在其他3个家系中类似。
|
图 6 凡纳对虾A家系经不同诱变时间处理下幼体在不同发育阶段的变态率 Fig.6 The metamorphosis rate of the larvae of P. vannamei Family A at different developmental stages under different mutagenic treatment time |
从低氧耐受性测试开始到结束,共持续10 h,在测试期间,空白对照组存活率≥95%。利用ARTP诱变凡纳对虾P10时期的仔虾进行低氧胁迫实验的结果如图 7所示,诱变4、8和12 min组在低氧胁迫5.5 h后基本死亡,对照组胁迫实验持续到9 h全部死亡,而诱变2 min组胁迫持续到10 h全部死亡。
|
图 7 凡纳对虾经不同诱变时间处理下仔虾低氧耐受存活时间曲线 Fig.7 Survival curve of hypoxia tolerance of larvae of P. vannamei under different radiation treatment time |
凡纳对虾经不同诱变时间处理下,幼体低氧耐受存活时间的描述性统计如表 1所示,对照组至50%存活率的时间为1.5 h,而诱变2 min组至50%存活率的时间为1.89 h,诱变2 min组半数致死时间显著高于对照组(P < 0.05)。随着诱变时间的递增,半数致死时间缩短,但与对照组差异不显著(P > 0.05);而当诱变时间为12 min时,半数致死时间降低为1 h,极显著低于对照组(P < 0.01);从达到20%存活率的结果来看,对照组至20%存活率的时间为5.75 h,极显著低于诱变2 min组(P < 0.01),极显著高于其他3组(P < 0.01)。
|
|
表 1 凡纳对虾经不同诱变时间处理下幼体低氧耐受存活时间的描述性统计 Tab.1 Descriptive statistics of hypoxia-tolerant survival time of larvae of P. vannamei under different radiation treatment time |
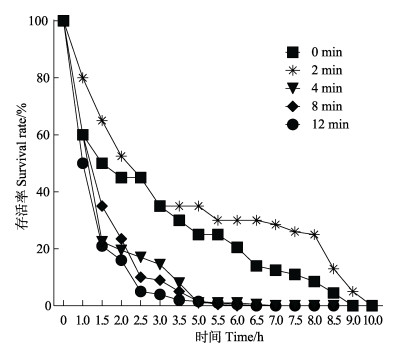
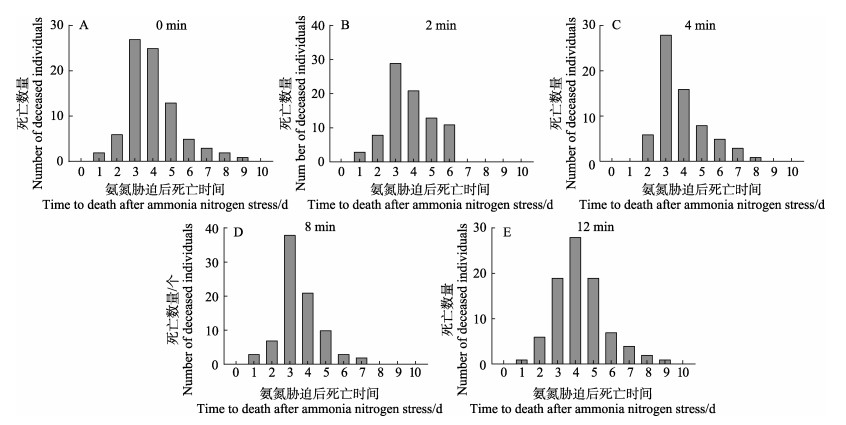
从氨氮胁迫测试开始到结束,共持续12 d,在测试期间,空白对照组未出现异常死亡。氨氮胁迫后的凡纳对虾仔虾死亡情况如图 8所示,凡纳对虾在氨氮胁迫8 h后开始出现死亡,对照组、诱变2、4和8 min组在胁迫72 h达到死亡高峰,分别于胁迫95、92、82和85 h达到半数死亡,而诱变12 min组在胁迫96 h达到死亡高峰,于胁迫104 h达到半数死亡,之后被胁迫的凡纳对虾每日死亡量呈降低趋势。
|
图 8 凡纳对虾经不同诱变时间处理下经氨氮胁迫后每日死亡 Fig.8 Daily mortality of P. vannamei after ammonia nitrogen stress under different mutagenesis treatment time |
经氨氮胁迫幼体在第4天和第7天的存活率描述性统计见表 2。实验期间,对虾的死亡率升高主要集中在第4天之后,与对照组相比,第4天时,诱变12 min组存活率极显著升高(P < 0.01),诱变2 min组极显著降低(P < 0.01);第7天时,诱变8 min组存活率极显著降低(P < 0.01)。
|
|
表 2 凡纳对虾经不同诱变时间处理下经氨氮胁迫幼体在第4天和第7天的存活率描述性统计 Tab.2 Descriptive statistics of survival of P. vannamei larvae under ammonia nitrogen stress at 4 d and 7 d under different mutagenesis treatment time |
人工诱变方法能够使动植物在短时间内高效获取大量的突变个体,是一种快速获得育种资源的有效途径(杨玲玲等, 2021)。在本研究中,利用ARTP诱变仪对凡纳对虾不同家系原肠胚期受精卵进行不同时间的诱变处理。结果显示,在不同家系间有一些共性的规律,在幼体发育前期阶段,4个家系随着诱变时间的增加,肢芽期畸形率均呈上升趋势,孵化率均呈下降趋势;与Hou等(2019)在牙鲆中的研究结果相一致。王思雨(2022)研究发现,ARTP诱变还可能造成斑马鱼胚胎发育情况异常,严重时会导致斑马鱼胚胎的孵化率下降、畸形率升高。红白锦鲤(李泓等, 2021)、团头鲂(Su et al, 2022)等的孵化率也随着诱变时间的延长而受到抑制。相关研究表明,受精卵在ARTP诱变仪所产生的具有高浓度活性粒子的等离子射流作用下,其DNA产生不同程度的损伤,从而产生了胚胎畸形或突变,诱变时间越长,造成的损伤越大(Hou et al, 2019),由此推测,在ARTP诱变下,肢芽期孵化畸形率梯度升高和受精卵孵化率梯度降低可能是由于诱变后胚胎产生了畸形或突变,且随着诱变时间的增加,畸形率越高,孵化成功的概率越低,越来越多的受精卵在胚胎时期发生死亡,不能发育到无节幼体阶段。
由诱变时间与孵化率和畸形率的线性回归分析也可以看出,经诱变处理后,诱变时间同幼体孵化率有显著的中度相关关系,与畸形率之间存在显著的中度或高度相关关系,这与利用射线诱变日本囊对虾(Marsupenaeus japonicus) (刘波, 2009)和长毛明对虾(Fenneropenaeus penicillatus) (刘波等, 2009)所得到的结果一致。虽然A、B、C和D家系的父母本皆不相同,但4个家系诱变时间与孵化率和畸形率的线性回归趋势相同,可以为摸索合适的诱变时间提供依据。
对诱变处理后的凡纳对虾无节幼体后期的发育情况进行相关研究,所有受精卵均在相同的环境下养殖、同等条件下操作,但诱变不同时间的凡纳对虾经过相同的处理后,在无节幼体到仔虾发育阶段表现各不相同,可能是诱变的不定向性以及诱变作用于个体造成的。联合分析凡纳对虾幼体的孵化率和仔虾存活率与辐照剂量之间的关系,结果显示,A、B、C和D 4个家系对照组、诱变2 min组孵化率要高于存活率,而诱变4 min及以上,则孵化率低于存活率;从各时期的变态率得知对照组和诱变2 min组死亡高峰期主要发生在幼体发育后期,高剂量组主要发生在幼体发育前中期,但所对应的阶段并不都相同。刘波(2009)通过γ射线对日本囊对虾进行诱变处理后发现,在高剂量中,尽管大量的受精卵在胚胎时期发生死亡,但还有部分胚胎能发育到无节幼体阶段,而从无节幼体到仔虾阶段的发育过程中,虽然不断有幼体死亡,但死亡数相对受精卵时期少得多。这与通过60Co-γ射线对长毛明对虾(刘波等, 2009)进行诱变所得到的结果一致。相关研究表明,ARTP诱变具有不定向性(刘波等, 2009)。因此,推测低剂量诱变对受精卵造成了一定的损伤,但其肢芽期受精卵畸形数量与对照组相比并未形成显著性差异,所以死亡高峰期主要在幼体发育后期;而进行高剂量诱变后,受精卵畸形数量显著增加,导致受精卵直接死亡或孵化失败,淘汰过多,存活下来的个体虽有一定的死亡率,但死亡的数量相对受精卵时期少,以至于死亡高峰期集中于幼体前中期。家系中的指标数据虽然呈现随着诱变时间的延长而变化的趋势,但彼此之间并无显著性差异,推测是由于指标数据有较大差异,导致平行样组内方差较大,计算得到的差异不显著。
3.2 ARTP对凡纳对虾A家系相关胁迫的影响近年来,由于凡纳对虾幼苗数量不断增加,养殖过程中缺氧导致对虾抗性下降,生长速度减慢,生理功能受到不可逆的损害,是造成凡纳对虾发病的重要因素之一,给对虾产业带来巨大经济损失(魏琳等, 2016)。本实验处理时间范围内,利用ARTP诱变仪对凡纳对虾进行极限低氧条件下的耐受性测试时,至50%存活率和20%存活率所需时间均会随着诱变时间的增加而呈现一致的规律性,且在诱变2 min时,达50%存活率和20%存活率所需时间最长,与对照组产生显著性差异,故ARTP诱变可以使凡纳对虾P10阶段仔虾的低氧耐受力增加,但需要控制诱变时间,诱变时间过长会导致耐低氧能力降低,故在A家系中,低剂量的辐射(2 min组)可能会在一定程度上提高低氧耐受能力。
氨氮作为危害对虾健康养殖最重要的环境因子之一,对养殖影响较大(顾楠等, 2021)。熊大林等(2020)研究表明,经氨氮胁迫72 h后,凡纳对虾鳃组织损伤导致生理功能紊乱。周钱森等(2021)研究表明,锦绣龙虾(Panulirus ornatus)机体对于氨氮胁迫反应迅速,组织中抗氧化酶活力升高。石祥等(2018)在凡纳对虾的幼体氨氮胁迫测试中发现,仔虾期氨氮耐受性最高。本研究选择凡纳对虾A家系平均体重为0.30 g的个体进行氨氮胁迫实验,结果发现,长期氨氮胁迫之后,对虾存活率呈现随氨氮胁迫时间的增加而递减的趋势,整体上说,诱变2 min组在第4天存活率很高,但随着胁迫时间增加,对其生存影响较大。而诱变8 min组在第7天的存活率比对照组高,可能是因为在前4天死亡较多,后面存活下来的对氨氮具有一定的耐受性,说明诱变对幼体对抗氨氮胁迫有一定的影响。
4 结论本研究首次利用ARTP技术对凡纳对虾原肠胚期受精卵进行诱变处理,结果表明,ARTP对凡纳对虾进行诱变处理后在不同家系间有一些共性的规律,在幼体发育前期阶段,4个家系随着诱变时间的增加,肢芽期孵化畸形率均呈上升趋势,孵化率均呈下降趋势;孵化率和胚胎在肢芽期孵化畸形率与诱变时间的线性关系分别呈中度相关或高度相关;通过孵化率、存活率和各期变态率综合分析可得,低剂量诱变死亡高峰期多发生于幼体发育后期,高剂量诱变幼体死亡高峰期多发生于幼体发育前中期;对A家系进行低氧胁迫测试,结果表明,中低剂量的辐射(2 min组)可能会在一定程度上提高其低氧耐受能力,诱变后的A家系幼体对抗氨氮胁迫有一定的影响;实验表明,诱变对抗逆性状的影响具有一定的不定向性,有部分辐射组的表现要高于对照组。相关研究结果为未来实现凡纳对虾诱变育种研究提供了基础数据和科学依据。
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2023. Beijing: China Agriculture Press, 2023 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴. 北京: 中国农业出版社, 2023]
|
CAO X P, AI J N, LIU Y N, et al. Mutagenic screening method of Isochrysis zhangjiangensis by atmospheric and room temperature plasmas. China Biotechnology, 2014, 34(12): 84-90 [曹旭鹏, 艾江宁, 刘亚男, 等. 基于常压室温等离子体技术的金藻诱变筛选方法. 中国生物工程杂志, 2014, 34(12): 84-90] |
CHANG M X. Effects of 60Co-γ, EMS and colchicine on mutagenesis of capsicum frutescens seeds. Master's Thesis of Guizhou University, 2022 [常媚瑕. 60Co-γ、EMS及秋水仙素对朝天椒种子诱变效应的影响. 贵州大学硕士研究生学位论文, 2022]
|
DAI J L, ZHANG X T, LU Z L, et al. Breeding of high isomycin-Ⅰ-producing strain by MPMS composite mutagenesis with plasma and UV. Chinese Journal of Antibiotics, 2018, 43(2): 182-188 [戴剑漉, 张晓婷, 卢智黎, 等. 新型常压室温等离子体–紫外复合诱变选育埃莎霉素Ⅰ高产菌株. 中国抗生素杂志, 2018, 43(2): 182-188 DOI:10.3969/j.issn.1001-8689.2018.02.011] |
FANG M, JIN L, CHONG Z, et al. Rapid mutation of Spirulina platensis by a new mutagenesis system of atmospheric and room temperature plasmas (ARTP) and generation of a mutant library with diverse phenotypes. PLoS One, 2013, 8(10): e77046 DOI:10.1371/journal.pone.0077046 |
GARCIA D K, FAGGART M A, RHOADES L, et al. Genetic diversity of cultured Penaeus vannamei shrimp using three molecular genetic techniques. Molecular Marine Biology and Biotechnology, 1994, 3(5): 270-280 |
GU N, DAI X L. Effects of chronic ammonia nitrogen stress on physiology and biochemistry indexes and hemocyanin gene expression of Litopenaeus vannamei. Journal of Southern Agriculture, 2021, 52(4): 1098-1107 [顾楠, 戴习林. 慢性氨氮胁迫对凡纳滨对虾生理生化指标及血蓝蛋白基因表达的影响. 南方农业学报, 2021, 52(4): 1098-1107] |
HOU J L, ZHANG X Y, WANG G X, et al. Novel breeding approach for Japanese flounder using atmosphere and room temperature plasma mutagenesis tool. BMC Genomics, 2019, 20(1): 323 DOI:10.1186/s12864-019-5681-6 |
KONG J, LUAN S, TAN J, et al. Progress of study on penaeid shrimp selective Breeding. Periodical of Ocean University of China (Natural Science), 2020, 50(9): 81-97 [孔杰, 栾生, 谭建, 等. 对虾选择育种研究进展. 中国海洋大学学报(自然科学版), 2020, 50(9): 81-97] |
LI H, WANG Y H, XIE G Q, et al. Summary of Cyprinus carpiohaematopterus ARTP mutagenesis test. Henan Fisheries, 2021(2): 3-5 [李泓, 王延晖, 谢国强, 等. 红白锦鲤ARTP诱变试验总结. 河南水产, 2021(2): 3-5] |
LI X, WANG Y, LI H Y, et al. Analysis and assessment of nutrient composition in head and muscle of Pacific white leg shrimp Litopenaeus vannamei. Fisheries Science, 2018, 37(1): 66-72 [李晓, 王颖, 李红艳, 等. 凡纳滨对虾虾头与肌肉营养成分分析与评价. 水产科学, 2018, 37(1): 66-72] |
LIN X Q, SUN Y, CHEN G, et al. Rapid breeding and screening of a high cellulase-producing mutant by atmospheric room temperature plasma. Journal of Jilin Agricultural University, 2016, 38(5): 543-547 [林晓琼, 孙旸, 陈光, 等. 常压室温等离子体快速诱变筛选高产纤维素酶生产菌株. 吉林农业大学学报, 2016, 38(5): 543-547] |
LIU B, KE C H, ZENG Z N. The researches of choice for the radiation-induced doses with 60Co-γ rays of Fenneropenaeus penicillatus. Journal of Fujian Fisheries, 2009(1): 1-5 [刘波, 柯才焕, 曾志南. 60Co-γ射线对长毛明对虾进行辐射诱变适宜剂量的初探. 福建水产, 2009(1): 1-5] |
LIU B. A Primary study on the biological effects of 60Co γ-rays irradiation on Marsupenaeus japonicus. Journal of Nuclear Agricultural Sciences, 2009, 23(5): 829-832 [刘波. γ射线对日本囊对虾生物学效应的初步探讨. 核农学报, 2009, 23(5): 829-832] |
LIANG Y, YAN Y Y, LAI Q X, et al. Researching advances in microalgal mutation breeding. Periodical of Ocean University of China (Natural Science), 2020, 50(6): 19-32 [梁英, 闫译允, 赖秋璇, 等. 微藻诱变育种研究进展. 中国海洋大学学报(自然科学版), 2020, 50(6): 19-32] |
PENG M, CHEN H F, LI Q Y, et al. Genetic diversity of three consecutive generations of Litopenaeus vannamei. Journal of Southern Agriculture, 2020, 51(6): 1442-1450 [彭敏, 陈慧芳, 李强勇, 等. 凡纳滨对虾连续3个世代选育群体的遗传多样性分析. 南方农业学报, 2020, 51(6): 1442-1450] |
SHI X, XIAO R, QIU L G, et al. Comparative study on sensitivity of ammonia nitrogen at different life stages of Litopenaeus vannamei. Marine Sciences, 2018, 42(2): 88-93 [石祥, 肖容, 邱立国, 等. 凡纳滨对虾幼体不同生长发育时期应答氨氮胁迫的敏感性研究. 海洋科学, 2018, 42(2): 88-93] |
SU X L, ZHAO S S, XU W J, et al. Efficiently whole-genomic mutagenesis approach by ARTP in blunt snout bream (Megalobrama amblycephala). Aquaculture, 2022, 555: 738241 |
WANG H, LI A, YANG J W. Optimized conditions of Nessler's reagent spectrophotometry for ammonia nitrogen determination in seawater. Journal of Liaoning Normal University (Natural Science), 2013, 36(1): 110-114 [王华, 黎奥, 杨敬闻. 海水中氨氮的纳氏试剂分光光度法测定条件优化. 辽宁师范大学学报(自然科学版), 2013, 36(1): 110-114] |
WANG L, WANG C Y, LIU J Y. Genetic parameter evaluation of growth and comprehensive stress tolerance traits in Litopenaeus vannamei. South China Fisheries Science, 2022, 18(4): 95-102 [王伦, 王崇懿, 刘建勇. 凡纳滨对虾生长和耐综合胁迫性状的遗传参数评估. 南方水产科学, 2022, 18(4): 95-102] |
WANG S Y. Screening and gene analysis of Danio rerio induced by plasma mutagenesis (ARTP) at room temperature and pressure. Master's Thesis of Yanshan University, 2022 [王思雨. 常温常压等离子诱变技术(ARTP)诱变斑马鱼性状筛选及基因分析. 燕山大学硕士研究生学位论文, 2022]
|
WEI L, QIU L G, LI Y H, et al. Comparison of the mitochondrial ultrastructure between two varieties of the shrimp Litopenaeus vannamei under hypoxia stress. Journal of Tropical Biology, 2016, 7(1): 17-22 [魏琳, 邱立国, 李玉虎, 等. 低氧胁迫下不同品种凡纳滨对虾线粒体超微结构的比较. 热带生物学报, 2016, 7(1): 17-22] |
WU X Y, LIU Z S, JIANG Y, et al. Plasma mutation of rainborne red globe algae and screening of high yield algae strains. Journal of Food Safety and Quality, 2016, 7(9): 3781-3787 [吴晓英, 柳泽深, 姜悦. 雨生红球藻等离子诱变及高产藻株的筛选. 食品安全质量检测学报, 2016, 7(9): 3781-3787] |
XIANG J H, HUANG H, YU Y, et al. Litopenaeus vannamei "Guangtai No.1". China Fisheries, 2017, 503(10): 58-63 [相建海, 黄皓, 于洋, 等. 凡纳滨对虾"广泰1号". 中国水产, 2017, 503(10): 58-63] |
XIONG D L, DUAN Y F, XU J M, et al. Physiological responses in gills of Litopenaeus vannamei exposed to the combined stress of temperature and ammonia. Journal of Southern Agriculture, 2020, 51(9): 2296-2303 [熊大林, 段亚飞, 徐敬明, 等. 凡纳滨对虾鳃组织对高温和氨氮胁迫的生理响应. 南方农业学报, 2020, 51(9): 2296-2303] |
XU H H, ZHANG H B, LI H X, et al. Application progress of atmospheric and room temperature plasma technology in microbial mutagenesis. Current Biotechnology, 2020, 10(4): 358-362 [徐欢欢, 张红兵, 李会宣, 等. 常压室温等离子体技术在微生物诱变中的应用进展. 生物技术进展, 2020, 10(4): 358-362] |
YANG L L, LIU F Z, MENG Q Y, et al. Effects of 60Co-γ irradiation and EMS on seed germination and seedling growth of Coix lacryma-jobi L. Seed, 2021, 40(7): 85-89 [杨玲玲, 刘凡值, 孟庆杨, 等. 60Co-γ辐照和EMS对薏苡种子萌发及幼苗生长的影响. 种子, 2021, 40(7): 85-89] |
ZENG X Y, LIU P, JING Z H, et al. Ecological breeding techniques for Litopenaeus vannamei in the Yellow River Delta Region. Hebei Fisheries, 2023, 349(1): 27-29 [曾现英, 刘朋, 敬中华, 等. 黄河三角洲地区凡纳滨对虾生态育苗技术. 河北渔业, 2023, 349(1): 27-29] |
ZHANG J, CAO F, LIU J, et al. Genetic parameters for growth and hypoxic tolerance traits in Pacific white shrimp Litopenaeus vannamei at different ages. North American Journal of Aquaculture, 2017, 79(1): 75-83 |
ZHOU Q S. Research on physiological response mechanism of Panulirus ornatus to ammonia nitrogen stress. Master´s Thesis of Shanghai Ocean University, 2021 [周钱森. 锦绣龙虾对氨氮胁迫的生理响应机制研究. 上海海洋大学硕士研究生学位论文, 2021]
|



