2. 青岛海洋科技中心海洋渔业科学与食物产出过程功能实验室 山东 青岛 266237;
3. 上海海洋大学水产与生命学院 上海 201306
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao Marine Science and Technology Center, Qingdao 266237, China;
3. School of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China
绿潮是由海水中某些大型绿藻在一定时期内暴发性增殖导致的海洋生态异常现象(吉启轩等, 2015)。大量漂浮藻类形成的绿潮无法在短时间内得到有效处置将导致绿藻堆积、腐烂,进而对沿海生态景观产生影响(Ye et al, 2011)。自然资源部海洋预警监测司(2023)发布的《2022年中国海洋灾害公报》显示,近年来引发我国黄海海域大面积绿潮灾害的主要藻类为浒苔(Ulva prolifera),浒苔绿潮分布面积最高可达18 002 km2,覆盖面积最高可达135 km2。浒苔具有营养吸收效率高、生长速度快和繁殖能力强的特点,比其他物种具有更明显的竞争优势(Luo et al, 2012)。
浒苔暴发的具体原因当前仍不完全清晰,目前的研究主要将其归结为海水富营养化、春夏季水温变化和增殖海域水动力交换缓慢导致局部种群密度增大等因素(Leskinen et al, 2004)。浒苔的发生与环境因素密不可分,适宜的温度、盐度、溶解氧(DO)和pH为浒苔绿潮的暴发提供了一定的环境条件(夏斌等, 2009; 葛红星等, 2019)。浒苔的暴发易导致水体缺氧、变酸、富营养化等严重的环境生态问题,并且与水中的其他生物竞争营养,对海水生态环境和海洋生物造成不良影响(刘牧时, 2021)。暴发后期,浒苔沉入海底或悬浮在一定深度后死亡,并被微生物分解,会大量消耗水体中的O2,造成水体缺氧(Hardison et al, 2010)。而腐烂释放的C、N、P等物质降低了海水水质,且影响异养微生物的繁殖和代谢(Ogawa et al, 2015)。同时,浒苔腐败导致大量的CO2溶解到海水中,降低海水的pH,加速海洋酸化,对海洋生态造成持续深远的影响(Witt et al, 2011)。
目前,关于浒苔暴发对环境生态影响的报道较多关注于暴发时的环境生态瞬时变化及其响应,而对浒苔暴发前后水体的自净作用效果及其微生物的生态风险的评估缺乏研究。因此,全面了解浒苔暴发前后水体和藻类中理化因子及菌群变化情况,并进一步评估主要优势菌的毒力和耐药性携带风险,对深入解析浒苔暴发对环境生态的影响机制具有重要意义。
基于此,本研究通过对青岛市沿岸海域绿潮暴发前后水体和藻体中理化因子和可培养细菌丰度、群落结构变化及主要优势菌的毒力和耐药基因携带风险进行评估,分析了绿潮暴发对青岛市沿岸水体和藻体中可培养细菌多样性以及环境生态特性的影响。相关研究结果将为黄渤海近岸海域生态系统的保护及公共卫生、水产养殖安全提供理论依据。
1 材料与方法 1.1 样品采集黄渤海地区绿潮暴发期为每年的5—8月(6—7月为高峰期),本研究于浒苔暴发前1个月(4月上旬)和暴发后1个月(9月下旬)为考察时间,依据山东省青岛市海岸线分布状况及区域属性,在黄岛区、市南区和崂山区共设定6个采样点,包括3种不同生境特点(内湾、浴场和外围海域)作为青岛近岸生态环境的代表。其中,琅琊湾(35°38′59.2″N;119°55′26.1″E)和鲁迅公园(36°3′25.7″N;120°18′43.1″E)采样点为内湾,水流交换弱,兼有岩岸和滩岸,底泥沙;金沙滩(35°57′19.0″N;120°14′35.9″E)和龙湾(35°39′42.1″N;119°54′29.4″E)采样点属于浴场,沿岸有大面积的海滩,水流交换适中;小麦岛(36°3′13.5″N;120°25′48.6″E)和凤凰山(35°58′7.8″N;20°16′20.0″E)采样点属外围海域,水流交换频繁,以焦岩和碎石为主。样品编号:黄岛琅琊地区LY (暴发前LY1,暴发后LY2)、鲁迅公园LX (暴发前:LX1;暴发后:LX2)、金沙滩JS (暴发前:JS1;暴发后:JS2)、龙湾LW (暴发前:LW1;暴发后:LW2)、小麦岛XM (暴发前:XM1;暴发后:XM2)、凤凰山FH (暴发前:FH1;暴发后:FH2)。其中,琅琊采样点绿潮暴发期间有大量浒苔聚集,表述为浒苔聚集地;龙湾、金沙滩、凤凰山、小麦岛和鲁迅公园采样点绿潮暴发期间浒苔未大量聚集,表述为非聚集地。
样品采集方式:在距岸边约15 m、深度约3 m处采集水样,每个采样点采集水样5 L,装入2个无菌塑料桶中,并利用YSI测定水体温度、pH、盐度等理化指标。采用无菌保鲜袋采集沿岸藻类或浒苔聚集物样品500 g,4 ℃低温打包带回实验室。
1.2 水体及藻类聚集物的环境理化因子检测参照《海洋监测规范第7部分:近海污染生态调查和生物监测》(GB 17378.7-2007)测定水体中大肠菌群和粪大肠菌群含量,参照《海洋监测规范第4部分:近海污染生态调查和生物监测》(GB 17378.4-2007)测定水体中化学需氧量(COD)、生化需氧量(BOD)、氨氮、亚硝酸盐、活性磷酸盐、无机氮、氰化物、As和Hg离子含量,参照《GB3097-1997海水水质标准》测定水体中非离子氨含量,参照《HY/T147.1-2013海洋监测技术规程第1部分:海水》测定水体中Cu、Zn、总Cr、Ni、Cd和Pb离子含量(测定标准参照《中华人民共和国国家标准》HY/T 147.1-2013),参照《水质硫化物的测定亚甲基蓝分光光度法》(HJ 1226-2021)测定水体中硫化物含量,参照《近岸海域环境监测规范》(HJ 442.3-2020)测定水体中Se离子含量。针对藻体及浒苔聚集物等藻类样品,参照《海洋监测规范第5部分:沉积物分析》(GB 17378.5-2007)对采集的藻类样品进行有机碳、硫化物、大肠菌群、粪大肠菌群、Hg和As离子含量的检测,参照《海洋监测技术规程第2部分:沉积物》(HY/T 147.2-2013)进行藻类样品中Cd、Pb、Zn、Cu和Cr离子含量的检测。共检测5个采样点的海水样品和2个采样点的藻体样品,每个样品设置3个重复组。
1.3 水体及藻体中可培养细菌检测利用10倍梯度稀释法将采集的水样稀释至一定倍数后,吸取100 μL涂布于TSB (胰蛋白胨大豆肉汤)培养基和TCBS (TCBS琼脂)培养基上,于28 ℃恒温箱中倒置培养24 h;称取1 g藻类样品,充分研磨后加入无菌1.5% NaCl溶液制成悬液,梯度稀释一定倍数后涂布到TSB和TCBS培养基上,28 ℃倒置培养24 h,每个样品3组平行实验。根据相应平板上的菌落数计算可培养细菌和弧菌总数,并计算弧菌占比。弧菌占比(%)=可培养弧菌总数÷可培养细菌总数×100%。
1.4 优势菌鉴定根据菌落的形态、颜色、大小、透明度等对平板上的细菌进行初步筛选和统计,随后挑取优势度较高的细菌单菌落进行纯化培养,并将纯化的单菌落置于保种液中,冻存于–80 ℃冰箱内。同时,挑取纯化后的单菌落,重悬于100 μL ddH2O中,99 ℃金属浴裂解15 min,4 ℃、12 000 r/min离心2 min后取上清液,测定菌体DNA浓度后,采用无菌ddH2O调整浓度至约100 μg/mL,用作PCR模板DNA,每个菌株设置3个重复。利用引物27F/1492R (Xiong et al, 2014)进行16S rDNA序列扩增,扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序合格的核酸序列通过NCBI数据库进行比对,确定病原所属种类。
1.5 优势菌中毒力和耐药基因检测采用普通PCR检测方法对优势菌株中4种耐药基因和5种毒力基因的携带风险进行检测,实验用毒力基因和耐药基因为常见弧菌病原菌的普遍检出耐药基因和毒力基因(Yu et al, 2023),耐药基因包括:氨基糖甙类strA、strB,喹诺酮类QnrVC,磺胺类sul2;毒力基因包括VAC、vhh、tlh、luxR、chxA和flaA。扩增条件:95 ℃预变性3 min;95 ℃变性30 s、依据Tm值设置退火温度退火30 s、72 ℃延伸45 s,循环30次;72 ℃温育5 min,4 ℃保存,PCR产物通过1%琼脂糖凝胶电泳进行检测。毒力基因与耐药基因引物及其退火温度等信息见表 1 (Yu et al, 2023),每个菌株设置3个重复,设置阴性对照和阳性对照。
|
|
表 1 实验所用引物 Tab.1 Primers used in the experiment |
数据采用IBM SPSS Statistics 26.0、Excel 2016、GraphPad Prism8.0和Origin 2022软件处理,结果以
平均值±标准差(Mean±SD)表示。使用SPSS 26.0统计软件对浒苔暴发前后水体和藻体理化因子进行非参数检验(Mann-Whitney U test),P < 0.05时差异显著;使用Origin 2022分析软件分析可培养细菌与环境因子的相关性。
2 结果与分析 2.1 浒苔暴发前后青岛近岸环境生态基本属性差异浒苔暴发前,青岛近岸环境生态的基本属性良好(图 1A、B和图 2A、B),内湾地区(琅琊、鲁迅公园采样点)沿岸岸基状态良好,岸边藻体呈青绿色;浴场地区(金沙滩、龙湾采样点)岸基状态良好,沿岸有大面积海滩,仅在水中见有少量漂浮浒苔,浒苔及石莼等藻类呈青绿色;外围海域(麦岛、凤凰山采样点)岸基状态良好,沿岸分布有海滩、大型岩石和草木等,仅在水中见有少量漂浮浒苔,藻体呈青绿色。

|
图 1 琅琊内湾浒苔聚集地环境生态状况 Fig.1 Environmental and ecological status of U. prolifera gathering area at Langya sampling site in basin A、B:暴发前琅琊采样点;C、D:暴发后琅琊采样点。 A and B: Langya sampling site before the outbreak; C and D: Langya sampling site after the outbreak. |

|
图 2 聚集处藻类样品外观形态 Fig.2 Appearance and morphology of algae samples at the gathering site A、B:暴发前琅琊采样点;C、D:暴发后琅琊采样点。 A and B: Langya sampling site before the outbreak; C and D: Langya sampling site after the outbreak. |
浒苔暴发后(图 1C、D),青岛近岸环境生态的基本属性总体变差,其中内湾地区海域环境生态变化尤其显著:以琅琊采样点为例,该处岸基状态差,沿岸海水中有大量腐烂浒苔沉积,呈黑褐色,似“石油”状,向海内延伸几十米,伴有刺鼻的恶臭味(图 1C、D);同时,自然状态的浒苔多呈短而细的褐绿色,具有腐败迹象(图 2C、D)。
2.2 浒苔暴发前后青岛沿岸水质理化因子变化特征分析对浒苔暴发前后青岛沿岸的水质理化因子进行显著性分析,其中有10个指标具有显著差异(P < 0.05) (图 3)。水体中DO含量由暴发前的8.79~9.88 mg/L下降至4.48~7.44 mg/L(P < 0.05),其中,内湾地区浒苔聚集地LY2采样点的DO值降低最为显著,下降至4.48 mg/L。COD、氨氮含量、无机氮含量、砷离子含量、活性磷酸盐含量较暴发期均显著升高;Cd、Pb、Cr、Cu等金属离子的含量均显著降低,但各采样点之间无明显区别。盐度、pH、大肠菌群、粪大肠菌群、生化需氧量(BOD5)、亚硝酸盐、非离子氨、Hg、Zn、Se、Ni、氰化物和硫化物含量在浒苔暴发前后无显著差异。
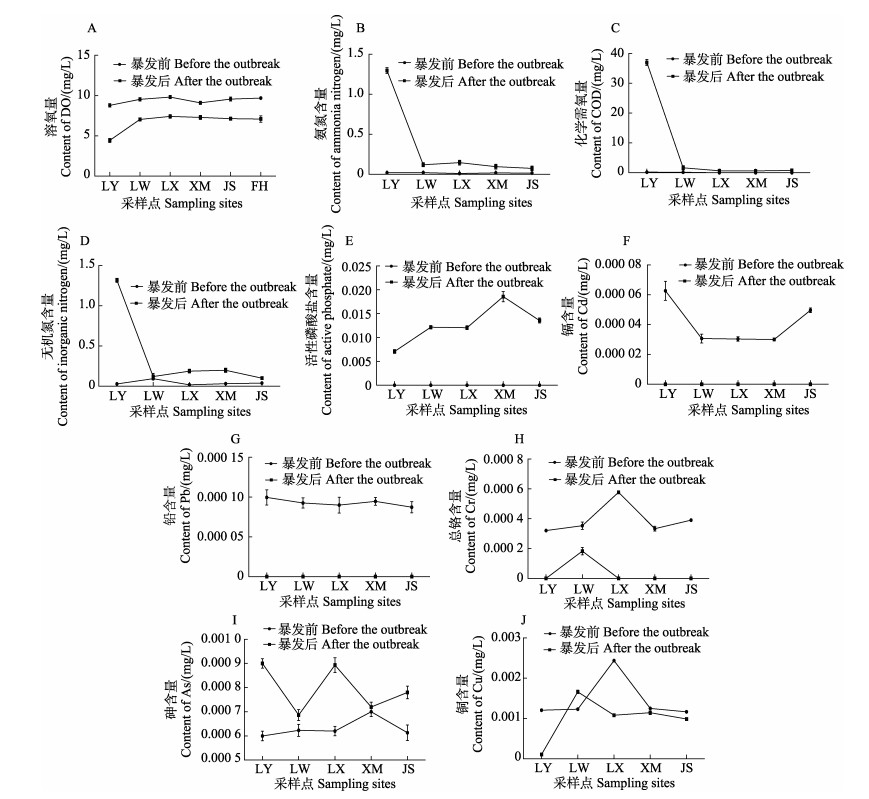
|
图 3 浒苔暴发前后水体中环境因子的变化情况 Fig.3 Changes in environmental factors in water before and after the outbreak of U. prolifera LY:琅琊地区;LW:龙湾地区;LX:鲁迅公园;XM:小麦岛;JS:金沙滩;FH:凤凰山。 LY: Langya region; LW: Longwan region; LX: Lu Xun Park; XM: Xiaomaidao Island; JS: Golden Beach; FH: Fenghuang Mountain. |
差异分析表明,浒苔暴发前,开放式海滩(龙湾地区,LW)无机氮含量显著高于内湾和市内外围海域(凤凰山和小麦岛);Cd离子在内湾(琅琊地区,LY)的检出量显著高于海水浴场和市内外围海域。浒苔暴发后,理化因子在各采样点间具有的差异性有所不同,氨氮、无机氮和COD含量在内湾地区显著高于浴场和外围海域,且三者在内湾浒苔聚集地(琅琊地区,LY)的含量最高,但DO值明显低于其他地区(图 3)。
暴发前后浒苔聚集地(内湾琅琊地区,LY1、LY2)与非聚集地(开放式海滩龙湾地区,LW1、LW2)浒苔样品中有机物和金属离子的差异分析表明二者具有明显差异(图 4)。暴发前,浒苔聚集地藻体中有机碳、Hg、Cd、Pb和Cu离子含量低于非聚集地;暴发后,浒苔聚集地藻体中有机碳含量仍低于非聚集地,但大肠菌群、粪大肠菌群、硫化物、Hg、Cd、Zn和Cu离子含量高于非聚集地,其中,大肠菌群和粪大肠菌群仅在聚集地有检出,含量为49 MPN/kg和23 MPN/kg,硫化物含量也由暴发前的139 mg/kg增加至2.19×104 mg/kg。在浒苔聚集地,浒苔暴发后比之暴发前Cd、Cr、As、硫化物含量均升高,其中,硫化物仅在浒苔暴发后有检出,含量为2.19×104 mg/kg。
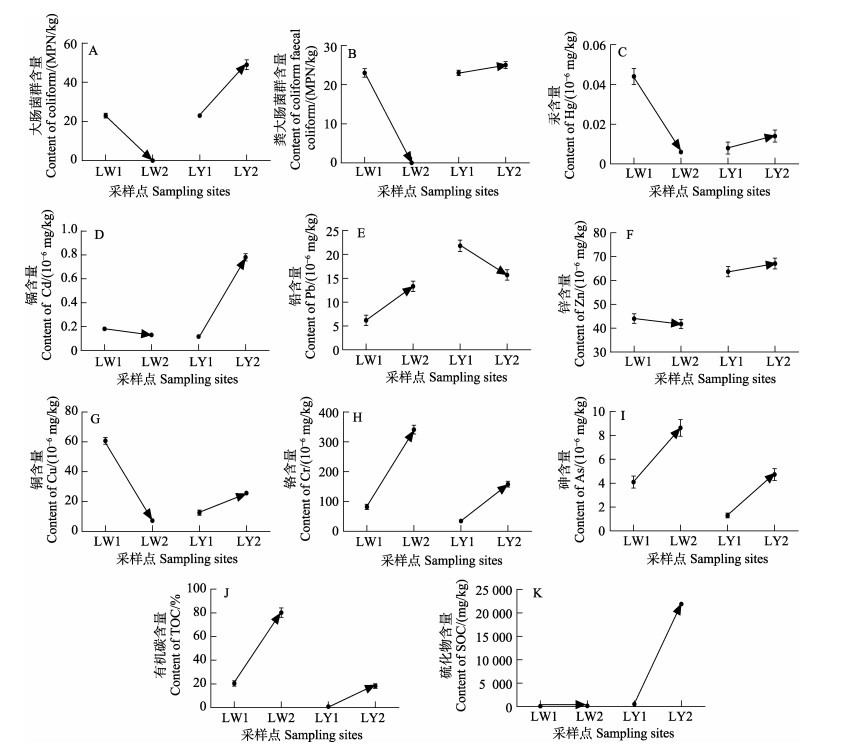
|
图 4 浒苔暴发前后聚集区与非聚集区浒苔中生物有机物和金属离子的变化 Fig.4 Changes in biological organics and metal ions in the clustered and non-clustered areas of U. prolifera before and after the outbreak LY1:暴发前琅琊地区;LW1:暴发前龙湾地区;LY2:暴发后琅琊地区;LW2:暴发后龙湾地区。 LY1: Langya region before U. prolifera outbreak; LW1: Longwan region before U. prolifera outbreak; LY2: Langya region after U. prolifera outbreak; LW2: Longwan region after U. prolifera outbreak. |
青岛沿岸海水和藻体中可培养细菌数量随浒苔的暴发而增加,其中,可培养弧菌由暴发前的9.65×104 CFU/mL(占比7%)增长到暴发后的1×107 CFU/mL (占比45%),增幅超2个数量级(图 5)。对各采样点可培养细菌丰度进行分析表明,暴发前可培养细菌数量为1.91×104~9.3×105 CFU/mL,均值为2.2×105 CFU/mL,其中琅琊采样点可培养细菌数量最多(9.3×105 CFU/mL),市内内湾鲁迅公园采样点可培养弧菌数量最多(1.15×105 CFU/mL)。暴发后,可培养细菌数量为5.01×104~6.65×106 CFU/mL,均值为2.22×106 CFU/mL,相较暴发前可培养细菌数量增长超1个数量级,可培养细菌和弧菌数量均达到106 CFU/mL,增长1~2个数量级;浒苔暴发后,6个采样点中5个采样点的可培养细菌和弧菌丰度均发生了增长,仅浒苔聚集地的LY2采样点可培养细菌和弧菌数量发生了下降,其中,可培养细菌由9.3×105 CFU/mL下降至5.01×104 CFU/mL,弧菌数量由6.31×104 CFU/mL下降至1.79×104 CFU/mL (图 6)。
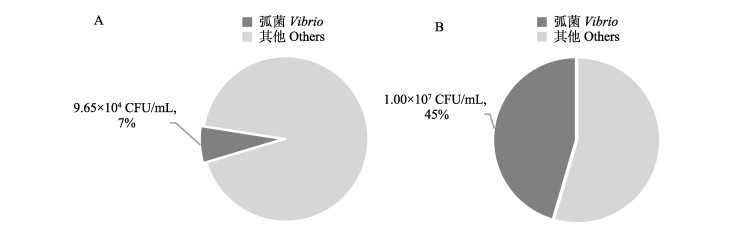
|
图 5 浒苔暴发前后可培养细菌中的弧菌占比 Fig.5 Proportion of Vibro in total culturable bacteria before and after the outbreak of U. prolifera A:暴发前;B:暴发后。 A: Before the outbreak; B: After the outbreak. |
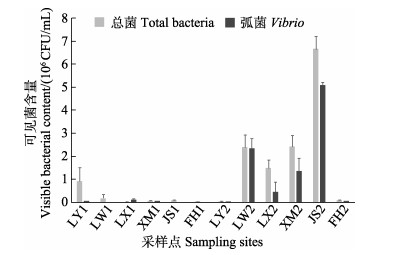
|
图 6 浒苔暴发前后各采样点的可培养细菌数量 Fig.6 Number of cultivable bacteria in the sampling sites before and after the outbreak of U. prolifera LY1:暴发前琅琊地区;LW1:暴发前龙湾地区;LX1:暴发前鲁迅公园;XM1:暴发前小麦岛;JS1:暴发前金沙滩;FH1:暴发前凤凰山;LY2:暴发后琅琊地区;LW2:暴发后龙湾地区;LX2:暴发后鲁迅公园;XM2:暴发后小麦岛;JS2:暴发后金沙滩;FH2:暴发后凤凰山。 LY1: Langya region before U. prolifera outbreak; LW1: Longwan region before U. prolifera outbreak; LX1: Lu Xun Park before U. prolifera outbreak; XM1: Xiaomaidao Island before U. prolifera outbreak; JS1: Jinshatan before U. prolifera outbreak; FH1: Fenghuang Mountain before U. prolifera outbreak; LY2: Langya region after U. prolifera outbreak; LW2: Longwan region after U. prolifera outbreak; LX2: Lu Xun Park after U. prolifera outbreak; XM2: Xiaomaidao Island after U. prolifera outbreak; JS2: Jinshatan after U. prolifera outbreak; FH2: Fenghuang Mountain after U. prolifera outbreak. |
为探究环境因子变化对水体和藻样中可培养细菌及弧菌数量的影响,将水体中可培养细菌和弧菌数量、藻样中可培养细菌和弧菌数量、水体和藻样中可培养细菌和弧菌总数与环境因子进行Spearman检验(图 7)。结果表明,水体和浒苔样品中可培养细菌丰度受温度、pH、氨氮、亚硝酸盐、无机氮、活性磷酸盐、总Cr和Ni等环境因子的影响。其中,pH、温度、亚硝酸盐、活性磷酸盐与浒苔样品中弧菌的丰度呈正相关,Ni、总Cr与浒苔样品中弧菌的丰度呈负相关;水体中弧菌数量随活性磷酸盐含量的增加而升高,随Ni离子的增加而降低;总弧菌数量随亚硝酸盐和活性磷酸盐的增加而增加,随总Cr和Ni离子的增加而降低。

|
图 7 浒苔暴发前后青岛沿岸水体与藻体细菌丰度与环境因子的关系 Fig.7 Relationship between bacterial abundance and environmental factors in the coastal waters and algae of Qingdao before and after the outbreak of U. prolifera (*P < 0.05, **P < 0.01) |
浒苔暴发前后各采样点中共获得158株优势菌。浒苔暴发前的79株优势菌中弧菌有62株,分属22个种,浒苔暴发后的优势菌中弧菌有65株,分属24个种(表 2)。
|
|
表 2 16S rDNA菌种鉴定结果 Tab.2 16S rDNA strain identification results |
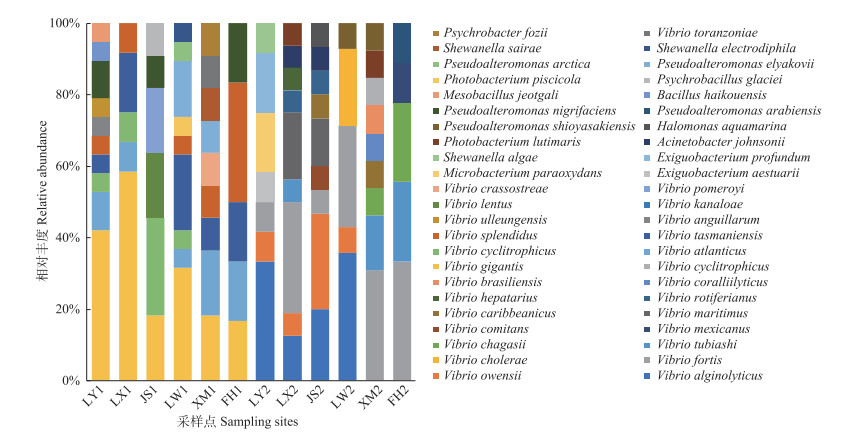
浒苔暴发前,各采样点中长巨牡蛎弧菌(Vibrio gigantis)均有检出(检出率100%)。相对丰度分析表明,在所有采样点中,长巨牡蛎弧菌为主要优势菌,相对丰度最高达32.91%。结合菌株在采样点中的出现频次和相对丰度可知,长巨牡蛎弧菌(100%,32.91%)、塔斯玛尼亚弧菌(V. tasmaniensis) (83.3%,11.39%)和大西洋弧菌(V. atlanticus) (83.3%,8.86%)是浒苔暴发前青岛沿岸海域可培养细菌的优势种。对各采样点中的这3种优势菌的检出频次进行统计分析可知,内湾地区优势菌检出频次最多为20株(次),外围海域优势菌检出频次最少为8株(次)。浒苔暴发后,各采样点中强壮弧菌(V. fortis)均有检出(检出率100%),相对丰度分析表明,在所有采样点中,强壮弧菌相对丰度最高,达22.78%。结合菌株在采样点中的出现频次和相对丰度可知,强壮弧菌(100%,22.78%)、溶藻弧菌(V. alginolyticus) (66.7%,17.72%)和欧文斯氏弧菌(V. owensii) (66.7%,8.86%)是浒苔暴发后青岛沿岸海域可培养细菌的优势种。对各采样点中的这3种优势菌的检出频次进行统计分析可知,浴场地区优势菌检出频次最多为18株(次),外围海域优势菌检出频次最少为7株(次)(图 8)。
|
图 8 浒苔暴发前后各采样点可培养细菌相对丰度图 Fig.8 Relative abundance of cultivable bacteria at sampling sites before and after the outbreak of U. prolifera LY1:暴发前琅琊地区;LW1:暴发前龙湾地区;LX1:暴发前鲁迅公园;XM1:暴发前小麦岛;JS1:暴发前金沙滩;FH1:暴发前凤凰山;LY2:暴发后琅琊地区;LW2:暴发后龙湾地区;LX2:暴发后鲁迅公园;XM2:暴发后小麦岛;JS2:暴发后金沙滩;FH2:暴发后凤凰山。 LY1: Langya region before U. prolifera outbreak; LW1: Longwan region before U. prolifera outbreak; LX1: Lu Xun Park before U. prolifera outbreak; XM1: Xiaomai Island before U. prolifera outbreak; JS1: Jinshatan before U. prolifera outbreak; FH1: Fenghuang Mountain before U. prolifera outbreak; LY2: Langya region after U. prolifera outbreak; LW2: Longwan region after U. prolifera outbreak; LX2: Lu Xun Park after U. prolifera outbreak; XM2: Xiaomai Island after U. prolifera outbreak; JS2: Jinshatan after U. prolifera outbreak; FH2: Fenghuang Mountain after U. prolifera outbreak. |
综上,浒苔暴发前后青岛沿岸海水和藻类中可培养优势菌均为弧菌属细菌,但弧菌的种类组成在浒苔暴发前后发生了改变,优势菌种类由浒苔暴发前的长巨牡蛎弧菌、塔斯玛尼亚弧菌和大西洋弧菌变为暴发后的强壮弧菌、溶藻弧菌和欧文斯氏弧菌。
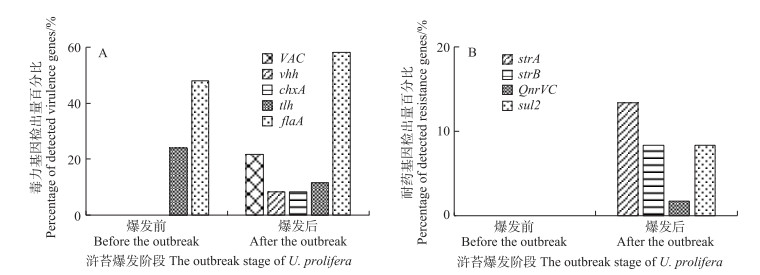
2.5 水产养殖生物潜在病原菌毒力风险评估对浒苔暴发前沿岸水体和藻体样品中分离到的54株优势菌(长巨牡蛎弧菌、塔斯玛尼亚弧菌、大西洋弧菌、灿烂弧菌V. splendidus、嗜环弧菌V. cyclitrophicus)和浒苔暴发后分离到的60株优势菌(强壮弧菌、溶藻弧菌、欧文斯氏弧菌、塔氏弧菌V. tubiashii、海生弧菌V. maritimus、霍乱弧菌V. cholerae、齐氏弧菌V. chagasii、加勒比弧菌V. caribbeanicus、轮虫弧菌V. rotiferianus、嗜环弧菌)进行弧菌常见毒力基因和耐药基因的携带风险检测(表 3)。结果表明,VAC、vhh、chxA、tlh和flaA等5种毒力基因与strA、strB、QnrVC和sul2等4种耐药基因均被检测到。其中,浒苔暴发前有39株菌中检测到了毒力基因,包括tlh和flaA,检出率分别为20.07%和48.14%(图 9A),浒苔暴发后有52株菌中检测到了5种毒力基因的携带,检出率在8.33%~58.33% (图 9A);4种耐药基因在浒苔暴发前均未检测到,浒苔暴发后,strA、strB、QnrVC和sul2的检出率分别为13.33%、8.33%、1.85%和8.33% (图 9B)。因此,浒苔暴发前后从水体和浒苔中分离到的优势菌中常见毒力基因的分布有很大的差异,浒苔暴发后比暴发前优势菌中毒力基因和耐药基因的检出率明显升高。
|
|
表 3 浒苔暴发前后优势菌的耐药基因与毒力基因分布 Tab.3 Distribution of resistance and virulence genes of dominant bacteria before and after the outbreak of U. prolifera |
|
图 9 浒苔暴发前后优势菌的毒力基因与耐药基因检出率 Fig.9 Detection rate of virulence genes and resistance genes of the dominant bacteria before and after the outbreak of U. prolifera A:毒力基因;B:耐药基因。 A: Virulence genes; B: Resistance genes. |
本研究发现,浒苔暴发后岸边及沿岸海水中有大量腐烂浒苔沉积,内湾浒苔聚集地伴有刺鼻的恶臭味,岸基下腐烂浒苔可周年残留。浒苔暴发后比暴发前DO (尤其是浒苔聚集地的DO)含量显著降低,砷离子、氨氮、COD、无机氮、活性磷酸盐含量显著增长。浒苔暴发会对海水的含氧量和pH值产生影响,导致水体出现缺氧和偏酸的状态(刘牧时, 2021)。浒苔暴发后,水体中砷离子含量升高,而As能以多种形式富集到海洋藻类和生物体中,最终通过食物链的累积作用到达人体,对人体健康造成危害(Clowes et al, 2004; Francesconi et al, 2004; Schaeffer et al, 2006)。氨氮是一种自然水体中广泛存在的无机污染物,能够加剧水体富营养化,且对水生动物有毒害效应(Chen et al, 2010; 孟振等, 2020)。COD表示水中还原性物质含量,COD越高,说明水体受有机物污染越严重(Kawabe et al, 1997)。研究发现,浒苔暴发后,COD含量显著升高,说明浒苔暴发后有机物污染加剧。无机氮和活性磷酸盐浓度过高容易引起水体富营养化,从而导致有害赤潮的发生(王燕等, 2021)。
Lin等(2017)研究发现,有浒苔池塘细菌群落的多样性和丰富度高于无浒苔池塘。王春忠等(2017)研究发现,浒苔具有抑制和增加不同致病菌的双重作用。本研究发现,浒苔暴发前后海洋环境中有害菌的增殖变化属性不同,浒苔暴发后海洋环境中可培养细菌的种类和丰度均增加。浒苔暴发后,海水环境可培养细菌的群落结构发生改变,浒苔暴发前,青岛沿岸海水环境中的主要优势菌为长巨牡蛎弧菌、塔斯玛尼亚弧菌和大西洋弧菌,而随着浒苔的暴发,该类优势菌的丰度降低,暴发后的优势菌变为强壮弧菌、溶藻弧菌和欧文斯氏弧菌,也是海水养殖生物的常见病原菌(Wang et al, 2016; Yang et al, 2021; Goullden et al, 2012)。毒力和耐药风险评估表明,浒苔暴发后比暴发前优势菌中的毒力基因(VAC、vhh、chxA和flaA)和耐药基因(strA、strB、QnrVC和sul2)的检出率明显升高。strA、trB、QnrVC和sul2耐药基因检出率的升高增强了细菌产生氨基糖苷类药物、喹诺酮类药物和磺胺类药物等水产养殖常用抗菌药物耐药性的风险,同时增强了耐药基因的传播风险(李十盛等, 2021)。VAC、vhh、chxA和flaA毒力基因检出率的升高表明海水养殖环境中致病性弧菌的种类和数量增多,同时,由于细菌具有携带和传播毒力基因的潜在风险,也大大增强了海洋生物的疾病发生风险(Yu et al, 2023)。
研究发现,浒苔暴发前后海洋环境中的各环境因子和病原菌的群落结构发生变化。在开放体系中,藻类大量繁殖常常受到可利用的碳含量的限制,而细菌能够驱动碳循环,在开放的藻类培养体系中增加异养细菌可以提高藻类的产量,因此,细菌能通过驱动水体碳循环改变水体环境,使之更适合浒苔的生长,为浒苔的暴发创造良好的条件(Bai et al, 2015)。浒苔腐烂分解过程中会与水中的其他生物竞争营养、产生有毒的氨氮和硫化氢,同时,浒苔会导致水体缺氧、变酸,对海水养殖动物的生存造成威胁(刘牧时, 2021; Wang et al, 2011)。研究表明,有浒苔池塘细菌群落的多样性和丰富度高于无浒苔池塘,浒苔的大量生长会对细菌群落结构产生严重影响,增加对海水养殖生物的潜在性威胁(Lin et al, 2017)。本研究中,浒苔暴发后细菌的群落结构发生变化,可培养弧菌的种类和数量均增多,增加了对海水养殖生物的潜在性威胁。浒苔对Cd、Cu等重金属离子具有富集作用(郭赣林等, 2011)。本研究中,浒苔暴发后其聚集地的藻体中Cd、Cu、Hg、Zn离子的含量均显著升高,说明浒苔不仅能富集Cd离子和Cu离子,对Hg离子和Zn离子同样具有吸附作用,藻体中重金属离子含量的升高容易在许多食藻动物体内进行富集,进而对水产品质量和人类健康产生威胁。
本研究通过对浒苔暴发前后青岛市近岸环境生态基本属性变化、水体和藻体中理化因子及可培养细菌丰度和种类的变化、优势菌常见毒力基因和耐药基因的分布变化等进行研究,分析了浒苔暴发对青岛市沿岸水体和藻体中可培养细菌多样性以及环境生态特性的影响,为黄渤海近岸海域浒苔绿潮防控、海洋生态保护、水产健康养殖和公共卫生治理提供了理论依据。
BAI X, LANT P, PRATT S. The contribution of bacteria to algal growth by carbon cycling. Biotechnology and Bioengineering, 2015, 112(4): 688-695 DOI:10.1002/bit.25475 |
CHEN G Y, CAO X Y, SONG C L, et al. Adverse effects of ammonia on nitrification process: The case of Chinese shallow freshwater lakes. Water Air and Soil Pollution, 2010, 210(1): 297-306 |
CLOWES L A, FRANCESCONI K A. Uptake and elimination of arsenobetaine by the mussel Mytilus edulis is related to salinity. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2004, 137(1): 35-42 DOI:10.1016/j.cca.2003.11.003 |
FRANCESCONI K A, KUEHNELT D. Determination of arsenic species: A critical review of methods and applications, 2000–2003. Analyst, 2004, 129(5): 373-395 DOI:10.1039/B401321M |
GE H X, CHEN Z, LI J, et al. Effects of temperature on the growth rate and nitrogen uptake of Ulva prolifera. Progress in Fishery Sciences, 2019, 40(6): 138-144 [葛红星, 陈钊, 李健, 等. 温度对浒苔生长及不同氮源吸收特性的影响. 渔业科学进展, 2019, 40(6): 138-144] |
GOULLDEN E F, HALL M R, BOURNE D G, et al. Pathogenicity and infection cycle of V. owensii in larviculture of the ornate spiny lobster (Panulirus ornatus). Applied and Environmental Microbiology, 2012, 78(8): 2841-2849 DOI:10.1128/AEM.07274-11 |
GUO G L, ZHU M, XU J T, et al. Biosorption of Cu2+ and Cd2+ by Enteromorpha prolifera and their physiological responses. Marine Environmental Science, 2011, 30(6): 850–852, 857 [郭赣林, 朱明, 徐军田, 等. 浒苔对重金属Cu2+、Cd2+的生物吸附及其生理反应. 海洋环境科学, 2011, 30(6): 850–852, 857 DOI:10.3969/j.issn.1007-6336.2011.06.021] |
HARDISON A K, CANUEL E A, ANDERSON I C, et al. Fate of macroalgae in benthic systems: Carbon and nitrogen cycling within the microbial community. Marine Ecology Progress, 2010, 414: 41-55 DOI:10.3354/meps08720 |
JI Q X, ZHAO X W, ZHANG Z. Spatial and temporal distribution characteristic of the Enteromorpha prolifera in the Jiangsu coastal area and their influence on the ecological environment. Journal of Shandong Agricultural University (Natural Science), 2015, 46(1): 61-64 [吉启轩, 赵新伟, 章志. 江苏海域浒苔时空分布特征及对海洋环境的影响. 山东农业大学学报(自然科学版), 2015, 46(1): 61-64] |
KAWABE M, KAWABE M. Temporal and spatial characteristics of chemical oxygen demand in Tokyo Bay. Journal of Oceanography, 1997, 53: 19-26 DOI:10.1007/BF02700745 |
LESKINEN E, ALSTROM-RAPAPORT C, PAMILO P. Phylogeographical structure, distribution and genetic variation of the green algae Ulva intestinalis and U. compressa (Chlorophyta) in the Baltic Sea area. Molecular Ecology, 2004, 13(8): 2257-2265 DOI:10.1111/j.1365-294X.2004.02219.x |
LI S S, GAO H, ZHAO F Q, et al. Research progress on the occurrence and influencing factors of antibiotic resistance genes in aquaculture environment. China Environmental Science, 2021, 41(11): 5314-5325 [李十盛, 高会, 赵富强, 等. 水产养殖环境中抗生素抗性基因的研究进展. 中国环境科学, 2021, 41(11): 5314-5325 DOI:10.3969/j.issn.1000-6923.2021.11.040] |
LIN G R, SUN F L, WANG C Z, et al. Assessment of the effect of Enteromorpha prolifera on bacterial community structures in aquaculture environment. PLoS One, 2017, 12(7): e0179792 DOI:10.1371/journal.pone.0179792 |
LIU M S. The effect of decay Enteromorpha prolifera on seawater ecological environment. Journal of Shandong Agricultural University (Natural Science), 2021, 52(3): 466-469 [刘牧时. 腐烂浒苔对海洋生态的影响. 山东农业大学学报(自然科学版), 2021, 52(3): 466-469] |
LUO M B, LIU F, XU Z L. Growth and nutrient uptake capacity of two co-occurring species, Ulva prolifera and Ulva linza. Aquatic Botany, 2012, 100: 18-24 DOI:10.1016/j.aquabot.2012.03.006 |
MENG Z, ZHANG H L, LIU X F, et al. Toxic effects of acute ammonia stress on young turbot Scophthalmus maximus. Progress in Fishery Sciences, 2020, 41(2): 51-60 [孟振, 张鸿丽, 刘新富, 等. 氨氮急性胁迫对大菱鲆幼鱼的毒性效应. 渔业科学进展, 2020, 41(2): 51-60] |
Ministry of Natural Resources. 2022 Bulletin of China marine disaster. China Natural Resources News, 2023-4-5 [自然资源部. 2022年中国海洋灾害公报. 中国自然资源报, 2023-4-5]
|
OGAWA T, OHKI K, KAMIYA M. High heterozygosity and phenotypic variation of zoids in apomictic Ulva prolifera (Ulvophyceae) from brackish environments. Aquatic Botany, 2015, 120: 185-192 DOI:10.1016/j.aquabot.2014.05.015 |
SCHAEFFER R, FRANCESCONI K A, KIENZL N, et al. Arsenic speciation in freshwater organisms from the river Danube in Hungary. Talanta, 2006, 69(4): 856-865 |
WANG C Z, SUN F L, HOU D Y, et al. Study on the microbial characteristics of seawater pond based on Enteromorpha bloom. Haiyang Xuebao, 2017, 39(4): 107-116 [王春忠, 孙富林, 侯代云, 等. 基于浒苔暴发海水池塘的微生物生态特征研究. 海洋学报, 2017, 39(4): 107-116] |
WANG C, YU R C, ZHOU M J. Acute toxicity of live and decomposing green alga Ulva (Enteromorpha) prolifera to abalone Haliotis discus hannai. Chinese Journal of Oceanology and Limnology, 2011, 29(3): 541-546 |
WANG X, ZHANG Y, Q G, et al. A novel pathogenic bacteria (Vibrio fortis) causing enteritis in cultured seahorses, Hippocampus erectus Perry, 1810. Journal of Fish Diseases, 2016, 39(6): 765-769 |
WANG Y, YAO Z T, ZHU Y J, et al. Seasonal variation of nutrients and eutrophication of 2019 in Bohai Sea, China. Marine Environmental Science, 2021, 40(6): 915-921 [王燕, 姚振童, 祝艳君, 等. 2019年渤海氮磷营养盐季节变化及富营养化状况. 海洋环境科学, 2021, 40(6): 915-921] |
WITT V, WILD C, ANTHONY K R N, et al. Effects of ocean acidification on microbial community composition of, and oxygen fluxes through, biofilms from the Great Barrier Reef. Environmental Microbiology, 2011, 13(11): 2976-2989 |
XIA B, MA S S, CUI Y, et al. Distribution of temperature, salinity, dissolved oxygen, nutrients and their relationships with green tide in Enteromorpha prolifera outbreak area of the Yellow Sea. Progress in Fishery Sciences, 2009, 30(5): 94-101 [夏斌, 马绍赛, 崔毅, 等. 黄海绿潮(浒苔)暴发区温盐、溶解氧和营养盐的分布特征及其与绿潮发生的关系. 渔业科学进展, 2009, 30(5): 94-101] |
XIONG J B, ZHU J L, WANG K, et al. The temporal scaling of bacterioplankton composition: High turnover and predictability during shrimp cultivation. Microbial Ecology, 2014, 67(2): 256-264 |
YANG B, ZHAI S Y, LI X, et al. Identification of Vibrio alginolyticus as a causative pathogen associated with mass summer mortality of the Pacific oyster (Crassostrea gigas) in China. Aquaculture, 2021, 535: 736363 |
YE N H, ZHANG X W, MAO Y Z, et al. 'Green tides' are overwhelming the coastline of our blue planet: Taking the world's largest example. Ecological Research, 2011, 26(3): 477-485 |
YU Y X, TANG M M, WANG Y G, et al. Virulence and antimicrobial resistance characteristics assessment of Vibrio isolated from shrimp (Penaeus vannamei) breeding system in south China. Ecotoxicology and Environmental Safety, 2023, Suppl C: 114615 |



