2. 上海海洋大学水产与生命学院 上海 201306;
3. 烟台开发区天源水产有限公司 山东 烟台 264001;
4. 长岛海洋生态文明综合试验区自然资源局 山东 烟台 265800
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. Yantai Development Zone Tianyuan Aquatic Products Co., Ltd., Yantai 264001, China;
4. Natural Resources Bureau Marine Ecological Civilization Comprehensive Experimental Area of Changdao, Yantai 265800, China
许氏平鲉(Sebastes schlegelii)是我国北方沿海网箱、深远海养殖和增殖放流的主要品种,具有适温范围广、适应性强、自然越冬等优点,养殖模式以“陆海接力”为主(张德胜等, 2012; 徐国成等, 2018),即在室内工厂化车间完成苗种培育,随后将相应规格的苗种转移至近海网箱、深远海网箱进行接力养成,在陆海接力运输中,苗种易受捕捞、水温、溶解氧、氨氮等理化因素刺激发生体表损伤和生理应激反应,导致鱼苗抵抗力降低,影响后续养殖成活率及经济效益,成为制约养殖产业发展的主要因素(高滨等, 2021)。
许氏平鲉苗种陆海接力运输中主要采用降低水温、增加溶解氧、添加消毒剂和抗生素对苗种进行处理,以降低苗种运输过程中的损伤,这种处理方式对体表有伤口的苗种有一定的效果,但不能解决苗种因运输过程导致的应激反应(徐国成等, 2018)。因此,筛选一种使用方便、安全无害并能有效降低许氏平鲉苗种生理应激反应的麻醉剂,以保障运输过程和入海初期苗种的成活率,对于许氏平鲉陆海接力养殖具有重要意义。
水产养殖中常用的麻醉镇定剂有间氨基苯甲酸乙酯甲磺酸盐(MS-222)、丁香酚和CO2等30余种(Priborsky et al, 2018; Hoseini et al, 2019; Liu et al, 2022)。MS-222是唯一被美国食品和药品管理局(FDA)批准使用的鱼用麻醉剂,广泛应用于鱼体的保活运输,已用于半滑舌鳎(Cynoglossus semilaevis Günther) (刘长琳等, 2008)、斑马鱼(Danio rerio)(Chambel et al, 2015)、大菱鲆(Scophthalmus maximus)(曹杰等, 2021)等多种鱼类的研究。其麻醉途径是通过鳃和皮肤进入鱼体,首先抑制脑的皮质(触觉丧失期),再作用于基底神经节与小脑(兴奋期),最后作用于脊髓(麻醉期),以抑制中枢神经功能而对鱼体麻醉,有效减少应激胁迫,通过降低呼吸速率和能量代谢,减小应激损伤(Späth et al, 1977)。关于麻醉剂在许氏平鲉中的应用,相关研究已探讨了丁香酚(关健等, 2010)、2-苯氧乙醇(关健等, 2010)和MS-222 (周竹君等, 1999; Son et al, 2001; 官曙光等, 2011)对不同规格幼鱼的麻醉效果,但由于已有研究的实验鱼体规格过小[体质量为(0.39~14.9) g,全长为4~10 cm]或过大(187.6 g),限制了其应用范围。
本研究针对许氏平鲉的增殖放流和近海网箱陆海转运以及深远海接力养殖不同阶段对幼鱼规格的不同需求,选择体质量约为10 g、40 g和80 g的3种规格幼鱼,探讨MS-222对其镇静和麻醉的效果及其理想浓度范围,以期为许氏平鲉不同规格苗种的安全运输和生物学实验操作(如测量、标记、样品采集)提供参考。
1 材料与方法 1.1 实验用鱼实验鱼为烟台开发区天源水产有限公司培育的人工苗种,分为3个规格组:W10组[体质量为(10.11± 2.13) g,全长为(8.20±0.68) cm]、W40组[体质量为(42.38±5.19) g,全长为(14.73±0.84) cm]和W80组[体质量为(80.79±6.65) g,全长为(17.41±0.67) cm],每组选择体表无损伤、体质健康、规格整齐的幼鱼,实验前在养殖水槽中暂养48 h (30尾/桶,150 L),暂养期间保持正常流水,养殖水温为18 ℃,盐度为30,pH为7.85,溶解氧浓度为(8.50±0.45) mg/L,禁食。
1.2 实验设计 1.2.1 实验条件麻醉剂MS-222购自Sigma公司[西格玛奥德里奇(上海)贸易有限公司],纯度大于98%。MS-222实验浓度共设置12个梯度(20、30、40、50、60、70、80、90、100、110、120和130 mg/L),每个浓度设置3个平行样,每个平行样10尾实验鱼,放置于盛有10 L新鲜海水的保温箱内,海水水温为(14.5±0.5) ℃、pH为7.85、盐度为30、溶解氧浓度大于7.5 mg/L。
1.2.2 麻醉效果分期标准参考常规麻醉效果分期和许氏平鲉幼鱼在MS-222麻醉效果下的行为特征,将麻醉过程分为6个时期,具体行为特征见表 1。
|
|
表 1 许氏平鲉麻醉期和复苏期及各期行为特征 Tab.1 Behavioral characteristics of anesthesia stages and recovery stages of S. schlegelii |
以实验幼鱼放入盛有相应浓度MS-222的保温箱的时间为零点,观察幼鱼在各浓度中的行为表现,每组均以15 min计时,效应时间指从将幼鱼放入MS-222麻醉溶液开始到镇静期(A2)、麻醉期(A4)、休克期(A6)和休克后转入清水至正常复苏(R)所需时间,分别是A2期、A4期、A6期和R期效应时间。
1.2.4 呼吸频率的测定以鳃盖张合1次判定为1次呼吸,呼吸频率单位为次/分。不同规格的初始呼吸频率为正常状态下的呼吸次数,实验幼鱼在麻醉剂中达到A2或A4期后,稳定30 s,记录各浓度条件下的呼吸频率,低浓度组(20~60 mg/L)记录A2期的呼吸频率,中高浓度组(70~130 mg/L)记录A4期的呼吸频率。
1.2.5 最佳镇静、麻醉浓度的确定参考Marking等(1985)确定的麻醉剂理想浓度标准,即麻醉剂理想浓度为鱼体在麻醉剂中180 s之内达到麻醉期(A4期),300 s之内复苏,且成活率为100%的浓度。最佳镇静浓度、麻醉浓度分别设定为幼鱼在180 s达到A2期或A4期,且能在5 min内复苏,复苏成活率为100%的麻醉剂浓度。
1.2.6 麻醉模拟运输实验模拟运输以上述获得的MS-222休克最低浓度(60 mg/L)为上限浓度,设置MS-222浓度为30、40、50和60 mg/L,共4个模拟运输组,每个浓度设置3个重复,设置1个空白运输组为对照组。模拟运输条件采用30 L塑料打包袋,装入10 L新鲜海水,水温为14.5 ℃,分别挑选体质健康的W10、W40和W80组苗种80、20和10尾置于打包袋中(运输密度约为80 g/L),以液氧充气,使水体溶解氧浓度达到过饱和状态(> 15 mg/L),打包后置于模拟运输振动台以100 r/min的速度往复振动模拟运输8 h,运输结束后,将鱼苗转入养殖水槽,统计24 h内的存活率并及时剔除死亡个体。
1.3 数据分析不同规格幼鱼达到A2期和A4期的时间及呼吸频率数据以平均值±标准差(Mean±SD)表示,并采用SPSS 26.0软件进行双因素方差分析(two-way ANOVA),以Tukey´s多重比较分析同一规格不同麻醉浓度和同一浓度不同规格组间的差异,P < 0.05为显著性差异,以二次曲线回归分析确定不同规格幼鱼的最佳镇静浓度和麻醉浓度。
2 结果 2.1 不同浓度的MS-222麻醉效果及鱼体行为反应观察并记录3种规格幼鱼在不同MS-222浓度下麻醉后的行为特征,在MS-222浓度为20~40 mg/L时,3种规格(W10、W40和W80)幼鱼在15 min观察时间内仅达到深度镇静期(A2),幼鱼可维持身体平衡,碰触后反应迟钝;50 mg/L时,3种规格幼鱼3~ 4 min可达到轻度麻醉期(A3),幼鱼表现为反应更为迟钝,躯体平躺后,头尾上翘成弓形摆动,无法保持平衡;60 mg/L时,3种规格幼鱼9~14 min可达到麻醉期(A4),幼鱼表现出典型的麻醉症状,即鱼体侧卧静止,肌肉张力消失,无法维持身体平衡;70~130 mg/L时,均可达到休克期(A6),鱼体表现为侧卧静止,鳃盖停止张合。麻醉效果达最终状态后,将幼鱼迅速转移至清洁海水中,微充气,各实验组均能在5 min内复苏,且恢复1 h后成活率达100%。
2.2 3种规格幼鱼的最佳镇静浓度双因素方差分析结果显示,在低浓度(20~60 mg/L)时,幼鱼体重、麻醉剂浓度及二者交互作用均对幼鱼A2期的效应时间具有显著性影响(P < 0.05) (图 1),具体表现为同一规格的幼鱼随麻醉浓度的升高,A2期效应时间呈下降趋势;同一麻醉浓度条件下,幼鱼A2期效应时间则与规格正相关。对不同规格幼鱼A2期效应时间与麻醉剂浓度进行二次曲线回归分析,W10、W40和W80组幼鱼A2期效应时间(y)和麻醉剂量(x)的关系式分别为y=0.210 7x2–21.207x+602.6 (R2=0.95)、y=0.202 1x2–21.501x+642.6 (R2=0.98)和y=0.089 3x2–14.153x+606 (R2=0.91)。以设定的A2期效应时间是180 s对应的麻醉剂浓度为最佳镇静浓度的标准,W10、W40、W80组幼鱼MS-222最佳镇静浓度分别为27.38、29.94和40.39 mg/L。
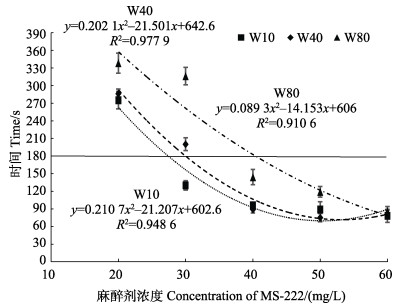
|
图 1 3种规格许氏平鲉幼鱼A2期效应时间与MS-222浓度的二次曲线回归分析 Fig.1 Quadratic regression analysis of the time reaching sedation stage (A2) and the concentration of MS-222 in three groups of S. schlegelii juveniles |
双因素方差分析结果显示,在高浓度(70~ 130 mg/L)时,幼鱼体重、麻醉剂浓度及二者交互作用均对幼鱼A4期效应时间具有显著性影响(P < 0.05) (图 2),具体表现为同一麻醉浓度条件下,幼鱼A4期效应时间与幼鱼规格呈正相关;同一规格幼鱼,A4期效应时间随麻醉剂浓度升高呈下降趋势;在130 mg/L时,3种规格A4期效应时间无显著性差异。对不同规格幼鱼A4期效应时间与麻醉剂浓度进行二次曲线回归分析,W10、W40和W80组幼鱼A4期效应时间与麻醉剂浓度间的关系式分别为y=0.043 1x2– 10.755x+813.57 (R2=0.97)、y=0.062 1x2–16.221x+1 205.6 (R2=0.97)和y=0.059 6x2–15.954x+1 229.9 (R2=0.92)。以设定的A4期效应时间是180 s对应的麻醉剂浓度为最佳麻醉浓度的标准,W10、W40和W80组幼鱼MS-222最佳麻醉浓度分别为95.32、107.32和116.58 mg/L。
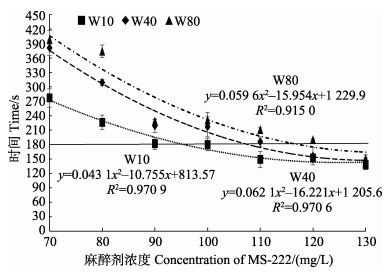
|
图 2 3种规格许氏平鲉幼鱼A4期效应时间与MS-222浓度的二次曲线回归分析 Fig.2 Quadratic regression analysis of the time reaching anesthesia stage (A4) and the concentration of MS-222 in three groups of S. schlegelii juveniles |
MS-222浓度高于70 mg/L时,3种规格幼鱼均可达到A6期,双因素方差分析结果显示,在高浓度(70~130 mg/L)时,幼鱼体重、麻醉剂浓度及二者交互作用均对幼鱼A6期效应时间具有显著性影响(P < 0.05) (图 3)。同一规格的幼鱼A6期效应时间随麻醉剂浓度的升高逐渐下降;在同一浓度条件下,除130 mg/L组外,W10组A6期效应时间最短,显著低于其他2组(P < 0.05),W40和W80组在MS-222浓度小于110 mg/L时,二者间A6期效应时间无显著性差异,此后,W40组A6期效应时间则显著低于W80组(P < 0.05)。
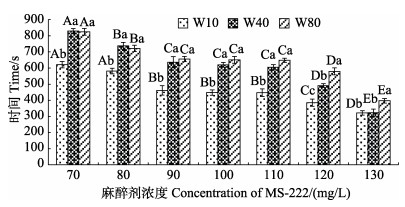
|
图 3 3种规格许氏平鲉幼鱼A6期效应时间与MS-222浓度的关系 Fig.3 Relationship between the time reaching shock stage (A6) and the concentration of MS-222 in three groups of S. schlegelii juveniles 柱形上方不同大写字母表示同一规格不同浓度组间存在显著差异(P < 0.05);不同小写字母表示同一浓度不同规格组间存在显著差异(P < 0.05)(下同)。 Different uppercase letters above the column indicate significant differences between MS-222 concentrations in the same specification group (P < 0.05). Different lowercase letters indicate significant differences between the three specification groups at the same MS-222 concentration (P < 0.05) (the same below). |
幼鱼达A6期1~2 min后,迅速转移至清洁海水中,记录复苏时间。结果表明,在设定的MS-222浓度范围内(70~130 mg/L),3种规格幼鱼休克后复苏时间波动范围为120~290 s (图 4)。幼鱼的复苏时间受体重和交互作用的显著影响,同一规格幼鱼复苏时间与麻醉剂浓度无显著相关性,同一浓度条件下,复苏时间与规格呈负相关,复苏时间由长到短依次为W10、W40、W80。
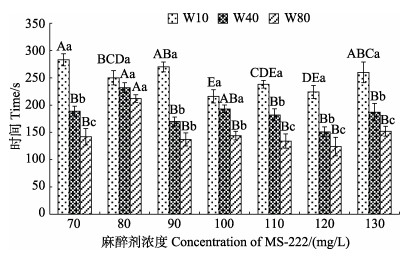
|
图 4 3种规格许氏平鲉幼鱼休克期后复苏效应时间与MS-222浓度的关系 Fig.4 Relationship between the recovery time after shock and MS-222 concentration in three groups of S. schlegelii juveniles |
由表 2可知,W10、W40和W80组幼鱼正常呼吸频率分别为(68.35±4.22)、(67.21±5.45)和(60.41± 3.91)次/min。MS-222浓度为20~60 mg/L时,3种规格的幼鱼在A2期均呼吸平缓,呼吸频率与正常呼吸频率间无显著差异,表明麻醉剂对镇静期的幼鱼呼吸频率无显著性影响。MS-222浓度为70~130 mg/L时,3种规格幼鱼在A4期呼吸频率随麻醉剂浓度升高均呈显著下降趋势(P < 0.05)。此后,随着麻醉时间的延长,幼鱼表现出裂鳃和间断呼吸的现象,最终呼吸频率降至0,进入休克期(A6)。
|
|
表 2 3种规格幼鱼在A2和A4期呼吸频率的变化 Tab.2 Respiratory rates during sedation and anesthesia stage of three groups of S. schlegelii juveniles |
采用不同浓度的MS-222麻醉幼鱼,模拟运输8 h后转入新鲜海水中,MS-222浓度为30~50 mg/L时,3种规格均保持100%的存活率,显著高于未添加麻醉剂的对照运输组,而MS-222浓度达到60 mg/L时,W10和W40存活率下降至约60%和80%,W80组仍保持100%的存活率(图 5)。由此得知,以运输时长8 h计,W10和W40最高安全运输浓度不应超过50 mg/L,W80最高安全浓度不超过60 mg/L。
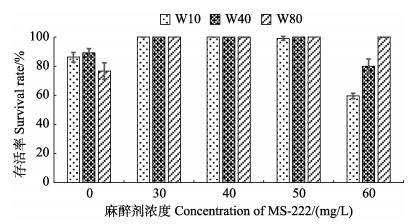
|
图 5 3种规格许氏平鲉幼鱼MS-222麻醉模拟运输8 h后存活率 Fig.5 Survival rates in three groups of S. schlegelii juveniles after 8 h of MS-222 anesthesia simulated transportation |
鱼苗种类、规格、健康状况等生物学因素和麻醉剂类型、浓度、水温、作用时间等环境因素是影响鱼类麻醉效果的主要因素(柳旭东等, 2009; 杨博学等, 2018; 范耘硕等, 2019; 李乐等, 2019; He et al, 2020; 王维鑫等, 2021)。MS-222作为神经麻醉剂,经鳃和皮肤进入鱼体,抑制Na+进入细胞并与Na+通道结合,阻断神经信号传导,降低神经敏感性(Ryan, 1992),且随着麻醉浓度的升高,在渗透压变化和细胞简单扩散的作用下,达到麻醉临界阈值的速度越快,同时,抑制气体交换,影响血压、心率和心输出量的变化,继而出现机体失衡、呼吸频率降低、丧失自主运动能力和休克等状态(Hill et al, 2004)。本研究结果表明,3种规格的幼鱼A2、A4和A6期效应时间均随麻醉剂浓度的升高逐渐缩短,随幼鱼规格的增加逐渐延长。究其原因,可能与小规格幼鱼呼吸频率高,加速了麻醉剂通过鳃呼吸代谢进入中枢神经系统的速度,麻醉效应时间缩短(Son et al, 2001; 刘艳超等, 2018)。Son等(2001)和官曙光等(2011)采用MS-222对许氏平鲉小规格(0.39~13.1 g)幼鱼的麻醉实验得到相似结论,但后者在MS-222浓度为80 mg/L时,小规格幼鱼尚未进入休克期,可能与温度、溶解氧等实验条件有关。本研究中,3种规格幼鱼休克后复苏时间与麻醉剂浓度无显著相关性,而与规格呈显著负相关。复苏时间主要与鳃组织面积、种属特异性和水体溶解氧浓度等因素有关,机体调节机制有待进一步研究(Houston et al, 1976; Hikasa et al, 1986; Obirikorang et al, 2020; Sorensen et al, 2023)。
深度镇静期(A2)被普遍认为是鱼类苗种运输的最佳时期(张伟佳等, 2023),处于A2期的幼鱼对外界刺激反应迟钝,并且能保持平衡,可以避免麻醉状态(A3~A4期)下因肌肉张力和身体平衡丧失导致鱼苗聚集引起缺氧窒息和机械损伤,从而提高运输成活率(魏锁成, 2005; 杨希等, 2018)。本研究中,按照设定的180 s到达A2期的麻醉剂浓度为最佳镇静浓度的标准,通过二次曲线分析得知,W10、W40和W80组的MS-222最佳镇静浓度分别为27.38、29.94和40.39 mg/L,可以作为3种规格幼鱼运输的参考浓度。8 h模拟运输实验结果证实,MS-222浓度为60 mg/L时,W10和W40组幼鱼长期处于麻醉期(A4),鱼体侧卧静止,肌肉张力消失,幼鱼因聚集和呼吸频率降低,均出现死亡现象;MS-222浓度为30~50 mg/L时,幼鱼在8 h模拟运输过程中处于A2或A3期,能够维持身体平衡,避免了幼鱼聚集缺氧死亡和机械损伤,3种规格运输成活率均达100%,由此,W10和W40组幼鱼运输的麻醉浓度上限为50 mg/L,W80组上限为60 mg/L。采用MS-222麻醉许氏平鲉大规格幼鱼长途运输研究结果表明,麻醉剂浓度较高时(160 mg/L和80 mg/L)运输14 h幼鱼全部死亡,水体中溶解氧显著低于对照组,在低浓度条件下(10~40 mg/L)运输11 h仅出现少量死亡,运输水体氨氮浓度显著降低(周竹君等, 1999)。MS-222麻醉运输圆口铜鱼(Coreius guichenoti) (Zhao et al, 2014)、神仙鱼(Pterophyllum scalare) (Barbosa et al, 2019)和大黄鱼(Larimichthys crocea) (张伟佳等, 2023)的研究发现,MS-222可有效降低血清皮质醇和水体氨氮含量。据此推测,MS-222麻醉处理在运输过程中可通过缓解生理应激反应和降低鱼体生理代谢速率,从而提高运输过程中的苗种成活率,关于麻醉剂对缓解运输过程中鱼体生理应激的调控机制仍有待于进一步研究。
麻醉期是生物学操作的最佳时期,在达到麻醉期后,幼鱼对各种外界刺激反应非常迟钝,且理化指标短期内不会因鱼体物理应激产生波动(Cooke et al, 2004)。Marking等(1985)认为,理想麻醉浓度的标准为3 min之内达到麻醉状态(A4期),5 min之内完全复苏(R期),按此标准,通过二次曲线回归分析可知,W10、W40和W80组幼鱼MS-222的理想麻醉浓度分别为95.32、107.32和116.58 mg/L,与已报道的小规格许氏平鲉(0.39~14.9 g)最佳麻醉浓度(100 mg/L)数值接近(官曙光等, 2011),可作为日常捕捞、分选、打样测量、血样采集和鱼体解剖的参考浓度,同时,建议最高浓度不超过130 mg/L。这是由于麻醉浓度过高会影响血液指标,如高浓度进行麻醉取血时,血浆皮质醇浓度还将持续增加,被认为是麻醉采血的最大缺点,过量MS-222会富集在肝脏和脾脏等器官,引起肝脏损伤,导致血液转氨酶等升高(Coyle et al, 2004; Hill et al, 2004)。通过对鱼类生态习性和理想麻醉浓度的比较表明,理想麻醉浓度除与物种、规格、麻醉剂种类等相关外,还可能与鱼类生态习性有关,如底栖型海水鱼类半滑舌鳎(刘长琳等, 2008)和圆斑星鲽(Verasper variegates)(赵明等, 2010)的理想麻醉浓度分别为120~210 mg/L和180~ 300 mg/L,而游泳性鱼类如大黄鱼(杨乐等, 2021)和大泷六线鱼(Hexagrammos otakii) (胡发文等, 2017)的有效浓度分别为40 mg/L和50~70 mg/L。底栖性鱼类理想麻醉浓度显著高于游泳性鱼类,原因与底栖型海水鱼类呼吸和能量代谢速率有关,对麻醉剂的耐受性要高于游泳性鱼类。许氏平鲉属于岩礁型鱼类,生态习性上介于底栖型和游泳性鱼类之间,其呼吸代谢介于二者之间,据此推测,其理想麻醉浓度要低于底栖型鱼类而高于游泳型鱼类,本研究结果符合这一规律。
呼吸频率是衡量鱼体麻醉程度的重要指标。本研究中,MS-222浓度为20~60 mg/L,3种规格幼鱼A2期的呼吸频率与正常呼吸频率均无显著差异,表明镇静期的MS-222浓度不会影响幼鱼的呼吸频率,因此,在溶解氧充足的情况下,运输过程中处于镇静期的幼鱼不会因缺氧导致窒息死亡;MS-222浓度为70~130 mg/L时,3种规格幼鱼A4期呼吸频率均显著低于正常呼吸频率(P < 0.05),且呼吸频率随麻醉剂浓度升高逐渐下降,与多数研究结果一致,如对吉富罗非鱼(Oreochromis niloticus, GIFT) (史东杰等, 2015)和大鳞鲃(Barbus capito) (张龙岗等, 2019)的研究也表明,麻醉期幼鱼呼吸频率随麻醉剂浓度升高呈下降趋势。而在MS-222对赤眼鳟(Squaliobarbus curriculus) (彭宁东等, 2016)、半滑舌鳎(刘长琳等, 2008)和圆斑星鲽(赵明等, 2010)等研究中则发现,幼鱼到达麻醉期后会出现呼吸频率上升的现象,这可能与呼吸频率起始统计时间有关,本研究中统计呼吸频率是在幼鱼达到麻醉期且呼吸频率稳定后进行。本研究中3种规格许氏平鲉幼鱼的呼吸频率(59~76次/min)显著低于官曙光等(2011)报道小规格幼鱼呼吸频率(150~ 180次/min),这与鱼体规格有关,还可能与实验鱼的养殖水温差异较大有关(14.5 ℃和25~26 ℃),但后者的实验中同样证实MS-222对镇静期许氏平鲉幼鱼的呼吸频率无显著性影响,而麻醉期则显著下降。
综上,本研究在海水水温为(14.5±0.5) ℃、pH为7.85、盐度为30、溶解氧浓度大于7.5 mg/L的条件下,MS-222对3种规格许氏平鲉幼鱼的镇静、麻醉、休克效应时间和呼吸频率均具有显著影响,对不同规格幼鱼A2、A4期效应时间与麻醉剂浓度进行二次曲线回归分析,按照最佳效应时间为180 s的标准,MS-222对3种规格幼鱼的最佳镇静浓度和麻醉浓度则分别为27.38、29.94、40.39 mg/L和95.32、107.32、116.58 mg/L。结合8 h模拟运输实验结果,W10、W40和W80运输浓度建议为27.38~50.00 mg/L、29.94~50.00 mg/L和40.39~60.00 mg/L,可以为增殖放流、近海网箱陆海转运和深远海陆海接力养殖不同阶段的苗种安全运输提供指导,最佳麻醉浓度则可作为不同规格苗种的生物学实验操作(如测量、标记、样品采集)的参考浓度。MS-222的有效性和麻醉时长与鱼类种类、规格和年龄等生物因素和温度、溶解氧和水质等环境因素等息息相关,在实际运输中麻醉剂浓度的选择需要考虑鱼类种类品种、规格、运输密度和运输时间等因素。
BARBOSA DE OLIVEIRA C P, DA PAIXAO LEMOS C H, FELIX E SILVA A, et al. Use of eugenol for the anaesthesia and transportation of freshwater angelfish (Pterophyllum scalare). Aquaculture, 2019, 513: 734409 DOI:10.1016/j.aquaculture.2019.734409 |
CAO J, XIE J. Effect of 3-aminobenzoic acid ethyl ester methanesulfonate (MS-222) on improving the survival of turbot (Scophthalmus maximus) during simulated live transportation. Food Science, 2021, 42(23): 237-244 [曹杰, 谢晶. 间氨基苯甲酸乙酯甲磺酸盐在大菱鲆模拟保活运输中的作用效果. 食品科学, 2021, 42(23): 237-244 DOI:10.7506/spkx1002-6630-20201217-207] |
CHAMBEL J, PINHO R, SOUSA R, et al. The efficacy of MS-222 as anaesthetic agent in four freshwater aquarium fish species. Aquaculture Research, 2015, 46(7): 1582-1589 DOI:10.1111/are.12308 |
COOKE S J, SUSKI C D, OSTRAND K G, et al. Behavioral and physiological assessment of low concentrations of clove oil anaesthetic for handling and transporting largemouth bass (Micropterus salmoides). Aquaculture, 2004, 239(1/2/3/4): 509-529 |
COYLE S D, DURBOROW R M, TIDWELL J H. Anesthetics in aquaculture. Southern Regional Aquaculture Center, 2004, 3900
|
FAN Y S, SHAO P, JIA X Y, et al. Effects of temperature stress on partial antioxidant and non-specific immunity indices of Paramisgurnus dabryanus. Progress in Fishery Sciences, 2019, 40(2): 58-64 [范耘硕, 邵蓬, 贾旭颖, 等. 温度胁迫对大鳞副泥鳅抗氧化与非特异性免疫指标的影响. 渔业科学进展, 2019, 40(2): 58-64] |
GAO B, WANG D B, NIU Z B, et al. Land-sea relay transportation technology of Sebastes schlegelii fry. Journal of Aquaculture, 2021(5): 48-49 [高滨, 王得宾, 牛志兵, 等. 许氏平鲉鱼苗陆海接力运输技术. 水产养殖, 2021(5): 48-49 DOI:10.3969/j.issn.1004-2091.2021.05.014] |
GUAN J, GUAN S G, ZHENG Y Y, et al. Experimental study on the anesthetic effect of 2-phenoxyethanol and eugenol on juvenile Sebastes schlegelii. Progress in Fishery Sciences, 2010, 31(6): 22-28 [关健, 官曙光, 郑永允, 等. 2-苯氧乙醇和丁香酚对许氏平鲉幼鱼麻醉效果的实验研究. 渔业科学进展, 2010, 31(6): 22-28 DOI:10.3969/j.issn.1000-7075.2010.06.004] |
GUAN S G, GUAN J, LIU H J, et al. Anesthetic effect of MS-222 on juveniles of Sebastes schlegeli. Marine Sciences, 2011, 35(5): 100-105 [官曙光, 关健, 刘洪军, 等. MS-222麻醉许氏平鲉幼鱼的初步研究. 海洋科学, 2011, 35(5): 100-105] |
HE R P, LEI B, SU Y P, et al. Effectiveness of eugenol as an anesthetic for adult spotted sea bass (Lateolabrax maculatus). Aquaculture, 2020, 523: 735180 DOI:10.1016/j.aquaculture.2020.735180 |
HIKASA Y, TAKASE K, OGASAWARA T, et al. Anesthesia and recovery with tricaine methanesulfonate, eugenol and thiopental sodium in the carp, Cyprinus carpio. Japanese Journal of Veterinary Science, 1986, 48(2): 341-351 |
HILL J V, FORSTER M E. Cardiovascular responses of Chinook salmon (Oncorhynchus tshawytscha) during rapid anaesthetic induction and recovery. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2004, 137(2): 167-177 DOI:10.1016/j.cca.2004.01.002 |
HOSEINI S M, MIRGHAED A T, YOUSEFI M. Application of herbal anaesthetics in aquaculture. Reviews in Aquaculture, 2019, 11(3): 550-564 DOI:10.1111/raq.12245 |
HOUSTON A H, CORLETT J T, WOODS R J. Specimen weight and M.S. 222. Journal of the Fisheries Research Board of Canada, 1976, 33(6): 1403-1407 DOI:10.1139/f76-184 |
HU F W, LI L, LIU Y W, et al. Anesthetic effect of clove oil and MS-222 on juvenile Hexagrammos otakii. Journal of Dalian Ocean University, 2017, 32(6): 671-675 [胡发文, 李莉, 刘元文, 等. 丁香油和MS-222对大泷六线鱼幼鱼的麻醉效果. 大连海洋大学学报, 2017, 32(6): 671-675] |
LI L, FAN Y, WANG X L, et al. Anesthetic effect of MS-222 on juveniles of steelhead trout (Oncorhynchus mykiss) at different temperatures. Periodical of Ocean University of China (Natural Science), 2019, 49(3): 155-160 [李乐, 樊英, 王晓璐, 等. 不同温度下MS-222对硬头鳟幼鱼的麻醉效果. 中国海洋大学学报(自然科学版), 2019, 49(3): 155-160] |
LIU C L, CHEN S Q, HE L, et al. Effects of MS-222 as an anaesthetic on adult Cynoglossus semilaevis Günther. Journal of Fishery Sciences of China, 2008, 15(1): 92-99 [刘长琳, 陈四清, 何力, 等. MS-222对半滑舌鳎成鱼的麻醉效果研究. 中国水产科学, 2008, 15(1): 92-99 DOI:10.3321/j.issn:1005-8737.2008.01.012] |
LIU X D, WANG J Y, ZHANG L M, et al. Anesthetic MS-222 and its influencing factors of anesthetic effect. Fisheries Science and Technology Information, 2009, 36(2): 56-59 [柳旭东, 王际英, 张利民, 等. 麻醉剂MS-222及其麻醉效果的影响因素. 水产科技情报, 2009, 36(2): 56-59 DOI:10.3969/j.issn.1001-1994.2009.02.001] |
LIU Y C, LIU H P, LIU S Y, et al. Anesthetic effects of MS-222 on Schizothorax o'connori Llord in two size ranges. Acta Hydrobiologica Sinica, 2018, 42(6): 1214-1223 [刘艳超, 刘海平, 刘书蕴, 等. MS-222对两种规格的异齿裂腹鱼麻醉效果研究. 水生生物学报, 2018, 42(6): 1214-1223] |
LIU Y, ZHOU X W, DING H T, et al. Effects of tricaine methanesulfonate (MS-222) on sedation and responses of yellow catfish (Pelteobagrus fulvidraco) subjected to simulated transportation stress. Aquaculture, 2022, 549(Suppl C): 737789 |
MARKING L L, MEYER F P. Are better anesthetics needed in fisheries?. Fisheries, 1985, 10: 2-5 |
OBIRIKORANG K A, ASANTE-TUOH D T, AGBO N W, et al. Anaesthetic potential of propofol for nile tilapia (Oreochromis niloticus): Effect of anaesthetic concentration and body weight. Scientific African, 2020, 10: e00595 DOI:10.1016/j.sciaf.2020.e00595 |
PENG N D, TANG W S, GUO D, et al. The anaesthesia effects of MS-222 on juvenile Squaliobarbus curriculus. Journal of South China Normal University (Natural Science Edition), 2016, 48(6): 37-43 [彭宁东, 汤文圣, 郭栋, 等. MS-222对赤眼鳟幼鱼麻醉效果的研究. 华南师范大学学报(自然科学版), 2016, 48(6): 37-43] |
PRIBORSKY J, VELISEK J. A review of three commonly used fish anesthetics. Reviews in Fisheries Science and Aquaculture, 2018, 26(4): 417-442 |
RYAN S. The dynamics of MS-222 anaesthesia in a marine teleost (Pagrus auratus: Sparidae). Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 1992, 101(3): 593-600 |
SHI D J, LIANG Y J, SUN Y S, et al. Preliminary study on the anesthetic effect of MS-222 on Oreochromis niloticus, GIFT. Scientific Fish Farming, 2015(5): 52-53 [史东杰, 梁拥军, 孙砚胜, 等. MS-222对吉富罗非鱼麻醉效果的初步研究. 科学养鱼, 2015(5): 52-53] |
SON M H, PARK M W, MYEONG J I, et al. Anaesthetic tolerance of juvenile black rockfish Sebastess schlegelii, produced for wild stock enhancement. Ocean and Polar Research, 2001, 23(3): 285-290 |
SORENSEN K, CRAIG S R, CNAANI A, et al. Hematological response of juvenile cobia to three anesthetics. Fishes, 2023, 8: 31 |
SPÄTH M, SCHWEICKERT W. The effect of metacaine (MS-222) on the activity of the efferent and afferent nerves in the teleost lateral-line system. Naunyn-Schmiedeberg's Archives of Pharmacology, 1977, 297(1): 9-16 |
WANG W X, CUI A J, XU Y J, et al. Anesthetic effect of MS-222 and clove oil on yellowtail kingfish. Progress in Fishery Sciences, 2021, 42(6): 205-214 [王维鑫, 崔爱君, 徐永江, 等. MS-222和丁香油对黄条  麻醉效果研究. 渔业科学进展, 2021, 42(6): 205-214] 麻醉效果研究. 渔业科学进展, 2021, 42(6): 205-214] |
WEI S C. Anesthetics and anesthetic management for fish. Journal of Northwest University for Nationalities (Natural Science), 2005, 26(1): 43-45 [魏锁成. 用于鱼类的麻醉剂及麻醉管理. 西北民族大学学报(自然科学版), 2005, 26(1): 43-45] |
XU G C, LI J J, LI X S, et al. Offshore cage culture technology of Sebastes schlegelii. Journal of Aquaculture, 2018(6): 23-26 [徐国成, 李建军, 李信书, 等. 许氏平鲉近海网箱养殖技术. 水产养殖, 2018(6): 23-26] |
YANG B X, LI B Y, JIANG C. Effects of MS-222 on blood biochemical indexes of juvenile Takifugu rubripes. Hebei Fisheries, 2018(2): 18-22 [杨博学, 李泊岩, 姜晨. MS-222对红鳍东方鲀幼鱼血液生化指标的影响. 河北渔业, 2018(2): 18-22] |
YANG L, ZHANG X L, LIU X D. Anesthetic effects of clove oil, MS-222 and propofol on Larimichthys crocea. Fishery Modernization, 2021, 48(2): 91-96 [杨乐, 张晓林, 刘贤德. 丁香油、MS-222和异丙酚对大黄鱼的麻醉效果分析. 渔业现代化, 2021, 48(2): 91-96] |
YANG X, LI P, YUAN Y F, et al. Anesthetic effect of MS-222 on Brachymystax lenok tsinlingensis. Progress in Veterinary Medicine, 2018, 39(4): 71-75 [杨希, 李平, 袁永峰, 等. MS-222麻醉秦岭细鳞鲑效果的研究. 动物医学进展, 2018, 39(4): 71-75] |
ZHANG D S, LU B, WANG X H. Study on the technology of deep-water anti-wave cage culture of Sebastes schlegelii. Fisheries Science and Technology Information, 2012, 39(2): 92-95 [张德胜, 陆波, 汪晓慧. 深水抗风浪网箱养殖许氏平鲉技术研究. 水产科技情报, 2012, 39(2): 92-95] |
ZHANG L G, FU P S, YANG L, et al. The anesthetic effect of MS-222 on juvenile Barbuscapito. Chinese Agricultural Science Bulletin, 2019, 35(21): 132-136 [张龙岗, 付佩胜, 杨玲, 等. MS-222对大鳞鲃幼鱼麻醉效果的初步研究. 中国农学通报, 2019, 35(21): 132-136] |
ZHANG W J, LI H D, GAO Y, et al. Effect of anesthetic transportation of Larimichthys crocea in MS-222. Oceanologia et Limnologia Sinica, 2023, 54(2): 559-565 [张伟佳, 李海东, 高阳, 等. MS-222对大黄鱼(Larimichthys crocea)麻醉保活运输效果研究. 海洋与湖沼, 2023, 54(2): 559-565] |
ZHAO J, ZHU Y, HE Y, et al. Effects of temperature reduction and MS-222 on water quality and blood biochemistry in simulated transport experiment of largemouth bronze gudgeon, Coreius guichenoti. Journal of the World Aquaculture Society, 2014, 45(6): 719 |
ZHAO M, LIU X Z, XU Y J, et al. Study on anaesthetic effects of MS-222 on adult Verasper variegatus. Advances in Marine Science, 2010, 28(4): 531-537 [赵明, 柳学周, 徐永江, 等. MS-222麻醉圆斑星鲽成鱼效果研究. 海洋科学进展, 2010, 28(4): 531-537] |
ZHOU Z J, SONG Z X, ZHOU Z H. Preliminary study on application of MS-222 in transportation of marine fish. Reservoir Fisheries, 1999(4): 52-53 [周竹君, 宋智修, 周振红. 应用MS-222运输海水鱼初探. 水利渔业, 1999(4): 52-53] |



