2. 广东省水产动物免疫与绿色养殖重点实验室 广东 广州 510380
2. Guangdong Provincial Key Laboratory of Aquatic Animal Immunology and Sustainable Aquaculture, Guangzhou 510380, China
硬骨鱼类终生生长,生长调控机制复杂,不仅不同种类的鱼在体型上差异大,同一种类、同一群体中的不同个体的生长速度往往也存在不确定性(Amundsen, 2016)。在自然界的鱼类群体中,生长缓慢群体普遍存在,目前,已对多种鱼类自然种群中存在的侏儒型鱼的现象进行了深入调查和研究,其中,对白鲈(Morone americana)、绿太阳鱼(Lepomis cyanellus) (Chizinski et al, 2010)和北极红点鲑(Salvelinus alpinus) (Amundsen, 2016)等鱼类在自然环境中的生长性状进行了测量和分析。但目前对养殖鱼类中出现生长缓慢的侏儒型鱼群体的现象研究还较少。有研究认为,一部分大西洋鲑(Salmo salar)被放到养殖场后,由于环境的巨大改变,对其产生了压力并激活鱼体的5-羟色胺能系统,使它产生了类似人类的“抑郁症”,因此出现了生长发育缓慢的侏儒型大西洋鲑(Vindas et al, 2016)。但该研究只通过生理学研究强调环境因素的作用,未对侏儒型鱼进行分子遗传机制的研究。
华南鲤(Cyprinus carpio rubrofuscus)是鲤的4个亚种之一(朱华平等, 2018),主要分布在云南元江水、珠江流域及其南部包括海南岛在内的华南地区(王桢璐等, 2017)。华南鲤作为华南地区特有的传统稻田养殖鲤鱼品种,在其养殖和选育的过程中发现,即使是在同一群体、同一个水体环境中养殖的华南鲤,也总会有些长不大的个体,称之为“侏儒型华南鲤”。对养殖华南鲤的初步生态学调查发现,无论是在池塘还是在稻田养殖条件下,有时会出现同一批繁殖的群体养殖到5月龄后就分化为“侏儒型”和“生长正常”2个体型差异明显的群体,侏儒型华南鲤的体重仅为正常华南鲤平均体重的4.5%~20%,而侏儒型个体数量约占养殖群体的10%~30%。
在侏儒型华南鲤下丘脑转录组研究中发现,编码华南鲤血管内皮生长因子(vascular endothelial growth factor, VEGF)的基因在侏儒型和对照组(正常鱼)的表达存在显著差异。VEGF又称血管通透因子(vascular permeability factor, VPF),是血管生成和淋巴管生成的诱导因子(Smith et al, 2015)。VEGF与不同的血管通透因子受体(vascular endothelial growth factor receptor, VPFR)结合,高度特异地调节内皮细胞增殖、迁移和新血管形成,在人类(Homo sapiens)心血管、神经系统、肿瘤等疾病发生的机理中有深入研究(Kikuchi et al, 2014; Piazza et al, 2017; McDermott et al, 2018)。水生动物中,斑马鱼(Danio rerio) VEGF的研究数据较为丰富,其研究结果主要应用于人类疾病的治疗(Tsuji-Tamura et al, 2020; Nathan et al, 2022)。而对水生经济动物日本鳗鲡(Anguilla japonica) (Huang et al, 2006)、泥鳅(Misgurnus anguillicaudatus) (Luo et al, 2016)、红鳍东方鲀(Fugu rubripes)(Gong et al, 2004)和凡纳对虾(Penaeus vannamei)(Wang et al, 2019)的vegf基因功能目前只有初步的研究,而关于该基因与鱼类生长性能的相关性还未见报道。因此,本研究对侏儒型和生长正常华南鲤的生长性状、摄食率和饲料利用率等指标进行测量和测定,并扩增和测序分析华南鲤vegf121基因的cDNA序列,利用实时荧光定量PCR(qRT-PCR)方法检测了vegf121 mRNA在侏儒型和生长正常华南鲤不同组织中的表达差异。该研究可为揭示vegf121基因在侏儒型华南鲤中的作用机制,以及侏儒型华南鲤生长发育缓慢产生的原因提供科学依据。
1 材料与方法 1.1 实验鱼的生长性状测定2019年4月,在广东省韶关市乳源瑶族自治县华南鲤养殖基地,选取健康且成熟度好的1龄亲鱼进行繁育,6月将当年孵化的平均体重约5.0 g的华南鲤鱼苗投放在水深2 m、面积约2 000~3 333 m2的池塘进行养殖,密度为30尾/m2,每天投喂2次大小合适(直径范围0.5~2.0 mm)的商业配方颗粒饲料,投喂量为体重的3%~4%,待平均体重约为20.0 g时,将养殖密度降低至约为6尾/m2,投喂量为体重的2%~3%。11月,将颗粒饲料抛到水面上引诱鱼摄食饲料,通过数次撒网(网孔尺寸10 mm),在每个池塘中收集200尾左右华南鲤,用300 mg/L MS-222麻醉并测量体重和形态性状,选取典型的侏儒型鱼的群体,描述群体中鱼体的体长分布特征。
1.2 实验鱼生长和摄食性能的测定根据测量群体体长分布曲线,将此时体长小于120 mm的华南鲤定义为侏儒型,从上述池塘中筛选250尾侏儒型华南鲤,在网箱中养殖至2020年9月,选取60尾体型较小的个体作为侏儒型鱼组进行室内饲养实验。
为了实验的准确性,使对照组与侏儒型鱼的体型相似,2020年4月用上一年的亲鱼重新繁育一批华南鲤鱼苗,在相同池塘条件下养殖至9月,待群体中生长正常的个体与2019年繁育的侏儒型鱼平均体重相当,选取60尾生长正常的个体作为对照组进行室内养殖,测定生长和摄食性能。
将对照组和侏儒型鱼转入室内带有循环水系统的玻璃缸(1.2 m×0.8 m×0.5 m)内,每缸放20尾鱼,温度保持在(25±1) ℃,在相同室内养殖条件下暂养2周,期间投喂人工配合饲料(饲料成分:粗蛋白38%,粗纤维12%,粗灰分18%,粗脂肪4%,钙1.5%~5%,总磷0.8%~2.5%,蛋氨酸0.5%,赖氨酸1.2%)。饥饿24 h后,经300 mg/L MS-222麻醉,称量每尾鱼的体重作为初始体重。然后每天09:30和17:30投喂过量的浮性颗粒饲料,至饱食为止。计数残余颗粒饲料的颗粒个数,根据单个颗粒饲料的平均重量估计残饵重量并记录。
室内养殖实验持续60 d,实验结束时,再饥饿24 h,称重作为终末体重。根据测得的投喂饲料总重量、残余饲料总重量、初始总体重和终末总体重,计算日摄食率(daily feed intake, DFI)、增重率(weight gain rate, WGR)和饲料系数(feed conversion ratio, FCR)等。
存活率(SR, %)=终末鱼尾数×100%/初始鱼尾数
日摄食率(DFI, %)=(投喂饲料总重量–残余饲料总重量)×100%/[实验天数×(初始总体重+终末总体重)/2]
增重率(WGR, %)=(平均终末体重–平均初始体重) ×100%/平均初始体重
饲料系数(FCR)=(投喂饲料总重量–残余饲料总重量)/(终末总体重–初始总体重)
室内养殖实验结束时,从每个玻璃缸中随机选取3尾鱼,麻醉后分别取垂体和20 mg肌肉、心脏、鳃、大脑、下丘脑、眼、胃、中肾、肝和脾组织,3尾鱼的相同组织等质量混成一个样品,每组鱼每个组织制成3个混合样品,立即放入液氮中,–80 ℃保存,用于提取总RNA。
1.3 总RNA的提取和cDNA的合成各组织样品分别加入1 mL TRIzol Reagent (Invitrogen, 美国),于全自动样品快速研磨仪中充分研磨,然后按照说明书提取总RNA。用酶标仪(BioTeK, 美国)测定RNA在波长260 nm与280 nm的OD值,并进行琼脂糖电泳检测RNA完整性,将质量浓度较好的总RNA样品用反转录试剂盒(PrimeScript RT)(TaKaRa)反转录成cDNA,–20 ℃保存。
1.4 vegf121基因cDNA序列的获得根据鲤鱼vegf121基因mRNA序列(ENSCCRG00- 010042534, https://www.embl.org/),用Primer Premier 5软件设计引物VEGF-F和VEGF-R,用于扩增vegf121基因的cDNA序列,委托广州天一辉远基因科技有限公司合成。以华南鲤脑组织的cDNA为模板进行PCR扩增,25 μL的反应体系中包含cDNA模板1.0 μL、rTaq酶12.5 μL、正反引物(10 mmol/L)各1.0 μL和ddH2O 9.5 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,30个循环;最后72 ℃延伸7 min。PCR产物经电泳检测后在ABI 3730全自动测序仪上测序。使用InterPro Scan (http://www.ebi.ac.uk/int-erpro/sequencesearch/)软件分析蛋白质的信号肽和保守功能结构域。
用NCBI网站(https://www.ncbi.nlm.nih.gov/)的BLAST程序搜索其他物种VEGF121蛋白氨基酸序列;用ClustalX软件对华南鲤VEGF121与13个其他物种的VEGF121蛋白氨基酸序列进行比对;用MEGA 7.0软件构建系统进化树。
1.5 华南鲤vegf121基因的组织表达检测根据测定的华南鲤vegf121 cDNA序列,避开保守区设计用于qRT-PCR扩增的引物VEGF-f和VEGF-r,以β-actin作为内参基因(表 1),用qRT-PCR方法检测正常组华南鲤肌肉、心脏、鳃、大脑、下丘脑、垂体、眼、胃、中肾、肝和脾组织各3个混样中vegf121基因mRNA的表达水平,20 μL反应体积中包含cDNA模板1.0 μL、SYBR Premix Ex TaqⅡGreen Master Mix (TaKaRa) 10.0 μL、正反向引物(10 mmol/L)各1.0 μL和ddH2O 7.0 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环;95 ℃,5 s;60 ℃,60 s,95 ℃,1 s;50 ℃,30 s,每个反应3个技术重复,采集熔解曲线。测得的Ct值采用2–ΔΔCt的方法计算vegf121的相对表达量(Livak et al, 2001)。分析vegf121 mRNA在侏儒型鱼的组织中的表达水平,并与生长正常鱼进行比较。
|
|
表 1 vegf121基因CDS序列扩增和基因表达分析所用的引物序列 Tab.1 Primer sequences used for the vegf121 gene CDS sequence amplification and gene expression analysis |
用Excel记录检测数据,再使用SPSS 22.0软件的t检验方差分析模块对实验数据进行显著性检验。结果以平均值±标准差(Mean±SD)表示,P < 0.05为差异显著。
2 结果 2.1 池塘养殖的侏儒型华南鲤的生长特性在一口约2 000 m2的池塘中,选择典型具有侏儒型个体的5月龄华南鲤群体,随机取217尾鱼,进行生长性状(体长和体重)的统计,以华南鲤的体长和个体数的关系作曲线图,结果显示,华南鲤群体呈现2个独立的正态分布曲线(图 1)。根据这2个正态分布曲线,将体长≤120.0 mm的31尾华南鲤侏儒型个体作为一个小群体区分出来进行统计,侏儒型小群体的平均体长为71.76 mm,约为整个群体中所有个体平均体长(138.76 mm)的50%;平均体重为13.85 g,小于整个群体中所有个体平均体重(159.60 g)的10%。
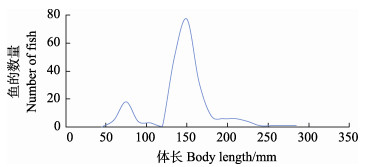
|
图 1 典型具有侏儒型个体的华南鲤群体体长双正态分布曲线 Fig.1 Bi-modal distribution curve of body length in the typical C. carpio rubrofuscus population with dwarf individuals |
从2019年孵化并养殖的华南鲤中筛选出的侏儒型作为实验组,将2020年孵化并养殖的规格与实验组相近的生长正常的华南鲤作为对照组,各60尾鱼在相同养殖条件下进行室内养殖,并测定其摄食和生长的性能。结果显示,侏儒型华南鲤和生长正常组的成活率均为100%,侏儒型华南鲤的平均摄食量(TFC)、终末平均体重(FABW)、日摄食率(DFI)、增重率(WGR)和饲料系数(FCR)均显著低于对照组(P < 0.05),而2组鱼的饲料系数则不存在显著差异(表 2) (P > 0.05)。
|
|
表 2 侏儒型华南鲤与生长正常华南鲤摄食和生长和摄食性能的比较 Tab.2 Comparison of the feeding and growth performance of C. carpio rubrofuscus between dwarf group and control group |
扩增得到的华南鲤vegf121基因cDNA序列全长为1 235 bp,其中开放阅读框432 bp,编码一个由144个氨基酸组成的多肽(图 2)。对华南鲤vegf121保守序列位点功能预测的结果显示,华南鲤vegf121的信号肽位于第1~23个氨基酸,其中,第1~6个氨基酸为信号肽N区(亲水),第7~18个氨基酸为信号肽H区(疏水),第19~23个氨基酸为信号肽C区(极性),推测华南鲤vegf121是分泌型蛋白(图 2)。
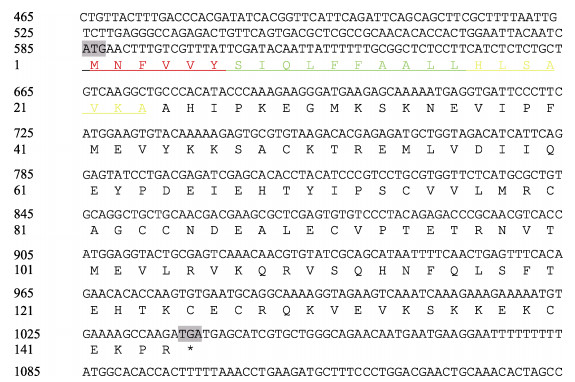
|
图 2 华南鲤vegf121 cDNA部分片段及其编码的氨基酸序列 Fig.2 Partial vegf121 cDNA of C. carpio rubrofuscus and the encoded amino acid sequence 灰色背景字体ATG为起始密码子和TGA为终止密码子;红色的氨基酸为信号肽N区(亲水区),绿色的氨基酸为信号肽H区(疏水区),黄色的氨基酸为信号肽C区(极性区)。 Gray ATG and TGA are the start codon and the stop codon; red amino acids are the signal peptide N region (hydrophilic region), green amino acids are the signal peptide H region (hydrophobic region), and yellow amino acids are the signal peptide C region (polarity region). |
用MEGA软件将华南鲤VEGF121氨基酸序列与13个其他物种的VEGF121氨基酸序列进行比对并构建系统进化树(图 3和图 4),结果显示,华南鲤的VEGF121蛋白氨基酸序列与已知鲤鱼(Cyprinus carpio)的VEGF121蛋白氨基酸序列一致性最高,同源性为100.00%,与安水金线鲃(Sinocyclocheilus anshuiensis)和犀角金线鲃(Sinocyclocheilus rhinocerous)的同源性均为99.31%,与四角蚴(Puntigrus tetrazona)、鲫(Carassius auratus)、黑头软口鲦鱼(Pimephales promelas)、斑马鱼、玫瑰高原鳅(Triplophysa rosa)、大西洋鲑、电鳗(Electrophorus electricus)和齿头鲱(Denticeps clupeoides)的同源性分别是97.92%、97.22%、93.75%、92.36%、89.58%、82.73%、80.56%和79.86%。而与人和小鼠(Mus musculus)的同源性较低,分别为51.02%和52.74%。

|
图 3 华南鲤与其他物种的VEGF121氨基酸序列的比对 Fig.3 Alignment of the VEGF121 amino acid sequences from C. carpio rubrofuscus and other species |
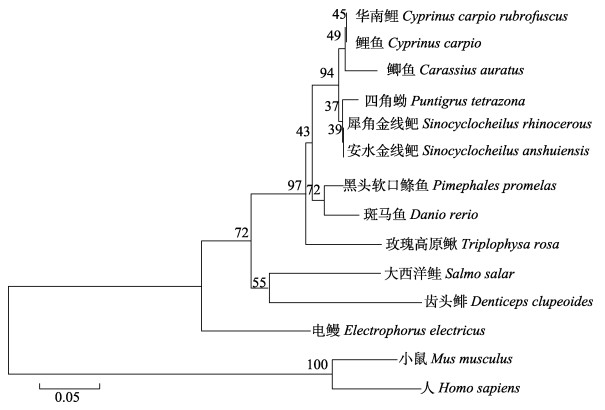
|
图 4 推测的华南鲤VEGF121与13个其他物种VEGF121氨基酸序列的系统进化树 Fig.4 Phylogenetic tree of the predict VEGF121 amino acid sequences from C. carpio rubrofuscus and 13 other species |
荧光定量PCR结果显示,vegf121基因在生长正常华南鲤的11个组织中均有表达,在肌肉中相对表达量最高,其次为心脏、鳃、大脑、胃、垂体、眼、肝、中肾和脾,在下丘脑中最低(图 5)。

|
图 5 生长正常的华南鲤vegf121基因在各组织中的相对表达量 Fig.5 The relative expression levels of vegf121 gene in 11 tissues of C. carpio rubrofuscus with normal growth rate 1:下丘脑;2:脾;3:肝;4:中肾;5:垂体;6:眼;7:胃;8:大脑;9:鳃;10:心脏;11:肌肉。 1: Hypothalamus; 2: Spleen; 3: Liver; 4: Kidney; 5: Pituitary; 6: Eye; 7: Stomach; 8: Brain; 9: Gills; 10: Heart; 11: Muscle. |
采用qRT-PCR方法比较侏儒型和生长正常鱼的下丘脑、垂体、大脑、肌肉和心脏5个组织vegf121 mRNA的表达水平(图 6)。结果显示,在2组鱼的垂体和大脑中,vegf121的表达水平相当,而在心脏和肌肉中都是生长正常鱼高于侏儒型鱼,但差异不显著;但是,在下丘脑中,侏儒型鱼vegf121的表达水平则显著高于生长正常鱼(P < 0.05)。
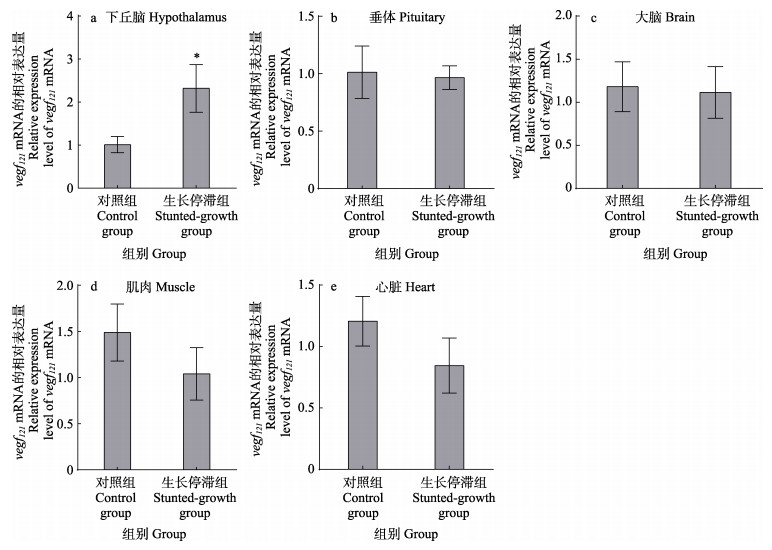
|
图 6 生长正常鱼与侏儒型华南鲤vegf121基因mRNA在下丘脑、垂体、大脑、肌肉和心脏5个组织中的相对表达量 Fig.6 Relative expression levels of vegf121 gene mRNA in hypothalamus, pituitary, brain, muscle and heart of the normal and the dwarf C. carpio rubrofuscus *表示显著差异(P < 0.05)。 *indicates significant difference (P < 0.05). |
之前对侏儒型鱼的研究主要以自然环境中的鱼类群体为研究对象,结果表明,引起鱼类发育缓慢、生长停滞的原因复杂多样,包括营养缺乏(Rikardsen et al, 2007)、不适宜的水质(如水温) (Berg et al, 2000)、高盐碱(逯冠政等, 2022)、不适的盐度(相智巍等, 2023)、存在捕食者(Chivers et al, 2008)或不适的种群密度(Rask, 1992)等因素,都有可能引起许多鱼类种群生长缓慢或停滞。而目前对于在同一人工可控养殖环境中侏儒型鱼产生原因的研究还较少。本研究首先对侏儒型鱼的摄食和饲料利用能力进行了测定和分析。实验鱼的选择对于实验结果的准确性非常重要。有研究表明,鱼体的规格显著影响摄食频率、饲料利用率和能量需求(Medeiros et al, 2014; Nunes et al, 2021; 赵书燕等, 2017),如果从同一个具有典型侏儒型华南鲤群体中选择极大和极小的个体进行研究,如到5月龄,侏儒型鱼的平均体重仅为13.85 g,小于整个群体中所有个体平均体重(159.60 g)的10%,那么得到的侏儒型鱼和生长正常鱼检测结果差异可能主要不是由于侏儒型鱼本身的缺陷引起的,而主要由2组鱼体型差异太大而引起,这样的实验设计不科学,数据分析结果就不准确。因此,本研究采用同批亲鱼在第2年重新繁殖的幼鱼生长到与去年繁殖的侏儒型个体体型相当时作为对照组,既保持了侏儒型鱼与对照组鱼遗传上的高度相似性,也使得实验组与对照组的体型无显著差异,确保了实验方法的科学性和结果的可靠性。测定结果表明,在室内养殖条件下,侏儒型华南鲤的日摄食率和增重率显著低于正常鱼,而饲料转化效率不存在显著差异,这与北极红点鲑的研究结果相似。在高密度的养殖条件下,在有生长发育缓慢的北极红点鲑的养殖群体中,食物的消耗率与鱼的特定生长率呈正相关(Amundsen et al, 2007);而自然环境中鲱形白鲑(Coregonus clupeaformis)的研究结果表明,生长发育缓慢的侏儒型鲱形白鲑的食物消耗率显著高于正常鱼,而食物转化效率却显著低于正常鱼(Trudel et al, 2001)。上述分析结果表明,侏儒鱼的产生原因复杂多样,但大多数的研究结果与本研究结果相似,即摄食量的减少是侏儒鱼产生的直接原因。那么引起鱼体食欲差的原因又是什么呢?众所周知,影响鱼类生长的因素包括遗传因素和环境因素两方面。先前的研究主要是对自然环境中侏儒鱼展开了生态学的分析,但人工养殖环境与自然环境有所不同,人工养殖环境具有人为可控的特点,可尽量避免上述对鱼类生长不利的环境因素,而本研究就是在人工养殖环境中进行,这时引起人工养殖的经济鱼类食欲变差、生长缓慢的另一个重要因素——遗传因素,就显得更为重要了。因此,推测本研究中的侏儒型华南鲤很可能是在某种遗传因素的作用下导致了生长发育的显著缓慢。
为了深入研究人工养殖条件下鲤鱼产生侏儒型个体的分子机制,对侏儒型华南鲤下丘脑的基因表达水平进行了分析,发现vegf121基因在侏儒型华南鲤下丘脑中的表达水平显著高于正常鱼,因此,本研究对华南鲤vegf121基因的序列、结构和表达特征进行了初步分析。人类和哺乳动物的血管内皮生长因子(VEGF)家族目前已研究得很深入,包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、VEGF-F和胎盘生长因子(PGF)(Samson et al, 2004),其中,VEGF-A的研究最为深入,是由单个vegf基因的mRNA通过可变剪切并翻译而成,分别含有110、121、145、165、183、189和206个氨基酸(Li et al, 2001)。鱼类VEGF家族中,斑马鱼的VEGF-A、VEGF-C和VEGF-D已有研究,其中研究较多的也是VEGF-A,而VEGF-B和VEGF-E在斑马鱼发育过程中的功能目前还未见报道(杨少丽等, 2009)。VEGF165和VEGF121是斑马鱼VEGF-A最主要的2种亚型,在胚胎发育的24~30 h表达量最高。斑马鱼VEGF165全长188个氨基酸残基,是斑马鱼胚胎发育早期的主要亚型,而VEGF121 (GenBank accession No. AF059661)全长144个氨基酸,是斑马鱼胚胎发育晚期及成体中的主要形式(Liang et al, 2001)。本研究从成体华南鲤组织中扩增获得1 235 bp华南鲤vegf121 cDNA,其中,开放阅读框为432 bp,编码一个由144个氨基酸组成的VEGF多肽,去除信号肽后为121个氨基酸的成熟肽,属于VEGF121亚型,且各组织中只扩增出其中编码VEGF121一个亚型的基因,并未扩增到编码188个氨基酸的VEGF165亚型的基因,研究结果与斑马鱼相似。华南鲤与其他物种VEGF121的氨基酸序列同源性分析表明,华南鲤VEGF121亚型蛋白氨基酸序列与其他已知的11种从鲤形目(Cypriniformes)到鲱形目(Clupeiformes)鱼类VEGF121的同源性变化范围为79.86%~100%,而与哺乳动物如人和小鼠的同源性分别为51.02%和52.74%。由此可以看出,该蛋白与其他大部分水生动物VEGF121的同源性较高,但与哺乳动物如人和小鼠的同源性相对较低。人类的VEGF121主要分布于胎盘组织,VEGF165分布于除胎盘之外的其他组织器官中,VEGF165的作用更为广泛(祁玥等, 2010)。VEGF121亚型在人类和鱼类的同源性较低且时空分布存在较大差异,可能与哺乳类动物和鱼类不同的呼吸方式以及在动物进化过程中,呼吸系统的血管形成模式转变有关。VEGF家族基因通过进化实现了精细调节促进不同生物体血管生长和分化的作用功能,以适应急性缺氧事件的出现(Baptista et al, 2016)。
在动物体内,血管内皮生长因子具有促进内皮细胞增生的作用,在体内可以诱导血管增生,在体外可以促进血管内皮细胞的生长(Leung et al, 1989),而血液循环为动物体的各个组织提供营养和能量,因此,血管内皮生长因子在动物体各组织中存在普遍表达的现象。本研究中,qRT-PCR的检测结果表明,成年华南鲤vegf121基因在检测的11个组织中均有表达,且在各组织的表达水平各不相同,其中,在肌肉中的相对表达量最高,其次为心脏、鳃、大脑、胃、垂体、眼、肝和中肾,在下丘脑和脾中表达量较小,说明血管内皮生长因子对华南鲤不同组织的发育具有不同程度的促进作用。
有趣的是,经过反复验证,本研究发现,侏儒型华南鲤vegf121基因在下丘脑的表达量显著高于生长正常鱼,而外周机体的肌肉和心脏中的表达量则低于正常鱼。杨少丽等(2009)和柳明洙等(2006)研究表明,血管内皮生长因子在参与斑马鱼血管发生的同时,对于斑马鱼神经系统的发育也有一定的促进作用。而在人类的研究中发现,VEGF除了具有促进血管的发生和形成的作用,还可直接作用于神经元和神经胶质细胞,促进它们生长、分裂以及轴突的再生(Gutiérrez-Fernández et al, 2011)。在生理条件下的人类正常成熟神经组织中VEGF不表达或少表达,但在许多病理情况如缺血、缺氧、神经系统脱髓鞘等病变下,神经组织及其受体表达显著增高(黄越芳等, 2004; Zan et al, 2011; Ramakrishnan et al, 2014)。而下丘脑作为调节内脏活动和内分泌活动的高级神经中枢,是重要的内分泌器官,人类下丘脑调控功能异常,会导致激素分泌紊乱,引起机体各种代谢疾病,如,肥胖、Ⅱ型糖尿病和代谢综合征等(Dietrich et al, 2013; Vogt et al, 2014; Mosialou et al, 2017)。鱼类的下丘脑调控功能异常也会破坏体内代谢平衡,引起鱼体的生长缓慢(Zhang et al, 2022)。因此,下丘脑作为鱼类调节内分泌和代谢活动的高级神经中枢,可能在某种环境或遗传因素的作用下,发生了某种病变,在分子水平表现为vegf121基因在下丘脑中的表达水平显著升高,导致华南鲤体内激素分泌紊乱,进而破坏了体内代谢平衡,引起鱼体食欲下降、摄食能力减退。同时,在心脏和肌肉中vegf121基因的表达水平有所下降(统计分析差异不显著),推测在侏儒型鱼中,由于下丘脑的异常引起了某种抑制机制,一定程度下调了华南鲤该基因在外周机体中的表达,导致外周器官血管的形成和分化作用降低,进而抑制了鱼体的生长,这与早期关于小鼠侏儒症的研究结果一致,其研究结果表明,在患有侏儒症的小鼠骨骼中,血管内皮生长因子的表达水平有所降低(Lee et al, 2007)。此外,伍校琼等(2006)关于兔子中vegf基因在血管中的表达研究也表明,在生长较快的侧支血管中,vegf基因显著表达。而具体华南鲤下丘脑发生病变情况以及导致病变的遗传因素还不清楚,仍需进一步研究。
4 结论本研究发现,典型的具侏儒型个体的华南鲤群体呈现了2个独立的正态分布曲线,通过对侏儒型华南鲤与生长正常华南鲤摄食和生长性能的比较,发现侏儒型华南鲤摄食效率降低、食欲下降,同时发现,vegf121基因在侏儒型华南鲤在下丘脑的表达与在其他组织的表达不同,发生了显著的上调,说明侏儒型鱼在养殖过程中下丘脑血管发育可能出现了异常,引起了下丘脑发生了器质性的病变,扰乱了下丘脑内分泌相关细胞的作用机制,进而影响了华南鲤个体的食欲和正常的生长,降低了华南鲤的生长速度和生产效益。本研究为进一步探讨一些群体中华南鲤生长发育缓慢的原因提供了科学依据。
AMUNDSEN P A, KUNDSEN R, KLEMETSEN A. Intraspecific competition and density dependence of food consumption and growth in Arctic charr. Journal of Animal Ecology, 2007, 76(1): 149-158 DOI:10.1111/j.1365-2656.2006.01179.x |
AMUNDSEN P A. Contrasting life-history strategies facilitated by cannibalism in a stunted Arctic charr population. Hydrobiologia, 2016, 783(1): 11-19 DOI:10.1007/s10750-015-2600-y |
BAPTISTA R B, SOUZA-CASTRO N, ALMEIDA-VAL V M F. Acute hypoxia up-regulates HIF-1α and VEGF mRNA levels in Amazon hypoxia-tolerant Oscar (Astronotus ocellatus). Fish Physiology and Biochemistry, 2016, 42(5): 1307-1318 DOI:10.1007/s10695-016-0219-1 |
BERG O K, THRONAES E, BREMSET G. Seasonal cycle of body composition and energy of brown trout (Salmo trutta) in a temperate zone lake. Ecology of Freshwater Fish, 2000, 9(3): 163-169 DOI:10.1111/j.1600-0633.2000.eff090305.x |
CHIVERS D P, ZHAO X, BROWN G E, et al. Predator-induced changes in morphology of a prey fish: The effects of food level and temporal frequency of predation risk. Evolutionary Ecology, 2008, 22(4): 561-574 DOI:10.1007/s10682-007-9182-8 |
CHIZINSKI C J, POPE K L, WILDE G R, et al. Implications of stunting on morphology of freshwater fishes. Journal of Fish Biology, 2010, 76(3): 564-579 DOI:10.1111/j.1095-8649.2009.02498.x |
DIETRICH M O, LIU Z W, HORVATH T L. Mitochondrial dynamics controlled by mitofusins regulate Agrp neuronal activity and diet-induced obesity. Cell, 2013, 155(1): 188-199 DOI:10.1016/j.cell.2013.09.004 |
GONG B, LIANG D, CHEW T G, et al. Characterization of the zebrafish vascular endothelial growth factor A gene: Comparison with vegf-A genes in mammals and Fugu. Biochimica et Biophysica Acta: Gene Structure and Expression, 2004, 1676(1): 33-40 DOI:10.1016/j.bbaexp.2003.10.006 |
GUTIÉRREZ-FERNÁNDEZ M, RODRÍGUEZ-FRUTOS B, ÁLVAREZ-GRECH J, et al. Functional recovery after hematic administration of allogenic mesenchymal stem cells in acute ischemic stroke in rats. Neuroscience, 2011, 175: 394-405 DOI:10.1016/j.neuroscience.2010.11.054 |
HUANG Y F, ZHUANG S Q, CHEN D P, et al. Angiogenesis and its regulatory factors in brain tissue of neonatal rat hypoxic-ischemic encephalopathy. Chinese Journal of Pediatrics, 2004, 42(3): 210-214 [黄越芳, 庄思齐, 陈东平, 等. 新生大鼠缺氧缺血性脑病模型脑组织新生血管形成及调控因素. 中华儿科杂志, 2004, 42(3): 210-214 DOI:10.3760/j.issn:0578-1310.2004.03.013] |
HUANG Y S, HUANG W L, LIN W F, et al. An endothelial-cell-enriched primary culture system to study vascular endothelial growth factor (VEGF A) expression in a teleost, the Japanese eel (Anguilla japonica). Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2006, 145(1): 33-46 DOI:10.1016/j.cbpa.2006.04.027 |
KIKUCHI R, NAKAMURA K, MACLAUCHLAN S, et al. An antiangiogenic isoform of VEGF-A contributes to impaired vascularization in peripheral artery disease. Nature Medicine, 2014, 20(12): 1464-1471 DOI:10.1038/nm.3703 |
LEE H H, BEHRINGER R R. Conditional Expression of Wnt4 during chondrogenesis leads to dwarfism in mice. PLoS One, 2007, 2(5): e450 DOI:10.1371/journal.pone.0000450 |
LEUNG D W, CACHIANES G, KUANG W J, et al. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science, 1989, 246: 1306-1309 DOI:10.1126/science.2479986 |
LI X, ERIKSSON U. Novel VEGF family members: VEGF-B, VEGF-C and. The International Journal of Biochemistry, 2001, 33: 421-426 |
LIANG D, CHANG J R, CHIN A J, et al. The role of vascular endothelial growth factor (VEGF) in vasculogenesis, angiogenesis, and hematopoiesis in zebrafish development. Mechanisms of Development, 2001, 108(1/2): 29-43 |
LIANG D, XU X, CHIN A J, et al. Cloning and characterization of vascular endothelial growth factor (VEGF) from zebrafish, Danio rerio. Biochimica et Biophysica Acta, 1998, 1397(1): 14-20 DOI:10.1016/S0167-4781(97)00233-9 |
LIU M Z, ZHANG X W, GAO G Y, et al. Expressions of angiopoietin-1 and its receptors during early development in zebrafish. Lishizhen Medicine and Materia Medica Research, 2006, 17(6): 912-913 [柳明洙, 张学武, 高圭永, 等. 血管内皮细胞生长因子和血管发生素-1及其受体在斑马鱼早期胚胎发育过程中的表达. 时珍国医国药, 2006, 17(6): 912-913 DOI:10.3969/j.issn.1008-0805.2006.06.010] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method. Methods, 2001, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
LU G Z, YAO Z L, LAI Q F, et al. Growth performance, blood parameters, and texture characteristics of juvenile largemouth bass (Micropterus salmoides) exposed to highly saline-alkaline water. Progress in Fishery Sciences, 2022, 43(4): 1-11 [逯冠政, 么宗利, 来琦芳, 等. 高盐碱环境下大口黑鲈幼鱼生长性能、血液生理指标与质构特征研究. 渔业科学进展, 2022, 43(4): 1-11] |
LUO W, LIANG X, HUANG S, et al. Molecular cloning, expression analysis and miRNA prediction of vascular endothelial growth factor A (VEGFAa and VEGFAb) in pond loach Misgurnus anguillicaudatus, an air-breathing fish. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2016, 202: 39-47 DOI:10.1016/j.cbpb.2016.07.006 |
MCDERMOTT D F, HUSENI M A, ATKINS M B, et al. Clinical activity and molecular correlates of response to atezolizumab alone or in combination with bevacizumab versus sunitinib in renal cell carcinoma. Nature Medicine, 2018, 24(6): 749-757 DOI:10.1038/s41591-018-0053-3 |
MEDEIROS P R, RADA D P, ROSA R S. Abundance and behavioural ecology of the blenny Ophioblennius trinitatis (Teleostei: Blenniidae) at an oceanic archipelago of Brazil (Atlantic). Scientia Marina, 2014, 78(2): 203-212 DOI:10.3989/scimar.03979.30G |
MOSIALOU I, SHIKHEL S, LIU J M, et al. Erratum: Corrigendum: MC4R-dependent suppression of appetite by bone-derived lipocalin 2. Nature, 2017, 546(7658): 440-440 DOI:10.1038/nature22808 |
NATHAN J, RAMACHANDRAN A. Efficacy of marine biomolecules on angiogenesis by targeting hypoxia inducible factor/vascular endothelial growth factor signaling in zebrafish model. Journal of Biochemical and Molecular Toxicology, 2022, 36(2): e22954 DOI:10.1002/jbt.22954 |
NUNES L T, BARNECHE D R, LASTRUCCI N S, et al. Predicting the effects of body size, temperature and diet on animal feeding rates. Functional Ecology, 2021, 35(10): 2229-2240 DOI:10.1111/1365-2435.13872 |
PIAZZA M, MUNASINGHE J, MURAYI R, et al. Simulating vasogenic brain edema using chronic VEGF infusion. Journal of Neurosurgery, 2017, 127(4): 905-916 DOI:10.3171/2016.9.JNS1627 |
QI Y, ZHENG Y N. Research on the VEGF. Journal of Qinghai Normal University (Natural Science), 2010, 26(4): 61-66 [祁玥, 郑亚宁. 血管内皮生长因子的研究进展. 青海师范大学学报(自然科学版), 2010, 26(4): 61-66 DOI:10.3969/j.issn.1001-7542.2010.04.016] |
RAMAKRISHNAN S, ANAND V, ROY S. Vascular endothelial growth factor signaling in hypoxia and inflammation. Journal of Neuroimmune Pharmacology, 2014, 9(2): 142-160 DOI:10.1007/s11481-014-9531-7 |
RASK M. Changes in the density, population structure, growth and reproduction of perch, Perca fluviatilis L. in two acidic forest lakes in southern Finland. Environmental Pollution, 1992, 78(1/2/3): 121-125 |
RIKARDSEN A H, DEMPSON J B, AMUNDSEN P A, et al. Temporal variability in marine feeding of sympatric Arctic charr and sea trout. Journal of Fish Biology, 2007, 70(3): 837-852 DOI:10.1111/j.1095-8649.2007.01345.x |
SAMSON M, PEALE F V, FRANTZ G, et al. Human endocrine gland-derived vascular endothelial growth factor: Expression early in development and in leydig cell tumors suggests roles in normal and pathological testis angiogenesis. Journal of Clinical Endocrinology and Metabolism, 2004, 89(8): 4078-4088 DOI:10.1210/jc.2003-032024 |
SMITH G A, FEARNLEY G W, HARRISON M A, et al. Vascular endothelial growth factors: Multitasking functionality in metabolism, health and disease. Journal of Inherited Metabolic Disease, 2015, 38(4): 753-763 DOI:10.1007/s10545-015-9838-4 |
TRUDEL M, TREMBLAY A, SCHETAGNE R, et al. Why are dwarf fish so small? An energetic analysis of polymorphism in lake whitefish (Coregonus clupeaformis). Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(2): 394-405 DOI:10.1139/f00-252 |
TSUJI-TAMURA K, SATO M, FUJITA M, et al. Glycine exerts dose-dependent biphasic effects on vascular development of zebrafish embryos. Biochemical and Biophysical Research Communications, 2020, 527(2): 539-544 DOI:10.1016/j.bbrc.2020.04.098 |
VINDAS M A, JOHANSEN I B, FOLKEDAL O, et al. Brain serotonergic activation in growth-stunted farmed salmon: Adaption versus pathology. Royal Society Open Science, 2016, 3(5): 160030 DOI:10.1098/rsos.160030 |
VOGT M C, PAEGER L, HESS S, et al. Neonatal insulin action impairs hypothalamic neurocircuit formation in response to maternal high-fat feeding. Cell, 2014, 156(3): 495-509 DOI:10.1016/j.cell.2014.01.008 |
WANG Q, YU Y, ZHANG Q, et al. Evaluation on the genomic selection in Litopenaeus vannamei for the resistance against Vibrio parahaemolyticus. Aquaculture, 2019, 505: 212-216 DOI:10.1016/j.aquaculture.2019.02.055 |
WANG Z L, YAO D L, ZHENG J, et al. Analysis and evaluation of nutrition composition of muscle in three species of Cyprininae fishes. Journal of Aquaculture, 2017, 38(7): 39-42 [王桢璐, 姚东林, 郑钧, 等. 三种鲤亚科鱼类的肌肉营养成分分析与评价. 水产养殖, 2017, 38(7): 39-42 DOI:10.3969/j.issn.1004-2091.2017.07.008] |
WU X Q, CAI W J, LUO X G. Expressions of vascular endothelial growth factor A (VEGF) and its receptor Flk-1 during arteriogenesis induced by arteriovenous shunt in rabbit hind-limbs. Chinese Journal of Histochemistry and Cytochemistry, 2006, 15(4): 437-440 [伍校琼, 蔡维君, 罗学港. 兔后肢动静脉短路诱导动脉生成过程中VEGF(A)及其受体Flk-1的表达. 中国组织化学与细胞化学杂志, 2006, 15(4): 437-440] |
XIANG Z W, JIANG K J, CHU H Y, et al. Effects of salinity on growth performance, digestive enzymes, and nonspecific immunity in juvenile hybrid grouper (Epinephelus fuscoguttatus♀ × E. lanceolatus♂). Progress in Fishery Sciences, 2023, 44(3): 64-73 [相智巍, 姜柯君, 褚洪永, 等. 不同盐度对珍珠龙胆石斑鱼幼鱼生长、消化酶活性和非特异性免疫的影响. 渔业科学进展, 2023, 44(3): 64-73] |
YANG S L, XUE Q Z, WANG Y, et al. Roles of vascular endothelial growth factor and its receptors in embryonic zebrafish vascular development. Acta Biophysica Sinica, 2009, 25(1): 1-8 [杨少丽, 薛钦昭, 王艳, 等. 血管内皮生长因子及其受体在斑马鱼胚胎血管发育中的作用. 生物物理学报, 2009, 25(1): 1-8] |
ZAN L, WU H, JIANG J, et al. Temporal profile of Src, SSeCKS, and angiogenic factors after focal cerebral ischemia: Correlations with angiogenesis and cerebral edema. Neurochemistry International, 2011, 58(8): 872-879 DOI:10.1016/j.neuint.2011.02.014 |
ZHANG S, GUO X, LU S, et al. Perfluorohexanoic acid caused disruption of the hypothalamus-pituitary-thyroid axis in zebrafish larvae Ecotoxicology and Environmental Safety, 2022, 232: 113283
|
ZHAO S Y, LIN H Z, HUANG Z, et al. Effect of dietary protein level on growth performance, plasma biochemical indices and flesh quality of grouper (Epinephelus lanceolatus × E. fuscoguttatus) at two growth stages. South China Fisheries Science, 2017, 13(4): 87-96 [赵书燕, 林黑着, 黄忠, 等. 不同蛋白水平对2种规格石斑鱼生长性能、血清生化及肌肉品质的影响. 南方水产科学, 2017, 13(4): 87-96] |
ZHU H P, SU H H, MA D M, et al. Comparative analysis of genetic diversity in Cyprinus carpio rubrofuscus among selective-breeding population and landraces. Journal of Agricultural Biotechnology, 2018, 26(8): 1371-1381 [朱华平, 苏换换, 马冬梅, 等. 华南鲤选育品种与地方品种的遗传多样性比较分析. 农业生物技术学报, 2018, 26(8): 1371-1381] |



