2. 中国水产科学研究院黄海水产研究所 海水养殖生物育种与可持续产出全国重点实验室 山东 青岛 266071;
3. 青岛海洋科技中心海洋渔业科学与食物产出过程功能实验室 山东 青岛 266237;
4. 邦普种业科技有限公司 山东 潍坊 261312;
5. 会达水产养殖有限公司 河北 唐山 063299
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, State Key Laboratory of Mariculture Biobreeding and Sustainable Goods, Qingdao 266071, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao Marine Science and Technology Center, Qingdao 266237, China;
4. BLUP Aquabreed Co, Ltd, Weifang 261312, China;
5. Huida Aquaculture Co, Ltd, Tangshan 063299, China
凡纳对虾(Penaeus vannamei),俗称南美白对虾,原产于中南美洲太平洋沿岸热带海域,是目前世界三大高产量对虾养殖种类之一。我国于1988年从美国夏威夷引进(张伟权等, 1990),其营养价值丰富,对环境的适应力较强且生长速度快,适合高密度工厂化养殖,得到大规模推广养殖(Gao et al, 2012)。2022年,我国凡纳对虾年产量达209万t,占国内对虾养殖总产量的90%以上(农业农村部渔业渔政管理局, 2023),是我国水产养殖业的支柱产业之一。
随着养殖规模的不断扩大,对虾病害问题日益严重,其中,急性肝胰腺坏死病(acute hepatopancreatic necrosis disease, AHPND)是阻碍全球对虾养殖产业发展、造成灾难性经济损失的对虾疾病之一。2009年AHPND首次在我国海南地区暴发,截至2021年,该疾病对凡纳对虾主要养殖地区(中国、马来西亚、泰国、越南和墨西哥)所造成的经济损失超过430亿美元(Kongrueng et al, 2015; Navaneeth et al, 2020; Kumar et al, 2021)。AHPND由副溶血弧菌(Vibrio parahaemolyticus, VpAHPND)的特定毒力株引起(叶彩燕, 2019),大约发生在虾苗放养后的7~8 d。对虾患病后,多数出现肝胰腺肿大,呈淡白色或淡黄色;感染后期,部分病虾的肝胰腺出现萎缩,呈红褐色发黑,质地变硬(De La Pena et al, 2015)。感染后20~30 d内死亡率高达90%。目前,对AHPND的研究主要集中在病理和病因方面(李吉云等, 2021; 安伟等, 2020; 陈平亚等, 2022; 王仁宝等, 2022; 魏紫等, 2022),通过养殖管理进行防控尚未形成完整体系,难以从根本上控制弧菌传播。培育AHPND抗性的凡纳对虾新种质是解决AHPND的有效途径之一(Moss et al, 2012)。近年来,国内研究人员通过建立自主的对虾选育体系,培育了“海兴农2号”、“壬海1号”等12个凡纳对虾新品种(孔杰等, 2017; 孟宪红等, 2016)。这些新品种多以生长、白斑综合征病毒(white spot syndrome virus, WSSV)抗性、养殖存活率、温度、盐度及氨氮耐受性等为目标性状,以AHPND抗性为目标性状的新品种尚未见报道。
遗传参数能够反映目标性状在该育种群体的遗传变异情况,是育种决策的重要参考。凡纳对虾AHPND抗性遗传参数评估已开展部分研究。Campos-Montes等(2020)评估了浸浴感染后不同凡纳对虾品系AHPND抗性遗传参数,其中,个体存活时间、存活率等均为低遗传力水平;Wang等(2019)估计了凡纳对虾注射感染后个体存活时间和存活率均为中低遗传力水平;刘绵宇等(2023)利用ssGBLUP-MF法评估了浸浴感染后凡纳对虾个体存活状态的遗传力,不同群体中均显示出一定的AHPND抗性选育潜力。由于国内已有的凡纳对虾种质遗传背景复杂,遗传参数评估受测试群体、感染方式等影响较大。针对育种基础群体开展稳定的感染测试并获得准确遗传参数是育种工作顺利开展的基础和重要保证。生长性状是水产动物遗传育种中的重要经济性状,国内12个凡纳对虾新品种中有11个品种的优良性状涉及了生长。评估凡纳对虾核心育种群生长与AHPND抗性之间的遗传关系,对充分利用优质种源、培育多性状复合的AHPND抗性新品种具有重要意义。
本研究以自主选育的凡纳对虾高抗系和快大系为研究对象,通过口饲的方式进行VpAHPND定量感染,分析不同品系体重、个体存活时间、家系半致死存活率(个体死亡数达测试个体总数50%时各个家系的存活率)的遗传力及品系内生长与AHPND抗性的遗传相关,旨在为AHPND抗性新品种培育提供理论及基础数据支撑。
1 材料与方法 1.1 实验材料实验材料来自邦普种业科技有限公司(山东潍坊)2022年构建的第5代以WSSV抗性为选育目标的高抗(GK)系和以生长速度为选育目标的快大(KD)系。其中,GK系选取40个出生日期接近的家系,每个家系随机取30尾;KD系选取30个出生日期接近的家系,每个家系随机取50尾,运至中国水产科学研究院黄海水产研究所对虾性状测试车间(山东青岛)。
GK组每个家系选取20尾活力正常对虾,共计800尾;KD组每个家系选取32尾活力正常对虾,共计960尾,按品系分2批次进行VpAHPND人工定量感染测试。各家系另随机选取8尾作为对照。测试对虾日龄为P70~P90,平均体重为3.08 g。
实验所用VpAHPND来自自然资源部第三海洋研究所,于–80 ℃冰箱保存。
1.2 实验方法毒饵制备参考田吉腾等(2023)的方法。将菌液从–80 ℃冰箱取出,4 ℃融化后加到200 mL 2216E液体培养基中,接种量的体积比为1∶200,封口后置于30 ℃摇床200 r/min培养9 h,获得(1~10)×109 CFU/mL菌液;将商品颗粒饲料放入菌液中浸泡50 min以上(30 ℃恒温),得到单颗粒(5~9)×106 CFU毒饵。
实验对虾放置于抗病测试防逃逸分隔装置(孔杰等, 2023)。按家系每10尾放入10 cm×12 cm×30 cm的亚克力盒中,每尾虾中间用隔板隔开。正式测试前暂养72 h。暂养温度从20 ℃开始,每天升温2 ℃,至28 ℃;暂养期间,每天上午吸底换水,换水量为养殖水体的40%;上午10点和晚上10点进行普通商品饲料的投喂,投喂量为体重的12%。
人工感染VpAHPND测试分为实验组与对照组。实验组:投喂毒饵前进行饥饿处理24 h,保证虾的肠胃排空无粪便。实验开始时(0 h),每尾虾投喂10粒毒饵,每隔3 h观察一次。观察时将死亡个体捞出,用电子台秤(精度为0.01 g)称量体重,记录死亡个体的家系编号、体重、存活时间(从投喂毒饵开始0 h到个体死亡时间),于–20 ℃冰箱内保存。
GK品系由于感染后实验个体死亡缓慢,分别于实验开始后36、72 h再次对存活个体进行感染,个体投喂毒饵量同上。品系内个体达到半数死亡后不再投喂毒饵。连续66 h没有死亡个体时,实验结束。实验结束时,仍存活个体的存活时间定为实验结束的时间。对照组:投喂的饲料为无接种培养液浸泡后的商品颗粒饲料,养殖条件与实验组保持一致。感染测试期间对照组未出现死亡。
1.3 数据分析描述性统计量利用Excel 2010软件进行。对所有实验个体的个体编号、家系编号、死亡时体重、感染后存活时间进行整理汇总,统计体重、个体存活时间、家系半致死存活率性状的均值、最大值、最小值、标准差和变异系数。
线性混合模型利用平均信息约束极大似然法(average information restricted maximum likelihood, AIREML),通过ASReml 4.0软件估计体重、个体存活时间的方差组分。育种分析模型为个体动物模型:
| $ {y_{1ij}} = {\mu _1} + {a_{1j}} + {e_{1ij}} $ | (1) |
| $ \begin{array}{<sup>*</sup>{20}{c}} {{y_{2ij}} = {\mu _2} + {a_{2j}} + {e_{2ij}}} \end{array} $ | (2) |
式中,
表型方差是所有方差组分的和,计算公式为:
| $ \begin{array}{<sup>*</sup>{20}{c}} {\sigma _p^2 = \sigma _a^2 + \sigma _e^2} \end{array} $ | (3) |
遗传力(
| $ \begin{array}{<sup>*</sup>{20}{c}} {{h^2} = \frac{{\sigma _a^2}}{{\sigma _p^2}}} \end{array} $ | (4) |
式中,
统计死亡个体数达到总数一半时,将存活的个体记录为1,死亡个体记录为0。采用父母本阈值模型估计测试个体半数致死时各家系的存活率遗传参数,分析模型如下:
| $ \begin{array}{<sup>*</sup>{20}{c}} {\Pr ({y_{ij}} = 1) = \Pr ({l_{ij}} > 0) = \Phi (\mu + {s_i} + {d_j} + {e_{ij}})} \end{array} $ | (5) |
式中,
家系半致死存活率的遗传力(h2)计算公式:
| $ \begin{array}{<sup>*</sup>{20}{c}} {{h^2} = \frac{{4\sigma _{sd}^2}}{{2\sigma _{sd}^2 + \sigma _e^2}}} \end{array} $ | (6) |
由于实验结束时部分存活个体的存活时间设为相同,导致模型无法收敛,评估各性状间遗传相关与表型相关时仅采用死亡个体的数据。利用两性状动物模型估计品系内体重与个体存活时间、体重与家系半致死存活率、个体存活时间与家系半致死存活率的遗传相关。
| $ \begin{array}{<sup>*</sup>{20}{c}} {{r_{g1}} = \frac{{cov({\sigma _1},{\sigma _2})}}{{{\sigma _{a1}}{\sigma _{a2}}}}} \end{array} $ | (7) |
| $ \begin{array}{<sup>*</sup>{20}{c}} {{r_{g2}} = \frac{{cov({\sigma _1},{\sigma _3})}}{{{\sigma _{a1}}{\sigma _{a3}}}}} \end{array} $ | (8) |
| $ \begin{array}{<sup>*</sup>{20}{c}} {{r_{g3}} = \frac{{cov({\sigma _2},{\sigma _3})}}{{{\sigma _{a2}}{\sigma _{a3}}}}} \end{array} $ | (9) |
式中,
采用Z-score检验各个性状遗传力、遗传相关参数估计值的差异显著性。
| $ \begin{array}{<sup>*</sup>{20}{c}} {Z = \frac{{{X_i} - {X_j}}}{{\sqrt {\sigma _i^2 + \sigma _j^2} }}} \end{array} $ | (10) |
式中,
各家系在进行VpAHPND感染实验前后均为单独养殖,因此,在体重、个体存活时间与家系半致死存活率性状方差组分估计中,未加入共同环境效应。
2 结果与分析 2.1 感染VpAHPND后2个品系死亡趋势GK组分别在0、36、72 h投喂3次毒饵后达半数死亡;KD组投喂1次毒饵后,达半数死亡。实验结束时,GK系死亡550尾,KD系死亡506尾。
GK系与KD系个体感染VpAHPND后累计死亡数量见图 1。GK系在感染后9 h开始出现死亡,感染45 h死亡数量骤增,达到死亡高峰期,感染78 h达半数死亡,此后每日死亡数量波动较大,感染228 h后连续66 h没有出现死亡个体。KD系在感染6 h后出现死亡个体,感染38 h达到死亡高峰期,感染60 h达半数死亡,此后每日死亡数呈下降趋势,感染106 h后连续66 h没有死亡个体出现。
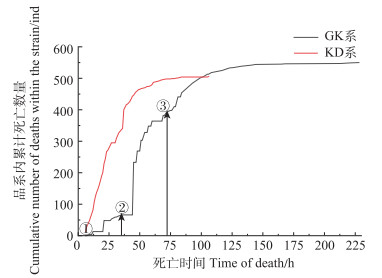
|
图 1 GK系和KD系感染VpAHPND累计死亡数量 Fig.1 Cumulative mortality of VpAHPND infection in GK and KD strains ①:0 h,第1次感染;②:36 h,第2次感染;③:72 h,第3次感染。 ①: 0 h, the first infection; ②: 36 h, the second infection; ③: 72 h, the third infection. |
GK系与KD系的体重、感染VpAHPND后个体存活时间和家系半致死存活率在家系水平的描述性统计见表 1。由表 1可知,GK系体重3.12~6.47 g,变异系数15.52%;个体存活时间62.40~228.15 h,变异系数31.89%;家系半致死存活率15.00%~80.00%,变异系数36.64%。KD系体重0.93~2.86 g,变异系数21.27%;个体存活时间37.03~155.44 h,变异系数32.19%;家系半致死存活率9.38%~87.50%,变异系数40.73%。AHPND抗性性状的高变异系数提示2个品系可能具有一定AHPND抗性选育潜力。
|
|
表 1 凡纳对虾测试群体体重、感染VpAHPND后个体存活时间、家系半致死存活率在家系水平的描述性统计 Tab.1 Descriptive statistics on the body weight, individual survival time after infection with VpAHPND, and half lethal survival rate of the tested population of P. vannamei at the family level |
遗传力水平可分为高(> 0.4)、中(0.2~0.4)和低(< 0.2) 3个水平(Lou, 1999)。GK系与KD系的体重、个体存活时间、家系半致死存活率方差组分及遗传参数结果见表 2。其中,GK系体重遗传力为0.599±0.122,为高等遗传力水平;个体存活时间遗传力为0.240± 0.072,为中等遗传力水平;家系半致死存活率遗传力为0.173±0.051,为低等遗传力水平。KD系体重、个体存活时间、家系半致死存活率的遗传力分别为0.266±0.082、0.374±0.096、0.257±0.048,均为中等遗传力水平。Z-score检验表明,2个品系各性状计算的遗传力与0差异均达到极显著水平(P < 0.01)。
|
|
表 2 凡纳对虾测试群体体重、感染VpAHPND后个体存活时间、家系半致死存活率方差组分和遗传力 Tab.2 Body weight, individual survival time after infection with VpAHPND, variance components and heritability of family half lethal survival rate in the tested population of P. vannamei |
遗传相关可分为高(> 0.8)、中(0.4~0.8)、低(< 0.4) 3个水平(Coman et al, 2010; 栾生等, 2013; Dai et al, 2022)。GK系与KD系的体重、感染VpAHPND后个体存活时间与家系半致死存活率遗传相关估计结果见表 3。GK系体重与个体存活时间、体重与家系半致死存活率的遗传相关分别为0.172±0.246、0.235±0.241,均为低度正相关,与0无显著性差异(P > 0.05);个体存活时间与家系半致死存活率遗传相关0.997±0.129,为高度正相关,与0差异极显著(P < 0.01)。KD系体重与个体存活时间、体重与家系半致死存活率的遗传相关分别为0.116±0.304、0.061±0.311,均为低度正相关,与0无显著性差异(P > 0.05);个体存活时间与家系半致死存活率遗传相关0.967±0.044,为高度正相关,与0差异极显著(P < 0.01)。
|
|
表 3 凡纳对虾测试群体体重、感染VpAHPND后个体存活时间、家系半致死存活率表型相关及遗传相关 Tab.3 Phenotypic and genetic correlations among body weight, survival time of individuals infected with VpAHPND, and half lethal survival rate of families in the tested population of L. vannamei |
凡纳对虾的生长作为选育的主要性状之一,其遗传力已开展大量研究。王伦等(2022)将(5.21±2.16) g的凡纳对虾进行混养测试,评估体重的遗传力为0.48,属高等遗传力水平;郑静静等(2016)对60、105、150日龄的凡纳对虾进行混养,评估其体重遗传力分别为0.39、0.25、0.22,属中等遗传力水平;刘东亚等(2022)利用ssGBLUP评估P30~P50的凡纳对虾(1.96~2.41 g)体重遗传力为0.40,属中等遗传力水平。本研究中评估的GK系和KD系凡纳对虾P70~P90体重遗传力分别为0.599和0.266,其中,GK系体重遗传力稍高于已有研究结果,KD系体重遗传力与已有研究范围相一致。测试群体的来源、个体规格、测试方式、评估模型等均可能影响遗传力估计结果。本研究采用家系+个体单养的方式进行体重测试,模型中无法剖分共同环境效应,导致体重遗传力存在一定程度偏高。此外,2个品系间体重的遗传力存在显著差异(P < 0.05),原因可能是多代选育后,KD系与生长快慢有关的基因得到一定程度富集,品系内的生长相关遗传变异出现一定程度下降。
凡纳对虾的AHPND抗性作为重要的经济性状之一,其遗传力估计也已开展部分研究。常用的VpAHPND感染方式有反向灌肠感染(Lee et al, 2015)、口饲感染(Angthong et al, 2017)、注射感染(Maralit et al, 2018)、单次浸泡感染(Boonchuen et al, 2018)和梯度浸泡感染(Ng et al, 2012)等。刘绵宇(2022)利用梯度浸泡感染法评估了体长为3 cm左右的凡纳对虾感染VpAHPND后半致死存活率遗传力为0.24,属中等遗传力水平;Lyu等(2020)利用注射法评估了(3.92±1.27) g凡纳对虾感染VpAHPND后存活时间与半致死存活率的遗传力分别为0.20±0.05、0.11±0.04,属中低遗传力水平;Wang等(2020)利用注射感染法评估了(5.56±2.16) g凡纳对虾13个全同胞家系感染VpAHPND后个体存活时间的遗传力为0.15~0.24,为中低遗传力水平。本研究通过定量口饲感染的方式进行VpAHPND感染,所得GK系个体存活时间和家系半致死存活率的遗传力分别为0.240±0.072和0.172±0.051,KD系个体存活时间和家系半致死存活率的遗传力分别为0.374±0.096和0.257±0.048,个体存活时间遗传力略高于Wang等(2020)的研究结果,家系半致死存活率与刘绵宇(2022)结果接近,略高于Lyu等(2020)的结果,可能与不同的感染方式及不同实验群体有关。刘杨等(2023)估计凡纳对虾感染AHPND后存活时间的遗传力为0.68~0.79,高于本研究估算的遗传力,原因可能是该实验群体是根据其亲本感染VpAHPND后存活时间的预测GEBV设计优化配种方案所构建的家系,家系间AHPND抗性差异显著,群体有一定特异性。研究结果也显示,本次评估的GK系和KD系AHPND抗性均有一定的选育潜力。
本研究中,GK系从感染VpAHPND后发病时间、感染次数、个体平均存活时间等性状表现上都优于KD系,显示以WSSV抗性为目标进行选育的GK系对AHPND的抗性较KD系强。已有研究表明,凡纳对虾不同抗性性状之间可能存在一定程度的正相关。如Campos-Montes等(2020)评估2个品系凡纳对虾(生长、抗性)的抗ANPND与抗WSSV存活率遗传相关为中低度正相关;卢霞等(2018)研究发现,凡纳对虾抗WSSV能力与氨氮急性胁迫之间存在正相关性;段毓佳等(2024)研究发现,凡纳对虾高抗品系(WSSV抗性)耐低氧性能明显高于快大品系。关于凡纳对虾WSSV抗性与AHPND抗性之间是否存在一定程度正相关,仍需做进一步的验证。
3.2 GK系与KD系生长与AHPND抗性遗传相关分析遗传相关是由Hazel等(1943)提出的,用来描述不同性状间由于各种遗传原因造成的相关程度大小,是育种方案制定的重要参考指标。目前,关于凡纳对虾生长与AHPND抗性相关的研究尚未见报道,而凡纳对虾生长与其他病原抗性的相关已有较多研究,可作为本研究结果的重要参考。例如,Argue等(2002)以来源于墨西哥、厄瓜多尔地区的凡纳对虾为研究对象,对3~5 g的仔虾进行为期15周的生长与桃拉综合征(Taura syndrome virus, TSV)抗性测试,获得体重与桃拉综合征抗性相关性为–0.46;Gitterle等(2005)以哥伦比亚地区的生长快及TSV抗性群体为研究对象,进行为期15~29 d的WSSV抗性测试,获得体重与WSSV抗性的遗传相关为–0.55~ –0.64;孙坤等(2022)以邦普种业科技有限公司自主选育的G0代高抗群体为研究对象,对3月龄群体进行为期13 d的WSSV抗性测试,评估体重与抗WSSV存活时间遗传相关为–0.057~ –0.162;冯亚萍(2017)以亲本来源为美国夏威夷、迈阿密地区的“壬海1号”G5代群体为研究对象,针对4月龄群体进行为期15 d的WSSV抗性测试,估计体重与抗WSSV存活时间之间的遗传相关为0.69;和怡婧等(2024)以邦普种业科技有限公司自主选育的G5代WSSV高抗群体为研究对象,对77~94日龄群体进行为期21 d的WSSV抗性测试,评估凡纳对虾体长与WSSV抗性的遗传相关为0.15~0.25,为中低度正相关。关于生长与抗病性之间的相关性目前的研究结果差异较大,其中,病原种类、实验群体的来源、实验个体的规格、实验环境、评估模型等均可能影响遗传参数评估结果。本研究评估生长与AHPND抗性遗传相关的结果显示,2个品系体重与个体存活时间、家系半致死存活率之间的遗传相关均为低度正相关(0.061~0.235),且与0差异不显著(P > 0.05),表明以生长作为主要目标性状对凡纳对虾进行选育,其AHPND抗性可能没有改良效果。因此,在凡纳对虾多性状复合选育时,需要采用经济加权或赋值的方式制定生长和AHPND抗性相关综合选择指数进行留种和优化配种方案的制定。此外,本研究GK系与KD系感染AHPND后个体存活时间与家系半致死存活率的遗传相关为0.967、0.997,均表现为高度正相关。与Lyu等(2020)估算凡纳对虾AHPND存活时间与半致死存活率的遗传相关结果范围一致,提示进行AHPND抗性选育时,可以将家系半致死存活率作为AHPND的抗性指标以简化抗性测试过程。
由于凡纳对虾个体的抗病力难以直接测量,评估育种值时,根据同胞表型值估计的传统BLUP法仅能利用50%测试群体的遗传变异,所得育种值准确性可能低于同时利用家系内与家系间遗传变异的全基因组育种值(Nielsen, 2009; Nirea, 2012; Dai et al, 2020)。随着对虾基因组学的飞速发展和基因分型成本的不断降低,通过育种芯片、简化基因组测序等方式获得分子标记信息并开展AHPND抗性的基因组遗传评估,有望进一步提高遗传参数估计的准确性。
AN W, XIAO Y, GAO X H, et al. Different expression levels of virulence genes of bacterial pathogen associated with acute hepatopancreatic necrosis disease under different environments. Chinese Agricultural Science Bulletin, 2020, 36(36): 132-136 [安伟, 肖雨, 高晓华, 等. 对虾急性肝胰腺坏死病病原毒素基因在不同环境下表达差异研究. 中国农学通报, 2020, 36(36): 132-136 DOI:10.11924/j.issn.1000-6850.casb20200300228] |
ANGTHONG P, ROYTRAKUL S, JARAYABHAND P, et al. Involvement of a tachylectin-like gene and its protein in pathogenesis of acute hepatopancreatic necrosis disease (AHPND) in the shrimp, Penaeus monodon. Developmental and Comparative Immunology, 2017, 76: 229-237 DOI:10.1016/j.dci.2017.06.011 |
ARGUE B J, ARCE S M, LOTZ J M, et al. Selective breeding of Pacific white shrimp (Litopenaeus vannamei) for growth and resistance to Taura syndrome virus. Aquaculture, 2002, 204(3/4): 447-460 |
BOONCHUEN P, JAREE P, TASSANAKAJON A, et al. Hemocyanin of Litopenaeus vannamei agglutinates Vibrio parahaemolyticus AHPND (VpAHPND) and neutralizes its toxin. Developmental and Comparative Immunology, 2018, 84: 371-381 DOI:10.1016/j.dci.2018.03.010 |
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2023. Beijing: China Agriculture Press, 2023 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴. 北京: 中国农业出版社, 2023]
|
CAMPOS-MONTES G R, CABALLERO-ZAMORA A, MONTALDO H H, et al. Genetic (co)variation in resistance of Pacific white shrimp Litopenaeus vannamei to acute hepatopancreatic necrosis disease (AHPND) and white spot syndrome virus (WSSV) in challenge tests. Aquaculture, 2020, 520: 734994 DOI:10.1016/j.aquaculture.2020.734994 |
CHEN P Y, WU S N, HE C H, et al. Establishment of a RAA assay for pathogenic bacteria of AHPND in shrimps. China Animal Health Inspection, 2022, 39(9): 128-133 [陈平亚, 吴山楠, 何翠华, 等. 对虾急性肝胰腺坏死病病原菌RAA检测方法的建立. 中国动物检疫, 2022, 39(9): 128-133 DOI:10.3969/j.issn.1005-944X.2022.09.023] |
COMAN G J, ARNOLD S J, WOOD A T, et al. Age: Age genetic correlations for weight of Penaeus monodon reared in broodstock tank systems. Aquaculture, 2010, 307(1/2): 1-5 |
DAI P, KONG J, LIU J, et al. Evaluation of the utility of genomic information to improve genetic evaluation of feed efficiency traits of the Pacific white shrimp Litopenaeus vannamei. Aquaculture, 2020, 527: 735421 DOI:10.1016/j.aquaculture.2020.735421 |
DAI P, ZHENG J, LUAN S, et al. Estimates of heritability and genetic correlation for growth traits at harvest in red claw crayfish, Cherax quadricarinatus. Aquaculture, 2022, 561: 738631 DOI:10.1016/j.aquaculture.2022.738631 |
DE LA PENA L D, CABILLON N A R, CATEDRAL D D, et al. Acute hepatopancreatic necrosis disease (AHPND) outbreaks in Penaeus vannamei and P. monodon cultured in the Philippines. Diseases of Aquatic Organisms, 2015, 116(3): 251-254 DOI:10.3354/dao02919 |
DUAN Y J, TAN J, LUAN S, et al. Evaluation of genetic parameters for survival traits of Litopenaeus vannamei under hypoxic conditions. Progress in Fishery Sciences, 2024, 45(1): 138-147 [段毓佳, 谭建, 栾生, 等. 凡纳滨对虾在低氧环境下存活性状的遗传参数评估. 渔业科学进展, 2024, 45(1): 138-147] |
FENG Y P. Estimation of genetic parameters for white spot syndrome virus (WSSV) resistance traits in Litopenaeus vannmei and comparison of resistance to WSSV between Litopenaeus vannamei and Fenneropenaeus chinensis. Master´s Thesis of Shanghai Ocean University, 2017 [冯亚萍. 凡纳滨对虾抗WSSV性状遗传参数评估及与中国明对虾抗WSSV性状差异研究. 上海海洋大学硕士研究生学位论文, 2017]
|
GAO W, TAN B, MAI K, et al. Profiling of differentially expressed genes in hepatopancreas of white shrimp (Litopenaeus vannamei) exposed to long-term low salinity stress. Aquaculture, 2012, 364: 186-191 |
GITTERLE T, SALTE R, GJERDE B, et al. Genetic (co)variation in resistance to white spot syndrome virus (WSSV) and harvest weight in Penaeus (Litopenaeus) vannamei. Aquaculture, 2005, 246(1/2/3/4): 139-149 |
HAZEL L N. The genetic basis for constructing selection indexes. Genetics, 1943, 28(6): 476-490 DOI:10.1093/genetics/28.6.476 |
HE Y J, LI X P, LUAN S, et al. Evaluation of genetic parameters for growth and survival traits of Litopenaeus vannamei during white spot syndrome virus infection. Progress in Fishery Sciences, 2024, 45(5): 155-164 [和怡婧, 李旭鹏, 栾生, 等. 凡纳对虾核心育种群生长和抗WSSV性状的遗传参数估计. 渔业科学进展, 2024, 45(5): 155-164] |
KONG J, HE J G, JIANG X W, et al. Litopenaeus vannamei "Hai Xing Nong No.2". China Fisheries, 2017(11): 67-71 [孔杰, 何建国, 江谢武, 等. 凡纳滨对虾"海兴农2号". 中国水产, 2017(11): 67-71] |
KONG J, TIAN J T, MENG X H, et al. The invention relates to a separating device for preventing escape in shrimp disease resistance test, CN202320811114.9.2023-8-11 [孔杰, 田吉腾, 孟宪红, 等. 一种对虾抗病测试防逃逸的分隔装置. CN202320811114.9.2023-8-11]
|
KONGRUENG J, YINGKAJORN M, BUNPA S, et al. Characterization of Vibrio parahaemolyticus causing acute hepatopancreatic necrosis disease in southern Thailand. Journal of Fish Diseases, 2015, 38(11): 957-966 DOI:10.1111/jfd.12308 |
KUMAR V, ROY S, BEHERA B K, et al. Acute hepatopancreatic necrosis disease (AHPND): Virulence, pathogenesis and mitigation strategies in shrimp aquaculture. Toxins, 2021, 13: 524 DOI:10.3390/toxins13080524 |
LEE C T, CHEN I T, YANG Y T, et al. The opportunistic marine pathogen Vibrio parahaemolyticus becomes virulent by acquiring a plasmid that expresses a deadly toxin. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(34): 10798-10803 |
LI J Y, SHEN H, MENG Q G, et al. Research progress on the epidemiology, diagnosis, prevention, and control of acute hepatopancreas necrosis in shrimp. Marine Sciences, 2021, 45(3): 163-172 [李吉云, 沈辉, 孟庆国, 等. 对虾急性肝胰腺坏死病(AHPND)流行病学、诊断方法及防控措施的研究进展. 海洋科学, 2021, 45(3): 163-172] |
LIU D Y, SUI J, KONG J, et al. Genetic parameters of larval weight traits of Litopenaeus vannamei under low temperature fluctuation. Journal of Fishery Sciences of China, 2022, 29(6): 834-842 [刘东亚, 隋娟, 孔杰, 等. 凡纳滨对虾幼虾体重性状在低温波动环境下的遗传参数分析. 中国水产科学, 2022, 29(6): 834-842] |
LIU M Y, LI X P, KONG J, et al. Application of the liquid chip "Yellow Sea Chip No.1" in genetic evaluation of the base population with resistance to acute hepatopancreatic necrosis disease in Litopenaeus vannamei. Journal of Fisheries of China, 2023, 47(1): 217-226 [刘绵宇, 李旭鹏, 孔杰, 等. 液相芯片"黄海芯1号"在凡纳滨对虾急性肝胰腺坏死病抗性基础群体遗传评估中的应用. 水产学报, 2023, 47(1): 217-226] |
LIU M Y. Application of the liquid chip "Yellow Sea Chip No. 1" in the selective breeding of resistance on AHPND in Litopenaeus vannamei. Master´s Thesis of Jiangsu Ocean University, 2022 [刘绵宇. 液相芯片"黄海芯1号"在凡纳滨对虾AHPND抗性选择育种中的应用. 江苏海洋大学硕士研究生学位论文, 2022]
|
LIU Y, LUAN S, LIU M Y, et al. Genomic prediction accuracy analysis of AHPND resistance genome prediction in Litopenaeus vannamei using SNP panels with different densities. Journal of Fisheries of China, 2023, 47(1): 165-174 [刘杨, 栾生, 刘绵宇, 等. 基于不同密度SNP面板的凡纳滨对虾AHPND抗性基因组预测准确性分析. 水产学报, 2023, 47(1): 165-174] |
LOU Y D. Fish breeding. Beijing: China Agriculture Press, 1999: 10-29 [楼允东. 鱼类育种学. 北京: 中国农业出版社, 1999: 10-29]
|
LU X, LUAN S, CAO B X, et al. Investigation on the susceptibility difference to WSSV between ammonia tolerant and sensitive Litopenaeus vannamei populations. Progress in Fishery Sciences, 2018, 39(1): 83-89 [卢霞, 栾生, 曹宝祥, 等. 凡纳滨对虾氨氮急性胁迫应激敏感群体和耐受群体对WSSV敏感性的差异分析. 渔业科学进展, 2018, 39(1): 83-89] |
LUAN S, LUO K, RUAN X H, et al. Genetic parameters and genotype by environment interaction for body weight and survival of Pacific white shrimp Litopenaeus vannamei. Oceanologia et Limnologia Sinica, 2013, 44(2): 445-452 [栾生, 罗坤, 阮晓红, 等. 凡纳滨对虾(Litopenaeus vannamei)体重、存活性状的遗传参数和基因型与环境互作效应. 海洋与湖沼, 2013, 44(2): 445-452] |
LYU D, YU Y, ZHANG Q, et al. Estimating genetic parameters for resistance to Vibrio parahaemolyticus with molecular markers in Pacific white shrimp. Aquaculture, 2020, 527: 735439 DOI:10.1016/j.aquaculture.2020.735439 |
MARALIT B A, JAREE P, BOONCHUEN P, et al. Differentially expressed genes in hemocytes of Litopenaeus vannamei challenged with Vibrio parahaemolyticus AHPND (VpAHPND) and VpAHPND toxin. Fish and Shellfish Immunology, 2018, 81: 284-296 DOI:10.1016/j.fsi.2018.06.054 |
MENG X H, LUAN S, LUO K, et al. Litopenaeus vannamei "Ren Hai No.1". China Fisheries, 2016(3): 49-52 [孟宪红, 栾生, 罗坤, 等. 凡纳滨对虾"壬海1号". 中国水产, 2016(3): 49-52] |
MOSS S M, MOSS D R, ARCE S M, et al. The role of selective breeding and biosecurity in the prevention of disease in penaeid shrimp aquaculture. Journal of Invertebrate Pathology, 2012, 110(2): 247-250 DOI:10.1016/j.jip.2012.01.013 |
NAVANEETH K A, BHUVANESWARI T, RAJAN J J S, et al. Characterization of Vibrio parahaemolyticus isolates from shrimp farms of southeast coast of India with special reference to acute hepatopancreatic necrosis disease (AHPND) status. Aquaculture, 2020, 518: 734813 DOI:10.1016/j.aquaculture.2019.734813 |
NG T H, LU C W, LIN S S, et al. The Rho signalling pathway mediates the pathogenicity of AHPND-causing V. parahaemolyticus in shrimp. Cellular Microbiology, 2018, 20: e12849 |
NIELSEN H M, SONESSON A K, YAZDI H, et al. Comparison of accuracy of genome-wide and BLUP breeding value estimates in sib based aquaculture breeding schemes. Aquaculture, 2009, 289(3/4): 259-264 |
NIREA K G, SONESSON A K, WOOLLIAMS J A, et al. Strategies for implementing genomic selection in family-based aquaculture breeding schemes: Double haploid sib test populations. Genetics Selection Evolution, 2012, 44(1): 30 DOI:10.1186/1297-9686-44-30 |
SUN K, LI X P, SUI J, et al. Evaluation of genetic parameters of body length, body weight and WSSV resistance of Litopenaeus vannamei based on microsatellite markers. Journal of Fisheries of China, 2022, 46(4): 583-593 [孙坤, 李旭鹏, 隋娟, 等. 基于微卫星标记评估凡纳滨对虾收获体长、体质量以及抗WSSV性状的遗传参数. 水产学报, 2022, 46(4): 583-593] |
TIAN J T, KONG J, LI X P, et al. A method for large-scale determination of the resistance of Litopenaeus vannamei to acute hepatopancreatic necrosis. CN202310391807.1.2023-6-23 [田吉腾, 孔杰, 李旭鹏, 等. 凡纳滨对虾抗急性肝胰腺坏死病性状的大规模测定方法. CN202310391807.1.2023-6-23]
|
WANG L, WANG C Y, LIU J Y. Evaluation of genetic parameters for growth and comprehensive stress tolerance traits of Litopenaeus vannamei. South China Fisheries Science, 2022, 18(4): 95-102 [王伦, 王崇懿, 刘建勇. 凡纳滨对虾生长和耐综合胁迫性状的遗传参数评估. 南方水产科学, 2022, 18(4): 95-102] |
WANG P, WANG J, SU Y, et al. Air exposure affects physiological responses, innate immunity, apoptosis and DNA methylation of kuruma shrimp, Marsupenaeus japonicus. Frontiers in Physiology, 2020, 11: 223 |
WANG Q, YU Y, ZHANG Q, et al. Evaluation on the genomic selection in Litopenaeus vannamei for the resistance against Vibrio parahaemolyticus. Aquaculture, 2019, 505: 212-216 DOI:10.1016/j.aquaculture.2019.02.055 |
WANG R B, SHI C Y, SONG X L, et al. The effect of Ig Y on the growth, immunity and resistance to VpAHPND infection of Litopenaeus vannamei. Journal of Fisheries of China, 2022, 46(12): 2409-2420 [王仁宝, 史成银, 宋晓玲, 等. 卵黄抗体对凡纳滨对虾生长、免疫及抗VpAHPND感染的影响. 水产学报, 2022, 46(12): 2409-2420] |
WEI Z, CHEN X Y, WANG S, et al. Protective effect of Chinese herbal compound preparations on hepatopancreas necrosis of Penaeus vannamei induced by Vibrio parahaemolyticus. Heilongjiang Animal Science and Veterinary Medicine, 2022(16): 108–115, 139–140 [魏紫, 陈心瑜, 王爽, 等. 中草药复方制剂对副溶血弧菌致南美白对虾肝胰腺坏死的保护作用. 黑龙江畜牧兽医, 2022(16): 108–115, 139–140] |
YE C Y. Isolation and identification of pathogen of an acute hepatopancreatic necrosis disease case from Litopenaeus vannamei and functional analysis of PirB protein. Master´s Thesis of Sichuan Agricultural University, 2019 [叶彩燕. 一例对虾急性肝胰腺坏死症病原分离鉴定及PirB蛋白的功能分析. 四川农业大学硕士研究生学位论文, 2019]
|
ZHANG W Q. Biological introduction of the world's important aquaculture species –White leg Shrimp in South America. Marine Sciences, 1990(3): 69-73 [张伟权. 世界重要养殖品种——南美白对虾生物学简介. 海洋科学, 1990(3): 69-73] |
ZHENG J J, LIU J Y, LIU J H, et al. Genetic parameterization and breeding value on body weight of Litopenaeus vannamei in different growth stages. Oceanologia et Limnologia Sinica, 2016, 47(5): 1005-1012 [郑静静, 刘建勇, 刘加慧, 等. 凡纳滨对虾(Litopenaeus vannamei)不同生长阶段体重的遗传参数和育种值估计. 海洋与湖沼, 2016, 47(5): 1005-1012] |



