2. 中国水产科学研究院珠江水产研究所 农业农村部热带亚热带水产资源利用与养殖重点实验室 广东 广州 510380;
3. 湖州师范学院生命科学学院 浙江 湖州 313000
2. Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Tropical and Subtropical Fishery Resource Application and Cultivation, Ministry of Agriculture and Rural Affairs, Guangzhou 510380, China;
3. School of Life Sciences, Huzhou University, Huzhou 313000, China
生殖是鱼类繁育后代的核心过程,鱼类繁殖的前提是其性腺正常发育。性腺发育是指原始生殖细胞起源至性腺发育成熟的整个阶段,可细分为发生、分化和成熟3个阶段。原始生殖细胞迁移至生殖嵴后与周围体细胞共同组成原始性腺,经过发育后进行分化,再进一步发育至成熟。鱼类性腺分化方式主要有雌雄异体、雌雄同体和兼性3种类型(Wang et al, 2023),其中,雌雄异体是硬骨鱼类最常见的性腺分化方式。雌雄异体又可分为分化型和未分化型两种,其中,分化型是指原始性腺直接分化为精巢或卵巢,硬骨鱼类中大多数为分化型,如鲤鱼(Cyprinus carpio)(Jiang et al, 2020)、大黄鱼(Larimichthys crocea)(游秀容等, 2012)、黄颡鱼(Pelteobagrus fulvidraco)(彭丽娜等, 2014)等。开展性腺分化和发育研究不仅对鱼类繁殖性能调控、品种资源开发利用等具有重要意义,还可以为单性诱导提供科学依据。
已有研究表明,与性别相关的基因在鱼类性别决定、性腺分化以及生殖和发育等生物学过程中发挥重要作用(Fajkowska et al, 2020)。在多数分化型硬骨鱼类中,dmrt1、sox9、foxl2、amh、cyp19a1a等被认为是参与性别调控的关键基因(李永婧等, 2017)。芳香化酶基因(cytochrome P450 family 19 subfamily A,cyp19a1a)通过芳香化酶以芳香化作用使雄激素向雌激素转化,在硬骨鱼类性腺分化和卵巢发育过程中发挥重要作用(Yan et al, 2019; 王金等, 2014)。该基因在性腺中特异表达(Sudhakumari et al, 2005),被作为性别向雌性分化的特征基因(Blázquez et al, 2008)。抗缪勒氏管激素(anti-Müllerian hormone, amh)对于生殖器官结构和生殖细胞的正常分化及发育具有调节作用(Kang et al, 2023)。在虹鳟(Oncorhynchus mykiss) (Yano et al, 2012)、鲤鱼(Wang et al, 2023)、草鱼(Ctenopharyngodon idella)(姚汶励等, 2019)等鱼类中,amh基因在精巢中的表达量显著高于卵巢,常作为性别向雄性分化的特征基因(Yano et al, 2012)。
草鱼与青鱼、鲢鱼、鳙鱼并称为四大家鱼。我国草鱼养殖年产量在养殖鱼类中长期占居首位,2022年养殖产量达到590.5万t,占淡水鱼类养殖总产量的24.3% (农业农村部渔业渔政管理局等, 2023)。草鱼性腺发育速度受季节、水温、生长环境及地域等多个因素影响,如华北地区草鱼性成熟一般需要5年,华南地区4年即可性成熟。本研究以华南地区草鱼为研究对象,通过组织切片观察草鱼不同月龄性腺结构变化和后期发育状态,同时,对性腺组织中性别特征基因cyp19a1a和amh的表达量进行分析,以期了解草鱼性腺分化时间和发育过程,为草鱼的繁殖生物学和激素诱导草鱼性别逆转等研究积累基础资料。
1 材料与方法 1.1 实验鱼养殖及样品采集实验用草鱼均来自中国水产科学研究院珠江水产研究所三水基地,从养殖池塘中挑选300尾10日龄[(1.24±0.63) g]草鱼幼苗放入面积为12 m2的网箱中养殖,饲养期间不间断充气增氧,每天于08:00和17:00左右各投喂1次,每次投喂量为鱼体重的2%~3%。实验所用饲料购自广东省佛山市联大农牧科技有限公司。
在实验草鱼为1、2、3、4、5和6月龄时分别从中随机挑选20尾,剪取尾鳍保存在无水乙醇中,用于遗传性别鉴定。另采取每尾鱼性腺组织,一部分连着腹腔膜一起放入4%的多聚甲醛溶液中固定24 h,随后保存在70%的无水乙醇中,用于制作组织切片观察性腺发育情况,剩余性腺组织放入RNA保存液(聚合美生物科技有限公司,北京),再转入–80 ℃保存,用于提取总RNA和检测基因表达量。
从试验基地草鱼成鱼养殖池中随机挑选12、24、36、48月龄草鱼各20尾,剪取尾鳍保存至无水乙醇中,采集性腺组织用于组织切片观察和基因表达分析,方法同上。
1.2 性腺组织切片观察取实验鱼性腺组织后置于4%的多聚甲醛中固定24 h后,经75%、85%、90%和95%酒精分别脱水4、2、2和1 h,再使用无水乙醇脱水2次,每次30 min。脱水完成后,使用2组二甲苯分别透明5~10 min后,将组织用石蜡包埋后切片,切片厚度为5 μm,再使用苏木精–伊红染色封片并使用Zeiss Axio Scope.A1显微镜观察拍照。
1.3 DNA提取及实验鱼遗传性别确定按照基因组DNA提取试剂盒(天根,北京)说明书提取基因组DNA,采用1%的琼脂糖凝胶电泳检测DNA质量。利用Wang等(2015)开发的草鱼雌雄特异性分子标记进行PCR扩增(F: AGCAGCAGGTAGC GGAAGAG, R: AATAACGACAGTTGACAGGATTG AATG)。PCR扩增体系包括Premix Taq™ 10 μL,DEPC水6 μL,性别鉴定正反向引物各1 μL,cDNA 2 μL,总体系20 μL。反应程序:95 ℃预变性4 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸5 min。根据扩增条带有无确定实验鱼的遗传性别为雄或雌。
1.4 RNA提取及雌雄基因表达分析使用RNA提取试剂盒(北京聚合美生物科技有限公司, 北京)提取性腺总RNA,采用1%的琼脂糖凝胶电泳检测所提取的总RNA质量,使用酶标仪(Biotek Cytation 5)检测其浓度。使用ToloScript All-in-one RT EasyMix试剂盒(安徽吐露港生物科技有限公司)将1 μg总RNA逆转录为cDNA。逆转录体系为20 μL,反应条件:50 ℃ 5 min,85 ℃ 5 s。cDNA稀释至20%后,使用2×Q3 SYBR qPCR Master mix (ToloBio)试剂和荧光定量仪(ABI QuantStudio6)进行实时荧光定量检测,该反应体系包括10 μL SYBR qPCR Master mix,正反向引物各0.5 μL,ddH2O 7 μL,cDNA 2 μL,总体系20 μL。qPCR程序:预变性95 ℃ 30 s,循环反应包括95 ℃ 10 s,60 ℃ 30 s,共40个循环。以β-actin作为内参基因,采用2–ΔΔCt方法计算定量结果。所用β-actin、amh和cyp19a1a基因引物序列来自姚汶励等(2019) (表 1),引物均由生工生物工程(上海)股份有限公司合成。
|
|
表 1 荧光定量引物序列 Tab.1 Primer for real-time PCR |
所有实验数据均以平均值±标准差(Mean±SD)表示,数据通过SPSS进行单因素方差分析(one-way ANOVA),Duncan´s进行多重比较分析组间差异,P < 0.05表示差异显著。
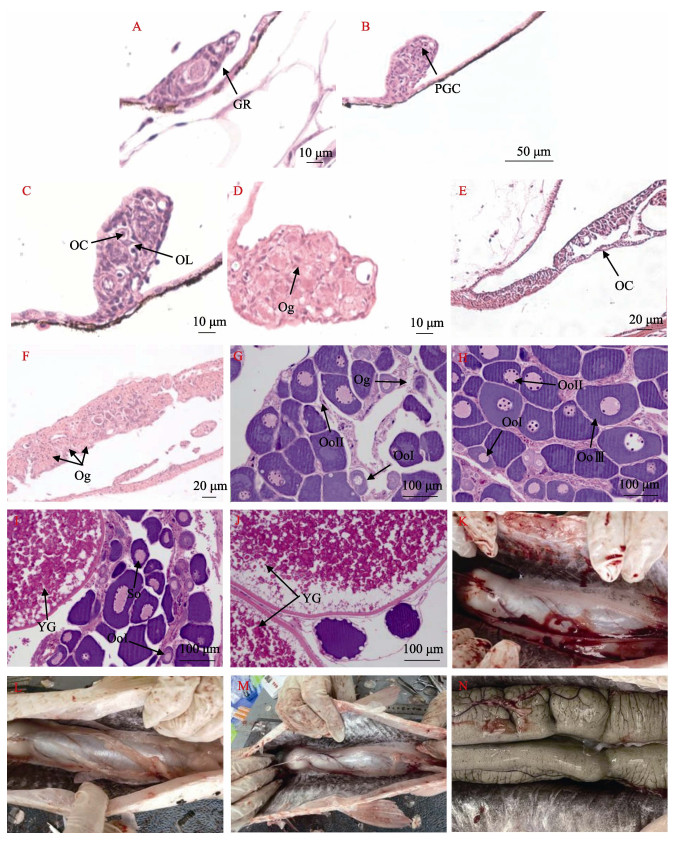
2 结果 2.1 不同月龄草鱼卵巢组织学观察不同月龄草鱼卵巢组织切片结果见图 1。1月龄草鱼出现生殖嵴(图 1A)。2月龄时,生殖嵴中出现原始生殖细胞(图 1B)。3月龄时,卵巢腔和卵巢小叶已形成(图 1C)。4月龄时,卵巢中出现卵原细胞(图 1D)。5月龄时,卵巢继续发育和变大(图 1E)。6月龄时,性腺中卵原细胞数量增多(图 1F),此时卵巢已完全分化。依据刘筠(1993)的卵巢分期标准,12月龄草鱼卵巢处于发育Ⅰ期,卵巢中存在发育变大的卵原细胞和第Ⅱ时相初期的卵母细胞,其体积均比周围体细胞大,细胞内核仁清晰可见,分布在仁膜内缘(图 1G)。24月龄草鱼卵巢处于发育Ⅱ期,以第Ⅱ时相初期细胞为主,也存在第Ⅲ时相初期卵母细胞,由于细胞间相互挤压,形状不规则,细胞质中已积累少量卵黄物质(图 1H)。36月龄草鱼卵巢以次级卵母细胞为主,卵黄颗粒清晰可见,此时卵巢处于发育第Ⅲ期(图 1I)。48月龄草鱼卵巢肥大充盈,内部的卵粒肉眼可见,卵母细胞减少,卵黄颗粒增多,处于发育第Ⅳ期(图 1J)。
|
图 1 草鱼不同时期卵巢结构观察 Fig.1 Observation of ovarian structure in grass carp at different stages A:1月龄草鱼卵巢切片;B:2月龄草鱼卵巢切片;C:3月龄草鱼卵巢切片;D:4月龄草鱼卵巢切片;E:5月龄草鱼卵巢切片;F:6月龄草鱼卵巢切片;G:12月龄草鱼卵巢切片;H:24月龄草鱼卵巢切片;I:36月龄草鱼卵巢切片;J:48月龄草鱼卵巢切片;K:12月龄草鱼卵巢;L:24月龄草鱼卵巢;M:36月龄草鱼卵巢;N:48月龄草鱼卵巢。GR:生殖嵴;PGC:原始生殖细胞;OC:卵巢腔;OL:卵巢小叶;Og:卵原细胞;OoⅠ:第Ⅰ时相卵母细胞;OoⅡ:第Ⅱ时相卵母细胞;OoⅢ:第Ⅲ时相卵母细胞;SO:次级卵母细胞;YG:卵黄颗粒。 A: Ovarian slice of 1-month-old grass carp; B: Ovarian slice of 2-month-old grass carp; C: Ovarian slice of 3-month-old grass carp; D: Ovarian slice of 4-month-old grass carp; E: Ovarian slice of 5-month-old grass carp; F: Ovarian slice of 6-month-old grass carp; G: Ovarian slice of 12-month-old grass carp; H: Ovarian slice of 24-month-old grass carp; I: Ovarian slice of 36-month-old grass carp; J: Ovarian slice of 48-month-old grass carp; K: Ovaries of 12-month-old grass carp; L: Ovaries of 24-month-old grass carp; M: Ovaries of 36-month-old-grass carp; N: Ovaries of 48-month-old grass carp. GR: Genital ridge; PGC: Primitive germ cells; OC: Ovarian cavity; OL: Ovarian lobules; Og: Oogonia; OoⅠ: Phase Ⅰ oocytes; OoⅡ: Phase Ⅱ oocytes; OoⅢ: Phase Ⅲ oocytes; SO: Secondary oocytes; YG: Yolk granules. |
草鱼不同月龄精巢组织切片结果如图 2所示。雄性草鱼在1~3月龄时均未观察到性腺分化的形态学特征(图 2A~C)。4月龄时,草鱼输精导管形成(图 2D)。5月龄时,精巢发育变大,出现精原细胞(Sg)及由精原细胞和结缔组织组成的精小囊(图 2E)。6月龄时,精原细胞数量增多,可以观察到极少量由精原细胞向初级精母细胞过渡的细胞(图 2F)。依据刘筠(1993)的精巢分期标准,1龄内草鱼精巢处于发育第Ⅰ期。12月龄和24月龄草鱼精巢发育均处于第Ⅱ期,二者精巢中均存在精原细胞和初级精母细胞,且12月龄草鱼精巢中以精原细胞为主(图 2G),24月龄草鱼精巢中初级精母细胞较多(图 2H)。36月龄草鱼精巢处于发育第Ⅲ期,在精小囊中可以观察到少量的由次级精母细胞分裂发育而成的精子细胞(图 2I)。48月龄的精巢已达到发育第Ⅳ期,精子细胞明显增多,精小囊破裂,小叶腔中出现成熟精子(图 2J)。

|
图 2 草鱼不同时期精巢结构观察 Fig.2 Observation of the testicular structure of grass carp at different stages A:1月龄草鱼精巢切片; B:2月龄草鱼精巢切片;C:3月龄草鱼精巢切片;D:4月龄草鱼精巢切片;E:5月龄草鱼精巢切片;F:6月龄草鱼精巢切片;G:12月龄草鱼精巢切片;H:24月龄草鱼精巢切片;I:36月龄草鱼精巢切片;J:48月龄草鱼精巢切片;K:12月龄草鱼精巢;L:24月龄草鱼精巢;M:36月龄草鱼精巢;N:48月龄草鱼精巢。ED:输精导管;Sv:精小囊;Sg:精原细胞;PS:初级精母细胞;SS:次级精母细胞;St:精子细胞;Sp:精子;T:精巢。 A: Testis slice of 1-month-old grass carp; B: Testis slice of 2-month-old grass carp; C: Testis slice of 3-month-old grass carp; D: Testis slice of 4-month-old grass carp; E: Testis slice of 5-month-old grass carp; F: Testis slice of 6-month-old grass carp; G: Testis slice of 12-month-old grass carp; H: Testis slice of 24-month-old grass carp; I: Testis slice of 36-month-old grass carp; J: Testis slice of 48-month-old grass carp; K: Testis of 12-month-old grass carp; L: Testis of 24-month-old grass carp; M: Testis of 36-month-old grass carp; N: Testis of 48-month-old grass carp. ED: Efferent duct; Sv: Seminal vesicles; Sg: Spermatogonia; PS: Primary spermatocytes; SS: Secondary spermatocytes; St: Spermoblast; Sp: Sperm; T: Testicle. |
Cyp19a1a在草鱼卵巢中的表达量检测结果如图 3所示。2月龄时cyp19a1a基因表达量开始显著上调(P < 0.05),3月龄时达到第一个峰值,4月龄时该基因表达量有所下降,5月龄时再次显著上调(P < 0.05),6月龄时再次达到峰值。12月龄和24月龄时其表达量有所下降,36月龄时再次显著上调(P < 0.05),48月龄时该基因表达量再次达到峰值。2~48月龄cyp19a1a基因在草鱼卵巢中的表达量均显著高于同期精巢(P < 0.05)。

|
图 3 不同时间段雌雄草鱼性腺cyp19a1a mRNA的相对表达变化 Fig.3 Expression variations of cyp19a1a mRNA in the gonads of male and female grass carp at different periods 不同字母表示各时间段基因表达差异显著(P < 0.05)。下同。 Different letters indicate significant differences in gene expression at different period (P < 0.05). The same below. |
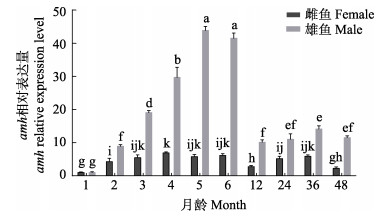
amh在草鱼精巢中的表达量如图 4所示,其随月龄增长总体呈现先上升后下降的趋势。2月龄时amh基因表达量开始显著上调(P < 0.05),5月龄时达到峰值;6月龄时该基因表达量有所下降,但和5月龄时无显著差异(P > 0.05)。12~48月龄基因表达量和2月龄表达量相接近。2~48月龄,amh基因在草鱼精巢中的表达量显著高于同时期卵巢(P < 0.05)。
|
图 4 不同时间段雌雄草鱼性腺amh mRNA的相对表达变化 Fig.4 Expression variations of amh mRNA in the gonads of male and female grass carp at different periods |
与脊椎动物类似,大多数硬骨鱼类性腺最早的表现是生殖嵴的形成,随后原始生殖细胞通过迁移到达生殖嵴形成原始性腺,原始性腺进一步分化为卵巢和精巢(Piprek et al, 2016)。不同鱼类的原始性腺形成时间存在差异,如花鲈(Lateolabrax maculatus)在55日龄时首次观察到原始性腺(李冰玉等, 2021);大黄鱼在20日龄时观察到原始性腺(游秀容等,2012);军曹鱼(Rachycentron canadum)在15日龄时出现原始性腺的雏形(邝杰华等, 2021);鲫鱼(Carassius auratus) (岳敏娟等, 2009)的原始性腺则于16日龄形成。本研究中,1月龄草鱼在腹腔膜附近初次观察到生殖嵴。2月龄时在生殖嵴中可以观察到原始生殖细胞,标志着原始生殖细胞完成迁移,原始性腺正式形成,比同是鲤科的鲫鱼晚了大约44 d。结果表明,1~2月龄是草鱼原始生殖细胞向生殖嵴迁移的关键时期。
原始性腺的形态变化也是研究鱼类性腺分化的重要特征之一,在大西洋鲑(Salmo salar)中,原始性腺横切面为圆形的普遍为雌鱼,横切面为三角形的普遍为雄鱼(赵维信等, 1994);革胡子鲶(Clarias gariepinus)原始性腺横切面呈梨形的普遍为雌性,横切面呈细条状的普遍为雄性(林光华等, 1995)。本研究中,生殖嵴形状为梨形且内部生殖细胞数量较多的为雌鱼,生殖嵴形状为椭圆状且生殖细胞数量较少的为雄鱼。这与军曹鱼(邝杰华等, 2021)、大菱鲆(Scophthalmus maximus) (Zhao et al, 2017)、青鳉(Oryzias latipes) (Saito et al, 2007)原始性腺的形态变化相似。
3.2 草鱼性腺发育的组织学研究在大多数硬骨鱼类中,性腺分化时间是确定使用外源性激素性逆转成功的关键因素之一(Arslan et al, 2009),因此,确定鱼类性腺分化时间可为鱼类激素诱导性逆转研究提供基础资料。硬骨鱼类性腺分化包括解剖学分化和细胞学分化,解剖学分化的标志为性腺的形态结构发生变化,细胞学分化的标志为性腺中出现性母细胞(Strüssmann et al, 2002)。一般情况下,鱼类性腺的解剖学分化早于细胞学分化(Li et al, 2024),如大口黑鲈(Micropterus salmoides)解剖学分化开始于20日龄,细胞学分化开始于30日龄(Du et al, 2022)。同种鱼类雌雄性腺分化时间也有差异,大部分鱼类卵巢分化早于精巢,如黄颡鱼卵巢分化最早出现于13日龄,而精巢分化则开始于55日龄(彭丽娜等, 2014)。也有部分鱼类精巢分化早于卵巢,如牙鲆(Paralichthys olivaceus)在50日龄精巢开始分化,65日龄时卵巢才开始分化(孙朝徽等, 2008)。黄河鲤(Cyprinus carpio)雌性性腺分化的起始时间为50~55日龄,雄性为90~100日龄(Jiang et al, 2020)。本研究中,卵巢腔和输精导管等解剖学分化标志分别在3月龄和4月龄出现,比黄河鲤晚1个月左右。草鱼性腺中卵原细胞和精原细胞等细胞学分化标志分别在4月龄和5月龄出现,表明草鱼同大多数硬骨鱼类一样,性腺的解剖学分化早于细胞学分化,且雌性性别分化时间早于雄性。
鱼类完成性腺分化后,其性腺逐步发育至成熟。依据鱼类性腺的分期标准,可将草鱼卵巢和精巢分为6个时期。Ⅰ期卵巢主要以卵原细胞为主,Ⅱ期卵巢主要以初级卵母细胞和少量卵原细胞为主,Ⅲ期卵巢以次级卵母细胞为主,Ⅳ期卵巢可观察到成熟的卵母细胞和卵黄颗粒,Ⅴ期卵巢为产卵后的卵巢,Ⅵ期卵巢中可观察到退化后的卵细胞。Ⅰ期精巢以输精管原基和少量精原细胞为主,Ⅱ精巢以精原细胞和少量初级精母细胞为主,Ⅲ期精巢以初级精母细胞和少量精子细胞为主,Ⅳ期精巢以大量精子细胞为主,小叶腔内可见少量成熟的精子,Ⅴ期精巢小叶腔内存在大量成熟的精子,Ⅵ期精巢为产后的精巢(刘筠, 1993)。在本研究雌性草鱼的性腺组织切片中,12月龄观察到发育变大的卵原细胞;24月龄观察到初级卵母细胞;36月龄观察到次级卵母细胞,卵黄颗粒清晰可见;48月龄观察到成熟的卵母细胞。在雄性草鱼的性腺组织切片中,12月龄时以精原细胞为主,24月龄时以初级精母细胞为主,36月龄可以观察到少量精子细胞;48月龄时精小囊破裂,小叶腔中出现成熟精子,由此可知,12、24、36和48月龄草鱼卵巢分别处于发育的第Ⅰ、Ⅱ、Ⅲ和Ⅳ期,精巢则分别处于发育的第Ⅱ、Ⅱ、Ⅲ和Ⅳ期。至48月龄时,华南地区雌雄草鱼性腺均已发育成熟。
3.3 性别特征基因cyp19a1a和amh的表达分析cyp19a1a基因是调控雌激素的关键因子之一,在鱼类卵巢发育过程中发挥重要作用(Paixão et al, 2022)。本研究结果显示,cyp19a1a基因在草鱼卵巢中的表达总体呈先上升后下降再上升的趋势,这与尼罗罗非鱼(Oreochromis niloticus)(Wen et al, 2013)卵巢中的表达模式相似。2、3月龄雌性草鱼性腺中cyp19a1a基因的表达量均呈显著升高趋势,且该时期组织切片中结果显示草鱼雌性性腺由原始性腺逐渐分化形成卵巢腔,表明cyp19a1a基因可能参与卵巢腔的形成过程。6月龄时,草鱼卵巢中卵原细胞大量增殖,此时该基因表达量达到峰值,表明cyp19a1a基因表达水平可能对卵原细胞的增殖具有促进作用。cyp19a1a基因在48月龄时表达量最高,此时草鱼卵巢已发育至Ⅳ期。该结果与黑鲷(Acanthopagrus schlegelii) (Liu et al, 2004)中的研究结果相似,推断cyp19a1a基因可能参与卵巢成熟过程。
amh基因可促进生殖细胞增殖与分化,在鱼类精巢分化过程中具有重要作用,在精巢分化阶段持续高表达(韩玉龙, 2019)。本研究雄性草鱼性腺中amh基因表达水平从2月龄时开始持续上调,5月龄草鱼精巢中可观察到精原细胞,此时amh基因表达水平达到峰值。这与amh基因在半滑舌鳎(Cynoglossus semilaevis) (刘姗姗等, 2013)和斑马鱼(Danio rerio) (Rodr et al, 2005)早期性腺组织中的表达规律相似,表明amh基因可能参与草鱼精原细胞的发生。也有研究表明,amh基因表达于未成熟精巢的支持细胞中,直至精巢成熟(Chen et al, 2014)。本研究中,草鱼amh基因表达量在6月龄后显著下降,并保持低表达至精巢成熟。大黄鱼(林爱强等, 2017)和大西洋鲑(Maugars et al, 2008)的研究中也发现了类似现象,amh基因在大西洋鲑未成熟的精巢中持续高表达,至精子快速增殖时该基因表达量开始显著下降,在精巢中精子量最多时表达量为最低。这可能是amh基因在抑制精子发生过程中也发挥了重要作用(Chen et al, 2014)。
4 结论本研究以不同月龄草鱼为研究对象,通过组织切片技术观察不同时期草鱼性腺结构变化,并结合荧光定量技术分析性别特征基因的表达,明确了草鱼性腺发育启动时间约为2月龄,雌雄性腺分化时间分别约为3月龄和4月龄,至6月龄时雌雄草鱼性腺均已完全分化。12、24、36和48月龄草鱼卵巢分别处于发育第Ⅰ、Ⅱ、Ⅲ和Ⅳ期,精巢则分别为发育第Ⅱ、Ⅱ、Ⅲ和Ⅳ期。研究结果不仅丰富了草鱼的繁殖生理学资料,也为激素诱导草鱼性别逆转技术研究提供了参考依据。
ARSLAN T, PHELPS R P, OSBORNE J A. Effects of oestradiol-17β or 17α-methyltestosterone administration on gonadal differentiation of largemouth bass Micropterus salmoides (Lacepède). Aquaculture Research, 2009, 40(16): 1813-1822 DOI:10.1111/j.1365-2109.2009.02286.x |
BLAZQUEZ M, GONZALEZ A, PAPADAKI M, et al. Sex-related changes in estrogen receptors and aromatase gene expression and enzymatic activity during early development and sex differentiation in the European sea bass (Dicentrarchus labrax). General and Comparative Endocrinology, 2008, 158(1): 95-101 DOI:10.1016/j.ygcen.2008.06.001 |
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2023. Beijing: China Agriculture Press, 2023 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴. 北京: 中国农业出版社, 2023]
|
CHEN Y P, WU W H, WU H M, et al. Effects of anti-Müllerian hormone and follicle stimulating hormone levels on in vitro fertilization pregnancy rate. Taiwan Journal of Obstetrics and Gynecology, 2014, 53(3): 313-316 DOI:10.1016/j.tjog.2013.06.012 |
DU J, ZHOU J, LI S, et al. Timing of early gonadal differentiation and effects of estradiol-17β treatments on the sex differentiation in largemouth bass (Micropterus salmoides). Fish Physiology and Biochemistry, 2022, 48(3): 805-815 DOI:10.1007/s10695-022-01074-4 |
FAJKOWSKA M, OSTASZEWSKA T, RZEPKOWSKA M. Review: Molecular mechanisms of sex differentiation in sturgeons. Reviews in Aquaculture, 2020, 12(2): 1003-1027 DOI:10.1111/raq.12369 |
HAN Y L. The mechanism of the role of amh genes in gender differentiation of Epinephelus obliquus. Doctoral Dissertation of Sun Yat-sen University, 2019 [韩玉龙. amh基因在斜带石斑鱼性别分化中的作用机制研究. 中山大学博士研究生学位论文, 2019]
|
JIANG M, JIA S, CHEN J, et al. Timing of gonadal development and dimorphic expression of sex-related genes in gonads during early sex differentiation in the Yellow River carp. Aquaculture, 2020, 518: 734825 DOI:10.1016/j.aquaculture.2019.734825 |
KANG A, BAO H Y, YU C T, et al. Potential role of Anti-Müllerian hormone in regulating seasonal reproduction in animals: The example of males. International Journal of Molecular Sciences, 2023, 24(6): 5874-5874 DOI:10.3390/ijms24065874 |
KUANG J H, CHEN G, MA Q, et al. Histological observation on gonadal differentiation and first annual gonadal development of cobia (Rachycentron canadum). Haiyang Xuebao, 2021, 43(8): 128-138 [邝杰华, 陈刚, 马骞, 等. 军曹鱼(Rachycentron canadum)性腺分化及首周年发育的组织学观察. 海洋学报, 2021, 43(8): 128-138] |
LI B Y, WEN H S, WANG L Y, et al. Histological of gonadal differentiation and expression analysis of sex-related genes cyp11b and cyp19a1a in spotted sea bass (Lateolabrax maculatus). Progress in Fishery Sciences, 2021, 42(6): 185-193 [李冰玉, 温海深, 王灵钰, 等. 花鲈性腺分化组织学及性别相关基因cyp11b和cyp19a1a的表达分析. 渔业科学进展, 2021, 42(6): 185-193] |
LI C, LI Y, QIN C, et al. Determination of the timing of early gonadal differentiation in silver pomfret, Pampus argenteus. Animal Reproduction Science, 2024, 261: 107373 DOI:10.1016/j.anireprosci.2023.107373 |
LI Y J, WU L M, LI X J. A review on the genes related with sex determination and differentiation in teleosts. Journal of Henan Normal University (Natural Science), 2017, 45(4): 72-78 [李永婧, 吴利敏, 李学军. 硬骨鱼类性别决定与分化相关基因研究进展. 河南师范大学学报(自然科学版), 2017, 45(4): 72-78] |
LIN A Q, XIE Y J, XU S B, et al. Cloning and expression profiling of gsdf and amh genes in large yellow croaker (Larimichthys crocea). South China Fisheries Science, 2017, 13(6): 1-13 [林爱强, 谢仰杰, 徐双斌, 等. 大黄鱼gsdf和amh基因的克隆及表达分析. 南方水产科学, 2017, 13(6): 1-13] |
LIN G H, XIONG J W. Studies on the differentiation and development in the first sex-cycle of the ovary of Clarias lazera. Zoological Research, 1995, 6(4): 366-372 [林光华, 熊敬维. 革胡子鲇卵巢在第一次性周期内分化与发育的研究. 动物学研究, 1995, 6(4): 366-372] |
LIU S S, SUN B, LIANG Z, et al. Cloning and expression of anti-Müllerian hormone gene in halfsmooth tongue-sole, Cynoglossus semilaevis. Journal of Fishery Sciences of China, 2013, 20(1): 35-43 [刘姗姗, 孙冰, 梁卓, 等. 半滑舌鳎抗缪勒氏管激素(AMH)基因的克隆及组织表达分析. 中国水产科学, 2013, 20(1): 35-43] |
LIU X, LIANG B, ZHANG S. Sequence and expression of cytochrome P450 aromatase and FTZ-F1 genes in the protandrous black porgy (Acanthopagrus schlegeli). General and Comparative Endocrinology, 2004, 138(3): 247-254 DOI:10.1016/j.ygcen.2004.04.005 |
LIU Y. Reproductive physiology of Chinese cultivated fish. Beijing: Agricultural Publishing House, 1993: 197 [刘筠. 中国养殖鱼类繁殖生理学. 北京: 农业出版社, 1993: 197]
|
MAUGARS G, SCHMITZ M. Changes in expression profiles of genes related to sexual maturation during spermatogenesis in testesof early-maturing male Atlantic salmon parr, Salmo salar. Cybium, 2008, 32(2): 167-168 |
PAIXÃO R V, SILVA G F, CAETANO A R, et al. Phylogenomic and expression analysis of Colossoma macropomum cyp19a1a and cyp19a1b and their non-classical role in tambaqui sex differentiation. Gene, 2022, 843: 146795 DOI:10.1016/j.gene.2022.146795 |
PENG L N, LU J G, LUAN P X, et al. Observation on gonadal differentiation in Pelteobagrus fulvidraco. Chinese Journal of Fisheries, 2014, 27(3): 48-51 [彭丽娜, 卢建国, 栾培贤, 等. 黄颡鱼(Pelteobagrus fulvidraco)性腺分化的组织学观察. 水产学杂志, 2014, 27(3): 48-51] |
PIPREK R P, KLOC M, KUBIAK J Z. Early development of the gonads: Origin and differentiation of the somatic cells of the genital ridges. Results and Problems in Cell Differentiation, 2016, 58: 1-22 |
RODR GUEZ-MAR A, YAN Y L, BREMILLER R A, et al. Characterization and expression pattern of zebrafish antiMüllerian hormone amh relative to sox9a, sox9b and cyp19a1a, during gonad development. Gene Expression Patterns, 2005, 5(5): 655-667 DOI:10.1016/j.modgep.2005.02.008 |
SAITO D, MORINAGA C, AOKI Y, et al. Proliferation of germ cells during gonadal sex differentiation in medaka: Insights from germ cell-depleted mutant zenzai. Developmental Biology, 2007, 310(2): 280-290 DOI:10.1016/j.ydbio.2007.07.039 |
STRÜSSMANN C A, NAKAMURA M. Morphology, endocrinology and environmental modulation of gonadal sex differentiation in teleost fishes. Fish Physiology and Biochemistry, 2002, 26(1): 13-29 DOI:10.1023/A:1023343023556 |
SUDHAKUMARI C C, SENTHILKUMARAN B, KOBAVASHI T, et al. Ontogenic expression patterns of several nuclear receptors and cytochrome P450 aromatases in brain and gonads of the Nile tilapia Oreochromis niloticus suggests their involvement in sex differentiation. Fish Physiology and Biochemistry, 2005, 31(2/3): 129-135 |
SUN C H, LIU H J, SI F, et al. Histological observation of gonadal differentiation in cultured Japanese flounder Paralichthys olivaceus. Journal of Dalian Fisheries University, 2008, 23(6): 451-454 [孙朝徽, 刘海金, 司飞, 等. 养殖牙鲆性腺分化的组织学观察. 大连水产学院学报, 2008, 23(6): 451-454] |
WANG M, CHEN L, ZHOU Z, et al. Comparative transcriptome analysis of early sexual differentiation in the male and female gonads of common carp (Cyprinus carpio). Aquaculture, 2023, 563: 738984 DOI:10.1016/j.aquaculture.2022.738984 |
WANG J, WEN C G, ZHAO Y, et al. The prokaryotic expression and protein purification of Nile tilapia cyp19a1a gene. Progress in Fishery Sciences, 2014, 35(4): 45-50 [王金, 文春根, 赵燕, 等. 尼罗罗非鱼(Oreochromis niloticus) cyp19a1a原核表达与蛋白纯化. 渔业科学进展, 2014, 35(4): 45-50] |
WANG Y P, LU Y, ZHANG Y, et al. The draft genome of the grass carp (Ctenopharyngodon idellus) provides insights into its evolution and vegetarian adaptation. Nature Genetics, 2015, 47(6): 625-631 DOI:10.1038/ng.3280 |
WEN J T, JING Y, LIN Y Z, et al. Characterization of gonadal transcriptomes from Nile tilapia (Oreochromis niloticus) reveals differentially expressed genes. PLoS One, 2013, 8(5): e63604 DOI:10.1371/journal.pone.0063604 |
YAN T, CAI Y, HE J, et al. Characterization and expression profiles of cyp19a1a in the schizothoracine fish Schizothorax prenanti. Tissue and Cell, 2019, 58: 70-75 |
YANO A, GUYOMARD R, NICOL B, et al. An immune-related gene evolved into the master sex-determining gene in rainbow trout, Oncorhynchus mykiss. Current Biology, 2012, 22(15): 1423-1428 |
YAO W L, JIANG P, BAI J J, et al. Analysis of differential expressed genes between male and female gonads of grass carp (Ctenopharyngodon idellus) based on high throughput transcriptome group sequencing. Genomics and Applied Biology, 2019, 38(9): 3901-3911 [姚汶励, 姜鹏, 白俊杰, 等. 基于高通量转录组测序的草鱼雌雄性腺差异表达基因分析. 基因组学与应用生物学, 2019, 38(9): 3901-3911] |
YOU X R, CAI M Y, JIANG Y H, et al. Histological observation of gonadal sex differentiation in large yellow croaker (Larimichthys crocea). Journal of Fisheries of China, 2012, 36(7): 1057-1064 [游秀容, 蔡明夷, 姜永华, 等. 大黄鱼性腺性别分化的组织学观察. 水产学报, 2012, 36(7): 1057-1064] |
YUE M J, YOU Y L, LIN D J. The influence of temperature on sex differentiation of Carassius auratus. Chinese Journal of Zoology, 2009, 44(1): 9-16 [岳敏娟, 尤永隆, 林丹军. 温度对鲫鱼性腺分化的影响. 动物学杂志, 2009, 44(1): 9-16] |
ZHAO C Y, XU SH H, LIU Y F, et al. Gonadogenesis analysis and sex differentiation in cultured turbot (Scophthalmus maximus). Fish Physiology and Biochemistry, 2017, 43(1): 265-278 |
ZHAO W X, HARACHE Y, LIU L Y. Gonadal differentiation and effects of heat shock in Atlantic salmo (Salmo salar). Chinese Journal of Fisheries, 1994, 7(2): 1-5 [赵维信, HARACHE Y, 刘丽燕. 大西洋鲑性腺分化及热休克的影响. 水产学杂志, 1994, 7(2): 1-5] |



