2. 广西壮族自治区海洋研究所 广西海洋生物技术重点实验室 北海 536000
2. Guangxi Institute of Oceanology, Key Laboratory of Marine Biotechnology of Guangxi, Beihai 536000
大黄鱼 (Larimichthys crocea) 是目前我国产量第一的海水养殖鱼类,2014年的养殖产量为12.79万t (中国渔业统计年鉴, 2015)。在其养殖生产过程中,常遇到分鱼、换网、台风和水温变化等应激条件,导致饲料利用率降低、疾病易发、死亡率增加和生长减缓等不利现象的发生,甚至会造成重大经济损失。提高大黄鱼的抗应激能力对于大黄鱼的养殖生产有着重要意义。
牛磺酸、脯氨酸、谷氨酰胺和甘氨酸等一些非必需氨基酸及其代谢物对体内一些关键代谢途径起到重要的调控作用,这对于维持生命、生长、摄食、营养利用、免疫和繁殖都是必需的,并且对于机体抵御环境应激和各种病原生物也同样重要 (Li et al, 2009; Wu et al, 2011、2013; Wang et al, 2013)。甘氨酸是中枢神经系统中的神经递质,调节动物行为、食物摄入量和全身的平衡 (Rajendra et al, 1997)。同时,通过白细胞和巨噬细胞中的甘氨酸门控氯离子通道,甘氨酸能够调控细胞内Ca2+水平,调节细胞因子和超氧化物的产生以及免疫功能 (Zhong et al, 2003)。尽管甘氨酸的轻微不足不会危及生命,但长期缺乏会导致次优生长、降低免疫力以及其他对营养代谢和健康不利的影响 (Matilla et al, 2002; de Koning et al, 2003; Lewis et al, 2005)。
关于甘氨酸在水产动物饲料中应用的研究较少。Xie等 (2014)确定以增重率为评价指标,初始体重为0.61 g左右的凡纳滨对虾 (Litopenaeus vannamei) 饲料中甘氨酸的适宜含量为2.54%。本研究拟通过分析饲料中不同含量的甘氨酸对大黄鱼抗氧化和抗应激反应的影响,为甘氨酸在大黄鱼配合饲料中的应用提供基础数据。
1 材料与方法 1.1 实验饲料采用单因素实验设计,以鱼粉和豆粕为主要蛋白源,小麦粉为主要糖源,鱼油和大豆卵磷脂为主要脂肪源,同时添加维生素混合物、矿物质混合物和诱食剂等,配制成含粗蛋白约46%、粗脂肪约12%的基础饲料 (表 1)。以大黄鱼体氨基酸含量为参考,添加晶体氨基酸,使基础饲料中各必需氨基酸含量达到大黄鱼体中的含量 (表 2)。并在此基础上,分别添加0、0.6%、1.2%、2.4%、4.8%和6.0%的甘氨酸 (饲料甘氨酸实测含量为1.58%、2.15%、2.75%、3.96%、6.33%、7.51%),配制成6组实验饲料。各组饲料中氨基酸组成分析结果见表 2。
|
|
表 1 饲料配方及其营养成分 (%干重) Table 1 Ingredients and proximate composition of the experimental diets (% dry weight) |
|
|
表 2 各组饲料的氨基酸组成分析 (%干重) Table 2 Amino acid composition of the diets (% dry weight) |
实验大黄鱼是购于福建省宁德市富发水产有限公司的同一批鱼苗,用基础饲料投喂驯化14 d,使之逐渐适应实验饲料和养殖环境。挑选体格健壮、规格一致,初始体重为 (130.35±8.37) g的大黄鱼麻醉后随机分配到18个网箱 (2 m×2 m×2.5 m) 中,每个网箱50尾鱼。
养殖实验在海上浮式网箱中进行,每种饲料按照随机分组投喂3个网箱 (即1个处理组3个重复)。每天05:00和17:00饱食投喂2次,并记录大黄鱼存活情况。养殖实验共进行30 d。
1.3 样品采集养殖实验结束时,饥饿大黄鱼24 h,随后从每个网箱随机捞取5尾鱼,麻醉后快速采集血液,并在冰块上静置12 h,于4℃以3000 r/min离心10 min,所得血清置于-80℃冻存备用。采血后的实验鱼解剖,取肝脏、肠、肌肉,液氮速冻,-80℃保存。
1.4 应激实验养殖实验结束时,先进行应激前样品采集,然后进行拖网应激实验,即拖网让养殖网箱中所有大黄鱼刚好离开水面,空气暴露10 s,再把网放下让鱼在水中10 s后再提起,重复操作3次,30 min后取血样 (Benfey et al, 2000)。
1.5 样品分析饲料原料及饲料中粗蛋白含量采用凯氏定氮法测定,粗脂肪含量采用索氏抽提法测定,肝脏组织蛋白含量采用考马斯亮蓝法测定,饲料甘氨酸含量选用酸水解法测定 (日立8900全自动氨基酸测定仪)。
总抗氧化力 (Total anti-oxidative capacity, T-AOC)、丙二醛 (Malondialdehyde, MDA)、过氧化氢酶 (Catalase, CAT) 活性、超氧化物歧化酶 (Superoxide dismutase, SOD) 活性、谷胱甘肽过氧化物酶 (Glutathion peroxidase, GSH-PX) 活性、谷草转氨酶 (Glutamic oxalacetic transaminase, GOT) 活性和谷丙转氨酶 (Glutamic-pyruvic transaminase, GPT) 活性、血清中皮质醇 (Cortisol) 含量等采用南京建成生物工程研究所生产的试剂盒进行测定。血清葡萄糖 (Glucose) 的测定选用己糖激酶法 (费维伦等, 2012),使用仪器为日立全自动生化分析仪 (HITACHI7600)。
肝脏匀浆液中CAT酶活力的定义:每毫克组织蛋白每秒分解1 μmol的H2O2的量为1个活力单位 (U/mg prot)。
肝脏匀浆液中SOD酶活力的定义:每毫克组织蛋白在1 ml反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位 (U/mg prot)。
肝脏匀浆液中T-AOC的定义:在37℃时,每分钟每毫克组织蛋白使反应体系的吸光度 (OD) 值每增加0.01时,为1个总抗氧化能力单位 (U/mg prot)。
肝脏匀浆液中GSH-PX酶活力的定义:每毫克组织蛋白每分钟扣除非酶促反应作用,使反应体系中GSH浓度降低1 μmol/L为1个酶活力单位 (U/mg prot)。
肝脏匀浆液和血清中GOT、GPT酶活力定义:在温度25℃、pH 7.4、波长340 nm、光径1 cm的条件下,1 ml血清使NADH的吸光度下降0.001的转氨酶活性为1个卡门氏单位,卡门氏单位用物质的吸光度表示酶的活力单位。
1.6 数据分析数据采用平均值±标准误 (Mean±SE) 表示。用SPSS 17.0进行单因素方差分析 (One-way ANOVA),差异显著后 (P < 0.05),采用Tukey检验进行多重比较。用t检验检测应激前后的变化。根据T-AOC数据,利用二次曲线模型确定大黄鱼饲料中甘氨酸的适宜含量。
2 结果 2.1 存活单因素方差分析显示,各处理组中大黄鱼存活率 (%) 依次为88.85±5.60、82.22±1.66、88.24±1.77、92.85±4.23、90.67±3.84和84.04±3.86,差异不显著 (P > 0.05)。
2.2 抗氧化反应大黄鱼抗氧化反应的结果见表 3。饲料中甘氨酸含量分别为2.15%和2.75%时,显著提高了肝脏SOD活性,且与饲料甘氨酸含量3.96%组差异不显著 (P > 0.05),并在饲料甘氨酸含量为2.75%时取得最大值291.12 U/mg prot (P < 0.05)。饲料中甘氨酸含量为2.75%和3.96%时,显著提高了肝脏CAT活性 (P < 0.05),并在2.75%甘氨酸组取得最大值。饲料中甘氨酸含量为3.96%时,肝脏中MDA水平显著降低 (P < 0.05),且与饲料甘氨酸含量为2.75%组差异不显著 (P > 0.05)。肝脏T-AOC水平在饲料甘氨酸含量为2.75%时取得最大值 (P < 0.05)。各处理组中肝脏GSH-PX活性差异不显著 (P > 0.05)。
|
|
表 3 饲料中不同甘氨酸含量对大黄鱼肝脏抗氧化反应的影响 Table 3 Effects of different dietary glycine levels on anti-oxidative responses in the liver of large yellow croaker |
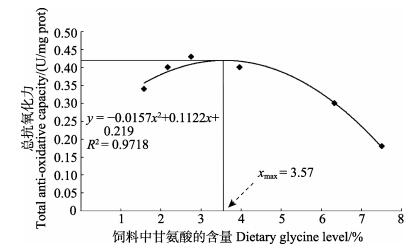
以饲料甘氨酸含量为横坐标、大黄鱼的肝脏T-AOC水平为纵坐标,经二次曲线回归分析得:y =-0.0157x2 +0.1122x +0.219,R2; = 0.9718。以T-AOC为评价指标,经计算得出大黄鱼饲料中甘氨酸的适宜含量为3.57% (图 1)。
|
图 1 饲料中甘氨酸含量与肝脏总抗氧化力水平的关系 Figure 1 Relationship between hepatic total anti-oxidative capacity and dietary glycine level |
大黄鱼抗拖网应激反应的结果见表 4。拖网应激前,饲料中甘氨酸含量为2.75%和3.96%时,血糖含量显著高于对照组 (P < 0.05)。拖网应激后,各处理组大黄鱼血糖含量差异不显著 (P > 0.05)。分析同一处理组拖网应激前后血糖含量的变化后发现:饲料甘氨酸含量为2.75%和3.96%时,拖网应激前后血糖含量差异不显著 (P > 0.05)。其他各处理组拖网应激后血糖含量显著高于应激前 (P < 0.05)。
|
|
表 4 饲料中不同甘氨酸含量对大黄鱼抗拖网应激反应的影响 Table 4 Effects of different dietary glycine levels on anti-stress responses of large yellow croaker |
拖网应激前,饲料甘氨酸含量为2.75%时,血清中皮质醇含量显著高于对照组 (P < 0.05)。拖网应激后,饲料甘氨酸含量为2.75%和3.96%时,血清皮质醇含量显著低于对照组 (P < 0.05)。分析同一处理组大黄鱼在拖网应激前后血清皮质醇含量的变化后发现:饲料甘氨酸含量为2.75%时,拖网应激前后血清皮质醇含量差异不显著 (P > 0.05),其他各处理组拖网应激后血清皮质醇含量显著高于应激前 (P < 0.05)。
2.4 鱼体成分分析大黄鱼体成分分析数据见表 5。饲料中甘氨酸的含量对大黄鱼水分、粗蛋白、粗脂肪和灰分的影响不显著 (P > 0.05)。
|
|
表 5 饲料中不同甘氨酸含量对大黄鱼体常规指标的影响 Table 5 Effects of different dietary glycine levels on the body composition of large yellow croaker |
大黄鱼肝脏和血清GOT和GPT活性数据见表 6。饲料中不同甘氨酸含量对肝脏GOT和GPT的活性没有显著影响 (P > 0.05)。血清GOT和GPT活性均在饲料甘氨酸含量为2.75%时取得最小值 (P < 0.05),分别为6.70和3.38 U/L。与对照组相比,7.51%甘氨酸组血清GOT水平显著升高 (P < 0.05)。
|
|
表 6 饲料中不同甘氨酸含量对大黄鱼肝脏和血清转氨酶活性的影响 Table 6 Effects of different dietary glycine levels on activity of transaminase in liver and serum of large yellow croaker |
由于甘氨酸不是鱼类的必需氨基酸,有关甘氨酸在养殖鱼类中营养作用的研究并不多。在以往的一些鱼类必需氨基酸需求量的研究中,需要配制含不同浓度梯度的必需氨基酸的系列饲料,常使用甘氨酸等非必需氨基酸来调节饲料的总氮含量。如Zhou等 (2006)在研究军曹鱼 (Rachycentron canadum) 饲料中蛋氨酸的需求量时,采用甘氨酸、天冬氨酸和谷氨酸调节饲料中总氮含量;Zhang等 (2008)在确定大黄鱼饲料中赖氨酸需求量时,采用谷氨酸来调节饲料中的总氮含量。这样进行实验设计的前体假设是:甘氨酸等非必需氨基酸,鱼体内自身能够合成并能满足正常生理需要,饲料中甘氨酸的含量在一定范围变动,对养殖鱼类的生长和存活等不会产生显著的影响。本研究30 d的养殖实验结果表明,饲料中甘氨酸的含量在1.58%-7.51%的范围内变动时,对大黄鱼幼鱼的存活和生长都没有显著影响。
然而,从抗氧化和抗应激的角度来分析,本研究发现饲料中不同含量的甘氨酸对养殖大黄鱼产生了显著影响。
3.1 饲料中添加甘氨酸对大黄鱼肝脏抗氧化能力的影响SOD、CAT和GSH-PX是机体内抗氧化酶系统的重要组成酶,T-AOC水平反映机体抗氧化酶系统和非酶促系统对外界刺激的代偿能力及机体自由基代谢状态,而MDA含量常用来表示脂质过氧化水平的高低,间接反映出体内自由基水平的变化情况 (周显青等, 2003; 赵敏等, 2015)。
本研究结果显示,饲料中2.75%的甘氨酸显著提高了大黄鱼肝脏CAT和SOD的活性,显著降低了肝脏MDA含量,且肝脏T-AOC水平在饲料甘氨酸含量为2.75%时取得最大值。当以T-AOC为评价指标,得出大黄鱼饲料甘氨酸的适宜含量为3.57%。类似的研究结果在凡纳滨对虾和陆生脊椎动物中也有发现 (Wang et al, 2013; Xie et al, 2014; Ito et al, 2008; Wijekoon et al, 2004; Yin et al, 2002)。由于甘氨酸在鱼类中的营养作用研究甚少,目前没有直接相关数据来解释本研究中所发现的甘氨酸在大黄鱼体内表现出的抗氧化功能。然而,甘氨酸是机体内抗氧化系统中的内源性抗氧化剂—还原型谷胱甘肽 (Reduced glutathione, GSH) 的组成氨基酸,其抗氧化作用可能是通过提高GSH的合成量而实现,而GSH的含量与GSH-PX的活性密切相关,共同参与体内自由基的代谢调节。从分子水平上来看,Sheth等 (2011)研究表明,甘氨酸对机体氧化损伤的保护机制可能是:甘氨酸受体被激活,引发了氯离子的内流和随后的膜超极化,从而维持细胞的能量生成,降低了氧化损伤。
3.2 饲料中添加甘氨酸对大黄鱼抗应激能力的影响鱼类遭受应激源刺激时,血清中皮质醇含量会显著升高,进而促进血糖含量增加,血糖的增加为肌肉和神经提供更多能量,使得鱼类适应应激环境。因此,血清中葡萄糖和皮质醇含量的变化是评价鱼类抗应激能力的重要指标 (Fanouraki et al, 2011; Millán-Cubillo et al, 2016)。
本研究中,饲料甘氨酸含量为2.75%时,在拖网应激前,大黄鱼血清皮质醇的含量最高,而在拖网应激后,该饲料处理组的大黄鱼的血清皮质醇的变化幅度最小,且与应激前相比,没有发生显著变化。同时,血糖维持在一个稳定的水平。由此表明,饲料甘氨酸的含量为2.75%时,有利于保持大黄鱼较强的抗应激能力。在水生动物中,Xie等 (2014)研究发现,饲料中添加2.58%的甘氨酸,能够显著提高凡纳滨对虾的抗盐度突变应激能力。甘氨酸在其他鱼类中抗应激作用的研究还未见报道。目前,还未有可用于解释甘氨酸在鱼虾体内提高抗应激能力现象的直接数据,需要进一步研究。在陆生脊椎动物中的相关研究结果认为,饲料中添加甘氨酸可提高机体抗应激能力的原因可能是:(1) 甘氨酸本身为生糖氨基酸,同时在体内甘氨酸还会转化为丝氨酸、谷氨酸和丙氨酸等生糖氨基酸。机体受到刺激后,与应激密切相关的生糖氨基酸浓度会升高,糖异生作用增强,以补充应激时的能量需求 (Matthews et al, 1981; 吴艳等, 2008)。(2) 在动物消化道内,甘氨酸可与多种微量元素螯合成结构比较稳定的有机微量元素,可有效提高动物对矿物质的利用率,增强抗应激能力 (Dean et al, 2006; Tan et al, 2001;马文强等, 20101))。
1) Ma WQ. Research on intestinal absorption characteristics of iron glycine chelate and its biological effects. Doctoral Dissertation of Zhejiang University, 2010, 1-151 [马文强.甘氨酸亚铁螯合物的肠道吸收特点及其生物学效应研究.浙江大学博士研究生学位论文, 2010, 1-151]
由此可见,饲料中添加适量甘氨酸可以有效提升大黄鱼的抗氧化和抗应激能力。然而,Mertz等 (1952)在猪的研究中表明,过量的甘氨酸会造成饲料中氨基酸不平衡,甚至会产生毒性,对肝脏造成损伤。在肝脏受到损伤或坏死时,血清中谷草转氨酶 (GOT) 和谷丙转氨酶 (GPT) 的活性会显著增强,因此,GOT、GPT可作为判断肝脏受损伤程度的重要指标 (Wang et al, 2005)。本研究结果显示,各处理组肝脏GOT和GPT水平差异不显著,血清GOT和GPT水平均在饲料甘氨酸含量为2.75%时取得显著最小值。由此可见,饲料中添加适量的甘氨酸对大黄鱼肝脏没有损伤作用。但当饲料的甘氨酸含量达到7.51%时,血清GOT水平显著升高,说明过量甘氨酸可能对大黄鱼肝脏造成了一定的损伤,然而,本研究缺乏肝脏组织观察等直接数据,关于饲料中甘氨酸的含量与大黄鱼肝脏健康的关系有待于进一步研究。
综上所述,对于提高大黄鱼抗应激能力,同时不影响存活和肝脏健康,本研究推荐饲料中甘氨酸的使用量为2.75%-3.57%。
| Benfey TJ, Biron M. Acute stress response in triploid rainbow trout (Oncorhynchus mykiss) and brook trout (Salvelinus fontinalis). Aquaculture, 2000, 184(1): 167-176 | |
| China Fishery Statistical Yearbook. Beijing: China Agriculture Press, 2015, 28-29 [中国渔业统计年鉴.北京:中国农业出版社, 2015, 28-29] | |
| Dean DW, Bidner TD, Southern LL. Glycine supplementation to low protein, amino acid-supplemented diets supports optimal performance of broiler chicks. Poultry Science, 2006, 85(2): 288-296 DOI:10.1093/ps/85.2.288 | |
| de Koning TJ, Snell K, Duran M, et al. L-serine in disease and development. Biochemical Journal, 2003, 371(3): 653-661 DOI:10.1042/bj20021785 | |
| Fanouraki E, Mylonas CC, Papandroulakis N, et al. Species specificity in the magnitude and duration of the acute stress response in Mediterranean marine fish in culture. General and Comparative Endocrinology, 2011, 173(2): 313-322 DOI:10.1016/j.ygcen.2011.06.004 | |
| Fei WL, Liang CY. Comparison of three serum glucose measurements. Laboratory Medicine and Clinic, 2012, 9(20): 2573-2574 [费维伦, 梁春阳. 3种血清葡萄糖测定方法的比较. 检验医学与临床, 2012, 9(20): 2573-2574] | |
| Ito K, Ozasa H, Noda Y, et al. Effect of non-essential amino acid glycine administration on the liver regeneration of partially hepatectomized rats with hepatic ischemia/reperfusion injury. Clinical Nutrition, 2008, 27(5): 773-780 DOI:10.1016/j.clnu.2008.06.012 | |
| Lewis RM, Godfrey KM, Jackson AA, et al. Low serine hydroxymethyl transferase activity in the human placenta has important implications for fetal glycine supply. The Journal of Clinical Endocrinology & Metabolism, 2005, 90(3): 1594-1598 | |
| Li P, Mai KS, Trushenski J, et al. New developments in fish amino acid nutrition: towards functional and environmentally oriented aquafeeds. Amino Acids, 2009, 37(1): 43-53 DOI:10.1007/s00726-008-0171-1 | |
| Matilla B, Mauriz JL, Culebras JM, et al. Glycine: Cell-protecting anti-oxidant nutrient. Nutricion Hospitalaria, 2002, 17(1): 2-9 | |
| Matthews DE, Conway JM, Young VR, et al. Glycine nitrogen metabolism in man. Metabolism, 1981, 30(9): 886-893 DOI:10.1016/0026-0495(81)90067-6 | |
| Mertz ET, Beeson WM, Jackson HD. Classification of essential amino acids for the weanling pig. Archives of Biochemistry and Biophysics, 1952, 38(1): 121-128 DOI:10.1016/0003-9861(52)90015-5 | |
| Millán-Cubillo AF, Martos-Sitcha JA, Ruiz-Jarabo I, et al. Low stocking density negatively affects growth, metabolism and stress pathways in juvenile specimens of meagre (Argyrosomus regius, Asso 1801). Aquaculture, 2016, 451: 87-92 DOI:10.1016/j.aquaculture.2015.08.034 | |
| Rajendra S, Lynch JW, Schofield PR. The glycine receptor. Pharmacology & Therapeutics, 1997, 73(2): 121-146 | |
| Sheth H, Hafez T, Glantzounis GK, et al. Glycine maintains mitochondrial activity and bile composition following warm liver ischemia-reperfusion injury. Journal of Gastroenterology and Hepatology, 2011, 26(1): 194-200 DOI:10.1111/jgh.2011.26.issue-1 | |
| Tan BP, Mai KS. Zinc methionine and zinc sulfate as sources of dietary zinc for juvenile abalone Haliotis discus hannai Ino. Aquaculture, 2001, 192(1): 67-84 DOI:10.1016/S0044-8486(00)00435-X | |
| Wang WW, Wu ZL, Dai ZL, et al. Glycine metabolism in animals and humans: Implications for nutrition and health. Amino Acids, 2013, 45(3): 463-477 DOI:10.1007/s00726-013-1493-1 | |
| Wang Y, Xiong L, Yang KJ, et al. Effect of beta-cypermethrin on GPT and GOT activities of crucian serum. Agricultural Science & Technology, 2005, 6(1): 20-23 | |
| Wijekoon EP, Skinner C, Brosnan ME, et al. Amino acid metabolism in the Zucker diabetic fatty rat: Effects of insulin resistance and of type 2 diabetes. Canadian Journal of Physiology and Pharmacology, 2004, 82(7): 506-514 DOI:10.1139/y04-067 | |
| Wu GY, Bazer FW, Burghardt RC, et al. Proline and hydroxyproline metabolism: Implications for animal and human nutrition. Amino acids, 2011, 40(4): 1053-1063 DOI:10.1007/s00726-010-0715-z | |
| Wu GY, Wu ZL, Dai ZL, et al. Dietary requirements of "nutritionally non-essential amino acids" by animals and humans. Amino Acids, 2013, 44(4): 1107-1113 DOI:10.1007/s00726-012-1444-2 | |
| Wu Y, Miao JF, Liu Y, et al. Effect of glutamine on amino acid profile of serum and tissues in rats by simulating transport stress. Journal of Yangzhou University (Agricultural and Life Science Edition), 2008, 29(2): 21-25 [吴艳, 苗晋锋, 刘仪, 等. 谷氨酰胺对模拟运输应激大鼠体内氨基酸的影响. 扬州大学学报 (农业与生命科学版), 2008, 29(2): 21-25] | |
| Xie SW, Tian LX, Jin Y, et al. Effect of glycine supplementation on growth performance, body composition and salinity stress of juvenile Pacific white shrimp, Litopenaeus vannamei fed low fishmeal diet. Aquaculture, 2014, 418: 159-164 | |
| Yin M, Zhong Z, Connor HD, et al. Protective effect of glycine on renal injury induced by ischemia-reperfusion in vivo. American Journal of Physiology-Renal Physiology, 2002, 282(3): F417-F423 DOI:10.1152/ajprenal.00011.2001 | |
| Zhang CX, Ai QH, Mai KS, et al. Dietary lysine requirement of large yellow croaker, Pseudosciaena crocea R. Aquaculture, 2008, 283(1): 123-127 | |
| Zhang DR, Zhang LM, Wang JY, et al. Effect of dairy-yeast prebiotic on growth performance and antioxidant capability of juvenile starry flounder Platichthys stellatus. Progress in Fishery Sciences, 2013, 34(4): 34-42 [张德瑞, 张利民, 王际英, 等. 乳制品-酵母益生元对星斑川鲽幼鱼生长性能和抗氧化能力的影响. 渔业科学进展, 2013, 34(4): 34-42] | |
| Zhao M, Liang MQ, Zheng KK, et al. Effects of dietary taurine on the reproductive performance and the larval quality in tongue sole Cynoglossus semilaevis. Progress in Fishery Sciences, 2015, 36(3): 101-108 DOI:10.11758/yykxjz.20150316 [赵敏, 梁萌青, 郑珂珂, 等. 牛磺酸对半滑舌鳎 (Cynoglossus semilaevis) 亲鱼繁殖性能及仔鱼质量的影响. 渔业科学进展, 2015, 36(3): 101-108] | |
| Zhong Z, Wheeler MD, Li XL, et al. L-Glycine: A novel anti-inflammatory, immunomodulatory, and cytoprotective agent. Current Opinion in Clinical Nutrition & Metabolic Care, 2003, 6(2): 229-240 | |
| Zhou QC, Wu ZH, Tan BP, et al. Optimal dietary methionine requirement for Juvenile Cobia (Rachycentron canadum). Aquaculture, 2006, 258(1): 551-557 | |
| Zhou XQ, Liang HM. Change in the contents of lipid peroxide, and activity of antioxidant enzymes in the liver of mice under crowding stress. Zoological Research, 2003, 24(3): 238-240 [周显青, 梁洪蒙. 拥挤胁迫下小鼠肝脏脂质过氧化物含量和抗氧化物酶活性的变化. 动物学研究, 2003, 24(3): 238-240] |



