2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛瑞滋海珍品发展有限公司 青岛 266400;
4. 蓬莱市大柳行兽医站 烟台 265600
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
3. Qingdao Ruizi Seafood Development Co., Ltd, Qingdao 266400;
4. Penglai Daliuhang Veterinary Station, Yantai 265600
浒苔(Enteromorpha prolifera)是一种底栖大型经济类绿藻(王晓坤等, 2007),自然繁殖能力强,产量大,在我国南、北方各海域均有分布(张智芳等, 2009),具有蛋白质种类丰富、碳水化合物含量高及矿物质均衡等特点(徐大伦等, 2003;李月欣等, 2015),是一种潜在的优质饲料原料。目前,由于刺参(Apostichopus japonicus)优质的天然饵料鼠尾藻、马尾藻等资源日渐匮乏,有关浒苔作为刺参饲料添加成分的研究得到了广泛开展。这些研究多集中于浒苔干粉直接替代或对浒苔进行单一预处理等方面(廖梅杰等, 2011;朱建新等, 2009;姜燕, 20141))。本研究通过有效结合微生物发酵技术与碱性蛋白酶(Alkaline protease)酶解技术,以浒苔为饲料原料,制作5组不同的浒苔型饲料,研究其对幼刺参的生长、消化和非特异性免疫的影响,确定了浒苔生物饲料的制备工艺,为提高浒苔利用率、制作优质刺参配合饲料提供了一定的参考依据和理论支持。
1) Jiang Y. Study on the processing technology and application of fermentation feed for sea cucumber Apostichopus japonicas. Doctoral Dissertation of Ocean university of China, 2014, 43–72 [姜燕.刺参(Apostichopus japonicas)发酵饲料的制作工艺与应用效果研究.中国海洋大学博士研究生学位论文, 2014, 43–72]
1 材料与方法 1.1 实验材料本实验所用浒苔于2015年6月中旬,在山东省青岛市第一海水浴场采集获得。鲜浒苔经海水洗涤、去沙处理后,一部分在50℃下烘干、粉碎、80目过筛后,–20℃下保存备用,另一部分采用半自动匀浆机进行匀浆,然后–20℃下保存备用。
本实验中采用的发酵菌种为酿酒酵母菌(Saccharomyces cerevisiae,编号为CICC1251),购自中国工业微生物菌种保藏管理中心,活化培养后经梯度耐盐筛选得到。在液体酵母浸出粉胨葡萄糖培养基(Yeast extract peptone dextrose medium, YPD)(赵斌等, 2002) 中37℃、140 r/min的恒温振荡培养18 h,所得菌悬液即为实验用发酵菌悬液。
本实验采用的碱性蛋白酶购自诺维信(中国)生物技术有限公司,活力为2.4 AU/ml。
1.2 实验饲料配方与制备 1.2.1 基础饲料配方采用浒苔粉:石莼粉:豆粕:扇贝边粉:葡萄糖:贝壳粉:维生素预混料:矿物质预混料为40:30:8:15:1:4:1:1的配比,制成粗蛋白质为19.16%、粗脂肪为1.60%的刺参配合饲料。
1.2.2 实验饲料的制备对照组:按照表 1中的实验配方配制饲料;
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal experimental diets(DM) |
酶解组:添加8‰的碱性蛋白酶对基础饲料进行酶解(酶解条件:50℃,2.5 h)(以干物质计),在90℃下灭活15 min。
发酵组:利用酿酒酵母菌菌液对基础饲料进行发酵(发酵条件:35℃、24 h、含水量80%、接种量16%)。
复合组:先用碱性蛋白酶对基础饲料进行酶解(8‰剂量,50℃,2.5 h)后,在90℃下灭活15 min,再利用酿酒酵母菌菌液对酶解饲料发酵(发酵条件:35℃、24 h、含水量80%、接种量16%)。
鲜浒苔组:称取40%的鲜浒苔匀浆,再与其他提前配合好的饲料成分(干物质重量比60%)充分混合;酶的用量为混合饲料干重的8‰,pH为9–11,含水量75%,反应温度为50℃,反应时间为2.5 h;酶解完成后对碱性蛋白酶进行灭活处理。然后进行微生物发酵,酿酒酵母培养液的用量为饲料干重的16%,发酵基质含水量80%,反应温度为35℃,反应时间为24 h,发酵期间每2 h搅拌混匀1次,反应结束后–20℃低温保存。
1.3 养殖实验分组与管理 1.3.1 养殖实验分组实验用幼刺参由山东青岛瑞滋海珍品发展有限公司提供,为当年3月中旬同批次繁育的苗种,挑选出体格健壮、活力良好、平均体重为(1.92±0.02) g/头的刺参,随机分为5组,每组设3个重复,每个重复30头,称重之后放入40 L塑料水槽中暂养。
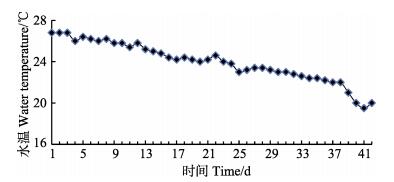
1.3.2 养殖实验管理实验于2015年8月14日–2015年9月25日在青岛瑞滋海珍品发展有限公司水族车间内进行,共计42 d。实验期间的海水盐度为30–32,溶氧浓度为5.6–6.0 mg/L,pH为7.5–8.0,连续充气,水温变化见图 1。每天08:00换水1/4–1/2,09:30将饲料与海泥按1:1 (以干重计)的比例混合、浸泡;16:30左右,将浸泡后的混合料充分搅拌、均匀泼洒,投喂量按刺参总重量的3%计算,并根据刺参摄食情况及养殖用水透明度适时调整。定期观察刺参摄食情况,并检查充氧设施工作状况。整个实验期间,每2 d吸底1次;每天记录水温、饲料投喂量、刺参摄食状况和死亡数目。
|
图 1 实验期间水温变化趋势 Figure 1 The variation of the water temperature during the experiment |
在实验0 d时随机取出4头幼刺参,14 d、28 d、42 d时各组随机取3头幼刺参,解剖后取出肠道,并将肠道内容物清理干净,进行淀粉酶(Amylase, AMS)、纤维素酶(Cellulase)和胰蛋白酶(Trypsin, TRY)活力的测定。实验结束后,取体壁、内脏团称重,用于计算脏壁比(Ratio of viscera to body wall, R);抽取体腔液用于酸性磷酸酶(Acid phosphatase, ACP)、碱性磷酸酶(Alkaline phosphatase, AKP)和超氧化物歧化酶(Superoxide dismutase, SOD)活力的测定。
1.4.2 指标测定计算幼刺参的成活率(Survival rate, SR)、增重率(Weight gain rate, WGR)、特定生长率(Specific growth rate, SGR)、饲料系数(Food coefficient, FC)和脏壁比(R)。各指标计算公式如下:
SR(%)=100×终末刺参头数/初始刺参头数;
WGR(%)=100×(终末平均体重–初始平均体重)/初始平均体重;
SGR(%/d)=100×(ln终末平均体重–ln初始平均体重)/养殖天数;
FC=饲料投喂量/增重量;
R(%)=100×内脏团重量/体壁重量
粗蛋白质含量的测定采用凯氏定氮法(VELP, UDK-142 Automatic Distillation Unit,意大利);粗脂肪含量的测定采用索氏抽提法(石油醚为抽提液) (FOSS脂肪测定仪SOXTEC-2050,瑞士)。
样品ACP、AKP、SOD、AMS活力和蛋白质浓度,采用南京建成生物工程研究所试剂盒测定,酶活力以比活力表示;TRY活力的测定参照Erlanger等(1961) 的方法;纤维素酶活力的测定采用3, 5-二硝基水杨酸法(中山大学生物化学教研室, 1978)。
1.5 数据处理与分析实验数据先采用Excel 2010进行数据统计与分析,再采用SPSS 17.0进行单因素方差分析(One-way ANOVA)和Duncan氏多重比较进行统计分析,设定显著水平为P < 0.05。实验结果以平均值±标准误(Mean±SE)表示。
2 结果 2.1 不同浒苔型饲料对幼刺参生长性能的影响由表 2可知,不同的浒苔型饲料对幼刺参的SR、WGR、SGR和FC有显著性影响(P < 0.05),而对幼刺参的R影响不显著(P > 0.05)。复合组与鲜浒苔组中幼刺参的SR显著高于酶解组(P < 0.05),而与其他2组均无显著性差异(P > 0.05)。鲜浒苔组中幼刺参的WGR远高于其他各组(P < 0.05),而复合组与发酵组的WGR显著高于酶解组(P < 0.05),与对照组差异不显著(P > 0.05)。幼刺参的SGR规律与WGR相一致。鲜浒苔组中幼刺参的FC显著低于对照组、发酵组和复合组(P < 0.05),与复合组差异不显著(P > 0.05)。
|
|
表 2 不同的浒苔型饲料对刺参生长性能的影响 Table 2 Effects of different E. prolifera-diets on the growth performance of A. japonicus |
由图 2可知,随着摄食饲料时间的推移,对照组、发酵组、复合组和鲜浒苔组中幼刺参肠道AMS活力先升高再下降后趋于稳定,而酶解组中一直呈现下降趋势。第2周,发酵组中幼刺参的AMS活力与对照组无显著差异(P > 0.05),均显著高于酶解组(P < 0.05),且显著低于鲜浒苔组和复合组(P < 0.05),二者之间无显著性差异(P > 0.05)。在第4、6周,各组中幼刺参的AMS活力的变化与第2周时相一致。

|
图 2 幼刺参肠道淀粉酶活力的变化 Figure 2 The variation of the intestinal AMS activity of juvenile A. japonicus |
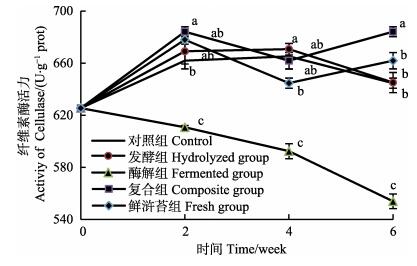
由图 3可知,酶解组幼刺参肠道纤维素酶活力呈现一直下降的趋势,而其他组呈现波动变化,且均高于初始活力值。第2周,复合组中幼刺参肠道纤维素酶活力最高,显著高于酶解组和对照组(P < 0.05),而与鲜浒苔组和发酵组无显著性差异(P > 0.05)。第4周,发酵组幼刺参纤维素酶活力最高,而各组中的肠道纤维素酶活力之间的规律与第2周基本相一致。第6周,复合组中幼刺参肠道纤维素酶活力最高,且显著高于其他各组(P < 0.05),而鲜浒苔组、发酵组和对照组之间无显著差异(P > 0.05),但均显著高于酶解组(P < 0.05)。
|
图 3 幼刺参肠道纤维素酶活力的变化 Figure 3 The variation of the intestinal cellulase activity of juvenile A. japonicus |
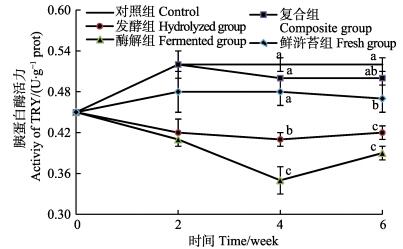
由图 4可知,随着摄食饲料时间的推移,除酶解组外,其余各组中幼刺参肠道TRY活力前后时间点变化差异不大,且在3个时间点上幼刺参肠道TRY活力大小顺序始终是对照组 > 复合组 > 鲜浒苔组 > 发酵组 > 酶解组。而在第2周,各组之间的TRY活力无显著性差异(P > 0.05)。第4周,发酵组中的肠道TRY活力显著高于酶解组(P < 0.05),但显著低于其他3组(P < 0.05),且其余3组之间均无显著性差异(P > 0.05)。第6周,鲜浒苔组中肠道TRY活力显著低于对照组(P < 0.05),与复合组之间无显著性差异(P > 0.05),但显著高于发酵组和酶解组(P < 0.05)。
|
图 4 幼刺参肠道胰蛋白酶活力的变化 Figure 4 The variation of the intestinal TRY activity of juvenile A. japonicus |
由表 3可知,不同浒苔型饲料饲喂的幼刺参体腔液中ACP、AKP和SOD活力均有显著性差异(P < 0.05)。在各组的ACP中,鲜浒苔组的活力最大,且与复合组无显著性差异(P > 0.05),而显著高于其他3组(P < 0.05),酶解组的活力最小。在各组的AKP中,鲜浒苔组和复合组AKP活力显著高于酶解组和对照组(P < 0.05),与发酵组无显著性差异(P > 0.05)。而在各组的SOD中,复合组的活力最大,且显著高于发酵组和酶解组(P < 0.05),而与对照组和鲜浒苔组均无显著性差异(P > 0.05)。
|
|
表 3 不同的浒苔型饲料对幼刺参体腔液非特异性免疫酶活力的影响 Table 3 Effects of different E.prolifera-diets on non-specific immune enzyme activities in the coelomic fluid of juvenile A. japonicus |
目前,浒苔在刺参饲料中的应用已开展了大量的研究,主要集中在浒苔纯粉直接投喂或经单一预处理后配合其他饲料成分进行投喂,且得到了一定的效果。而本实验是结合微生物发酵与碱性蛋白酶水解技术对浒苔型配合饲料进行不同处理后,对幼刺参开展投喂实验。
在本研究中,酶解组的幼刺参生长性能指标整体最差,可能有两方面的原因。一是在酶解反应的过程中,蛋白质的相对分子量逐渐变小,并转化为肽或者氨基酸,更易于消化吸收(Arai et al, 1970),但碱性蛋白酶作为一种内肽酶,作用于蛋白质分子内部肽键,生成小分子肽段而产生苦味(林敏刚, 2009),从而影响到酶解组饲料的适口性;二是由于刺参饲料投喂的方式为泼洒投喂,降解后小分子物质比例增加,水溶性增强,造成饲料营养物质不足或失衡等,导致酶解组刺参的生长性能低下,这与王黎(2010)1)微胶团饲料对刺参生长影响的现象相符。而复合组刺参生长性能优于对照组和酶解组,但与发酵组之间的差异不显著,这可能是浒苔饲料经过酶解之后,其中的小分子物质所占的比例变大,促进了酿酒酵母菌发酵初期的生长与繁殖速率,这与熊子书(2002) 关于中国酿酒酵母菌的研究结果一致。而酿酒酵母菌会利用饲料中的营养物质满足自身生长代谢需要,并能够生成一些呈味物质,比如有机酸,还原糖等(熊子书, 2002)。微生物发酵还可以提高饲料中菌体蛋白的含量,为水产动物生长提供高品质的蛋白质(丁理法等, 2008)。而鲜浒苔组中的刺参生长性能最优,可能与饲料的物理性状有较大的关系。鲜浒苔组饲料是将鲜浒苔通过匀浆之后,再混合其他饲料原料而得,其粒径较大,在水中的吸附作用增强,小分子营养物质能够被有效吸附,且研究证实浒苔作为吸附剂能发挥良好的作用(程凤莲等, 2011);此外,鲜浒苔作为饲料原料能够有效保持藻体的鲜味,促进刺参摄食行为。
1) Wang L. Effects of micro-mixed bolus feeds on the growth of sea cucumber, Apostichopus japonicas and water quality. Master' s Thesis of Dalian University of Technology, 2010 [王黎.微胶团饲料对刺参生长和水质的影响研究.大连理工大学硕士研究生学位论文, 2010]
3.2 不同浒苔型饲料对幼刺参消化酶活力的影响刺参肠道中常见的消化酶有淀粉酶、蛋白酶和纤维素酶等,消化酶活力的大小可以反映出刺参的摄食效果。淀粉酶是刺参肠道中最主要的内源性消化酶之一,对刺参消化吸收淀粉等物质有很大作用(秦博等, 2015)。
本研究发现,除酶解组的淀粉酶活力下降之外,随着时间的推移,其他组刺参的淀粉酶活力变化先升高后下降,最后趋于稳定,这与吴垠等(2003) 在中国对虾(Penaeus chinensis)中的研究一致。吴永恒等(2012) 认为造成这种现象的原因可能是刺参消化道内的消化酶活性与饲料改变后的应激反应有关,随着投喂饲料时间的延长,刺参通过神经调节内分泌系统使淀粉酶的分泌趋于稳定,且本实验中的纤维素酶和胰蛋白酶活力的变化同样符合此规律。除酶解组外,其他各组中的纤维素酶活力一致处于较高的水平,分析原因可能是浒苔和石莼均属大型藻类,其纤维素等大分子碳水化合物比重大,可以促进刺参消化道分泌更多的纤维素酶。Kao等(1996) 研究认为,纤维素酶活力不仅与自身的内分泌调节有关,同时会受到外源性因素(饲料、环境等)的影响。从图 4中可以看出,刺参肠道内胰蛋白酶活力与饲料蛋白质含量、分子量大小有关:对照组中的蛋白质未经酶解处理,也未被酿酒酵母利用,因此,该组的刺参需要提高蛋白酶的分泌量来完成消化过程;而复合组和鲜浒苔组中,由于微生物在增殖过程中会合成大量的菌体蛋白,提高了饲料中蛋白质的储备量,因此,两组的胰蛋白酶活力与对照组无显著差异。酶解组由于蛋白质水解程度大,在水中的溶失增大,因而被刺参摄食吸收的量小,其胰蛋白酶活力最低。而酶解组的营养物质散失在水中的比例大,刺参摄食营养不足,导致其没有足够的营养物质供给合成消化酶。
3.3 不同浒苔型饲料对幼刺参体腔液非特异性免疫酶活力的影响刺参体腔液中的非特异性免疫酶活力可以反映出刺参对所处内环境与外环境的调节能力。SOD是重要的抗氧化酶之一,在清除活性氧自由基、防止生物分子损伤方面有十分重要的作用,对增强吞噬细胞的吞噬能力和整个机体的免疫功能也起着重要作用(陈竞春等, 1996)。ACP和AKP是2种重要的水解酶,在刺参抵抗疾病、免疫反应和细胞损伤与修复过程中具有重要的生物学意义(张明等, 2004; Cajaravile et al, 2000; Rajalakshmi et al, 2005)。本研究中,复合组与鲜浒苔组刺参体腔液中的SOD、ACP和AKP活力略高于其他3组,可能是微生物发酵饲料中的益生菌容易在养殖水体中扩散,不仅可以改善水环境和底质,而且被养殖动物摄食后可维持肠道菌群平衡(李豫红等, 2003)。且Gill等(2000) 研究证实,发酵微生物生长代谢中产生的一些代谢产物可在一定程度上抑制或杀死病原菌,预防或降低疾病的发生,增强动物的免疫力。
4 结论本研究中,幼刺参在摄食鲜浒苔组的浒苔生物饲料后,获得良好的生长效果,适当改善肠道消化酶活力,维持正常生理免疫功能。同时,该结果证明了鲜浒苔作为刺参饲料成分的可靠性,从而为减轻处理浒苔工作量、提高浒苔利用率提供了理论依据和实践方法。
| Aria S, Yamashifa M, Kato H, et al. Applying proteolytic enzymes on soybean. Agricultural Biological Chemistry, 1970, 34: 729 | |
| Cajaravile MP, Bebianno MJ, Blasco J, et al. The use of biomarkers to assess the impact of pollution in coastal environments of the Iberian peninsula: A practical approach. Science of the Total Environment, 2000, 247(2/3): 295-311 | |
| Chen JC, Shi AJ. Malacozoan immunobiology research: A review. Acta Hydrobiologica Sinica, 1996, 20(1): 74-78 [陈竞春, 石安静. 贝类免疫生物学研究概况. 水生生物学报, 1996, 20(1): 74-78] | |
| Cheng FL, Meng FP, Zhou Y, et al. Large seaweed Enteromorpha to alkaline dye adsorption properties of methylene blue. Chemical Industry and Engineering Progress, 2011, 5(1): 887-891 [程凤莲, 孟范平, 周游, 等. 大型海藻浒苔对碱性染料亚甲基蓝的吸附性能. 化工进展, 2011, 5(1): 887-891] | |
| Ding LF, Ye J. The study of biotechnology in the aquatic animal nutrition and feed applications. Fisheries Science and Technology Information, 2008, 35(5): 229-232 [丁理法, 叶婧. 生物技术在水产动物营养与饲料研究中的应用. 水产科技情报, 2008, 35(5): 229-232] | |
| Erlanger BF, Kokowsky N, Cohen W. The preparation and properties of two new chromogenic substrates of trypsin. Archives of Biochemistry and Biophysics, 1961, 95(2): 271-278 DOI:10.1016/0003-9861(61)90145-X | |
| Gill HS, Rutherfurd KJ, Prasad J, et al. Enhancement of natural and acquired immunity by Lactobacillus rhamnosus (HN001), Lactobacillus acidophilus (HN017) and Bifidobacterium lactis (HN019). British Journal of Nutrition, 2000, 83(2): 167-176 DOI:10.1017/S0007114500000210 | |
| He Q. Evaluation on nutrition components of Enteromorpha linza. Marine Sciences, 2006, 30(1): 34-38 [何清. 东海绿藻缘管浒苔营养成分分析及评价. 海洋科学, 2006, 30(1): 34-38] | |
| Kao C, Blaha J H, Skarkowa L. Estimation of the enzyme preparation required to obtain optimum nutrient utilization and growth performance in young broiler chicks fed on barley diets. Zivocisna Vyroba, 1996, 41(1): 18-19 | |
| Liao MJ, Hao ZK, Shang DR, et al. Nutrition components analysis of Enteromorpha prolifera and its preliminary study on feeding Apostichopus japonicas. Fishery Modernization, 2011, 38(4): 32-36 [廖梅杰, 郝志凯, 尚德荣, 等. 浒苔营养成分分析与投喂刺参试验. 渔业现代化, 2011, 38(4): 32-36] | |
| Lin MG. Application of alkaline protease in hydrolysis of vegetable protein. China Oils and Fats, 2009, 34(12): 30-33 DOI:10.3321/j.issn:1003-7969.2009.12.009 [林敏刚. 碱性蛋白酶在水解植物蛋白中的应用. 中国油脂, 2009, 34(12): 30-33] | |
| Li YH, Gao F. Introduction to the aquaculture microorganisms living bacteria preparation. Hebei Fisheries, 2003, 11061106(1): 6-7 [李豫红, 高峰. 浅谈水产养殖中的微生物活菌制剂. 河北渔业, 2003, 11061106(1): 6-7] | |
| Li YX, Liu N, Zhou DQ. Effects of complex enzymes extraction on adsorption capabilities of dietary fiber from Entenmorpha sp. . Progress in Fishery Sciences, 2015, 36(4): 146-149 [李月欣, 刘楠, 周德庆. 复合酶提取法对浒苔(Enteromorpha sp. )膳食纤维吸附能力的影响.渔业科学进展, 2015, 36(4): 146-149] | |
| Qin B, Chen SQ, Chang Q, et al. Effects of Enteromorpha prolifera on growth, digestion and non-specific immunity of juvenile sea cucumber (Apostichopus japonicus Selenka). Journal of Fisheries of China, 2015, 39(4): 66-75 [秦搏, 陈四清, 常青, 等. 饲料中浒苔添加量以及处理方法对幼刺参生长、消化率、消化酶和非特异性免疫酶的影响. 水产学报, 2015, 39(4): 66-75] | |
| Rajalakshmi S, Mohandas A. Copper-induced changes in tissue enzyme activity in a freshwater mussel. Ecotoxicology and Environmental Safety, 2005, 62(1): 140-143 DOI:10.1016/j.ecoenv.2005.01.003 | |
| Sun Yat-sen University Biochemistry Teaching and Research Section. Introduction to the biochemical technology. Beijing: People's Education Press, 1978: 53-55. [中山大学生物化学教研室. 生化技术导论. 北京: 人民教育出版社, 1978: 53-55.] | |
| Wang XK, Ma JH, Ye DC, et al. Preliminary study on the life history of Enteromorpha prolifera. Marine Science Bulletin, 2007, 26(5): 112-116 [王晓坤, 马家海, 叶道才, 等. 浒苔(Enteromorpha prolifem)生活史的初步研究. 海洋通报, 2007, 26(5): 112-116] | |
| Wu Y, Sun JM, Zhou ZC, et al. The effects of dietary protein levels on the growth and activities of digestive enzymes in shrimp, Penaeus chinensis. Journal of Dalian Fisheries University, 2003, 18(4): 258-262 [吴垠, 孙建明, 周遵春, 等. 饲料蛋白质水平对中国对虾生长和消化酶活性的影响. 大连水产学院学报, 2003, 18(4): 258-262] | |
| Wu YH, Wang QY, Feng ZF, et al. The effect of dietary protein on the enzymes and intestinal structure of Apostichopus japonicas. Marine Sciences, 2012, 36(1): 36-41 [吴永恒, 王秋月, 冯政夫, 等. 饲料组蛋白含量对刺参消化酶及消化道结构的影响. 海洋科学, 2012, 36(1): 36-41] | |
| Xiong ZS. Research on liquor-making yeasts in China-records on screening of varieties of yeast and their applications continous. Liquor-Making Science and Technology, 2002(5): 19-21 [熊子书. 中国酿酒酵母菌的研究——不同酒类酵母筛选与应用纪实(下). 酿酒科技, 2002(5): 19-21] | |
| Xu DL, Huang XC, Yang WG, et al. Analysis of nutrition composition of Enteromorpha prolifera. Journal of Zhejiang Ocean University (Natural Science), 2003, 22(4): 318-320 [徐大伦, 黄晓春, 杨文鸽, 等. 浒苔营养成分分析. 浙江海洋学院学报(自然科学版), 2003, 22(4): 318-320] | |
| Zhang M, Wang L, Guo ZY, et al. Effect of lipopolysaccharide and Vibrio anguillarum on the activities of phosphatase, superoxide dismutase and the content of hemocyanin in the serum of Fenneropenaeus chinesis. Marine Sciences, 2004, 28(7): 22-25 [张明, 王雷, 郭振宇, 等. 脂多糖和弧菌对中国对虾血清磷酸酶、超氧化物歧化酶和血蓝蛋白的影响. 海洋科学, 2004, 28(7): 22-25] | |
| Zhang ZF, Lin WT, Chen CK. Study on extraction process of water-soluble polysaccharide from Enteromorpha prolifera. Food and Nutrition in China, 2009(3): 39-41 [张智芳, 林文庭, 陈灿坤. 浒苔水溶性多糖提取工艺研究. 中国食物与营养, 2009(3): 39-41] | |
| Zhao B, He SJ. Experiment of microbiology. Beijing: Science Press, 2002, 67: 67-72 [赵斌, 何绍江. 微生物学实验. 北京:科学出版社, 2002, 67: 67-72] | |
| Zhu JX, Qu KM, Li J, et al. Growth of young sea cucumber Apostichopus japonicus fed on processed Enteromorpha prolifera. Progress in Fishery Sciences, 2009, 30(5): 108-112 [朱建新, 曲克明, 李健, 等. 不同处理方法对浒苔饲喂稚幼刺参效果的影响. 渔业科学进展, 2009, 30(5): 108-112] |



