2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
对虾池塘养殖一直是我国主要的传统生产模式,但该模式存在养殖水域污染严重、易出现流行病、受气候制约以及单位面积产出较低等问题,而对虾工厂化养殖模式对环境污染较轻,能有效防止对虾暴发性流行病,产量高且能有效保证对虾的食品安全(孟庆武等, 2008)。近几年,凡纳滨对虾(Litopenaeus vannamei)工厂化养殖模式在山东青岛、日照等地区迅速发展起来。工厂化养殖模式尽管切断了与外界病源的联系,对养殖用水进行了更规范、更科学的管理,但病害仍时有发生,这可能跟水体中浮游藻类群落演替有着一定的关系(陈剑锋等, 2006)。微藻是虾池生态系的重要组成部分,尤其是数量和生物量都占统治地位的优势种,在一定程度上代表着微藻的群落特征,其变动会给对虾的生长带来一定的影响。深入研究虾池微藻的群落特征,不仅对阐明虾池人工生态系的结构、功能有重要理论意义,而且对控制适宜的浮游植物种群和数量,维持对虾稳定产出也有重要的实践意义(Attayde et al, 1999)。我国对虾工厂化养殖发展的时间还较短,目前的研究报道多集中于养殖效益、理化因子、管理技术等方面(李玉全, 20061); 谢立民等, 2003; 刘娇等, 2008; 刘海英, 20061); 管崇武等, 2010),关于凡纳滨对虾工厂化养殖系统中微藻的群落特征还未见系统的研究报告,微藻群落演替规律及其与养殖环境因子之间的关系也不明确。本文研究了凡纳滨对虾工厂化养殖系统的微藻群落特征,系统地分析了微藻种类组成、丰度、多样性和优势种演替特征,并结合养殖情况进行了讨论,以期为优化对虾工厂化养殖环境、指导养殖生产提供参考。
1) Li YQ. Analysis on farming system of super-intensive and effect of main factors on growth, immunity and nutrient budgets in shrimp. Doctoral Dissertation of Ocean University of China, 2006, 40–68 [李玉全.工厂化养殖系统分析及主要养殖因子对对虾生长、免疫及氮磷收支的影响.中国海洋大学博士研究生学位论文, 2006, 40–68]
1) Liu HY. Water quality characteristic of industrial shrimp farming and effects of higher dissolved oxygen on its farming. Master′s Thesis of Ocean University of China, 2006, 26–52 [刘海英.对虾工厂化养殖水质特征及高溶解氧对养殖的影响.中国海洋大学硕士研究生学位论文, 2006, 26–52]
1 材料与方法 1.1 采样地点本实验于2015年6–9月在青岛市宝荣水产科技有限公司进行。对虾工厂化养殖车间顶部覆盖塑料薄膜用于保温,内设60个面积为2.67 m2的近六边形水泥池,池底铺设“回”形纳米气孔管道进行供气,具备独立的给排水系统,养殖用水为经砂滤、消毒以及充分曝气的地下海水。选取6个条件基本相同的水泥池用于本实验,实验用凡纳滨对虾购自广东恒兴育苗场,虾苗经20 d暂养后,体重达(0.036±0.006) g,于6月10日放至养殖池,编号为A1、A2、B1、B2、C1、C2,其中,A1池和A2池对虾放养密度为300 ind/m2,B1和B2池为400 ind/m2,C1和C2为500 ind/m2。
参照彭聪聪等(2011)划分对虾养殖阶段的方法,根据对虾的生长情况并兼顾采样周期,将对虾养殖周期分为3个阶段:6月13日–7月11日为前期,7月12日–8月8日为中期,8月9日–9月6日为后期。
1.2 样品采集与处理2015年6月13日– 9月6日,共计84 d,每隔14 d从各池采水样2 L,取1 L倒入聚乙烯塑料瓶,加入5%鲁哥氏液(Lugol’s solution)固定,静置24 h后,将水样浓缩至20 ml,显微镜下检查微藻。另外1 L水样装瓶带回实验室,低温保存,用于测定氨氮等化学因子。
依照《中国海藻志》(郭玉洁等, 2003)、《水生生物学》(赵文等, 2005)等对微藻进行定性鉴定。用血球计数板进行定量检测,取0.1 ml浓缩水样于计数框内在显微镜下计数,假定浮游植物细胞为随机分布,计数误差在±10%内。
每天使用YSI556型多参数水质仪(YSI,美国)监测实验池水体的温度(T)、溶解氧(DO)、盐度(S)和pH值等常规水质参数。水样中氨氮(NH4+-N)、亚硝酸盐(NO2–-N)、硝酸盐(NO3–-N)、磷酸盐(PO43–-P)、总氮(TN)和总磷(TP)等浓度均按照《海洋调查规范》(GB/T12763.4-2007) 进行测定。
1.3 数据处理微藻密度D (cell/L)=200×Pn×N0/N1
式中,Pn为计数框计数的浮游植物个数,N0为计数框总格数,N1为计数过的方格数。
生物量(mg/L)计算参照蔡林婷等(2013)的方法:
B=D×R
式中,B为微藻生物量,R小型藻=2×10–7mg;R中型藻=2×10–6mg;R大型藻=5×10–6mg
浮游植物多样性指数采用Shannon-Wiener物种多样性指数(H′):
| $ H = - \sum\limits_{i = 1}^s {{P_i}{{\log }_2}{P_i}} $ |
式中均采用物种数量作为指标,其中,Pi=ni/N,ni为物种i的个体数,N为群落样本的总个体数,即Pi为物种i占总个体数的比例,S为群落物种数。
参照张才学等(2007)划分微藻丰度的方法,微藻Pi<0.01,为稀有种;0.01≤Pi≤0.1,为常见种;Pi≥0.1,为优势种。
2 结果与分析 2.1 环境理化因子变化状况和养殖情况养殖期间,不同养殖时期各实验池的pH、氨氮等环境理化因子的变化情况见表 1。pH范围为7.75–8.32,后期降幅较大。总氨氮为0.02–1.79 mg/L,中期升幅较大。亚硝氮为0.01–0.71 mg/L,养殖前期处于较低水平,中期迅速上升,后期稳定在较高水平。硝酸氮为0.01–2.70 mg/L,随着养殖进行,浓度上升较快。无机磷为0.01–2.04 mg/L。总氮为1.48–5.65 mg/L,总磷为0.79–4.24 mg/L。
|
|
表 1 虾池主要理化因子的变化情况 Table 1 Changes of main physical-chemical factors in shrimp ponds |
各养殖池对虾存活率和产量等生长性能如表 2所示。养殖第26天(7月9日)–第40天(7月23日),出现连续阴雨天气,此阶段B1池和C2池对虾前7 d死亡率超过40%,随后一直都有对虾死亡。养殖至70 d以后,B1池和C1池对虾出现“偷死”症状,直至养殖结束,都有对虾陆续死亡。
|
|
表 2 对虾生长性能 Table 2 The growth performance of shrimp |
对虾工厂化养殖实验池中的微藻种类和丰富度如表 3所示。6个实验池中共鉴定出微藻5门28属49种,其中绿藻门8属10种,占总种类数的20.4%;硅藻门9属19种,占38.8%;蓝藻门6属13种,占26.5%;甲藻门4属6种,占12.2%;隐藻门1属1种,占2%。绿藻、蓝藻和硅藻多为优势种和常见种,甲藻有2种优势种,隐藻有1种优势种,其余为常见种和稀有种。
|
|
表 3 虾池微藻种类和丰富度 Table 3 Species and abundance of microalgae in shrimp ponds |
不同养殖时期对虾实验池中微藻的密度、生物量和多样性指数如表 4所示。整个养殖期间,6个实验池的微藻密度为5.2×105–9.4×108 cell/L,生物量为1.23–208.00 mg/L,微藻密度和生物量均呈现出逐渐升高的趋势。A1和A2池对虾密度最低(300 ind/m2),整个养殖过程中微藻的密度和生物量也处于较低水平,而C1和C2池对虾密度最高(500 ind/m2),养殖后期微藻密度和生物量都达到较高水平,明显高于低密度池,主要类群为颤藻,生物量占比达到80%以上。养殖期间,各实验池微藻多样性指数范围为0.42–2.44。低密度(A1和A2间)以及中密度(B1和B2间)实验池微藻的多样性指数变化呈现一定的差异性,而2个高密度(C1和C2间)实验池微藻多样性指数变化趋势一致,均表现为随养殖时间增加一直下降。
|
|
表 4 不同养殖期虾池中微藻的总密度、总生物量以及多样性指数 Table 4 Density, biomass and diversity index of microalgae in shrimp ponds |
不同养殖时期各虾池微藻优势种演替情况如图 1所示,优势种及对应编号参见表 5。
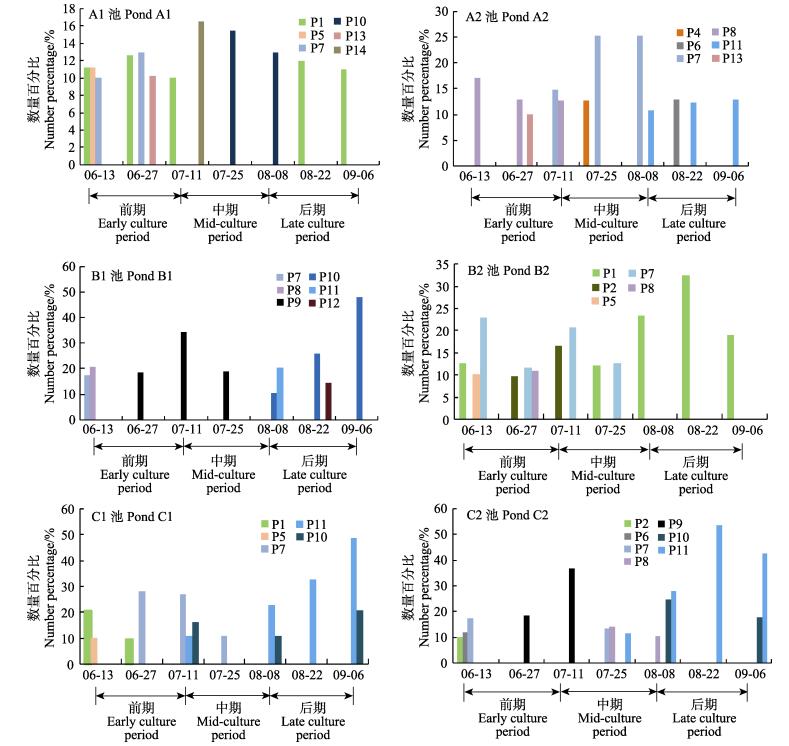
|
图 1 虾池微藻优势种演替动态
Figure 1 Dynamic succession of microalgae species in shrimp ponds
P1–P14代表微藻优势种种类的编号,种类及对应编号见表 5
P1–P14 in this diagram represented corresponding codes for dominant species, and microalgae species, and their corresponding codes were shown in Tab. 5 |
|
|
表 5 微藻优势种及相应编号 Table 5 Microalgae dominant species and their corresponding codes |
低密度养殖实验池A1优势种有6种,养殖前期,小球藻一直处于优势地位,此外,还有扭曲小环藻(C.comta)、扁多甲藻(P.depressum)和卵形隐藻(C.ovata),优势种优势度都在0.15以下,养殖至第42天,蓝藻门的威利颤藻(Oscillatoria willei)演替成为优势种,随后颤藻优势度减少,小球藻重新成为优势种并保持至养殖末期。A2池优势种有6种,整个养殖阶段微藻密度明显低于其他池,前、中期优势种主要为硅藻门的线形圆筛藻(C.lineatus)和牟氏角毛藻(C.muelleri),第14天,扁多甲藻和牟氏角毛藻共同成为优势种,后期蓝藻门的弱细颤藻(O.tenuis)长期占据优势地位。
中密度养殖实验池B1优势种有6种,前期以牟氏角毛藻为主要优势种,14 d以后,不定微囊藻(M.incerta)迅速演替成为优势种,一直持续到50 d以后,优势种演替为威利颤藻和弱细颤藻,微小原甲藻(P.minimum)在养殖70 d左右成为优势种,只持续5 d,威利颤藻在养殖末期优势度达到0.48,成为绝对优势种。B2池优势种有5种,前、中期优势种主要是绿藻门的小球藻和硅藻门的扭曲小环藻和洛氏角毛藻(C.lorenzianus),后期小球藻成为绝对优势种,优势度高达0.32。
高密度养殖实验池C1优势种有5种,前期优势种为小球藻、扭曲小环藻和洛氏角毛藻,第28天左右,蓝藻门的弱细颤藻和威利颤藻逐渐演替成为优势种并在养殖后期成为绝对优势种,颤藻优势度高达0.82。C2池优势种有7种,养殖前14 d内,优势种为蛋白核小球藻(C.pyrenoidesa)、诺氏海链藻(T.nordenskioldi)和牟氏角毛藻,随后不定微囊藻迅速演替为绝对优势种;第28天,优势种变为硅藻门的角毛藻和弱细颤藻,第38天,颤藻取代角毛藻成为绝对优势种。
3 讨论本研究中,各实验池中微藻的数量变化均呈前期较低、中期快速升高、后期达到最高的趋势。青岛地区凡纳滨对虾工厂化养殖用水多来源于地下海水经砂滤后使用,进入养殖池前还要通过滤网过滤,经过多层过滤的水体中的微藻含量较少,因此,养殖前期密度偏低。养殖中、后期,水温逐渐升高,随着对虾的快速生长和投饵量的增加,大量未被摄食的残料、对虾排泄物等营养盐也在养殖池中累积,刺激了微藻的大量繁殖(刘孝竹等, 2011; 彭聪聪等, 2011)。C1池在最后一次采样时,颤藻生物量达到165 mg/L,占微藻总生物量的78%,C2池颤藻生物量也达到119 mg/L,占63%,水中可见颤藻丝状群体结块贴壁生长,对虾大量发病死亡。据曹平等(2011)报道,当颤藻浓度达到12.5 mg/L时,对虾成活率明显下降。虽然颤藻也能吸收氨氮、亚硝氮等有害物质,但高密度的颤藻极易引发“倒藻”,导致大量羟胺、硫化物等有毒物质释放,造成对虾应激死亡(Cremen et al, 2007)。因此,在养殖后期,应该注意对颤藻等不良微藻进行繁殖评估和有效控制。A2池微藻生物量明显低于其他养殖池,对虾虽未发病,但生长缓慢,终产量明显低于相同放养密度的A1池,分析原因可能是低密度的藻相结构造成了微藻对养殖系统调节能力的低下,水质多变不稳定,给对虾生长带来了不利影响。
多样性指数可用于定量反映浮游植物的异质性与稳定性,该指数越大,微藻群落信息含量越大,抗干扰能力越强,稳定性越高(孙耀等, 1998)。中、高密度对虾实验池微藻多样性指数呈现先升高后降低的趋势,可能是由于养殖前期水体经多层过滤,池中微藻种类和数量都极少,相应地多样性指数偏低,随着养殖的进行,生态系统逐步完善,稳定性增强,多样性指数也相应增加;到了养殖后期,由于蓝藻类的颤藻暴发性生长成为优势种,微藻群落演替向单一方向发展,表现为多样性指数迅速降低(彭聪聪等, 2011)。B1池中后期、C1和C2池后期,多样性指数多低于0.9,水质不同程度恶化,对虾表现出病症和死亡现象,其他虾池除几次低于0.9,其余多在0.9以上,对虾生长良好。这与郭皓等(1996)报道的结论相似。因此,在养殖过程中,当微藻多样性指数低于0.9时,应加强管理,预防对虾发病。
优势种可代表一个群落的生态特征(黄翔鹄等, 2002)。本研究中,对虾工厂化养殖的中后期,颤藻优势种占到总量的58%–90%,表明微藻总量的变动是由较为单一的优势种控制的。张才学等(2007)调查发现,湛江地区对虾工厂化养殖池后期,微藻优势种主要是小球藻和小环藻等耐污种类。李玉全等(2006)在青岛小麦岛进行的研究发现,对虾工厂化养殖池中的微藻群落以硅藻为主。本研究中,前期优势种主要以绿藻和硅藻的一些种类为主,中后期蓝藻的微囊藻和颤藻多演替成为优势种,与以上二者的研究结果有较大差异。可能原因是后期水体的高营养水平是颤藻等蓝藻大量暴发的原因,蓝藻的大量繁殖抑制了绿藻和硅藻等的生长(彭聪聪等, 2010)。对虾工厂化养殖模式是在小水体中进行的高密度商业化养殖方式,在养殖过程中受到投饵、换水、增氧、消毒等多种人工因子调控(孟庆武等, 2008),不同养殖地区、不同养殖工艺、养殖用水的处理方式等都有可能造成微藻优势种差异(吴斌等, 2008; 李雪松等, 2006)。
本研究发现,养殖密度对微藻群落的演替也有较大影响,较低养殖密度的A1池(300 ind/m2),大部分时间都以小球藻占优势地位,藻相良好,而B1池(400 ind/m2)和C1、C2池(500 ind/m2)在养殖后期,藻相被颤藻控制。卢静等(2000)报道,低密度(70 ind/m2)养殖围隔,微藻以硅藻种类的舟形藻(Navicule)和小环藻为主,中高养殖密度(210–350 ind/m2)虾池,裸甲藻属(Gymnodinium)、蓝球藻属(Chroococcus)等种类占优势。李玉全等(2013)报道,对虾养殖密度显著影响工厂化养殖系统氮磷的输出,随着养殖密度的增加,投饵量以及对虾的代谢物、排泄物都高于低养殖密度,使得高密度虾池的营养水平高于低密度虾池,水中不同的营养水平可能造成微藻演替差异。以上表明,过高的养殖密度可能是导致养殖后期蓝藻等不良微藻演替成为优势种的原因之一。
| Attayde JL, Hansson LA. Effects of nutrient recycling by zooplankton and fish on phytoplankton communities. Oecologia, 1999, 121(1): 47-54 DOI:10.1007/s004420050906 | |
| Cai LT, Chen C, Wang YN, et al. Dynamic change of the phytoplankton in the breeding ponds of Penaeus vannamei. Journal of Ningbo University (Natural Science and Engineering Edition), 2013, 26(2): 7-11 [蔡林婷, 陈晨, 王一农, 等. 凡纳滨对虾设施化养殖塘中浮游植物的动态变化. 宁波大学学报(理工版), 2013, 26(2): 7-11] | |
| Cao P, Huang XH, Li CL, et al. Effects of Oscillatoria sp. on growth and immune activities of Litopeuaeus vauuamei. Fishery Modernization, 2011(5): 25-30 [曹平, 黄翔鹄, 李长玲, 等. 颤藻对凡纳滨对虾生长和免疫相关酶活力的影响. 渔业现代化, 2011(5): 25-30] | |
| Chen JF, Lai YH, Tong WP. Fluctuation of pH values in water of industrialized cultivation of white leg shrimp Litopenaeus vannamei. Fisheries Science, 2006, 25(9): 457-458 [陈剑锋, 赖廷和, 童万平. 凡纳滨对虾工厂化养殖水体pH值的变化特征. 水产科学, 2006, 25(9): 457-458] | |
| Cremen MC, Martinez-Goss MR, Corre VL, et al. Phytoplankton bloom in commercial shrimp ponds using green-water technology. Journal of Applied Phycology, 2007, 19(6): 615-624 DOI:10.1007/s10811-007-9210-7 | |
| Guan CW, Liu H, Zhang YL. Experimental study on breeding Litopenaeus vannamei in recirculating aquaculture system. Fishery Modernization, 2010, 38(4): 21-25 [管崇武, 刘晃, 张宇雷. 凡纳滨对虾工厂化循环水养殖试验研究. 渔业现代化, 2010, 38(4): 21-25] | |
| Guo H, Yu ZG. The characterisitics of phytoplankton community in prawn pond and the relationships with shrimp disease. Marine Science, 1996(1): 39-45 [郭皓, 于占国. 虾池浮游植物群落特征及其与虾病的关系. 海洋科学, 1996(1): 39-45] | |
| Guo YJ. Chinese algae. Beijing: Science Press, 2003. [郭玉洁. 中国海藻志. 北京: 科学出版社, 2003.] | |
| Huang XH, Wang QH. A study on dominant phytoplankton species in high-level prawn ponds and its formation cause. Journal of Tropical Oceanography, 2002(4): 36-44 [黄翔鹄, 王庆恒. 对虾高位池优势浮游植物种群与成因研究. 热带海洋学报, 2002(4): 36-44] | |
| Li XS, Liang JR, Chen CP, et al. Species diversity of phytoplanktons in shrimp aquaculture areas in the Quanzhou Bay Fujian Province. Journal of Xiamen University (Natural Science), 2006(S1): 234-239 [李雪松, 梁君荣, 陈长平, 等. 泉州湾虾池浮游植物种类多样性研究. 厦门大学学报(自然科学版), 2006(S1): 234-239] | |
| Li YQ, Li J, Wang QY, et al. Analysis on structure and benefit of super-intensive and semi-intensive shrimp farming systems. Marine Fisheries Research, 2006, 27(5): 85-90 [李玉全, 李健, 王清印, 等. 对虾工厂化养殖与池塘养殖系统结构与效益比较分析. 海洋水产研究, 2006, 27(5): 85-90] | |
| Li YQ, Wang RJ, Jiang LX. Effects of density-stress on water quality and growth of Marsupenaeus japonicas. Marine Fisheries Research, 2013, 37(10): 53-57 [李玉全, 王仁杰, 姜令绪. 密度胁迫对日本囊对虾生长和水环境的影响. 海洋科学, 2013, 37(10): 53-57] | |
| Liu J, Qu KM, Liu HY, et al. Studies on features of water environment in industrialized shrimp culture system. Marine Fisheries Research, 2008, 29(6): 1-8 [刘娇, 曲克明, 刘海英, 等. 对虾工厂化养殖水环境基本特征研究. 海洋水产研究, 2008, 29(6): 1-8] | |
| Liu XZ, Cao YC, Li ZJ, et al. Study on microalgae community structure and its relationship with environment factors in the shrimp ponds during the later phases of culture period. Progress in Fishery Sciences, 2011, 32(3): 84-91 [刘孝竹, 曹煜成, 李卓佳, 等. 高位虾池养殖后期浮游微藻群落结构特征. 渔业科学进展, 2011, 32(3): 84-91] | |
| Lu J, Li DS, Dong SL. The impact of stocking density on plankton community in shrimp pond. Journal of Fisheries of China, 2000, 24(3): 240-246 [卢静, 李德尚, 董双林. 对虾池的放养密度对浮游生物群落的影响. 水产学报, 2000, 24(3): 240-246] | |
| Meng QW, Wang S, Zhao YJ, et al. The characteristics, development trend and prospects of prawn's industrial aquaculture in China. Ocean Development and Management, 2008, 25(3): 124-127 [孟庆武, 王圣, 赵玉洁, 等. 我国对虾工厂化养殖的特点、发展趋势及前景. 海洋开发与管理, 2008, 25(3): 124-127] | |
| Peng CC, Li ZJ, Cao YC, et al. Change of dominant species of planktonic microalgae in Litopenaeus vannamei's semi-intensive culture ponds and its impact on the culture environment. Marine Environmental Science, 2011, 30(2): 193-198 [彭聪聪, 李卓佳, 曹煜成, 等. 凡纳滨对虾半集约化养殖池塘微藻优势种变动规律及其对养殖环境的影响. 海洋环境科学, 2011, 30(2): 193-198] | |
| Sun Y, Li F, Li J, et al. Phytoplankton community characteristics and the interrelationship with nutrient salts in shrimp ponds. Marine Fisheries Research, 1998, 19(2): 45-51 [孙耀, 李锋, 李健, 等. 虾塘水体中浮游植物群落特征及其与营养状况的关系. 海洋水产研究, 1998, 19(2): 45-51] | |
| Wu B, Liao SM. Primary report of species composition of microalgae in the culture ponds of shrimp Litopenaeus vannamei in Beihai, Guangxi. Guangxi Sciences, 2008, 15(4): 452-455 [吴斌, 廖思明. 广西北海凡纳滨对虾养殖池塘中微型藻类组成调查. 广西科学, 2008, 15(4): 452-455] | |
| Xie LM, Lin XT, Xu ZN, et al. Phytoplankton communities and physical and chemical factors in different types of shrimp ponds. Ecologic Science, 2003, 22(1): 34-37 [谢立民, 林小涛, 许忠能, 等. 不同类型虾池的理化因子及浮游植物群落的调查. 生态科学, 2003, 22(1): 34-37] | |
| Zhang CX, Lao Z, Liu YL, et al. Change of phytoplankton and physicochemical factors in ponds of shrimp Peuaeus vauuamei with different cultural patterns during late period. Journal of Guangdong Ocean University, 2007, 27(4): 38-44 [张才学, 劳赞, 刘玉莲, 等. 凡纳滨对虾常见养殖模式下养殖后期浮游植物及理化因子的变化. 广东海洋大学学报, 2007, 27(4): 38-44] | |
| Zhao W. Hydrobiology. Beijing: China Agriculture Press, 2005. [赵文. 水生生物学. 北京: 中国农业出版社, 2005.] |



