2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室 青岛 266071;
4. 烟台开发区天源水产有限公司 烟台 264003
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
4. Yantai Tianyuan Aquatic Limited Corporation, Yantai 264003
大菱鲆(Scophthalmus maximus)是原产于欧洲大西洋海域的底栖硬骨鱼类,成鱼在12–40盐度范围内能较好的生长,甚至能在盐度低至5的水环境中生存(马爱军等, 2002)。为了适应大范围的盐度变化,鱼类往往进化出较为复杂的渗透调节机制,并通过控制基因的表达来控制离子平衡,从而达到渗透压平衡的效果(Burel et al, 1996)。近年来,有关广盐性鱼类渗透压调节机制的研究日趋完善。人们对鱼类渗透调节的研究,已经从由观察鳃丝及其氯细胞的形态变化、测定鳃丝等渗透调节器官Na+-K+-ATPase的活性和血浆激素浓度等生理生化方面(唐贤明等, 2006; 曾霖等, 2014; 郭黎等, 2012; 罗海忠等, 2015),深入到了分子水平的研究(刘珊等, 2011),而从分子方面揭示大菱鲆渗透压调节机制却少有报道。
催乳素(Prolactin, PRL)和Na+-K+-ATase作为盐度调控相关的主要功能基因,受到国内外越来越多学者的关注。王杰等(2012)在研究建鲤(Cyprinus carpio var. Jian)催乳素基因时发现,PRL在建鲤的多个渗透调节器官和组织都有表达。目前,已报道了金头鲷(Sparus aurata) (Laiz-Carrión et al, 2009)、建鲤(王杰等, 2012)、红鳍东方鲀(Takifugu rubripes)(Lee et al, 2006)、平鲷(Rhabdosargus sarba)(Kwong et al, 2008)、黄金鲈(Perca flavescens)(Lynn et al, 2007)、尼罗罗非鱼(Tilapia nilotica)(Shepherd et al, 1999)、斜带石斑鱼(Epinephelus coioides)(Zhang et al, 2004)、黑鲷(Acanthopagrus schlegelii)(Chang et al, 2007)、莫桑比克罗非鱼(Oreochromis mossambicus)(Breves et al, 2011)、金鱼(Carassius auratus)(Imaoka et al, 2000)、大西洋鲑(Salmo salar)(Ágústsson et al, 2003)、齐口裂腹鱼(Schizthorax prenanti)(Li et al, 2011)等鱼的PRL基因序列及其在不同盐度环境下的表达变化研究。
广盐性硬骨鱼盐度适应过程中血液皮质醇、生长激素水平增加刺激鳃上氯细胞内Na+-K+-ATPase mRNA的表达提高,酶活性的增加与氯细胞数量的增加及鳃Na+外排量成正比(McCormick, 2001)。目前,已报道了斑马鱼(Barchydanio rerio var)(Rajarao et al, 2001)、萨罗罗非鱼(Sarotherodon melanotheron) (Hwang et al, 1998)、虹鳟(Oncorhynchus mykiss) (Richards et al, 2003)、大西洋鲑(D’cotta et al, 1996)等鱼的Na+-K+-ATPase α1基因序列,并且证明了不同物种间的Na+-K+-ATPase α1基因的氨基酸序列极为保守。
研究表明,PRL与Na+-K+-ATPase两个功能基因具有极其显著的相关性,其中,PRL在脊椎动物中具有多种生理作用,而在鱼类中已知的主要功能是通过改变Na+-K+-ATPase活性来调控血浆渗透压的大小,以调节鱼体渗透压和离子平衡(Li et al, 2011)。广盐性鱼类从海水到淡水适应过程中,催乳素分泌增加明显使氯细胞变小并抑制Na+-K+-ATPase的活性,减少鳃对Na+、C1–的排出量(魏渲辉等, 2001)。因此,研究不同盐度条件下两种功能基因的相互作用极其表达变化,对于揭示鱼类渗透压调节的分子机制有着重要的理论意义,而此类研究鲜有报道。因此,本研究采用实时荧光定量PCR技术,检测不同盐度条件下不同组织内PRL和Na+-K+-ATPase α1两种功能基因的表达量变化,探索Na+-K+-ATPase α1、PRL基因在大菱鲆渗透调节过程中的作用和二者之间的相互作用,以期为大菱鲆的耐盐性研究提供科学依据,并为大菱鲆推广工作打下坚实的理论基础。
1 材料与方法 1.1 实验材料实验大菱鲆幼鱼取自山东省烟台天源水产有限公司,体长为(10.14±0.29) cm (n=300)的健康个体。正式实验前暂养2周,25尾/桶,盛水160 L,采用静水充气养殖,养殖用水为深井过滤海水。养殖用水盐度在30±1(对照组)的基础上,分别调至5±0.5、10±1、30±1、40±1和50±1这5个盐度,每个盐度设3个重复组,高盐度和低盐度由天然海水(盐度为30±1)与海水晶或淡水调配而成,每天换水率为90%。实验过程中不喂食。实验开始后5、12、24、53、102 h分别取样,每个盐度取4尾鱼,每条鱼分别取鳃和肠组织,迅速浸入10倍体积RNA保存液中,4℃暂存一昼夜,再转入–20℃冰箱长期保存,带回实验室进行实验。
1.2 总RNA提取及cDNA文库构建总RNA的提取按照总RNA试剂盒(RNA prep pure Tissue Kit, 天根)进行,琼脂糖电泳检测RNA的纯度,紫外分光光度计检测样品浓度。RNA原液置于–80℃保存。取1 μg总RNA,用Quant Reverse Transcriptase逆转录酶(TIANscript RT Kit, 天根),按照说明书合成cDNA第一链,–20℃保存。
1.3 实时荧光定量PCR检测实时荧光定量PCR试剂盒为北京天根生化科技有限公司的SuperReal PreMix Plus(SYBR Green);实时荧光定量PCR反应采用上海启文生物科技有限公司生产的FTC-3000P Real-Time Quantitative Thermal Cycler。根据GenBank中斑马鱼(Barchydanio rerio var) PRL序列,用Primer 5.0设计PRL基因引物,Na+-K+-ATPase α1基因的引物引用刘珊等(2012) (表 1),以大菱鲆β-actin基因为内参,由北京擎科新业生物技术有限公司合成。用Oligo6.0检验引物优劣,BLASTX验证引物特异性和唯一性。分别检测PRL和Na+-K+-ATPase α1基因在各组织的mRNA相对表达量。在96孔板中装入以下体系:2×SuperReal PreMix Plus 10 μl、50×ROX Reference Dye 0.4 μl、RNase-Free ddH2O 7.4 μl、引物F和引物R各0.6 μl、cDNA模板1 μl。PCR反应条件为95℃ 15 min,95℃ 10 s,60℃ 30 s,40个循环;最后在55–95℃制作熔解曲线。
|
|
表 1 PRL和Na+-K+-ATPase α1qPCR引物序列(刘珊等, 2012) Table 1 Primers of PRL and Na+-K+-ATPase α1 in quantitative PCR (Liu et al, 2012) |
利用网上资源http://blast.ncbi.nlm.nih.gov/Blast的blastN和blastX工具进行同源基因搜索。在保证扩增效率的前提下,正常条件下基因的组织分布表达分析采用2-ΔCt法,ΔCt=Ct(target)-Ct(reference),盐胁迫下基因在组织中的表达分析采用2-ΔΔCt法,ΔΔCt = ΔCt(test)-ΔCt(control),其中,ΔCt(test)=Ct(test, target)-Ct(test, reference),ΔCt(control)=Ct(control, target)-Ct(control, reference) (Schmittgen et al, 2000)。数据采用平均值±标准差(Mean±SD)表示。用Excel软件进行作图。应用SPSS19.0统计软件单因素方差分析(One-way ANOVA)及Duncan检验对数据进行统计学分析(P < 0.05为显著水平),相关性用分析-相关-双变量方法进行皮尔逊检验(Pearson correlation),判断两个基因是否具有相关性,Pearson系数相关公式为:
| $ {r_{xy}} = \frac{{\sum\limits_{i = 1}^n {({x_i} - \bar x)({y_i} - \bar y)} }}{{\sqrt {\sum\limits_{i = 1}^n {{{({x_i} - \bar x)}^2}\sum\limits_{i = 1}^n {{{({y_i} - \bar y)}^2}} } } }}. $ |
以大菱鲆β-actin为内参基因,荧光定量PCR检测肠、鳃中PRL mRNA的相对表达量,以盐度30数据为对照组,盐度5、10、40和50为实验组,进行数据分析。结果显示,PRL mRNA在肠、鳃中均有表达。鳃组织和肠组织中PRL mRNA的相对表达量,在高盐胁迫条件下,随盐度的升高呈现降低趋势;在低盐胁迫条件下,随盐度的降低呈现降低趋势,其中,正常盐度条件下表达量最高且差异极显著(P < 0.01)(图 1)。

|
图 1 PRL mRNA在肠、鳃中的表达 Figure 1 The mRNA expression of PRL in the gill and intestine 不同的字母代表组间差异显著(P < 0.05),下同 Different letters represented significant differences between groups (P < 0.05), the same as below |
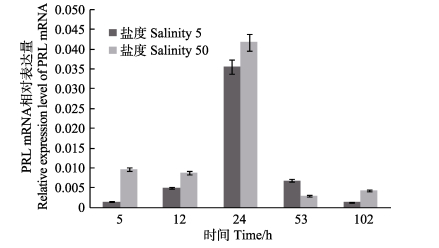
根据预实验结果,选取了在鳃、肠道2个组织中PRL mRNA表达差异性显著的2个极端盐度(50和5)开展时间累积效应分析。结果显示,鳃组织在盐度50和盐度5两组极端胁迫条件下,随实验时间延长,PRL mRNA的表达呈先升高后降低的趋势,且在第12小时达到峰值(图 2);而在盐度50和盐度5条件下的肠组织,在实验时间内PRL mRNA的表达均呈现先增加后减少的趋势,并且均在实验进行的第24小时达到峰值(图 3)。

|
图 2 鳃组织中PRL mRNA表达量 Figure 2 The mRNA expression of PRL in the gill |
|
图 3 肠组织中PRL mRNA表达量 Figure 3 The mRNA expression of PRL in the intestine |
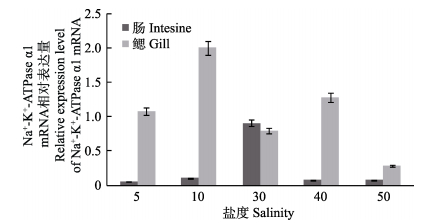
以大菱鲆β-actin为内参基因,荧光定量PCR检测肠、鳃中Na+-K+-ATPase α1 mRNA的相对表达量,以盐度30数据为对照组进行数据分析。结果显示,Na+-K+-ATPase α1 mRNA在肠和鳃中均有表达。肠组织中该基因表达量在高、低盐度胁迫条件下,随盐度的升高(或降低)呈现先升高后降低趋势,在正常盐度(30)时最高,差异极显著(P < 0.01);鳃组织中该基因表达量在高、低盐度胁迫条件下,随盐度的升高(或降低)均呈现降低趋势,其中,在盐度10时最高,差异极显著(P < 0.01)(图 4)。
|
图 4 Na+-K+-ATPase a1 mRNA在肠、鳃中的表达 Figure 4 The mRNA expression of Na+-K+-ATPase α1 in the gill and intestine |
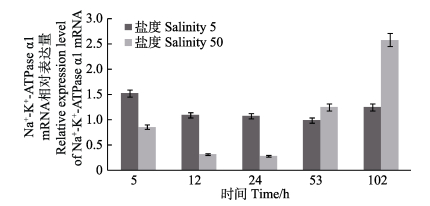
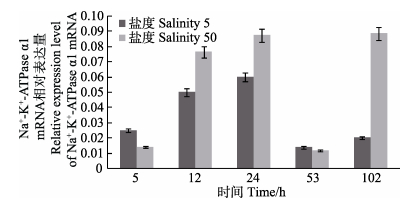
根据预实验结果,选取了Na+-K+-ATPase α1 mRNA在鳃、肠道两个组织中表达差异性显著的两个极端盐度(50和5)开展时间累积效应分析,具体结果如下:低盐(盐度5)胁迫后,鳃组织中的Na+-K+-ATPase α1 mRNA随时间没有显著性变化;高盐(盐度50)胁迫后,大菱鲆鳃组织Na+-K+-ATPase α1 mRNA表达水平整体呈先减少后增加的变化趋势,且在24 h内达到最低值后mRNA表达水平显著上调(P < 0.05)(图 5);盐度50和盐度5胁迫下的肠组织表现出相同的变化趋势,在胁迫24 h mRNA表达量达到最大值,其后出现显著降幅(P < 0.05)(图 6)。
|
图 5 鳃组织中Na+-K+-ATPase a1 mRNA表达量 Figure 5 The mRNA expression of Na+-K+-ATPase α1 in the gill |
|
图 6 肠组织中Na+-K+-ATPase a1 mRNA表达量 Figure 6 The mRNA expression of Na+-K+-ATPase α1 in the intestine |
不同盐度胁迫12 h、24 h和53 h条件下,PRL和Na+-K+-ATPase α1两种基因在肠组织中mRNA表达量变化趋势均相似,即以正常盐度(30)为对照,随着盐度升高或者降低两种基因的mRNA表达量都呈降低趋势(图 7);两种基因在3个时间点的相关系数分别为0.999、0.992和1,正相关性极显著(P < 0.01)。在鳃组织中,以正常盐度(30)为对照,3个时间点的Na+-K+-ATPase α1的mRNA表达量随着盐度的升高或下降,均呈现先升高后降低的趋势,而PRL的mRNA表达量则呈现下降趋势(图 8);二者表达量变化的拮抗作用表现为盐度在10–40区间内,当PRL的mRNA表达量呈现升高趋势时,Na+-K+-ATPase α1的mRNA表达量呈现下降趋势,而当PRL的mRNA表达量呈现下降趋势时,Na+-K+-ATPase α1的mRNA表达量都呈现上升趋势,而在盐度5和盐度50的极端胁迫条件下全部降低到最低点,PRL mRNA表达量较低时Na+-K+-ATPase α1 mRNA有较高的表达量;两种基因在3个时间点的相关系数分别为–0.864、–0.742、–0.945,负相关性不显著(P > 0.05)。
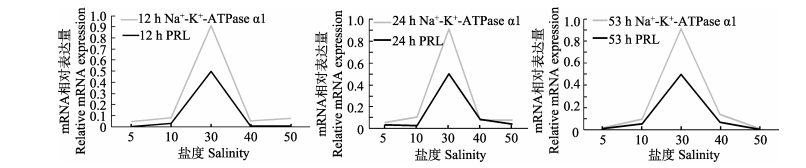
|
图 7 不同时间、不同盐度条件下PRL与Na+-K+-ATPase α1 mRNA在肠中表达变化 Figure 7 The variations in the mRNA expression of PRL and Na+-K+-ATPase a1 in the intestine under different salinities at different 17:39:02 |

|
图 8 不同时间、不同盐度条件下PRL与Na+-K+-ATPase α1 mRNA在鳃中表达变化 Figure 8 The variations in the mRNA expression of PRL and Na+-K+-ATPase a1 in the gill under different salinities at different 17:39:19 |
鳃是鱼类主要的渗透压调节器官,当水环境中的盐度发生变化时,鱼鳃中的氯细胞会分泌体内过多的Na+、Cl–,调节体液渗透压平衡。在低盐环境中,氯细胞中的线粒体数量少且不发达;在高盐环境下,氯细胞中的线粒体数量多且发达。氯细胞的这种结构和功能,是鱼类能够调整自身来适应环境中复杂的盐度变化的重要原因。王兵等(2011)对不同盐度下吉丽罗非鱼(O.niloticus×S.melanotheron F2)不同组织中NKCC1a基因mRNA表达量进行分析表明,鳃组织在吉丽罗非鱼高渗透压调节中起最主要作用。Pisam等(1993)研究发现,注射催乳素后的罗非鱼鳃中α氯细胞体积变小并出现了一些小的β氯细胞。肠是鱼体内营养物质消化吸收、水和离子(Na+)交换的主要场所,当肠内的Na+、Cl–较高时,肠道是被动吸收Na+、Cl–,也是维持水和盐平衡的重要器官(Hirose et al, 2003)。两种器官功能的实现都需要Na+-K+-ATPase。
催乳素PRL是由动物脑垂体合成分泌的一种单链多肽类激素(Kelly et al, 2001),其作用是防止体内离子的流失和外界水分的进入,降低体内器官的渗透性(Bole-Feysot et al, 1998)。PRL是Farmer等(1977)首先从非鲫脑垂体中分离出来。Na+-K+-ATPase又称Na-K泵,其由α、β两亚基组成。α亚基是催化亚基,由Na+-K+-ATPase α基因编码,α亚基存在4种同工型,分别是α1、α2、α3和α4,其中,α1型在各种组织中广泛存在,是一种维持Na+、K+浓度梯度及渗透压的管家基因(Lingrel et al, 2007)。左映平等(2007)研究表明,PRL可以降低肠对水和盐的通透性以及Na+-K+-ATPase的活性,从而减少对Na+、Cl–和水的吸收;在淡水环境中,PRL降低鳃中盐的排出量,增加肠中盐和水的摄取量。探讨不同盐度胁迫下鳃和肠组织中PRL和Na+-K+-ATPase两种基因的表达,对于研究大菱鲆渗透压调节机制有着非常重要的意义。
3.1 PRL基因对盐度胁迫的响应采用实时荧光定量PCR技术对大菱鲆幼鱼肠和鳃中PRL mRNA的表达量进行检测,结果显示PRL mRNA在两种组织中均有表达,这与王杰等(2012)的研究结果相似。Ágústsson等(2003)对大西洋鲑海水适应研究发现,PRL基因的表达量随着盐度的升高表达量明显上升,这与本研究结果基本一致,即从低盐度(5)到正常盐度(30)的升高过程中,PRL mRNA的相对表达量逐渐升高。但与Laiz-Carrión等(2009)对金头鲷(Sparus auratus)在高盐度(38)、中盐度(12)和低盐度(6)3种盐度条件下的PRL mRNA表达水平研究结果存在较大的差异。研究发现,随着盐度的升高,PRL mRNA的相对表达水平逐渐降低。这可能与大菱鲆较强的低盐度水体适应能力有密切的关系。大菱鲆有较强的渗透压调节能力,在淡水适应过程中随盐度的降低,进入鱼体的离子减少,需要调节离子的氯细胞的数量减少、体积减小,从而离子排出量减少,不需要通过催乳素的增加来减少鳃对Na+、Cl–的排出量来调节渗透压;也可能不需要通过增加催乳素降低上皮对离子和水的渗透性来调节离子平衡。
3.2 Na+-K+-ATPase α1基因对盐度胁迫的响应采用实时荧光定量PCR技术对大菱鲆幼鱼肠和鳃中Na+-K+-ATPase α1 mRNA的表达量进行检测,结果显示,Na+-K+-ATPase α1基因在两种组织中均有表达。当环境盐度发生变化时,机体细胞为了适应外界环境而快速应答,细胞内盐度有关的基因(如Na+-K+-ATPase α1)通过表达量的变化来调节机体细胞渗透压。在本研究的鳃组织中,以正常盐度(30)为对照,Na+-K+-ATPase α1 mRNA的表达量随着盐度的升高或下降,均呈现先升高后降低的趋势,原因可能是在高盐适应过程中,环境盐度升高后,会有更多的离子进入体内,为了排出过多的离子,鳃丝Na+-K+-ATPase活力逐步上升,以调节血清中过高的离子浓度,直至平衡。随着盐度的降低,进入鱼体内的离子减少,通过调节使氯细胞数量减少,体积缩小,所以Na+-K+-ATPase活性下降。随着盐度的进一步降低,进入体内的离子急剧减少,为防止各种离子的流失,需从外界水体中吸收离子,因此Na+-K+-ATPase活性会增加。
本研究结果显示,在盐度50和5的肠组织中,Na+-K+-ATPase α1 mRNA随时间呈先升高后降低最后趋于平缓的趋势,证明当环境盐度增加时伴随着Na+-K+-ATPase活性的剧烈升高,而随着盐度和时间的升高和延长,Na+-K+-ATPase活性逐渐降低。此阶段基因调控系统通过反馈调节系统使得机体与外界环境逐渐相适应,细胞内基因表达调控系统也随着环境的改变而改变。冯平等(2006)对青鳉鱼(Oryzias latipes)的研究发现,Na+-K+-ATPase α基因表达量不受盐度变化的影响,这与本研究盐度5中的鳃组织中Na+-K+-ATPase α1 mRNA的表达量随时间没有出现显著性变化的发现相一致。而Romão等(2001)认为盐度对鱼类鳃丝Na+-K+-ATPase的活力无显著影响,但是对河鲀鱼(Takifugu sp.)的研究发现,盐度对鳃丝Na+-K+-ATPase活力有显著的影响。这可能是不同种类的鱼渗透压调节能力和方式不同。本研究还发现,在盐度50中的鳃组织Na+-K+-ATPase α1 mRNA的表达量随时间呈先降低后升高的趋势,推测其是在高盐度胁迫初期,大菱鲆不需要Na-K泵排出Na+、泵进K+,来防止细胞水肿,胁迫后期细胞失水严重从而需要Na-K泵吸收离子保持细胞形态,进而细胞中Na+-K+-ATPase α1基因表达量上调。
3.3 两种基因在盐度胁迫下的相互作用本研究发现,在肠组织中PRL和Na+-K+-ATPase α1 mRNA的表达存在极显著(P < 0.01)的协同作用,两种基因在正常盐度时的表达量最高且差异最大,随着盐度升高或者降低两种基因的表达量都呈现出降低的趋势。由于肠是鱼类吸收水分和盐的重要器官,需要两种基因的协同作用调节体内渗透压来适应外界环境的变化。但在鳃组织中,两种基因的表达存在相关性较好但不显著(P > 0.05)的拮抗作用,在盐度为10–40区间内,当PRL mRNA表达量呈现升高趋势时,Na+-K+-ATPase α1 mRNA的表达量呈现下降趋势,而当PRL mRNA的表达量呈现下降趋势时,Na+-K+-ATPase α1 mRNA的表达量都呈现上升趋势。推测鳃是机体与外界接触的第一道防线,盐度变化对鳃的胁迫应激较为显著,从而使功能基因在分子水平上表现出较为敏感的变化。但大菱鲆具有较强的渗透压调节能力,盐度的变化并没有使得PRL对Na+-K+-ATPase α1 mRNA的表达水平产生较强的抑制作用。也可能是由于在高盐度和低盐度下,环境盐度与体内渗透压差距过大,需要消耗大量的Na+-K+-ATPase来维持生命活动,从而导致两种基因的拮抗作用不显著。但是,在相同盐度胁迫下Na+-K+-ATPase α1 mRNA表达水平显著高于PRL的表达量,其中,PRL mRNA表达量的降低减少了对Na+-K+-ATPase α1基因的抑制,使得Na+-K+-ATPase α1 mRNA的表达水平在短时间内提高。证实了PRL具有抑制Na+-K+-ATPase活性的作用,这与Herndon等(1991)和Pisam等(1993)对海水罗非鱼注射PRL后会导致鳃盖氯细胞中Na+-K+-ATPase斑状分布以及数量的减少的结果相吻合。
4 结论本研究采用实时荧光定量PCR技术,检测大菱鲆不同盐度下不同时间点不同组织中PRL和Na+-K+-ATPase α1 mRNA的表达量。对结果的统计分析发现,两种基因存在组织和时间特异性。研究表明,两种基因作为渗透压调节基因在鱼体内的定量分布和鱼的种类、生长环境和生长阶段相关。基因对环境变化做出的应答机制是多种基因相互作用的复杂过程,PRL和Na+-K+-ATPase α1基因具有相同的作用位点,因此可能存在表达上的相互作用。为在分子水平上阐述大菱鲆的渗透压调节机制,为大菱鲆的内陆推广和海陆交接提供科学依据,大菱鲆盐度基因有待更深入的研究。
| Ágústsson T, Sundell K, Sakamoto T, et al. Pituitary gene expression of somatolactin, prolactin, and growth hormone during Atlantic salmon parr-smolt transformation. Aquaculture, 2003, 222(1-4): 229-238 DOI:10.1016/S0044-8486(03)00124-8 | |
| Bole-Feysot C, Goffin V, Edery M, et al. Prolactin (PRL) and its receptor: Actions, signal transduction pathways and phenotypes observed in PRL receptor knockout mice. Endocrine Reviews, 1998, 19(3): 225-268 DOI:10.1210/edrv.19.3.0334 | |
| Breves JP, Seale AP, Helms RE, et al. Dynamic gene expression of GH/PRL-family hormone receptors in gill and kidney during freshwater-acclimation of Mozambique tilapia. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2011, 158(2): 194-200 DOI:10.1016/j.cbpa.2010.10.030 | |
| Burel C, Ruyet JPL, Gaumet F, et al. Effects of temperature on growth and metabolism in juvenile turbot. Journal of Fish Biology, 1996, 49(4): 678-692 DOI:10.1111/jfb.1996.49.issue-4 | |
| Chang YJ, Min BH, Choi CY. Black porgy (Acanthopagrus schlegeli) prolactin cDNA sequence: mRNA expression and blood physiological responses during freshwater acclimation. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 147(1): 122-128 DOI:10.1016/j.cbpb.2007.01.006 | |
| DxCotta HC, Gallais C, Saulier B, et al. Comparison between parr and smolt Atlantic salmon (Salmo salar) α subunit gene expression of Na+/K+ ATPase in gill tissue. Fish Physiology and Biochemistry, 1996, 15: 29-39 DOI:10.1007/BF01874835 | |
| Farmer SW, Papkoff H, Bewley TA, et al. Isolation and properties of teleost prolactin. General and Comparative Endocrinology, 1977, 31(1): 60-71 DOI:10.1016/0016-6480(77)90191-5 | |
| Feng P, Wang F, Fan GL. The effect of salinity on intestine Na+-K+-ATPase genes experssion of medaka (Oryzias latipes). Acta Agriculturae Boreali-Occidentalis Sinica, 2006, 15(6): 24-27 [冯平, 王峰, 范光丽. 盐度对青鳉鱼肠内Na+-K+-ATPase基因表达的影响. 西北农业学报, 2006, 15(6): 24-27] | |
| Guo L, Mai AJ, Wang XA, et al. Effects of temperature and salinity on the activities of antioxidant enzymes of juvenile turbot Scophthalmus maximu. Journal of Dalian Ocean University, 2012, 27(5): 422-428 [郭黎, 马爱军, 王新安, 等. 盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响. 大连海洋大学学报, 2012, 27(5): 422-428] | |
| Herndon TM, Mccormick SD, Bern HA. Effects of prolactin on chloride cells in opercular membrane of seawater-adapted tilapia. General and Comparative Endocrinology, 1991, 83(2): 283-289 DOI:10.1016/0016-6480(91)90032-2 | |
| Hirose S, Kaneko T, Naito N, et al. Molecular biology of major components of chloride cells. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2003, 136(4): 593-620 DOI:10.1016/S1096-4959(03)00287-2 | |
| Hwang PP, Fang MJ, Tsai JC, et al. Expression of mRNA and protein of Na+-K+-ATPase α subunit in gills of tilapia (Oreochromis mossambicus). Fish Physiology and Biochemistry, 1998, 18(4): 363-373 | |
| Imaoka T, Matsuda M, Mori T. Extrapituitary expression of the prolactin gene in the goldfish, African clawed frog and mouse. Zoological Science, 2000, 17(6): 791-796 DOI:10.2108/zsj.17.791 | |
| Kelly PA, Binart N, Lucas B, et al. Implications of multiple phenotypes observed in prolactin receptor knockout mice. Frontiers in Neuroendocrinology, 2001, 22(2): 140-145 DOI:10.1006/frne.2001.0212 | |
| Kwong AKY, Woo NYS. Prolactin-releasing peptide, a possible modulator of prolactin in the euryhaline silver sea bream (Sparus sarba): A molecular study. General and Comparative Endocrinology, 2008, 158(2): 154-160 DOI:10.1016/j.ygcen.2008.06.006 | |
| Laiz-Carrión R, Fuentes J, Redruello B, et al. Expression of pituitary prolactin, growth hormone and somatolactin is modified in response to different stressors (salinity, crowding and food-deprivation) in gilthead sea bream Sparus auratus. General and Comparative Endocrinology, 2009, 162(3): 293-300 DOI:10.1016/j.ygcen.2009.03.026 | |
| Lee KM, Kaneko T, Aida K. Prolactin and prolactin receptor expressions in a marine teleost, pufferfish Takifugu rubripes. General and Comparative Endocrinology, 2006, 146(3): 318-328 DOI:10.1016/j.ygcen.2005.12.003 | |
| Lei JL. Marine fish culture theory and techniques. Beijing: China Agriculture Press, 2005. [雷霁霖. 海水鱼类养殖理论与技术. 北京: 中国农业出版社, 2005.] | |
| Li C, Chen X, Zhang Y, et al. Molecular and expression characterization of growth hormone/prolactin family genes in the Prenant's schizothoracin. Molecular Biology Reports, 2011, 38(7): 4595-4602 DOI:10.1007/s11033-010-0592-2 | |
| Lingrel JB, Williams MT, Vorhees CV, et al. Na, K-ATPase and the role of α isoforms in behavior. Journal of Bioenergetics and Biomembranes, 2007, 39(5-6): 385-389 DOI:10.1007/s10863-007-9107-9 | |
| Liu S, Li B, Zhang CF, et al. Research advance on osmoregulation in teleost fish. Journal of Anhui Agricultural Sciences, 2011, 39(20): 12239-12242 DOI:10.3969/j.issn.0517-6611.2011.20.103 [刘珊, 李冰, 张成锋, 等. 硬骨鱼类渗透调控的研究进展. 安徽农业科学, 2011, 39(20): 12239-12242] | |
| Luo HZ, Li WY, Fu RB, et al. The effects of salinity on the growth of juvenile Eleutheronema tetradactylum and Na+/K+-ATP enzyme. Progress in Fishery Sciences, 2015, 36(2): 94-99 DOI:10.11758/yykxjz.20150212 [罗海忠, 李伟业, 傅荣兵, 等. 盐度对四指马鲅(Eleutheronema tetradactylum)幼鱼生长及其鳃丝Na+/K+-ATP酶的影响. 渔业科学进展, 2015, 36(2): 94-99] | |
| Lynn SG, Shepherd BS. Molecular characterization and sex-specific tissue expression of prolactin, somatolactin and insulin-like growth factor-Ⅰ in yellow perch (Perca flavescens). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 147(3): 412-427 DOI:10.1016/j.cbpb.2007.02.005 | |
| Ma AJ, Lei JL, Chen SQ, et al. Effects of spawning season on biologic and biochemistry characteristic of eggs of turbot Scophthalmus maximus L. Oceanologia et Limnologia Sinica, 2002, 33(1): 75-82 DOI:10.11693/hyhz200201012012 [马爱军, 雷霁霖, 陈四清, 等. 大菱鲆产卵季节对卵子的生物学及生化特征的影响. 海洋与湖沼, 2002, 33(1): 75-82] | |
| McCormick SD. Endocrine control of osmoregulation in teleost fish. American Zoologist, 2001, 41(4): 781-794 | |
| Pisam M, Auperin B, Prunet P, et al. Effects of prolactin on α and β chloride cells in the gill epithelium of the saltwater adapted tilapia "Oreochromis niloticus". The Anatomical Record, 1993, 235(2): 275-284 | |
| Rajarao SJR, Canfield VA, Mohideen MAPK, et al. The repertoire of Na, K-ATPase α and β subunit genes expressed in the zebrafish, Danio rerio. Genome Research, 2001, 11(7): 1211-1220 DOI:10.1101/gr.186001 | |
| Richards JG, Semple JW, Bystriansky JS, et al. Na+/K+-ATPase α-isoform switching in gills of rainbow trout (Oncorhynchus mykiss) during salinity transfer. The Journal of Experimental Biology, 2003, 206: 4475-4486 DOI:10.1242/jeb.00701 | |
| Romão S, Freire CA, Fanta E. Ionic regulation and Na+, K+-ATPase activity in gills and kidney of the Antarctic aglomerular cod icefish exposed to dilute sea water. Journal of Fish Biology, 2001, 59(2): 463-468 | |
| Schmittgen TD, Zakrajsek BA. Effect of experimental treatment on housekeeping gene expression: validation by realtime, quantitative RT-PCR. Journal of Biochemical and Biophysical Methods, 2000, 46(1): 69-81 | |
| Shepherd BS, Sakamoto T, Hyodo S, et al. Is the primitive regulation of pituitary prolactin (tPRL177 and tPRL188) secretion and gene expression in the euryhaline tilapia (Oreochromis mossambicus) hypothalamic or environmental?. Journal of Endocrinology, 1999, 161(1): 121-129 DOI:10.1677/joe.0.1610121 | |
| Tang XM, Sui Z, Tian JB, et al. Effects of salinity on metabolic rate of juvenile turbot (Scophamus maximus). South China Fisheries Science, 2006, 2(4): 54-58 [唐贤明, 隋曌, 田景波, 等. 盐度对大菱鲆幼鱼耗氧率和排氨率的影响. 南方水产科学, 2006, 2(4): 54-58] | |
| Wang B, Fan WJ, Li SF. Tissue-specific changes of NKCC1a mRNA expression by salinity in "GILI" tilapia. Journal of Fishery Sciences of China, 2011, 18(3): 515-522 [王兵, 范武江, 李思发. 不同盐度下"吉丽"罗非鱼(尼罗罗非鱼♀×萨罗罗非鱼♂) NKCCla mRNA的组织特异性表达. 中国水产科学, 2011, 18(3): 515-522] | |
| Wang J, Li B, Zhang CF, et al. Full-length cDNA cloning and tissue expression of PRL from Cyprinus carpio var. jian. Journal of Shanghai Ocean University, 2012, 21(6): 935-944 [王杰, 李冰, 张成锋, 等. 建鲤催乳素基因全长cDNA的克隆及序列分析和组织表达. 上海海洋大学学报, 2012, 21(6): 935-944] | |
| Wei XH, Ru SG, Xu L, et al. Structural and functional changes of euryhaline fish branchial chloride cell and hormonal regulation during seawater and freshwater adaptation. Marine Sciences, 2001, 25(4): 16-20 [魏渲辉, 汝少国, 徐路, 等. 海水和淡水适应过程中广盐性鱼类鳃氯细胞的形态与功能变化及其激素调节. 海洋科学, 2001, 25(4): 16-20] | |
| Zeng L, Lei JL, Liu B, et al. Effects of salinity on Na+-K+-ATPase activity in gills, and concentrations of ions and hormones in serum of juvenile turbot (Scophthalmus maximus). Chinese Journal of Zoology, 2014, 49(3): 407-414 [曾霖, 雷霁霖, 刘滨, 等. 盐度对大菱鲆幼鱼鳃Na+-K+-ATPase活力, 血清离子浓度和激素水平的影响. 动物学杂志, 2014, 49(3): 407-414] | |
| Zhang W, Tian J, Zhang L, et al. cDNA sequence and spatio-temporal expression of prolactin in the orange-spotted grouper, Epinephelus coioides. General and Comparative Endocrinology, 2004, 136(1): 134-142 DOI:10.1016/j.ygcen.2003.12.001 | |
| Zuo YP, Cao JS. The role of prolactin on fish osmotic adjustment. Chemistry of Life, 2007, 27(5): 455-457 [左映平, 曹劲松. 鱼类体内催乳素的渗透调节作用. 生命的化学, 2007, 27(5): 455-457] |



