2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 河北鑫海水产生物技术有限公司 黄骅 061100;
4. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Hebei Xinhai Aquatic Biological Technology Co., Ltd, Huanghua 061100;
4. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
凡纳滨对虾(Litopenaeus vannamei)是我国重要的对虾养殖品种,2015年产量达160多万t,占全国对虾养殖总产量的80%以上(农业部渔业局, 2015)。凡纳滨对虾可在盐度为0.5~40的范围内生存,仔虾期经淡化后可在低盐度条件下生长。随着凡纳滨对虾淡化培育技术的发展,低盐度养殖已成为凡纳滨对虾的主要养殖模式之一(杨海朋等, 2014)。国内低盐度养殖产量超过73万t (农业部渔业局, 2015),但尚未培育出专门针对低盐度养殖的新品种。
在正常海水盐度养殖条件下,国内外学者对凡纳滨对虾的选育已见成效。Goyard等(1992)开展了凡纳滨对虾的选育工作,F4和F5生长率分别提高了18%和21%;Donato等(2005)对凡纳滨对虾持续选育11代,显著提高了其存活率和生长速率;黄永春等(2010)选育了经白斑综合征病毒(WSSV)感染的凡纳滨对虾家系,其存活率显著高于对照组。国内凡纳滨对虾种虾主要来自正大、SIS等国际种虾公司,其性状测试主要在国外测试场进行,尚未在国内针对包括低盐度养殖在内的各种养殖模式建立性状测试场。种虾引入国内后,可能会存在较强的基因型与环境互作效应。
已有研究表明,在低盐条件下,凡纳滨对虾的生长速率、特定生长率、饲料转化率和抗逆性等均较低(申玉春等, 2010、2012; Wang et al, 2010)。因此,针对凡纳滨对虾低盐度养殖模式开展选择育种研究势在必行。当前,主要是以家系为基础开展凡纳滨对虾选择育种,利用数量遗传学估计重要经济性状的遗传参数,预测其育种值,比较不同家系和个体间性能差异,通过最优化配种技术组配优秀家系和个体,不断提高育种群体的遗传进展。为有效开展针对低盐度养殖模式的选择育种研究,首先,需要估计目标性状的遗传参数;其次,为提高选择强度、增加遗传进展和降低近交率等,要求育种群体维持一定规模的家系数量(Gitterle et al, 2005a)。目前,多数低盐度环境下凡纳滨对虾家系存活性能研究报道涉及的家系数量少,且尚未大规模开展家系在低盐度环境下生长和存活性能的测试和遗传评估研究。本研究从凡纳滨对虾育种核心群2015G4代家系中,随机选择100个家系,在低盐度条件下测试和比较家系幼虾淡化和养殖阶段的存活率,并进一步估计了2个阶段存活性状的遗传参数,为选育适应低盐度养殖条件下的凡纳滨对虾优良新品种提供数据支持。
1 材料与方法 1.1 家系构建在河北鑫海水产生物技术有限公司遗传育种中心测试车间开展家系幼虾淡化和养殖测试实验。实验用亲虾为2014G3代育种核心群个体。该育种群体以生长速度和存活率为育种目标性状,已经连续选育了4个世代(Sui et al, 2016)。由于该群体系谱清楚,家系间存在遗传联系,可以更准确地估计存活性状的遗传参数。通过眼柄标记后进行强化培育,并从中挑选性腺发育成熟的亲虾,根据配种方案并利用定向交尾技术构建2015G4代家系,在170 L白桶孵化。孵化出幼体后,每个家系随机留取10000尾在170 L白桶培育至仔虾,之后再随机留取1500尾至170 L白桶继续培育,期间主要投喂虾片、螺旋藻(Spirulina)、卤虫(Artemia)和配合饲料等。每4 h投喂1次,投喂量及比例根据不同发育时期适当调整,每天换水并逐渐加大换水量,直至所有家系变为仔虾。
1.2 家系幼虾淡化和养殖测试随机选取100个家系(表 1),每个家系随机选取150尾个体应用于淡化和养殖实验。淡化养殖分2个阶段,第1阶段是淡化过程,盐度从30降到5,持续32 d;第2阶段是低盐度养殖过程,持续37 d。
|
|
表 1 凡纳滨对虾2015G4代淡化测试全(半)同胞家系数及其亲本数量 Table 1 The number of sires, dams, full-sib and half-sib families in the generation G4 of L. vannamei |
第1阶段:每个家系测试个体置于(0.4×0.4×1.0) m3的网箱中,暂养7 d。淡化过程主要是通过排出高盐度海水并加入人工配制的低盐度海水完成;低盐度海水由正常盐度海水中加入一定量的淡水并经充分曝气配制而成;每天降低盐度为1~2,直到盐度降低至5时淡化过程结束。淡化过程投喂虾片、配合饲料并通过调整比例逐步过渡到仅有配合饲料,每6 h投喂1次。淡化结束后,凡纳滨对虾家系在盐度为5的水体中稳定10 d。
第2阶段:统计每个家系的存活个体数,计算第1阶段每个家系存活率,然后将存活个体移入0.7×0.7×1.0 m3网箱中,在盐度为5的海水中持续养殖37 d。养殖过程中投喂配合饲料,每6 h投喂1次,每天换水,换水量为20%,及时捞取残饵。第2阶段结束,达到VIE(Visible Implant Elastomer)标记规格时,统计每个家系的存活个体数,计算本阶段养殖存活率,取样30尾个体测量每个家系的平均体重。上述整个过程温度为(26.5±0.4)℃,pH为8.01±0.30。
1.3 数据分析对于存活性状,存活个体记录为1,死亡个体记录为0。利用广义线性混合效应模型和AIREML (Average information restricted maximum likelihood method)方法估计存活性状的方差组分(栾生等, 2013)。育种分析模型为父母本模型:
模型A:
| $ \Pr \left({{y_{ijk}} = 1} \right) = \Pr \left({{l_{ijk}} > 0} \right) = \mathit{\Phi }\left({{\rm{ \mathsf{ μ} }} + {\rm{Ag}}{{\rm{e}}_{\rm{k}}} + {s_i} + {d_j}} \right) $ | (1) |
模型A+C:
| $ \Pr \left({{y_{ijk}} = 1} \right) = \Pr \left({{y_{ijk}} > 0} \right) = \mathit{\Phi }\left({{\rm{ \mathsf{ μ} }} + {\rm{Ag}}{{\rm{e}}_{\rm{k}}} + {f_n} + {s_i} + {d_j}} \right) $ | (2) |
式中,yijk或yijkn表示第k尾虾的存活状态(1为存活,0为死亡);lijk或lijkn为潜在变量,假定符合累积标准正态分布,如果lijk或lijkn > 0,那么yijk或yijkn=1;如果lijk或lijkn≤0,那么yijk或yijkn=0;μ为总体均值;Agek为第k尾虾日龄;si为第i个父本的加性遗传效应,dj为第j个母本的加性遗传效应,fn是由于家系单独养殖产生的共同环境效应。
存活性状的遗传力计算公式:
模型A:
模型A+C:
式中,
基于Probit模型估计的遗传力,是基于潜在变量尺度,需要转换为表型值尺度,转换公式为(Robertson et al, 1949):
| $ h_p^2 = \frac{{{z^2}}}{{\bar p\left({1 - \bar p} \right)}}h_l^2 $ |
式中,
z-score用来检验遗传力估计遗传力估计值与0之间是否存在显著差异。其公式为:
| $ z = \frac{{{x_i}}}{{{\sigma _i}}} $ |
式中,xi是存活性状的遗传力估计值,
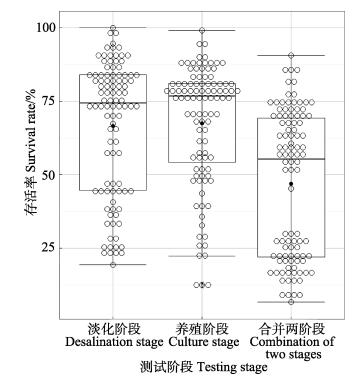
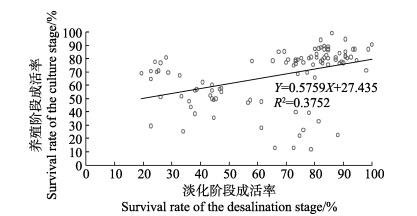
凡纳滨对虾家系幼虾期2个阶段存活率的描述性统计参数见表 2。家系幼虾期淡化和养殖阶段存活率平均值分别为66.69%和67.48%,后者略高于前者。每个阶段家系间存活率差异达到显著性水平(P < 0.05)。家系幼虾期整体存活率均值为46.91%,最小值为6.67%,最大值为90.67%,变异系数高达53.51%。箱形图也显示(图 1),家系存活率均值与中位数不重合,上下Whisker长度不一致,低存活率家系间存较大差异。淡化与养殖阶段家系存活率的相关系数为0.61 (P < 0.01),表现为中度线性正相关(0.3 < r < 0.8)(图 2)。测试日龄与淡化、养殖阶段和合并阶段的存活率的相关系数分别为0.46±0.09 (P < 0.01)、0.16±0.10 (P > 0.05)和0.36±0.09 (P < 0.01),平均体重与养殖阶段存活率的相关系数为0.19±0.10 (P > 0.05)。
|
|
表 2 凡纳滨对虾幼虾淡化和养殖阶段存活性状的家系数量﹑均值﹑最小值﹑最大值﹑标准差和变异系数 Table 2 The number, mean, minimum, maximum, standard deviation and coefficient of variation for survival rate of the juvenile Pacific white shrimp L. vannamei at desalination and culture stages |
|
图 1 凡纳滨对虾家系幼虾淡化和养殖阶段存活率箱形图 Figure 1 Box plot of the survival rate of the juvenile Pacific white shrimp L. vannamei at desalination and culture stages 箱形图盒子由中位数、第1四分位数和第3四分位数组成。Whisker上限值和下限值用横线表示,线外数值为异常值 The median, 25th and 75th percentiles are plotted as boxes. Upper and lower limits of whiskers were shown as lines. Data beyond the end of the whiskers are outliers. |
|
图 2 凡纳滨对虾家系幼虾淡化和养殖阶段存活率散点图 Figure 2 Scatter plot of the survival rate of the juvenile Pacific white shrimp L. vannamei at desalination and culture stages |
幼虾淡化和养殖阶段存活性状的遗传参数见表 3。模型中仅包括加性遗传效应(模型A),获得2个阶段存活性状的转换后遗传力分别为0.46和0.41,2个阶段数据合并后得到的转换后遗传力估计值为0.53,z-score检验显示,与0相比,达到极显著水平(z > gt; 2.58);在模型中进一步包括共同环境效应(A+C),获得2个阶段存活性状的转换后遗传力分别为0.06和0.05,2个阶段数据合并后得到的转换后遗传力估计值为0.07,与0相比,估计值均未达到显著水平(z < 1.96)。由家系单独养殖产生的共同环境方差所占比例较大,3个阶段c2估计值均为0.23,且与0相比,统计性检验达到显著。基于A模型和A+C模型,获得的2个阶段间家系存活性状育种值的相关系数分别为0.41±0.09和0.48±0.09。对于广义线性模型,难以用LogL值评价模型优劣,比较A模型和A+C模型的BIC值,后者小于前者,因此,A+C模型更优。
|
|
表 3 凡纳滨对虾家系幼虾淡化和养殖阶段存活性状遗传参数估计 Table 3 Genetic parameters in survival rate of juvenile families for desalination and culture stage in Pacific white shrimp L. vannamei |
本研究中,凡纳滨对虾幼虾100个家系在淡化阶段和养殖阶段的存活率差异极显著,变异系数较大(30.75%~53.51%),家系间适应低盐度的能力差异可能由家系的遗传差异性导致;2个阶段家系存活相关系数为0.61,说明整体趋势表现为在淡化阶段存活率高的家系在养殖阶段的存活率也较高。在低盐度条件下,环境与体液形成的渗透压差会造成对虾生理状态的变化。对虾个体的渗透压调节能力影响着其生长和存活状态。甲壳动物维持渗透压平衡主要是通过调节血淋巴中无机离子以及其他渗透压效应物含量,调节能力主要取决于血淋巴中水分和无机离子的通透性以及渗透压效应物的含量(潘鲁青等, 2005)。凡纳滨对虾淡水耐受性实验结果可作为评价虾苗质量的一项指标,淡水耐受性较强的家系在养殖过程中的生长速度及存活率有一定优势。不同家系由于遗传背景不同致使其渗透压调节能力存在差异。丁森等(2007)研究发现,对虾不同发育时期的渗透压调节能力不同,随着个体发育其调节能力逐渐增强。本研究分析也表明,日龄与淡化、养殖和合并阶段存活率存在一定程度的正相关(0.16~0.46)。因此,为了准确地估计不同阶段存活性状的遗传参数,需将日龄作为协变量纳入模型中校正不同家系的存活率。
3.2 凡纳滨对虾家系存活性状的遗传参数存活性状在数量遗传学上被称为阈值性状,是一类表型符合二项分布(存活和死亡),但在遗传上由多基因决定的复杂性状,水产动物中应用的主要有线性动物模型和父母本阈模型两种方法(张嘉晨等, 2016)。已有学者利用线性动物模型估计了尼罗罗非鱼(Oreochromis niloticus)存活率遗传力(0.03~0.14) (Rezk et al, 2009),栾生等(2012)利用父母本阈模型估计了斑点叉尾(Ictalurus punctatus)存活率遗传力(0.021~0.053)。殷宗俊等(2005)认为,利用GLMM方法和父母本阈模型优于常规线性模型。本研究利用父母本阈值模型估计了凡纳滨对虾幼虾淡化和养殖阶段存活性状的遗传力,基于A+C模型获得的估计值为0.05~0.07,属于低遗传力。Caballero-Zamora等(2015)和Gitterle等(2005a)估计凡纳滨对虾存活率遗传力为(0.06±0.03)和(0.04~0.10),也均表现为低遗传力。其他水产动物如中国对虾(Fenneropenaeus chinensis) (0.03±0.021) (栾生等, 2008)、大菱鲆(Scophthalmus maximus) (0.06~0.12) (Wang et al, 2010)、罗氏沼虾(Macrobrachium rosenbergii) (0.007±0.020~0.066±0.44) (Luan et al, 2015)的存活性状估计值也均属于低遗传力。利用线性动物模型获得的斑节对虾(Penaeus monodon)存活率遗传力估计值较高(0.27±0.07和0.36~0.71) (Kenway et al, 2006; Krishna et al, 2011),主要因为模型中无法有效地剖分出由家系单独养殖产生的共同环境效应。Gitterle等(2005b)研究表明,收获体重及存活性状的共同环境效应占有一定的比例,因此,在估计体重和存活性状遗传力时应剖分共同环境效应。同时也指出,应通过标准化各家系的养殖条件以及缩短标记前暂养时间来降低共同环境效应。
本研究中,利用A和A+C模型获得的存活性状的遗传力估计值差别较大,其主要原因有两个。第一个因素是各网箱的环境差异较大。由于幼虾个体小,无法标记家系进行混养测试,每个家系个体不得不在单独的网箱中养殖。尽管各个网箱同处一个养殖池,整个大环境条件基本一致,但不同网箱的内部环境还是存在较大差异。在养殖过程中,由于不同家系的遗传差异性导致在低盐度环境下的存活率不一致,进而产生养殖密度差异。这种养殖密度差异会导致网箱内个体间的竞争性、饲料利用率存在差异。竞争性的强弱会影响网箱的存活率。网箱面积小,清理困难,多余的饲料和粪便等会导致不同网箱的水质存在较大差别,也会影响存活率。第二个原因是半同胞家系比例较低,导致难以准确剖分出共同环境效应。本研究群体半同胞家系数量仅占47%,而且由于二项分布的特点,使每个家系仅有1个存活率数据,没有重复,实验数据较少,导致遗传力估计值存在偏差。随着选育世代的增加,测试规模的不断扩大,系谱信息和家系测定数据的不断累积,存活性状遗传力估计值将更加准确。此外,仔虾期直接混养家系个体,然后基于微卫星等分子标记亲子鉴定技术识别不同家系个体,将会大幅度地降低共同环境效应,生长和存活性状遗传参数估计值会更加准确。
| Caballero-Zamora A, Montaldo HH, Campos-Montes GR, et al. Genetic parameters for body weight and survival in the Pacific white shrimp Penaeus (Litopenaeus) vannamei affected by a white spot syndrome virus (WSSV) natural outbreak. Aquaculture, 2015, 447: 102-107 DOI:10.1016/j.aquaculture.2014.08.028 | |
| Ding S. The basic research of effects of salinity fluctuation on the ecophysiology of Fenneropenaeus chinensis. Masterxs Thesis of Ocean University of China, 2007, 35–48 [丁森. 盐度变化对中国明对虾生理生态学影响的基础研究. 中国海洋大学硕士研究生学位论文, 2007, 35–48] | |
| Donato MD, Manrique R, Ramirez RC, et al. Mass selection and breeding effects on a cultivated strain of Penaeus (Litopenaeus) vannamei in Venezuela. Aquaculture, 2005, 247(1–4)): 159-167 | |
| Gitterle T, Rye M, Salte R, et al. Genetic (co)variation in harvest body weight and survival in Penaeus (Litopenaeus) vannamei under standard commercial conditions. Aquaculture, 2005a, 243(1–4): 83-92 | |
| Gitterle T, Salte R, Gjerde B, et al. Genetic (co)variation in resistance to white spot syndrome virus (WSSV) and harvest weight in Penaeus (Litopenaeus) vannamei. Aquaculture, 2005b, 246(1–4): 139-149 | |
| Goyard E, Patmis J, Peigllon JM. IF-REMER's shrimp genetics program. Aquaculture Advocate, 1992, 2(6): 26-28 | |
| Huang YC, Ai HS, Yin ZX, et al. Studies on WSSV-resistant and immune characteristic of 4th generation selective breeding families for resistant to the white spot syndrome virus (WSSV) of Litopenaeus vannamei. Journal of Fisheries of China, 2010, 34(10): 1549-1557 [黄永春, 艾华水, 殷志新, 等. 第四代凡纳滨对虾抗WSSV选育家系的抗病及免疫特性研究. 水产学报, 2010, 34(10): 1549-1557] | |
| Kenway M, Macbeth M, Salmon M, et al. Heritability and genetic correlations of growth and survival in black tiger prawn Penaeus monodon reared in tanks. Aquaculture, 2006, 259(1): 138-145 | |
| Krishna G, Gopikrishna G, Gopal C, et al. Genetic parameters for growth and survival in Penaeus monodon cultured in India. Aquaculture, 2011, 318(1–2): 74-78 | |
| Luan S, Bian WJ, Deng W, et al. Genetic parameters for growth and survival of the base population in channel catfish (Ictalurus punctatus). Journal of Fisheries of China, 2012, 36(9): 1313-1321 [栾生, 边文冀, 邓伟, 等. 斑点叉尾基础群体生长和存活性状遗传参数估计. 水产学报, 2012, 36(9): 1313-1321] | |
| Luan S, Kong J, Zhang TS, et al. Phenotype and breeding value based correlation analyses of growth and stress-resistance traits in Fenneropenaeus chinensis. Marine Fisheries Research, 2008, 29(3): 14-20 [栾生, 孔杰, 张天时, 等. 基于表型值和育种值的中国对虾生长、抗逆性状相关分析. 海洋水产研究, 2008, 29(3): 14-20] | |
| Luan S, Luo K, Ruan XH, et al. Genetic parameter and genotype by environment interaction for body weight and survival of white pacific shrimp Litopenaeus vannamei. Oceanologia et Limnologia Sinica, 2013, 44(2): 445-452 DOI:10.11693/hyhz201302029029 [栾生, 罗坤, 阮晓红, 等. 凡纳滨对虾(Litopenaeus vannamei)体重、存活性状的遗传参数和基因型与环境互作效应. 海洋与湖沼, 2013, 44(2): 445-452] | |
| Luan S, Wang JY, Yang GL, et al. Genetic parameters of survival for six generations in the giant freshwater prawn Macrobrachium rosenbergii. Aquaculture Research, 2015, 46(6): 1345-1355 DOI:10.1111/are.2015.46.issue-6 | |
| Ministry of Agriculture, Fisheries Bureau. China. China fishery statistics yearbook in 2015. Beijing: China Agriculture Press, 2015: 28-30. [农业部渔业局. 2015年中国渔业统计年鉴. 北京: 中国农业出版社, 2015: 28-30.] | |
| Pan LQ, Liu HY. Review on the osmoregulation of crustacean. Journal of Fisheries of China, 2005, 29(1): 109-114 [潘鲁青, 刘泓宇. 甲壳动物渗透调节生理学研究进展. 水产学报, 2005, 29(1): 109-114] | |
| Rezk MA, Ponzoni RW, Khaw HL, et al. Selective breeding for increased body weight in a synthetic breed of Egyptian Nile tilapia Oreochromis niloticus: Response to selection and genetic parameters. Aquaculture, 2009, 293(3–4): 187-194 | |
| Robertson A, Lerner IL. The heritability of all-or-none traits: Viability of poultry. Genetics, 1949, 34(4): 395-411 | |
| Shen YC, Chen ZZ, Liu L, et al. The effects of salinity and nutrition on molt and growth of Litopenaeus vannamei. Journal of Fisheries of China, 2012, 36(2): 290-299 [申玉春, 陈作洲, 刘丽, 等. 盐度和营养对凡纳滨对虾蜕壳和生长的影响. 水产学报, 2012, 36(2): 290-299] | |
| Shen YC, Chen ZZ, Wu ZH, et al. Effects of salinity and nutrition on growth, respiration and excretion of Litopenaeus vannamei. Journal of Tropical Oceanography, 2010, 29(5): 111-118 DOI:10.11978/j.issn.1009-5470.2010.05.111 [申玉春, 陈作洲, 吴灶和, 等. 盐度和营养对凡纳滨对虾生长、耗氧率及排氨率的影响. 热带海洋学报, 2010, 29(5): 111-118] | |
| Sui J, Luan S, Luo K, et al. Genetic parameters and response to selection for harvest body weight of pacific white shrimp, Litopenaeus vannamei. Aquaculture Research, 2016, 47(9): 2795-2803 DOI:10.1111/are.2016.47.issue-9 | |
| Wang XA, Ma AJ, Huang ZH, et al. Heritability and genetic correlation of survival in turbot (Scophthalmus maximus). Chinese Journal of Oceanology and Limnology, 2010, 28(6): 1200-1205 DOI:10.1007/s00343-010-9014-5 | |
| Wang XQ, Cao M, Yan BL. Effects of salinity fluctuation and dietary protein/carbohydrate ratio on the survival and growth of juvenile Litopenaeus vannamei. Marine Science Bulletin, 2010, 12(2): 61-72 | |
| Yang HP, Hu CQ, Zhang LP, et al. The relationship between tolerance to fresh water and growth traits for desalination culture in families of Pacific white leg shrimp, Litopenaeus vannamei. Journal of Tropical Oceanography, 2014, 33(4): 69-76 DOI:10.11978/j.issn.1009-5470.2014.04.009 [杨海朋, 胡超群, 张吕平, 等. 凡纳滨对虾家系淡水耐受性状与生长性状的关系. 热带海洋学报, 2014, 33(4): 69-76] | |
| Yin ZJ, Zhang Q. Estimation of heritability for threshold traits in livestock using GLMM method. Journal of China Agricultural University, 2005, 10(6): 33-36 [殷宗俊, 张勤. 利用GLMM方法估计家畜阈性状的遗传力. 中国农业大学学报, 2005, 10(6): 33-36] | |
| Zhang JC, Cao FJ, Liu JY, et al. Estimation on genetic parameters and genetic gain in growth and hypoxic tolerance traits of Litopenaeus vannmei. Oceanologia et Limnologia Sinica, 2016, 47(4): 869-874 DOI:10.11693/hyhz20160400084 [张嘉晨, 曹伏君, 刘建勇, 等. 凡纳滨对虾(Litopenaeus vannmei)生长和耐低溶氧性状的遗传参数估计和遗传获得评估. 海洋与湖沼, 2016, 47(4): 869-874] |



