2. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛市海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 中国科学院海洋研究所 青岛 266071;
5. 楮岛水产有限公司 荣成 264300
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture of Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology, Qingdao 266071;
4. Institute of Oceanology, Chinese Academy of Sciences(Qingdao), Qingdao 266071;
5. Chudao Fishing Limited Company, Rongcheng 264300
凸壳肌蛤(Arcuatula senhousei)亦称寻氏肌蛤,俗称‘薄壳’、‘乌鲶’、‘海葡萄’等,属于广温性贝类,适宜生长盐度范围为11.2~28.8,水温为18~28℃(蔡英亚, 1975)。沿太平洋西岸自我国南海、东海、黄渤海至北海道以南、日本海、鄂霍茨克海均有分布(关福田等, 1989)。其肉质鲜美,营养丰富,蛋白质含量高达10.48%,比有‘海洋牛奶’之称的牡蛎(Crassostrea gigas)还高出近1倍(孔美兰等, 2013),是一种沿海居民热衷食用的小型贝类。凸壳肌蛤是一种较为理想的优质低值活体饵料,体内含有的n-3和n-6型多不饱和脂肪酸(PUFA)占总脂肪酸的35.57%,DHA和EPA占比高达16.44%,在对虾养殖过程中的高温季节投喂,水质不易变质。但凸壳肌蛤仅在广东和福建的部分地区有养殖利用(关福田等, 1989; 余纲哲等, 1996),关于其他地区的养殖情况鲜有报道。本研究于2015年6月在山东桑沟湾开展大面积调查时发现,部分区域有野生凸壳肌蛤分布,密度最高可达200 g·m–2 (湿重)。凸壳肌蛤喜泥砂底,个体之间通过足丝相互缠绕,常黏连在一起营固着生活,通过滤水、摄食、排泄等生理活动,发挥底栖生物的生物扰动作用,促进沉积物中的矿化速率以及营养盐、有机质、重金属等在沉积物-水界面的转化与迁移过程(Glud, 2008),显著改变养殖区的底质状况(Vanni, 2002)。同时,凸壳肌蛤具有分布范围广、繁殖能力强、养殖方法简易、生产周期短的优点,可见其具有显著的经济效益和生态效益,是一种值得深入研究和推广的养殖品种。通过对贝类生理能量学的研究,能够充分了解贝类在养殖过程中的生理生态变化,为养殖容量的确定提供大量科学依据,从而可以合理规划养殖规模,避免高密度养殖所带来的风险或养殖密度过低造成的资源浪费。
目前,国内外学者开展了大量关于贻贝(Mytilus edulis)、牡蛎、菲律宾蛤仔(Ruditapes philippinarum)、缢蛏(Sinonovacula constricta)、文蛤(Meretrix meretrix)、毛蚶(Scapharca subcrenata)、栉孔扇贝(Chlamys farreri)生理能量学的研究(Widdows et al, 1988; Ren et al, 2001; Mao et al, 2006; 林小涛等, 2002; 姜祖辉等, 1999a, b; 范德朋等, 2002; 冯建彬等, 2004; 匡世焕等, 1996; 柴学良等, 2006),研究结果对于养殖容量的确定具有重要参考意义,还可以为构建DEB模型(Dynamic energy budget)提供基础数据。但目前有关不同温度下凸壳肌蛤能量收支的研究未见报道,因此,对其进行相关的能量学研究十分必要。
1 材料及方法 1.1 样品采集与实验地点实验所用凸壳肌蛤样品从山东桑沟湾楮岛海域网箱养殖区(37°02.509′ N, 122°30.260′ E)采集,该区域水深约为8 m,于2015年7月18日利用抓斗式采泥器(型号为DP-201, 开口面积为40 cm2)挖取深度约为5 cm的沉积物,30 min内带回实验室(位于桑沟湾湾口的楮岛码头),从沉积物筛选规格相近[壳长为(17.14± 0.72) mm]、进出水口活动正常的健康凸壳肌蛤。在玻璃缸流水槽(长×宽×高为9.00 cm × 23.50 cm × 29.00 cm)中暂养7 d后开始实验,暂养期间,水槽水位保持在距底部24 cm处。沿岸的自然海水经砂滤后作为实验用水,实验水温由冷水机(HXLS 1000, 大连)控制。实验期间,海水盐度为30.90±1.10,pH为8.10± 0.70,溶氧为6.00 mg/L以上。
1.2 实验设计实验温度共设7℃、15℃、23℃、31℃,4个梯度。每个梯度均设3个重复和3个空白对照。凸壳肌蛤暂养7 d后,开始实验。摄食、排粪实验中,每个平行选取5个实验用贝,放入已洗刷干净的1 L玻璃烧杯中进行实验,水量为500 ml,饵料为硅藻(Nitzschia closterium)。实验过程中,为防止饵料沉降,在不影响实验用贝正常摄食的前提下保持微充气,使硅藻在水体中均匀分布,尽量避免产生实验误差,实验持续2 h。实验结束后,将贝放入经0.45 μm滤膜过滤的海水中,收集实验后24 h内的粪便,并测定其颗粒有机物(POM)和总颗粒物(TPM)。实验过程中均未产生假粪。选用容积为0.53 L的聚乙烯实验瓶测定耗氧率和排氨率,实验组每个瓶中放3个凸壳肌蛤。观察实验贝开始正常滤水后,即用保鲜膜密封瓶口,开始实验。对照瓶不放贝,进行同样操作。实验过程中,全程水浴,保持各处理组的温度一致,实验持续2 h,实验结束后,虹吸法取水样进行耗氧率和排氨率的测定。
1.3 测定方法 1.3.1 摄食率测定摄食率[Ingestion rate, IR, mg/(g·h)]以实验前后水体中饵料浓度的变化来表示,以颗粒有机物POM的浓度为测定指标。
| $ {\rm{POM}} = {W_{65}} - {W_{450}} $ |
式中,W65为饵料样品经GF/C玻璃纤维滤纸(Whatman)(预先在马福炉中经450℃灼烧8 h处理)过滤后在65℃烘箱中烘至恒重,用天平(精密度为0.01 mg)称重所得,W450为W65样品滤纸在马福炉中经450℃灼烧处理并冷却后的重量。
IR的计算公式:
| $ {\rm{IR}} = \left({{C_0} - {C_t}} \right) \times V/\left({W \times t} \right)\left({{\rm{Griffiths, 1980}}} \right) $ |
式中,C0和Ct分别为实验结束时空白组和实验组水中的饵料浓度(mg/L),V为实验水体的体积(L);W为实验用贝软体干重(g),t为实验持续的时间(h)。
1.3.2 排粪率和同化效率测定运用摄食率和同化效率(Assimilation efficiency, AE, %)计算排粪率[Fecal pellet production rate, FR, mg/(g·h)],粪便中POM的计算同上。
| $ {E^\prime } = {W_1}/{W_2};\;{W_1} = {W_{65}} - {W_{450}};\;{W_2} = {W_{65}} - {W_0} $ |
式中,W0为GF/C滤膜初始重量,F′与E′的计算方法一致。
AE的计算公式:
| $ {\rm{AE}} = ({F^\prime } - {E^\prime })/[(1 - {E^\prime }) \times {F^\prime }] \times 100\left({{\rm{Conover}}, {\rm{ }}1966} \right) $ |
式中,F′为饵料中无灰分干重的比例(%),E′为粪便中无灰分干重的比例(%)。
FR的计算公式:
| $ {\rm{FR}} = {\rm{IR}} \times \left({1 - {\rm{AE}}} \right) $ |
式中,IR为摄食率[mg/(g·h)];AE为同化效率(%)。
1.3.3 耗氧率和排氨率测定溶解氧(DO)的测定采用(Winkler)碘量法(国家海洋局, 2007),根据实验前后溶解氧的浓度变化计算单位软体干重的耗氧率[Oxygen consumption rate, OR, mg/(g·h)]。
OR的计算公式如下:
| $ {\rm{OR}} = \left[ {\left({{\rm{D}}{{\rm{O}}_0} - {\rm{D}}{{\rm{O}}_{\rm{t}}}} \right) \times V} \right]/(W \times t) $ |
式中,DO0和DOt分别为实验开始和结束时实验水中溶解氧含量(mg/L),V为实验用水的体积(L),W为实验用贝软体干重(g),t为实验持续时间(h)。
氨氮(NH4+-N)采用次溴酸钠氧化法(国家海洋局,2007)测定,根据实验前后氨氮浓度变化计算单位软体干重的排氨率[Ammonia excretion rate, NR, μmol/(g·h)]。
NR的计算公式:
| $ {\rm{NR}} = \left[ {\left({{N_t} - {N_0}} \right) \times V} \right]/\left({W \times t} \right) $ |
式中,N0和Nt分别为实验开始和结束时实验水中氨氮浓度(μmol/L),V为实验用水的体积(L),W为实验用贝软体干重(g),t为实验持续时间(h)。
1.3.4 滤水率测定滤水率[Filtration rate, FR, L/(g·h)]的计算公式:
| $ {\rm{FR}} = \left[ {V \times {\rm{ln}}\left({{C_0}/{C_t}} \right)} \right]/\left({W \times t} \right)\left({{\rm{Griffiths, 1980}}} \right) $ |
式中,V为实验水的体积(L),C0和Ct分别为实验开始和结束时水中的饵料浓度(mg/L),W为实验用贝软体干重(g),t为实验持续的时间(h)。
1.3.5 氧氮比的计算方法氧氮比(O/N)的计算公式如下:
| $ \begin{array}{*{20}{c}} {{\rm{O/N}} = \left( {{\rm{mg}}\;{{\rm{O}}_2}/h/16} \right)/\left( {{\rm{mg}}\;{\rm{NH}}_4^ + {\rm{ - N}}/h/14} \right)}\\ {\left( {{\rm{Widdows}}\;et\;al,{\rm{1988}}} \right)} \end{array} $ |
摄食能(Ingestion energy, C, J):根据摄食率和有机物–能量转换系数,1 mg POM=20.78 J (Crisp, 1984);
排粪能(Feces energy, F, J):据排粪率和有机物-能量转换系数,1 mg POM=20.78 J (Crisp, 1984);
呼吸能(Respiration energy, R, J):根据耗氧率和耗氧量–能量转换系数,l mgO2=14.23 J (Crisp, 1984);
排泄能(Excretion energy, U, J):根据排氨率和排氨量–能量转换系数,1 μmol NH4+-N=0.34 J (Bayne et al, 1987);
生长能(Growth energy, P, J):P = C – R – U – F
能量收支的计算公式如下:
| $ C = F + R + U + P = F + A\left({{\rm{Carfoot, 1987}}} \right) $ |
式中,C为摄食能,F为粪便能,R为呼吸能;U为排泄能,P为生长能,A为吸收能。
1.4 数据统计与处理数据处理采用Excel 2013,统计分析采用SPSS 19.0软件,对所得数据用单因素方差分析(One-way ANOVA)和Duncan多重比较进行分析,以P<0.05作为差异显著水平。
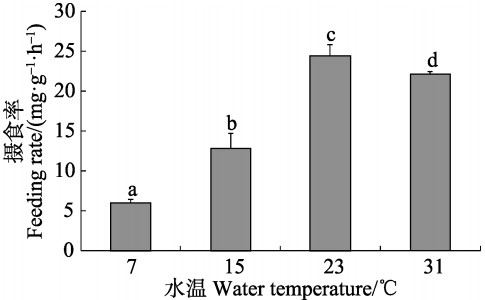
2 结果 2.1 温度对凸壳肌蛤滤水率和摄食率的影响从图 1和图 2可以看出,随温度的升高,滤水率和摄食率均呈先升高后降低的趋势,在23℃时达到最大值,分别为1.09 L/(g·h)、24.46 mg/(g·h),在7℃时为最小值,分别为0.24 L/(g·h)、6.04 mg/(g·h),且不同温度之间两两差异显著(P<0.05)。

|
图 1 凸壳肌蛤不同温度下的滤水率 Figure 1 Filtration rate of A. senhousei at different temperature 注:不同字母表示差异显示(P<0.05),下同 Note: Different letters represent significant difference (P<0.05), the same as below |
|
图 2 凸壳肌蛤不同温度下的摄食率 Figure 2 Ingestion rate of A. senhousei at different temperature |
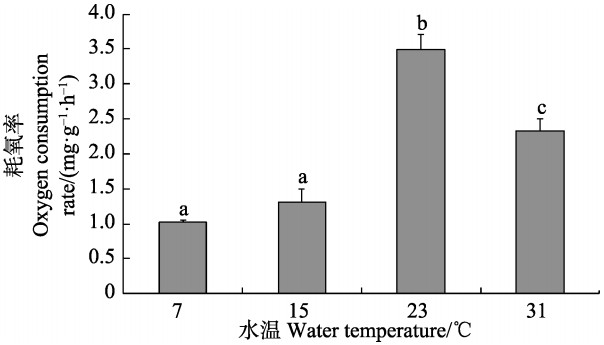
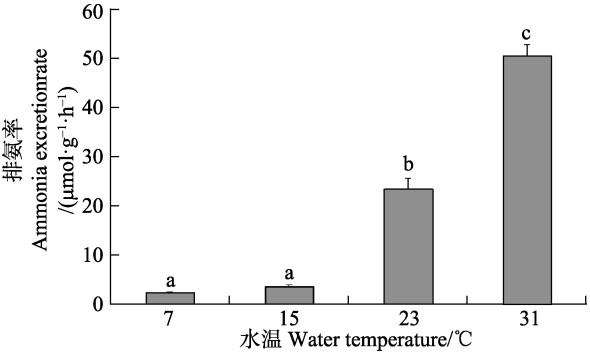
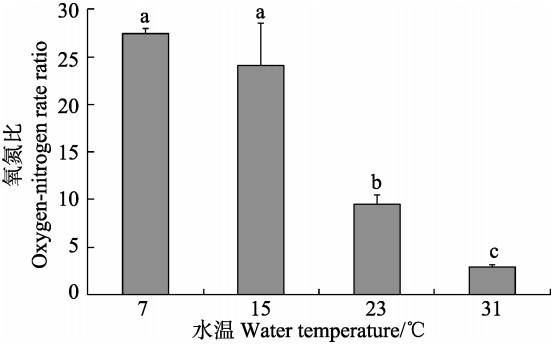
从图 3可以看出,随着温度的升高,耗氧率呈先升高后降低的趋势,23℃时达到最大值,为3.50 mg/(g·h),7℃时为最小值,为1.02 mg/(g·h),且23℃时与其他温度梯度之间差异显著(P<0.05)。从图 4和图 5可以看出,排氨率随温度的升高而升高,氧氮比随温度的升高而降低。7℃时,排氨率达最小值,为2.33 μmol/(g·h),氧氮比达最大值,为27.45,31℃时排氨率达最大值,为50.44 μmol/(g·h),氧氮比最小值为2.89。且三者在7℃和15℃时均无显著性差异(P>0.05),但与其他2个温度梯度之间差异显著(P<0.05)。
|
图 3 凸壳肌蛤不同温度下的耗氧率 Figure 3 Oxygen consumption rate of A. senhousei at different temperature |
|
图 4 凸壳肌蛤不同温度下的排氨率 Figure 4 Ammonia excretion rate of A. senhousei at different temperature |
|
图 5 凸壳肌蛤不同温度下的氧氮比 Figure 5 Oxygen-nitrogen ratio of A. senhousei at different temperature |
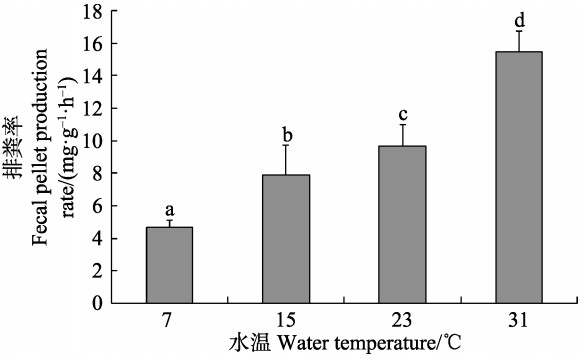
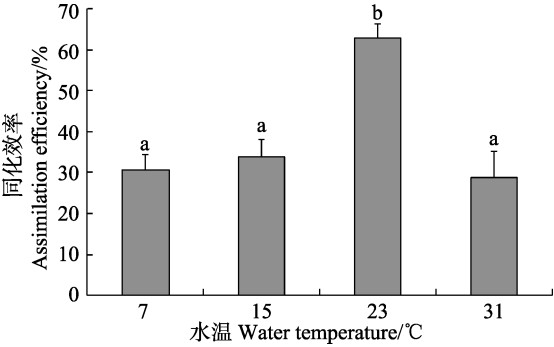
从图 6可以看出,排粪率随温度的升高而升高,31℃时达到最大值,为15.76 mg/(g·h),7℃时达最小值,为4.20 mg/(g·h),且排粪率在不同温度时两两差异显著(P<0.05)。从图 7可以看出,随着温度的升高,同化效率呈先升高后降低的趋势,23℃时达到最大值,为62.93%,31℃时达最小值,为28.90%,且23℃时,与其他温度梯度之间差异显著(P<0.05)。
|
图 6 凸壳肌蛤不同温度下的排粪率 Figure 6 Fecal pellet production rate of A. senhousei at different temperature |
|
图 7 凸壳肌蛤不同温度下的同化效率 Figure 7 Assimilation efficiency of A. senhousei at different temperature |
从表 1可以看出,23℃时,凸壳肌蛤生长能占摄食能的比例最高,而排粪能比例最低;7℃时正好相反;排粪能的占比随水温的升高呈先下降后上升趋势,拐点位于23℃;呼吸能占比始终较高,均大于28%;排泄能的占比始终处于较低水平,且31℃时,排泄能占比显著高于其他温度梯度(P<0.05)。
|
|
表 1 凸壳肌蛤不同温度下的能量收支 Table 1 Energy budget of A. senhousei at different temperature |
温度变化会影响滤食性贝类的滤水速度,改变鳃上纤毛的运动速率(Shumway, 1982),进而直接影响贝类的新陈代谢和生长发育,也可以通过改变水体中的浮游生物量,间接对贝类生理产生影响。通常在适温范围内,贝类的代谢速率随温度的升高而加速,但超出这一范围时,各项生理活动的频率均会出现不同程度的降低(杨红生等, 1998; 范德朋等, 2002; 董志国等, 2004),生物通过不断地调整自身的生理代谢以适应环境。本研究中,凸壳肌蛤的耗氧率、摄食率、滤水率和同化效率均随温度的升高而升高,在23℃达到最高,并且在31℃时显著下降。Newell等(1997)研究表明,双壳贝类的摄食率会随着温度的升高而升高,当温度超过最适温度时,摄食率会急剧降低,这与本研究结果类似。Jansen等(2007)研究发现,在环境温度超过24℃时,贻贝(Mytilus spp.)呼吸系统的振幅相应下降;Hiebenthal等(2013)研究发现,在温度过高的情况下,北极蛤(Arctica islandica)和紫贻贝(Mytilus edulis)的生理应激增加,表现为死亡率升高和脂褐素积累,壳破断力和壳增长降低等。考虑到取样海域全年最高温度为25℃左右,因此,31℃可能已经超过了凸壳肌蛤的耐受限度,生理代谢已经发生了紊乱,其生长发育在一定程度上受到了影响。
诸多研究表明,氧氮比与生物受到的环境胁迫紧密相关,其可作为判断生物是否能够适应某些环境的一项重要指标(Dall et al, 1986)。Conover等(1968)研究表明,主要由碳水化合物或脂肪供能,氧氮比接近无穷大;Mayzaud (1976)研究表明,全部由蛋白质供能,氧氮比约为7。本研究中,7℃和15℃的氧氮比分别为27.45±0.48、24.10±4.45,因此,在这2个温度梯度下,凸壳肌蛤以碳水化合物、脂肪和蛋白质混合供能,在23℃和31℃时的氧氮比分别为9.46±1.06、2.89±0.28,表明其主要由蛋白质供能,凸壳肌蛤通过代谢调节来满足自身的营养需求进而适应环境。钱佳慧等(2015)对栉孔扇贝的研究发现,超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶的活性会随着温度的变化而变化,且均在26.4℃达到最大值,这说明贝类的代谢活动与温度联系密切。
由能量收支方程可以看出,在温度为23℃时,凸壳肌蛤生长能占摄食能的比例显著大于其他3个温度梯度(P<0.05),这与蔡英亚(1975)的研究结果相似,同时,在23℃时,同化效率和滤水率也达到了最高,进一步说明了该温度梯度适宜其生长发育。从凸壳肌蛤的能量收支方程来看,排粪能占比最大(17.18%~ 58.12%),呼吸能(28.26%~46.74%)次之,其次是生长能(–7.4%~34.37%),排泄能最小(<14.66%)。与栉孔扇贝的能量分配策略(王俊等, 1999)[呼吸能(44.29%~ 51.70%), 排粪能(31.40%~36.80%), 生长能(12.72%~ 21.68%),排泄能(<1.71%)]不同,但与近江牡蛎(Ostrea rivularis)类似[排粪能(33.22%~64.22%),生长能(27.75%~58.93%),呼吸能(6.62%~16.46%),排泄能(<1.24%)],排粪能的占比最大。同化效率在0.29~0.63之间,不同温度梯度差别较大,对比其他滤食性贝类的同化效率,如翡翠贻贝(Perna viridis)测得的同化率在0.66~0.94之间(颉晓勇, 2001),栉孔扇贝的同化率在0.63~0.69之间(王俊等, 1999);牡蛎同化率的平均值在0.73左右(Valenti et al, 1981),海湾扇贝(Argopecten irradias)和栉孔扇贝对金藻(Chrysophyta sp.)、海带(Laminaria japonica)底泥的同化效率分别为0.95、0.62、0.29和0.92,0.45、0.43 (毛兴华等, 1997),可以看出在不同条件下,不同贝类在对于饵料的同化率也有所不同。
Bayne BL, Hawkins AJS, Navarro E. Feeding and digestion by the mussel Mytilus edulis L. (Bivalvia:Mollusca) in mixtures of silt and algal cells at low concentrations. Journal of Experimental Marine Biology and Ecology, 1987, 111(1): 1-22 |
Cai YY. Aquaculture and utilization of Museulus senhousia. Fisheries and Education, 1975(1): 87-90 [ 蔡英亚. 寻氏肌蛤的养殖和利用. 水产与教育, 1975(1): 87-90] |
Carfoot TH. Animal energetics. New York: Academic Press, 1987: 407-515
|
Chai XL, Zhang JM, Fang J, et al. Study on carbon budget of main bivalves in Yueqing Bay and Sanmeng Bay. Journal of Shanghai Fisheries University, 2006, 15(1): 52-58 [ 柴雪良, 张炯明, 方军, 等. 乐清湾, 三门湾主要滤食性养殖贝类碳收支的研究. 上海水产大学学报, 2006, 15(1): 52-58] |
Conover RJ. Assimilation of organic matter by zooplankton. Limnology and Oceanography, 1966, 11(3): 338-345 DOI:10.4319/lo.1966.11.3.0338 |
Conover RJ, Corner EDS. Respiration and nitrogen excretion by some marine zooplankton in relation to their life cycles. Journal of Marine Biological Association of the UK, 1968, 48(1): 49-75 DOI:10.1017/S0025315400032410 |
Crisp DJ. Energy flow measurements. Methods for the Study of Marine Benthos, 1984, 284-372 |
Dall W, Smith DM. Oxygen consumption and ammonia-N excretion in fed and starved tiger prawns, Penaeus esculentus Haswell. Aquaculture, 1986, 55(1): 23-33 DOI:10.1016/0044-8486(86)90052-9 |
Dong ZG, Li JL, Wang MZ, et al. The influence of body size and temperature on oxygen consumption rate of Hyriopsis cummingii. Journal of Shanghai Fisheries University, 2004, 13(1): 47-51 [ 董志国, 李家乐, 王美珍, 等. 规格和温度对三角帆蚌耗氧率的影响. 上海水产大学学报, 2004, 13(1): 47-51] |
Fan DP, Pan LQ, Ma S, et al. Effects of temperature on oxygen consumption rate and ammonia excretion rate of Sinonovacula constricta. Journal of Ocean University of Qingdao, 2002, 32(1): 56-62 [ 范德朋, 潘鲁青, 马甡, 等. 温度对缢蛏(Sinonovacula constricta)耗氧率和排氨率的影响. 青岛海洋大学学报, 2002, 32(1): 56-62] |
Feng JB, Wang MZ, Chen HC, et al. Effects of temperature and body size on oxygen consumption rate of Meretrix meretrix. Journal of Shanghai Fisheries University, 2004, 13(2): 126-129 [ 冯建彬, 王美珍, 陈汉春, 等. 温度和规格对文蛤耗氧率的影响. 上海水产大学学报, 2004, 13(2): 126-129] |
Glud RN. Oxygen dynamics of marine sediments. Marine Biology Research, 2008, 4(4): 243-289 DOI:10.1080/17451000801888726 |
Griffiths RJ. Filtration, respiration and assimilation in the black mussel Choromytilus meridionalis. Marine Ecology Progress Series, 1980, 3(1): 63-70 |
Guan FT, Han YP, Qu WG. On the habitat and growth of Museulus senhousei (Benson). Journal of Fisheries of China, 1989, 13(3): 181-188 [ 关福田, 韩一萍, 曲维功. 寻氏肌蛤生境及生长的初步研究. 水产学报, 1989, 13(3): 181-188] |
Hiebenthal C, Philipp EER, Eisenhauer A, et al. Effects of seawater pCO2 and temperature on shell growth, shell stability, condition and cellular stress of western Baltic Sea Mytilus edulis (L.) and Arctica islandica (L.). Marine Biology, 2013, 160(8): 2073-2087 DOI:10.1007/s00227-012-2080-9 |
Jansen JM, Pronker AE, Kube S, et al. Geographic and seasonal patterns and limits on the adaptive response to temperature of European Mytilus spp. and Macoma balthica populations. Oecologia, 2007, 154(1): 23-24 DOI:10.1007/s00442-007-0808-x |
Jiang ZH, Wang J. Effects of temperature and body size on oxygen consumption rate and ammonia excretion rate of Arca subcrenata. Journal of Qingdao University, 1999a, 12(1): 77-81 [ 姜祖辉, 王俊. 温度和规格对毛蚶耗氧率和排氨率的影响. 青岛大学学报, 1999a, 12(1): 77-81] |
Jiang ZH, Wang J, Tang QS. Studies on physiological ecology of short-necked clam (ruditapes philippinarum) I. effects of temperature, body weight and feeding state on oxygen consumption rate and ammonia excretion rate. Marine Fisheries Research, 1999b, 20(1): 40-44 [ 姜祖辉, 王俊, 唐启升. 菲律宾蛤仔生理生态学研究Ⅰ. 温度、体重及摄食状态对耗氧率及排氨率的影响.海洋水产研究, 1999b, 20(1): 40-44] |
Kong ML, Chen BY, Liu MQ, et al. Study on peptided-zinc chelate of hydrolyzed protein from Arcuatula senhousei. Journal of Anhui Agricultural Sciences, 2013, 41(27): 11145-11149 [ 孔美兰, 陈碧云, 刘谋泉, 等. 寻氏肌蛤蛋白水解液制备锌蛋白盐的研究. 安徽农业科学, 2013, 41(27): 11145-11149 DOI:10.3969/j.issn.0517-6611.2013.27.097] |
Kuang SH, Fang JG, Sun HL, et al. Seasonal variation of filtration rate and assimilation efficiency of scallop Chlamys farreri in Sanggou Bay. Oceanologia et Limnologia Sinica, 1996, 27(2): 194-199 [ 匡世焕, 方建光, 孙慧玲, 等. 桑沟湾栉孔扇贝不同季节滤水率和同化率的比较. 海洋与湖沼, 1996, 27(2): 194-199] |
Lin XT, Zhong JX, Xie XY, et al. The effect of temperature on the energy budget of Perna viridis. Marine Sciences, 2002, 26(4): 13-16 [ 林小涛, 钟金香, 颉晓勇, 等. 温度对翡翠贻贝能量收支的影响. 海洋科学, 2002, 26(4): 13-16] |
Mao YZ, Zhou Y, Yang HS, et al. Seasonal variation in metabolism of cultured Pacific oyster, Crassostrea gigas, in Sanggou Bay, China. Aquaculture, 2006, 253(1): 322-333 |
Mao XH, Hao YW, Yang XL. Carbon metabolism and energy metabolism of Argopecten irradians and Chlamys farreri. Acta Oceanologica Sinica, 1997, 19(4): 132-137 [ 毛兴华, 郝亚威, 杨小龙. 海湾扇贝和栉孔扇贝的碳代谢及能量代谢. 海洋学报, 1997, 19(4): 132-137] |
Mayzaud P. Respiration and nitrogen excretion of zooplankton. IV. The influence of starvation on the metabolism and the biochemical composition of some species. Marine Biology, 1976, 37(1): 47-58 DOI:10.1007/BF00386778 |
Newell RC, Johson LG, Kofoed LH. Adjustment of the components of energy balance in response to temperature change in Ostrea edulis. Oecologia, 1977, 30(2): 97-110 DOI:10.1007/BF00345414 |
Qian JH, Li ZM, Shen YC, et al. Synergistic effect of temperature and salinity on antioxidant enzymes activities of Chlamys nobilis. South China Fisheries Science, 2015, 11(6): 49-57 [ 钱佳慧, 栗志民, 申玉春, 等. 温度和盐度对华贵栉孔扇贝抗氧化酶活性的联合效应研究. 南方水产科学, 2015, 11(6): 49-57] |
Ren JS, Ross AH. A dynamic energy budget model of the Pacific oyster Crassostrea gigas. Ecological Modelling, 2001, 142(1): 105-120 |
Shumway SE. Oxygen consumption in oysters:An overview. Marine Biology Letters, 1982, 3(1): 1-23 |
Valenti CC, Epifanio CE. The use of a biodeposition collector for estimation of assmilation efficiency in oysters. Aquaculture, 1981, 25(1): 89-94 DOI:10.1016/0044-8486(81)90102-2 |
Vanni MJ. Nutrient cycling by animals in freshwater ecosystems. Annual Review of Ecology and Systematics, 2002, 33(1): 341-370 DOI:10.1146/annurev.ecolsys.33.010802.150519 |
Wang J, Jiang ZH, Zhang B, et al. Study on energy budget of farrerid scallop (Chlamys farreri). Marine Fisheries Research, 1999, 20(2): 71-75 [ 王俊, 姜祖辉, 张波, 等. 栉孔扇贝能量收支的研究. 海洋水产研究, 1999, 20(2): 71-75] |
Widdows J, Johnson D. Physiological energetics of Mytilus edulis:Scope for growth. Marine Ecology Progress Series, 1988, 46(1): 113-121 |
Xie XY. Study on energy budgets and carrying capacity of Perna viridis (Linnaeus). Master's Thesis of Jinan University, 2001, 13-14[颉晓勇. 翡翠贻贝能量收支及养殖容量的研究. 暨南大学硕士研究生学位论文, 2001, 13-14]
|
Yang HS, Zhang T, Wang P, et al. Effect of temperature on oxygen consumption and ammonia-N excretion of the Southern Bay scallop Argopecten irradians concentricus. Acta Oceanologica Sinica, 1998, 20(4): 91-96 [ 杨红生, 张涛, 王萍, 等. 温度对墨西哥湾扇贝耗氧率及排泄率的影响. 海洋学报, 1998, 20(4): 91-96] |



