2. 山东省日照市海洋与渔业研究所 日照 276800;
3. 上海海洋大学水产与生命学院 上海 201306;
4. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Rizhao Municipal Ocean and Fishery Research Institute of Shandong Province, Rizhao 276800;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
4. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
栉江珧(Atrina pectinata Linnaeus)广泛分布于印度-太平洋地区海域,形态变异较大,仅在我国沿海就已经发现了多个不同的形态类型(任建峰等, 2005),给栉江珧的分类带来了极大的困惑,分类地位比较混乱。Liu等(2011)通过基因序列比较和形态特征分析,研究了16个中国沿海地理群体和1个日本沿海群体栉江珧的遗传分化及演化历史,认为栉江珧存在5个遗传分化较大的进化支系,并可能存在5个隐存种。Yan等(2013)和严加坤等(2013a、b)基于线粒体基因组、16S rRNA、28S rRNA和COⅠ基因等序列,分析了我国不同地理群体栉江珧遗传多样性及系统发生的状况,并推测我国栉江珧可能由于地理隔离而分化为南方、北方两个不同亚种。但至今有关栉江珧分类、遗传分化等方面研究报道仍不多。长期滥捕导致栉江珧野生资源严重衰退,很多海域已经很难采捕到。由于栉江珧的经济价值和在海水养殖业上的巨大发展潜力,其人工育苗日益受到重视,这需要更多的种质资源和生物学基础资料的支撑。
各种生物的染色体具有一定的类型和组数,染色体组型或核型一般是以处于体细胞有丝分裂中期的染色体数目和形态来表示,常采用由Levan等(1964)所提出的根据着丝粒的位置进行分类的方法。研究物种染色体不仅可以探讨其分类地位和系统演化,也有助于近缘物种的鉴定和群落分析。迄今为止,未见栉江珧染色体核型分析的报道,本研究从改变暂养条件和取材方法上刺激成贝体细胞应激性增生,有效增加中期分裂相数目,建立大型贝类染色体制备技术并研究其核型,对于丰富贝类遗传学和分类学内容、探究该物种的起源及分类进化地位、指导遗传育种生产实践都有重要的意义。
栉江珧多为雌雄异体,但存在雌雄同体现象(王梅芳等, 2000)。栉江珧个体发育各阶段尚未发现明显的雌雄性别特征,只有繁殖盛期性腺充分发育时,通过解剖依据性腺色泽才能准确判断雌雄,尚无有效剔除雌雄同体个体的方法,这更加限制了栉江珧规模化人工苗种繁育技术的研究。本研究拟建立快捷便利的染色体制备技术,通过核型分析,为鉴定育苗亲贝的性别奠定细胞遗传学基础。
1 材料与方法 1.1 实验动物2016年6月17日和2017年6月8日,2批次从山东省日照市海洋与渔业研究所取健康的人工促熟栉江珧亲贝共12枚,5♀,7♂。雄性壳绞合部长为(21.77±3.72) cm,体重为(291.46±40.72) g,雌性壳绞合部长为(20.98±1.07) cm,体重为(283.26±53.06) g。雌雄分开暂养于25 L水槽中,暂养水温为20~23℃,高于原养殖场水温3℃左右,饲以实验室培育的扁藻(Platymonas)和叉鞭金藻(Dicrateria inornata),每天早晚各投饵1次,每天换水1次,每次换一半过滤海水。
1.2 实验方法提前准备好染色体制片的载玻片,要求干净、无油污、不挂水。栉江珧细小前端朝下斜靠墙角阴干10~30 min,宽大的后端双壳即张开,用一个厚约1 cm的软塑料板塞在壳腹缘处使双壳无法闭合,迅速沿鳃丝边界剪取0.2 cm宽、0.3 cm长的鳃丝,制造微小创面,把栉江珧放回水体中精养2~3 d后,再取该创面的愈合增生组织。所取鳃丝和愈合增生组织在过滤海水中漂洗后,立即放入含有0.04%秋水仙素的50%无菌海水(纯净水与海水等体积混合)处理30~45 min,用镊子取出组织放入0.075 mol/L KCl溶液中低渗30~45 min,再取出组织用预冷的新鲜配制的卡诺氏(Carnoyxs)液(甲醇:冰醋酸=3:1)充分固定。制片时先用50%的冰醋酸将固定的组织解离成细胞悬浊液,热滴片法制片,10%的Giemsa染液染色30 min,自来水冲洗,晾干后镜检,拍照。
1.3 栉江珧核型分析与比较选取染色体收缩适中、分散好的雄性栉江珧中期分裂相18个,雌性中期分裂相16个,进行显微照相并放大测量,并用下式计算相对长度和臂比:
| $ 相对长度=(实测染色体长度/ \\ \ \ 全部染色体长度总和)×100 \\ 臂比=长臂长度/短臂长度 $ |
用Excel求出它们的平均数和标准差,按Levan等(1964)确定的标准进行染色体分类,臂比值1~1.7为中着丝粒染色体,1.7~3为亚中着丝粒染色体,3~7为亚端着丝粒染色体,7~∞为端着丝粒染色体。依据染色体相对长度由大到小排序配对,得出栉江珧的染色体核型公式,中、亚中、亚端着丝粒染色体臂数(NF)均记为2条。
2 结果 2.1 栉江珧染色体数目的确定5枚雌性和7枚雄性栉江珧均观察到清晰分裂相,雌雄分别随机挑选50个中期分裂相进行染色体众数统计,结果见表 1,确定二倍体染色体众数2n=34。
|
|
表 1 雌性和雄性栉江珧中期分裂相二倍体染色体计数 Table 1 Mitotic metaphase cells number, chromosome number, and percentage of male and female Atrina pectinata |
雌雄栉江珧染色体相对长度和臂比值见表 2,二者中期分裂相皆为二倍体,雌雄都有1对相对长度特大型的染色体,序号为1。其中雄性第1对染色体的相对长度存在明显差异,雄性最大的染色体比雌性最大的染色体略大,其余各对染色体间相对长度差异不明显,但第14对染色体的类型在雌雄中明显不同,雄性为中着丝粒染色体,雌性为亚端着丝粒染色体。
|
|
表 2 栉江珧染色体类型、相对长度及臂比 Table 2 Relative length and arm ratio of metaphase chromosome of A. pectinata |
雌性和雄性的染色体依据相对长度从大到小依次排序,二者染色体排序基本一致,雄性染色体组型为2n = 8m+10sm+16st,臂数NF=68 (图 1);雌性染色体组型为2n=6m+10sm+18st,臂数NF=68 (图 2),雌雄栉江珧的染色体组型略有不同,第1对染色体为最大号中着丝粒染色体,雄性第1对染色体呈现异形的性别分化,或1大1小(图 1d),或有些大小分化不是特别明显,但形态(着丝点位置)明显不同(图 1b),雄性最大的染色体分化比雌性最大的染色体分化更加突出。由此可见,最大的1对染色体出现了性染色体分化,但不完全等同于人类(Homo sapiens)、果蝇(Drosophila melanogaster)和线虫(Caenorhabditis elegans)性染色体的分化,推测是低等生物的初级分化,属于XX/XY型性别决定方式。第14对染色体在雄贝中属于中着丝粒染色体(图 1b、图 1d),在雌贝中属于亚端着丝粒染色体(图 2b)。

|
图 1 雄性栉江珧中期分裂相染色体及核型 Figure 1 The metaphase chromosome and karyotype of A. pectinata a、c:雄性栉江珧中期分裂相染色体; b、d:雄性栉江珧染色体核型 a and c: Metaphase chromosomes of male A. pectinata; b and d: Karyotype of male A. pectinata |
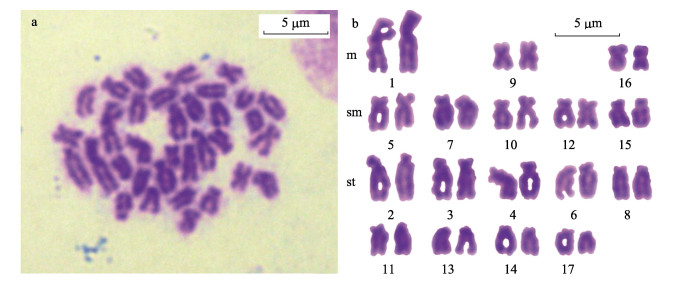
|
图 2 雌性栉江珧中期分裂相染色体及核型 Figure 2 The metaphase chromosome and karyotype of female A. pectinata a:雌性栉江珧中期分裂相染色体; b:雌性栉江珧染色体核型 a. Metaphase chromosomes of female A. pectinata; b. Karyotype of female A. pectinata |
本研究所取的12枚栉江珧亲贝从当地养殖场购得,并饲养于相同的环境中,但研究发现,雌雄个体间存在染色体组型差别,不仅存在1对染色体类型的区别,还存在雄性相对长度最大的1对染色体呈异形的情形,这是本研究的意外发现。迄今为止,国内已报道过的贝类染色体中均未发现异形的性染色体,国外仅在腹足类报道发现有XO型或XY型性染色体,这似乎与腹足纲贝类一般具有第二性征(交接器官)相吻合(陈宇, 2007)。Twyman(2002)认为,大部分雌雄异体型动物原始性别是由性染色体决定的,第二性征可以仍由性染色体决定,但还要受发育过程中性腺释放的荷尔蒙调控。本研究还发现,栉江珧的染色体组成基本稳定,但雄性最大的1对染色体的异形情况不太稳定,可能处于初级的性别分化阶段,也有可能是正常的同种异体核型多态性现象。高等哺乳动物染色体中,罗伯逊异位(包括着丝粒融合或断裂)、存在B染色体、结构重排(导致染色体长度变化)等是引起同种异体核型多态现象的主要原因(粘伟红, 2006)。雌雄个体间第14对染色体类型的区别是否属于性别分化还不能完全确定,这是今后要解决的问题之一。从事贝类染色体核型分析的科研人员也发现,贝类核型存在多态性,即同一种贝类的核型会有差异,孙振兴(1991)认为,各研究者采用实验方法不同,如秋水仙素浓度、低渗液的种类和浓度以及处理时间等,均可对染色体的形态和长度产生影响。Komaru等(1985)也发现,以同一种贝类的不同组织为材料,即使采用同样方法制片后的染色体长度也有变化。王琼等(1994)则认为地域差异形成的不同地理种群之间会有核型多态现象。
目前,北方海域栉江珧人工育苗还处于试验阶段,尚未见有大规模人工育苗成功的报道,主要原因是人工诱导栉江珧亲贝排放精卵量少,幼虫上浮粘连常导致幼虫大量死亡,不能满足生产需求(郑言鑫等, 2015)。正如前言所述,栉江珧分类和系统进化尚存在很多疑问,课题组前期在对栉江珧遗传变异分析中发现,即便是同一群体中的不同个体的微卫星标记都存在很大的区别,如:同一对引物在某个个体中能扩增出条带,而在另一个个体中却扩增不出条带,不同个体间微卫星等位基因杂合度(HO和HE)变化范围分别为0.0714~0.9231以及0.1948~0.9237(Wu et al, 2014),栖息同一海区的栉江珧种内差异也十分明显(任建峰等, 2005)。本实验结果显示,不同个体的最大号出现性别分化的染色体形态存在一定的多态性。栉江珧群体内个体间分子标记遗传多样性丰富的原因是什么?亲贝遗传组成差异大或染色体存在多态性是否与人工育苗难点有关?排序相同的一对染色体类型不同,以及雄性最大一对染色体异形是否真的是性别分化染色体?这些问题都有待进一步考证。
纵观动物由低等向高等进化历程,遗传分化中遗传因素的作用逐渐增强,环境因素的影响渐渐减弱(Volff et al, 2003)。贝类是无脊椎动物漫长进化过程中较独特的一支,性别表型多样,雌雄同体和性变的现象时有发生,大多数人认为双壳贝类的性别是在相同遗传背景下生殖细胞分化的结果,分化过程如受环境影响可能会发生性别逆转。王梅芳等(1999)在江珧科栉江珧和二色裂江珧中发现,性逆转及雌雄同体的个体,雌雄滤泡在性腺中分布有两种类型:一种为滤泡混合型,另一种为滤泡并存型。性变方向有雄性转化为雌性、雌性转化为雄性及两种性别均衡发育等三种类型,且以雄性转化为雌性为主。并据此推测,性变及雌雄同体在江珧科是较普遍的现象。栉江珧性变是否与染色体变异有关也有待进一步的实验论证。
3.2 大型贝类染色体制备方法的改进北方海区尚未见有栉江珧人工育苗技术成功的报道,很难获得组织细胞分裂增生能力强的幼虫和稚贝,杨青等(2009)观察人工诱导栉江珧第1卵裂抑制型雌核发育二倍体的染色体时,认为栉江珧二倍体细胞染色体数为32,与本研究观察的二倍体染色体众数34有出入,且论文中展示的幼虫细胞中期分裂相染色体图片中未见有本研究观察到的特大号染色体,他们观察雌核发育二倍体胚胎倍性为1N=16±1,2N=32±2,其他视为非整倍体,则与本研究观察结果稍吻合,他们的结果是否也预示栉江珧染色体较容易发生变异?这也有待进一步考证。本研究所获得的栉江珧大多都是野生采捕的成年贝,生长缓慢,组织细胞分裂增生的能力较弱,而要制备大量的染色体收缩适中、分散好的中期分裂相需要细胞分裂增生能力强的组织材料,如胚胎、幼虫、幼贝和成贝的鳃、生殖腺、肾脏等(吴宝铃, 1999),但这些取材都需要解剖杀死试验动物。早在1991年,Alvarez提出通过取鱼类的尾鳍进行原代培养获得成纤维细胞制备染色体的方法(Alvarez et al, 1994),尽管该方法理论上对鱼体损伤很小,一个样品还可重复取样或进行其他研究,但细胞培养的操作要求严格,实验条件要求也较高,并不是每次或每个物种的细胞培养都能成功,且时间跨度较长,一般数天或者数周。但到目前为止,贝类的组织培养还未取得突破性的进展,多停留在原代培养的探索阶段(李建军等, 2015; 陈宇, 2007),仅有建立了一种淡水蜗牛担轮幼虫胚胎(Biomphalaria glabrata embryonic, BGE)细胞系(Hansen, 1976)的报道,除此之外,未见有其他贝类细胞建系的报道。因此,采用培养细胞制备贝类染色体标本目前尚不可取。作者曾建立直接剪取波纹唇鱼(Cheilinus undulates)鳍条边缘及剪鳍后的愈合增生组织制备染色体的方法,未对鱼体健康造成明显伤害,且整个过程操作简便,可在实验基地或生产单位随时开展(周丽青等, 2010)。基于实验对象少而珍贵的情况,作者借鉴这种方法,利用贝类鳃丝也具有伤口修复的能力,获取大量分裂增生的愈合增生组织的细胞用于染色体制备,取得了相当好的结果,而且还能保证实验动物仍能健康存活,取鳃丝时还能观察性腺色泽进行性别的初步判断。
众所周知,成贝的生长速率随着年龄的增长而下降甚至停滞,体细胞的分裂增生能力有限。通过适当地改变成贝的暂养条件来刺激生物体体细胞的分裂增生能力,尚未见有报道。本研究通过改变暂养温度和加强营养供给,使实验成贝的体细胞在短期内出现应激性的增生高峰,取得了非常好的实验效果。采用创口愈合增生组织制备动物中期分裂相染色体的报道也较少,仅见合浦珠母贝(Pinctada martensii)成贝外套膜再生组织染色体制备技术的报道,而且分析的核型与其他学者使用不同的材料和方法制备的染色体核型有较大的差异(沈亦平等, 1993),这与本研究的结果类似。本研究建立的调节暂养水温、采用鳃丝及鳃丝对应部位创面的愈合增生组织制备大型贝类染色体技术简单快捷、实用性强、可重复操作。
Alvarez MC, Otis J, Amores A, et al. Short-term cell culture technique for obtaining chromosomes in marine and freshwater fish. Journal of Fish Biology, 1991, 39(6): 817-824 DOI:10.1111/jfb.1991.39.issue-6 |
Chen Y. The study on cytology of Lamprotula fibrosa. Masterxs Thesis of Huazhong Agricultural University, 2007 [陈宇.绢丝丽蚌细胞学研究.华中农业大学硕士研究生学位论文, 2007] http://cdmd.cnki.com.cn/Article/CDMD-10504-2007210182.htm
|
Hansen EL. A cell line from embryos of Biomphalaria glabrata (Pulmonata): Establishment and characteristics. In: Maramorosch K Ed. New York: Invertebrate tissue culture: Research applications, 1976: 77–99 https://www.researchgate.net/publication/290218477_A_Cell_Line_from_Embryos_of_Biomphalaria_glabrata_Pulmonata_Establishment_and_Characteristics
|
Li JJ, Huang BY. Technology and application of marine shellfish cell culture. Marine Science Bulletin, 2015, 34(3): 247-251 [ 李建军, 黄宝玉. 海洋贝类细胞培养技术及其应用. 海洋通报, 2015, 34(3): 247-251] |
Levan A, Fredga K, Sandberg AA. Nomenclature for centromeric position on chromosomes. Hereditas, 1964, 52(2): 201-220 |
Liu J, Li Q, Kong LF, et al. Cryptic diversity in the pen shell Atrina pectinata (Bivalvia: Pinnidae): High divergence and hybridization revealed by molecular and morphological data. Molecular Ecology, 2011, 20(20): 4332-4345 DOI:10.1111/j.1365-294X.2011.05275.x |
Komaru A, Wada KT. Karyotypes of four species in the Pectinidae (Bivalvia: Pteriomorphia). Japanese Journal of Malacology Venus, 1985, 44(4): 249-259 |
Nian WH. Verification of Y chromosome of the tufted deer by FISH and studies of the mechanisms of karyotype polymorphism. Masterxs Thesis of Nanjing Normal University, 2006 [粘伟红. FISH技术验证毛冠鹿Y染色体及核型多态性机理初步研究.南京师范大学硕士研究生学位论文, 2006] http://cdmd.cnki.com.cn/article/cdmd-10319-2006153824.htm
|
Ren JF, Yang AG. Current status of study on pen shell Atrina pectinata and its prospects of application and exploitation. Marine Fisheries Research, 2005, 26(4): 84-88 [ 任建峰, 杨爱国. 栉江珧研究现状及开发利用前景. 海洋水产研究, 2005, 26(4): 84-88] |
Shen YP, Wang XJ, Ma WT, et al. A technique for preparation of metaphase chromosome from mantle tissue of adult pearl oyster Pinctada martensii Dunker. Journal of Wuhan University (Science Edition), 1993(5): 121-122 [ 沈亦平, 王孝举, 马文涛, 等. 合浦珠母贝成贝外套膜染色体制备技术. 武汉大学学报(理学版), 1993(5): 121-122] |
Sun ZX. A method for observing the chromosomes of shellfish. Chinese Journal of Zoology, 1991, 26(4): 34-35 [ 孙振兴. 一种观察贝类染色体的制片法. 动物学杂志, 1991, 26(4): 34-35] |
Twyman RM. Instant notes in developmental biology. Molecular Biotechnology Unit. John Innes Centre, Norwich, UK. Bios Scientific Publishers Limited, 2002, 151–159
|
Volff JN, Zarkower D, Bardwell VJ, et al. Evolutionary dynamics of the DM domain gene family in metazoans. Journal of Molecular Evolution, 2003, 57(S1): S241-S249 |
Wang MF, Yu XY, Ye FL. The gonad development of Pinna (Atrina) pectinata in Beibu Gulf and adjoining coast. Guangxi Sciences, 2000, 7(2): 140-143 [ 王梅芳, 余祥勇, 叶富良. 北部湾及附近海域栉江珧性腺发育研究. 广西科学, 2000, 7(2): 140-143 DOI:10.3969/j.issn.1005-9164.2000.02.019] |
Wang MF, Yu XY, Wang JY. The hermaphrodites and sex-reversal of Atrina pectinata Linnaeus and Pinna bicolor Gmelin. Journal of Zhanjiang Ocean University, 1999, 19(4): 6-10 [ 王梅芳, 余祥勇, 王君彦. 两种江珧雌雄同体及性转换现象. 湛江海洋大学学报, 1999, 19(4): 6-10] |
Wang Q, Tong SL. The karyotype and banding-patterns of blue mussel, Mytilus edulis. Acta Zoologica Sinica, 1994, 40(3): 309-316 [ 王琼, 童裳亮. 贻贝(Mytilus edylis)核型及染色体带型分析. 动物学报, 1994, 40(3): 309-316 DOI:10.3321/j.issn:0001-7302.1994.03.013] |
Wu B, Bai LJ, Yang AG, et al. Novel polymorphic microsatellite markers isolated from the pen shell Atrina pectinata (Mollusca: Bivalvia: Pinnidae). Genetics and Molecular Research, 2014, 13(4): 10643-10647 DOI:10.4238/2014.December.18.6 |
Wu BL. Biology of settlement and metamorphosis in molluscs reproduction. In: Fundamental research on elite germplasm and disease resistance of mariculture organism. Jinan: Shandong Science & Technology Press, 1999, 137–144 [吴宝铃.海水增养殖生物优良种质和抗病力的基础研究贝类繁殖附着变态生物学.济南: 山东科学技术出版社, 1999, 137–144]
|
Yan JK, Wu B, Yang AG, et al. The complete mitochondrial genome of the pen shell Atrina pectinata (Mollusca: Bivalvia: Pinnidae): The first representative from the family Pinnidae. Mitochondrial DNA, 2013, 24(4): 368-369 DOI:10.3109/19401736.2013.763233 |
Yan JK, Yang AG, Zhou LQ, et al. The genetic diversity and phylogenetic studies of five populations of Atrina pectinta in China. Progress in Fishery Sciences, 2013a, 34(2): 29-35 [ 严加坤, 杨爱国, 周丽青, 等. 我国不同地理群体栉江珧遗传多样性及系统发生分析. 渔业科学进展, 2013a, 34(2): 29-35] |
Yan JK, Yang AG, Zhou LQ, et al. The genetic diversity of five populations of Atrina pectina in China based on mitochondrial 16S rRNA gene. Marine Science, 2013b, 37(2): 36-42 [ 严加坤, 杨爱国, 周丽青, 等. 基于线粒体16S rRNA基因研究5个栉江珧野生群体的遗传多样性. 海洋科学, 2013b, 37(2): 36-42] |
Yang Q, Li Q, Yu RH, et al. Artificial induction of gynogenetic diploids by suppression of the first cleavage in Atria pectinata. Marine Sciences, 2009, 33(10): 63-67 [ 杨青, 李琪, 于瑞海, 等. 栉江珧第1卵裂抑制型雌核发育二倍体人工诱导的研究. 海洋科学, 2009, 33(10): 63-67] |
Zheng YX, Yang AG, Wu B, et al. Studies on the spawning inducement and the conditions for thelarval of Atrina pectionata. Progress in Fishery Sciences, 2015, 36(6): 127-133 [ 郑言鑫, 杨爱国, 吴彪, 等. 栉江珧(Atrina pectinata)催产方法及幼虫培养条件. 渔业科学进展, 2015, 36(6): 127-133] |
Zhou LQ, Yang AG, Wu B, et al. A preliminary study on chromosome preparation and karyotype of humphead wrasse Cheilinus undulates. Progress in Fishery Sciences., 2010, 31(1): 54-58 [ 周丽青, 杨爱国, 吴彪, 等. 波纹唇鱼染色体制备及核型的初步研究. 渔业科学进展, 2010, 31(1): 54-58 DOI:10.3969/j.issn.1000-7075.2010.01.009] |



