2. 中国水产科学研究院黄海 水产研究所 青岛 266071;
3. 中国水产科学研究院北戴河中心实验站 秦皇岛 066100
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Beidaihe Central Experiment Station, Chinese Academy of Fishery Sciences, Qinhuangdao 066100
基因sox(SRY-related HMG-box)是与哺乳动物睾丸决定基因SRY(Sex determination Region of Y chromosome)的保守区HMG基序有60%以上同源性的一类基因的统称,而sox9(Sex determining region Y-box 9)是sox基因家族中重要的一员(Foster et al, 1994)。东天等(2015)研究表明,sox9基因是目前发现的大多数脊椎动物睾丸发育的主要基因之一,被认为与性逆转、性别分化胚胎期的细胞分化以及精原细胞的形成有关。哺乳类sox9下调wnt4 (Wingless-type MMTV integration site family, member 4)的表达,性腺将发育成睾丸(侯林等, 2007);sox9参与激活amh (Anti-mullerian hormone),可以使哺乳动物性腺向精巢方向发育(文爱韵等, 2011)。目前,在尼罗罗非鱼(Oreochromis niloticus)、青鳉(Oryzias latipes)、高身丽脂鲤(Astyanax altiparanae)、西伯利亚鲟鱼(Acipenser baerii)和牙汉鱼(Odontesthes bonariensis)等多种鱼类中获得了sox9基因(Kobayashi et al, 2008; Nakamura et al, 2012; Fernandino et al, 2003; Adolfi et al, 2015; Berbejillo et al, 2013)。证实了sox9基因在鱼类性别分化和性腺发育过程中发挥着重要的作用。李永婧等(2017)研究发现,sox9的突变会导致雌性个体出现雄性表型,这可能与生殖细胞数目的减少相关,表明在硬骨鱼类中sox9基因可能具有新的功能,即在生殖细胞系维持和存活方面发挥了重要作用。
圆斑星鲽(Verasper variegatus)是一种具有广阔养殖前景的新兴养殖对象,雌性在生长速度与体型上明显比雄性大,5~8 cm的圆斑星鲽经养殖4年,雌、雄鱼的体重分别达4.3 kg和1.2 kg(叶建生等, 2006)。通过进行性别控制,培育单一雌性苗种,可以有效提高其养殖效益。性别决定机制与性别分化特征的研究对实现单性化繁殖十分重要。迄今圆斑星鲽性别相关基因的研究还未见报道。作者克隆了圆斑星鲽sox9基因的全长序列,并分析其在圆斑星鲽成鱼不同组织及在幼鱼不同发育阶段的表达差异,为圆斑星鲽的性别决定及性腺发育机制提供了基础资料和理论依据。
1 材料与方法 1.1 实验材料 1.1.1 成鱼各组织样品的制备圆斑星鲽成鱼取自蓬莱天源水产有限公司,解剖鱼体,观察其性腺,确定性别,然后取成体雄鱼和雌鱼各3尾,体长为(23.5±0.5) cm、体重为(340±20) g,取其组织(全脑、眼、鳃、心、肝、胆、肠、精巢、卵巢、肾和肌肉),置于有RNA later试剂的离心管中,液氮速冻后,将样品保存于-80℃超低温冰箱,待用。
1.1.2 仔鱼各发育时期样品的制备不同发育时期的仔鱼取自于山东省威海市乳山市的山东科合海洋高技术有限公司。选取20、30、40、50、60、70和80日龄仔鱼,其全长分别为(10.5±0.7)、(13.5±0.6)、(19.6±1.8)、(29.6±2.4)、(36.2±2.5)、(45.1±2.3)和(57.7± 2.8) cm,每个日龄取10尾鱼,去头去尾保留腹部,处理后装入冻存管中,液氮速冻,于-80℃超低温冰箱中保存备用。
1.2 RNA提取及反转录本研究采用Trizol法提取成鱼不同组织以及仔鱼各发育时期性腺组织的RNA。用分光光度计和琼脂糖凝胶电泳检验RNA质量。用DEPC处理水将RNA稀释成浓度为1 μg/μl的溶液,并使用反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser (TaKaRa),以稀释后的RNA为模板,将RNA反转录成cDNA。具体实验步骤为:在冰上,向0.2 ml的PCR管中依次加入5×gDNA Eraser Buffer 2.0 μl,gDNA Eraser 1.0 μl,Total RNA 1 ng,RNase Free dH2O补至10 μl;42℃水浴2 min,置于冰上;再加入PrimeScript RT Enzyme Mix Ⅰ 1.0 μl,RT Primer Mix 1.0 μl,5×PrimeScript Buffer 2 4.0 μl,RNase Free dH2O 4.0 μl;然后,37℃水浴15 min,85℃水浴5 s,置于冰上。产物cDNA转移至-20℃保存备用。
1.3 sox9基因核心片段的克隆基于本课题组前期获得的圆斑星鲽转录组数据(Ge et al, 2017),使用软件Oligo7设计特性引物sox9-S1和sox9-A1(表 1),以成鱼性腺组织的cDNA为模板,PCR扩增sox9核心序列。
|
|
表 1 本实验所用引物 Tab.1 Primers used in this study |
PCR反应体系(50 µl):在0.2 ml PCR管中依次加入2×TSINGKE Master Mix 25 µl,sox9-S1(10 µmol/L) 1 µl,sox9-A1(10 µmol/L) 1 µl,cDNA 1 µl,加双蒸水补至50 µl;PCR反应条件为94℃ 5 min;94℃ 30 s,58℃ 30 s,7℃ 1 min,35个循环;72℃ 10 min。扩增产物保存于-20℃。
1.2%的琼脂糖凝胶电泳检测PCR产物中的目的条带。UV2下切胶,使用SanPrep柱式DNA凝胶回收试剂盒(生工)和PMDTM 18-T载体(TaKaRa)对目的DNA片段进行回收、连接和转化培养。具体步骤参考试剂盒使用说明书。菌液PCR进行阳性克隆筛选。
菌液PCR反应体系(10 µl)如下,在0.2 ml PCR管中依次加入2×TSINGKE Master Mix 5 µl,M13-S1 (10 µmol/L) 0.4 µl,M13-A1 (10 µmol/L) 0.4 µl,菌液2 µl,加双蒸水补至10 µl。PCR反应条件为94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。扩增产物保存于-20℃。
扩增产物经1.0%琼脂糖凝胶电泳检测目的条带(原目的条带加150~200 bp为阳性克隆)。有目的条带的菌液送测。测序结果与NCBI数据库进行对比,确定序列为sox9基因的核心序列。
1.4 sox9基因5' UTR和3' UTR的扩增使用SMARTTM RACE cDNA Amplification RACE (TaKaRa)反转录试剂盒,以性腺组织RNA为模板制备5'和3'cDNA的第一条链。根据前面所得的核心序列设计特异性引物3' GSP-1和3' GSP-2扩增sox9基因的3' UTR。设计特异性引物5' GSP-1和5' GSP-2扩增sox9基因的5' UTR(表2)。5' UTR和3' UTR扩增都采用巢式PCR方法,共2轮PCR反应,第一轮以5'和3' cDNA的第一条链为模板及外侧特异引物GSP-1进行扩增,第二轮以第一轮PCR产物为模板及内侧特异引物GSP-2进行扩增。
反应体系25 µl:10×Buffer 2.5 µl,dNTP (2.5 mmol/L) 0.5 µl,UPM 2.5 µl,5'或3'特异引物0.5 µl,5'或3' RACE模板1.25 µl,Taq DNA聚合酶0.5 µl,ddH2O补足至25 µl。PCR反应条件为94℃,30 s;68℃,30 s;72℃,2 min。
将PCR所得的5'和3'端产物进行电泳检测,UV2下切胶回收DNA片段,并连接转化,挑取阳性克隆测序。测序结果与NCBI数据库进行比对,确定为sox9基因的片段。
1.5 序列和系统发育分析使用软件Gene Tool对sox9基因进行序列分析,使用软件DNAMAN对其进行蛋白序列多重比对分析,使用软件MEGA 5进行系统进化分析。
1.6 荧光定量PCR根据sox9基因的核心序列,运用软件Oligo7设计多对特异性引物,以圆斑星鲽成鱼不同组织和幼鱼不同发育阶段性腺组织的cDNA为模板,荧光定量PCR(qRT-PCR)测定sox9基因在圆斑星鲽不同组织中和幼鱼不同发育阶段的表达水平。特异性引物要进行引物试扩增,检测其条带的特异性及扩增效率,找出最佳的特异引物。通过预实验筛选出最佳引物sox9-S2和sox9-A2(表 1),目的基因sox9与内参基因β-actin的扩增效率都接近100%,扩增效率一致,采用2-△△Ct法分析基因相对表达量。
qRT-PCR反应体系(20 µl)为2×SYBR Premix Ex TaqTM Ⅱ(TaKaRa) 10µl, cDNA模板2 µl,正反向引物各0.8 µl,ROX Reference Dye Ⅱ 0.4 µl,ddH2O补齐至20 µl。扩增反应条件:94℃ 30 s (1个循环);94℃ 5 s,60℃ 34 s (40个循环);95℃ 15s (1个循环);60℃ 1 min (1个循环);95℃ 15 s (1个循环)。每一实验样品重复扩增3次,用于后续实验数据。运用SPSS 19.0软件进行One-way ANOVA差异显著性分析。
2 结果 2.1 序列和系统发育分析通过对sox9基因核心片段的克隆以及对其5' UTR和3' UTR的扩增,得到了sox9基因的全长序列。基因全长为3287 bp,经软件预测sox9基因包括1431 bp的ORF,可编码477个氨基酸,368 bp的5' UTR和1488 bp的3' UTR(图 1)。在3' UTR中有多聚腺苷酸尾和加尾信号AATAAA。

|
图 1 圆斑星鲽sox9基因核苷酸序列 Fig.1 The nucleotide sequence of the sox9 gene in spotted halibut 大写字母:编码区;小写字母:非编码区 Uppercase letters: Coding regions; Lowercase letters: Untranslated regions (UTR) |
如图 2所示,将圆斑星鲽Sox9蛋白序列与其他物种的Sox9蛋白序列进行比对分析,比对所用的物种包括:人(Homo sapiens,CAA86598.1)、原鸡(Gallus gallus,AAB09663.1)、鼠(Mus musculus,NP_035578.3)、非洲爪蟾(Xenopus laevis,NP_001084276.1)、红鳍东方鲀(Takifugu rubripes,Sox9a:AAQ18507.1,Sox9b:AAQ18508.1)、大菱鲆(Scophthalmus maximus,ART89197.1)、牙鲆(Paralichthys olivaceus,ACO40490.1)、赤点石斑鱼(Epinephelus akaara,AAT77677.1)和青鳉(Oryzias latipes,Sox9a:NP_001098556.1,Sox9b:AAX62151.1)。比对结果显示,包括圆斑星鲽在内的鱼类Sox9蛋白均含有高度保守的HMG结构域。sox9基因编码的477个氨基酸,其中103~173 aa为HMG结构域。
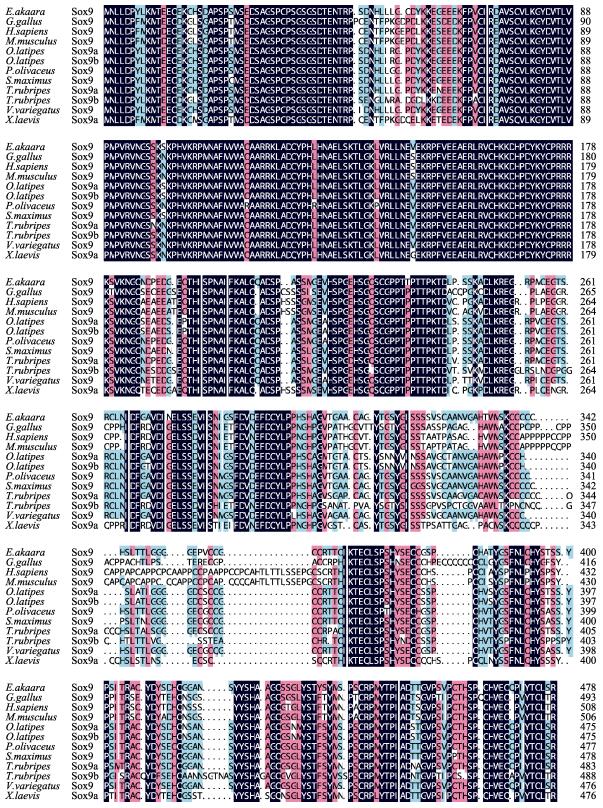
|
图 2 鱼类Sox9蛋白序列比对分析 Fig.2 Alignment analysis of Sox9 protein sequences of fishes 人(H. sapiens, CAA86598.1)、原鸡(G. gallus, AAB09663.1)、鼠(M. musculus, NP_035578.3)、非洲爪蟾(X. laevis, NP_001084276.1)、红鳍东方鲀(T. rubripes, Sox9a: AAQ18507.1, Sox9b: AAQ18508.1)、大菱鲆(S. maximus, ART89197.1)、牙鲆(P. olivaceus, ACO40490.1)、赤点石斑鱼(E. akaara, AAT77677.1)和青鳉(O. latipes, Sox9a: NP_001098556.1, Sox9b: AAX62151.1) |
根据已发表的各个物种的Sox9蛋白序列,采用MEGA软件的邻接法(Neighbor-joining, NJ),自举次数(bootstrap)1000次,构建NJ分子系统进化树(图 3)。进化树构建所用的Sox9蛋白的其他物种包括:人(H. sapiens,CAA86598.1)、原鸡(G. gallus,AAB09663.1)、鼠(M. musculus,NP_035578.3)、沼泽鳄(Crocodylus palustris,ACU12296.1)、红鳍东方鲀(T. rubripes,Sox9a:AAQ18507.1,Sox9b:AAQ18508.1)、大菱鲆(S. maximus,ART89197.1)、牙鲆(P. olivaceus,ACO40490.1)、斑马鱼(Barchydanio rerio,Sox9a:AAG09814.1,Sox9b:AAG09815.1)、赤点石斑鱼(E. akaara,AAT77677.1)和青鳉(O. latipes,Sox9a:NP_001098556.1,Sox9b:AAX62151.1)。从图 3可以看出,哺乳类(如人)、鸟类(如原鸡)和爬行类(如沼泽鳄)的Sox9聚在了一起,圆斑星鲽Sox9与牙鲆、青鳉等其他硬骨鱼类的Sox9聚在了一起。
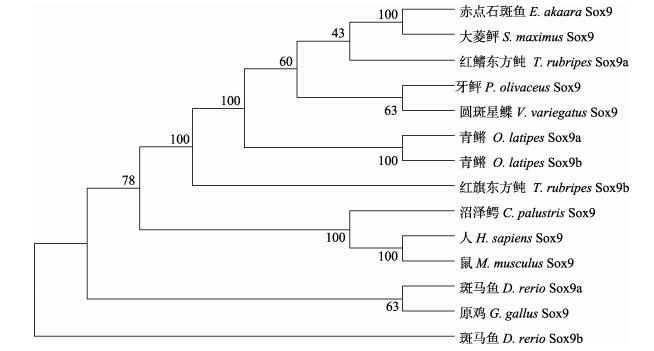
|
图 3 多个物种Sox9蛋白序列的系统进化分析 Fig.3 A neighbor-joining tree based on multiple Sox9 protein sequences 人(H. sapiens, CAA86598.1);原鸡(G. gallus, AAB09663.1);鼠(M. musculus, NP_035578.3);沼泽鳄(C. palustris, ACU12296.1);红鳍东方鲀(T. rubripes, Sox9a: AAQ18507.1, Sox9b: AAQ18508.1);大菱鲆(S. maximus, ART89197.1);牙鲆(P. olivaceus, ACO40490.1);斑马鱼(B. rerio, Sox9a: AAG09814.1, Sox9b: AAG09815.1);赤点石斑鱼(E. akaara, AAT77677.1);青鳉(O. latipes, Sox9a: NP_001098556.1, Sox9b: AAX62151.1) |
荧光定量PCR测定圆斑星鲽sox9基因在成体各组织中的表达水平,结果显示,圆斑星鲽sox9 mRNA普遍存在于成体各组织中(脑、眼、鳃、心、肝、肠、胆、精巢、卵巢、肾和肌肉)(图 4)。比较雌雄个体相同组织的表达水平,可以发现sox9基因在鳃和性腺组织中的表达显示出性别两相性差异(P < 0.05),雄鱼的表达水平要显著高于雌鱼;比较不同组织的表达水平,可以发现sox9基因在雌鱼鳃、脑和肠组织中表达水平较高,在卵巢、肌肉、心和肾脏组织中表达水平较低,在雄鱼鳃、脑和精巢组织中表达水平较高,在肌肉、心和肾脏中表达水平较低。
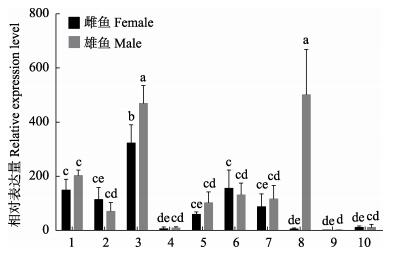
|
图 4 sox9基因在圆斑星鲽成鱼不同组织中表达的定量分析
Fig.4 Quantitative analysis of the expression of sox9 gene in different tissues of adult spotted halibut
1:脑;2:眼;3:鳃;4:心;5:肝;6:肠;7:胆;8:性腺;9:肾;10:肌肉 a、b、c、d表示组间具有显著性差异(P < 0.05),ce、cd、de含相同字母表示组间差异不显著 1: Brain; 2: Eye; 3: Gill; 4: Heart; 5: Liver; 6: Intestine; 7: Gallbladder; 8: Gonad; 9: Kidney; 10: Muscle a, b, c, and d indicated the expression levels are significantly different among tissues (P < 0.05), ce, cd and de which have one identical letter indicated the expression levels are not significantly different among tissues |
荧光定量PCR测定圆斑星鲽sox9 mRNA在仔鱼各发育时期的表达水平。结果显示,sox9基因在仔鱼20~50日龄表达量逐渐下降,在60日龄表达量上升,在70日龄之后表达量下降(图 5)。

|
图 5 sox9基因在仔鱼发育时期表达的定量分析 Fig.5 Quantitative analysis of the expression of sox9 gene in the larval developmental stages of spotted halibut |
本研究克隆了圆斑星鲽sox9基因,并通过RACE技术得到了sox9基因的全长。sox9 mRNA全长为3287 bp,编码477个氨基酸。将其蛋白序列与其他物种Sox9蛋白序列进行比对,发现其103~173 aa为高度保守的HMG结构域。利用已知物种的Sox9蛋白序列构建分子系统进化树,发现圆斑星鲽Sox9与牙鲆等硬骨鱼类的Sox9聚在一起,说明sox9基因在鱼类中是比较保守的。而且其与牙鲆Sox9在同一分支,则说明二者亲缘关系最近。同时,通过系统进化树可发现,在人、鼠和原鸡等较高等的脊椎动物中只出现一种sox9基因,而在斑马鱼、青鳉和红鳍东方鲀等鱼类中出现2种类型的sox9基因,即sox9a和sox9b。斑马鱼的Sox9a和原鸡在同一分枝上,而斑马鱼Sox9b却在另一分支,这说明斑马鱼Sox9a与鸟类等较高等脊椎动物Sox9亲缘关系较近,功能也会更相似,这一点与Rodríguez-Marí等(2005)的研究发现相吻合。Rodríguez-Marí等(2005)研究发现,斑马鱼sox9a基因在精巢组织的Sertoli细胞中表达,而sox9b基因则在卵巢的卵母细胞中表达。我们在研究中发现,圆斑星鲽也存在2种类型的sox9基因,但只成功克隆出1种类型的sox9基因,因sox9亚型的划分没有公认的标准,暂时将其命名为sox9基因。
通过荧光定量PCR分析圆斑星鲽sox9基因在成体各组织中的表达,发现其在圆斑星鲽成鱼的各组织中都有不同程度的表达,这与牙鲆和许氏平鲉(Sebastes schlegelii)sox9基因的研究结果一致(文爱韵等, 2011; 马丽曼, 2014)。sox9在精巢中的表达量要显著高于卵巢,显示出性别两相性差异,与裸盖鱼(Anoplopoma fimbria)、点带石斑鱼(Epinephelus coioides)、尼罗罗非鱼和斜带石斑鱼(Epinephelus coioides)sox9基因的表达情况一致(Smith et al, 2013; Luo et al, 2010; Kobayashi et al, 2008; Xia et al, 2007),说明sox9基因与雄性性别相关,推测sox9基因可能参与了圆斑星鲽精巢发育过程。sox9基因除在精巢中表达最高,在鳃和脑组织中也有较高表达,说明sox9在其他组织的发育过程中也发挥了作用。如Dong等(2011)发现,半滑舌鳎(Cynoglossus semaluevas) sox9a基因在雄性的脑、垂体和性腺中的表达都显著高于雌性,且9月龄的半滑舌鳎精巢中的表达量达到峰值,在原肠胚期的表达量高于其他时期,说明sox9a基因对半滑舌鳎的脑-垂体-性腺轴及精原细胞的形成起重要作用。青鳉sox9b基因的突变会导致雌性个体出现雄性表型,可能与生殖细胞数目的减少相关,表明在硬骨鱼类中可能具有新的功能,在生殖细胞系维持和存活方面发挥了重要作用(李永婧等, 2017)。此外,在斑马鱼、黄鳝(Monopterus albus)和黄颡鱼(Pelteobagrus fulvidraco)等鱼类中发现了2个sox9基因(Rodríguez-Marí et al, 2005; Zhou et al, 2003; 俞菊华等, 2005)。Rodríguez-Marí等(2015)在斑马鱼中筛选到sox9a和sox9b两个sox9基因。sox9a在精巢和脑等多个组织中表达,在卵巢中不表达;sox9b仅在卵巢中表达,在其他组织中不表达。而Zhou等(2003)在黄鳝中发现sox9a1和sox9a两个基因,其在精巢、卵巢和间性性腺(精卵巢)中都表达。这说明sox9基因的2个分型的功能是不同的。Volff等(2005)指出,在硬骨鱼类中存在2种类型的sox9基因,也许是由鱼类特有的基因组复制导致的。
荧光定量PCR测定了圆斑星鲽sox9基因在仔鱼各发育时期的表达水平,结果显示,sox9基因在仔鱼20~50日龄表达量逐渐下降,而在60日龄时表达量上升,这与许氏平鲉sox9基因在其仔鱼不同发育阶段的表达模式相同,即在孵化后5 d和10 d表达量有降低的趋势,15 d和25 d的表达量逐渐上升,许氏平鲉在孵化后约25~35 d性腺开始分化,因此,许氏平鲉sox9基因在25日龄表达量达到较高的水平可能与性腺的分化有关(马丽曼等, 2014)。圆斑星鲽性腺分化的研究未见报道,而条斑星鲽(Verasper moseri)在60~70日龄性腺开始分化(李忠红, 2009),这与圆斑星鲽sox9基因表达量上升的时间接近,因此,推测表达量上升可能与幼鱼性腺分化有关。
Adolfi MC, Carreira AC, Jesus LW, et al. Molecular cloning and expression analysis of dmrt1 and sox9 during gonad development and male reproductive cycle in the lambari fish, Astyanax altiparanae. Reproductive Biology and Endocrinology, 2015, 13: 2 DOI:10.1186/1477-7827-13-2 |
Berbejillo J, Martinez-Bengochea A, Bedó G, et al. Expression of dmrt1 and sox9 during gonadal development in the Siberian sturgeon (Acipenser baerii). Fish Physiology and Biochemistry, 2013, 39(1): 91-94 |
Dong T, Liu FJ, Hu HX, et al. Research progress on sex differentiation related genes on sturgeon. Biotechnology Bulletin, 2015, 31(10): 62-70 [ 东天, 刘凤娇, 胡红霞, 等. 鲟鱼性别分化相关基因研究进展. 生物技术通报, 2015, 31(10): 62-70] |
Dong XL, Chen SL, JI XS, et al. Molecular cloning, charactcrization and expression analysis of Sox9a and Foxl2 genes in half-smooth tongue sole (Cynoglossus semilaevis). Acta Oceanologica Sinica, 2011, 30(1): 68-77 DOI:10.1007/s13131-011-0092-9 |
Fernandino JL, Guilgur LG, Strobl-Mazzulla PH, et al. Molecular cloning of SOX9, DMRT1 and SF1 cDNA partial sequences in the pejerrey fish Odontesthes bonariensis (Atheriniformes). Fish Physiology and Biochemistry, 2003, 28(1-4): 145-146 DOI:10.1023/B:FISH.0000030503.86575.f3 |
Foster JW, Dominguez-Steglich MA, Guioli S, et al. Campomelic dysplasia and autosomal sex reversal caused by mutations in an SRY-related gene. Nature, 1994, 372(6506): 525-530 DOI:10.1038/372525a0 |
Ge J, Chen S, Liu C, et al. Characterization of the global transcriptome and microsatellite marker information for spotted halibut Verasper variegatus. Genes and Genomics, 2017, 39(3): 307-316 DOI:10.1007/s13258-016-0496-1 |
Hou L, Cui YX, Yao B. Progress in sexual determination related SOX9. Chinese Journal of Birth Health and Heredity, 2007, 15(8): 1-2, 9 [ 侯林, 崔英霞, 姚兵. 性别决定相关基因SOX9研究进展. 中国优生与遗传杂志, 2007, 15(8): 1-2 DOI:10.3969/j.issn.1006-9534.2007.08.001] |
Kobayashi T, Kajirua-Kobayashi H, Guan G, et al. Sexual dimorphic expression of DMRT1 and Sox9a during gonadal differentiation and hormone-induced sex reversal in the teleost fish Nile tilapia (Oreochromis niloticus). Developmental Dynamics, 2008, 237(1): 297-306 DOI:10.1002/(ISSN)1097-0177 |
Li YJ, Wu LM, Li XJ. A review on the genes related with sex determination and differentiation in teleosts. Journal of Henan Normal University (Natural Science Edition), 2017, 45(4): 72-78 [ 李永婧, 吴利敏, 李学军. 硬骨鱼类性别决定与分化相关基因研究进展. 河南师范大学学报(自然科学版), 2017, 45(4): 72-78] |
Li ZH. Gynogenesis induced and histological observation on gonadal sex differentiation in barfin flounder (Verasper moseri). Master's Thesis of Northeast Agricultural University, 2009, 28-34 [李忠红.条斑星鲽Verasper moseri雌核发育诱导及性别分化过程的初步研究.东北农业大学硕士研究生学位论文, 2009, 28-34] http://cdmd.cnki.com.cn/Article/CDMD-10224-2009219310.htm
|
Luo YS, Hu W, Liu XC, et al. Molecular cloning and mRNA expression pattern of Sox9 during sex reversal in orange-spotted grouper (Epinephelus coioides). Aquaculture, 2010, 306(1-4): 322-328 DOI:10.1016/j.aquaculture.2010.06.019 |
Ma LM. Study on sex related genes Sox3, Sox9 and Dmrt1 in black rockfish, Sebastes Schlegeli. Doctoral Dissertation of Ocean University of China, 2014, 79-91 [马丽曼.许氏平鲉性别相关基因Sox3、Sox9和Dmrt1的研究.中国海洋大学博士研究生学位论文, 2014, 79-91] http://cdmd.cnki.com.cn/Article/CDMD-10423-1014369094.htm
|
Nakamura S, Watakabe I, Nishimura T, et al. Analysis of medaka sox9 orthologue reveals a conserved role in germ cell maintenance. PLoS One, 2012, 7(1): e29982 DOI:10.1371/journal.pone.0029982 |
Rodríguez-Marí A, Yan YL, BreMiller RA, et al. Characterization and expression pattern of zebrafish anti-Müllerian hormone (amh) relative to sox9a, sox9b, and cypl9ala, during gonad development. Gene Expression Patterns, 2005, 5: 655-667 DOI:10.1016/j.modgep.2005.02.008 |
Smith EK, Guzmán JM, Luckenbach JA. Molecular cloning, characterization, and sexually dimorphic expression of five major sex differentiation-related genes in a Scorpaeniform fish, sablefish (Anoplopoma fimbria). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2013, 165(2): 125-137 DOI:10.1016/j.cbpb.2013.03.011 |
Volff JN. Genome evolution and biodiversity in teleost fish. Heredity, 2005, 94(3): 280-294 DOI:10.1038/sj.hdy.6800635 |
Wen AY, You F, Sun P, et al. Study on cloning and expression of gene sox9 in olive flounder (Paralichthys olivaceus). Advances in Marine Science, 2011, 29(1): 97-104 [ 文爱韵, 尤锋, 孙鹏, 等. 牙鲆sox9基因的克隆与表达研究. 海洋科学进展, 2011, 29(1): 97-104 DOI:10.3969/j.issn.1671-6647.2011.01.012] |
Xia W, Zhou L, Yao B, et al. Differential and spermatogenic cell-specific expression of DMRT1 during sex reversal in protogynous hermaphroditic groupers. Molecular and Cellular Endocrinology, 2007, 263(1-2): 156-172 DOI:10.1016/j.mce.2006.09.014 |
Ye JS, Wang XQ, Ma S, et al. Studies on biological and advances of Verasper variegates. Fisheries Economy Research, 2006(6): 5-7 [ 叶建生, 王兴强, 马甡, 等. 圆斑星鲽的生物学特性及其研究进展. 渔业经济研究, 2006(6): 5-7 DOI:10.3969/j.issn.1674-9189.2006.06.002] |
Yu JH, Li JL, Cao LP, et al. Isolation and analysis of Sox9 derived from yellow catfish (Pelteobagrus fulvidraco). Journal of Agricultural Biotechnology, 2005, 13(5): 620-623 [ 俞菊华, 李建林, 曹丽萍, 等. 黄颡鱼Sox9基因的分离及分析. 农业生物技术学报, 2005, 13(5): 620-623 DOI:10.3969/j.issn.1674-7968.2005.05.016] |
Zhou R, Liu L, Guo Y, et al. Similar gene structure of two Sox9a genes and their expression patterns during gonadal differentiation in a teleost fish, rice field eel (Monopterus albus). Molecular Reproduction and Development, 2003, 66(3): 211-217 DOI:10.1002/(ISSN)1098-2795 |



