2. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与 食物产出过程功能实验室 青岛 266071;
4. 荣成楮岛水产有限公司 荣成 264312
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. Rongcheng Chudao Aquaculture Corporation, Rongcheng 264312
海草为生活在海洋中的高等显花植物的统称,它们依靠根和地下茎固着于底质中生长,于水下完成开花传粉及种子的产生等一系列生物过程。全球海草约72种,在温带各海草种类中,以大叶藻(Zostera marina L.)分布最为广泛。在我国,该种高等显花植物的分布见于山东、辽宁和河北沿海(中国科学院中国植物志编辑委员会, 1992)。大叶藻广泛生长形成的草床可为周围生物提供栖息和育幼场所(Ward, 1985),极大地增加周围环境的生物多样性,并能稳固潮滩、净化水质等(Ward et al, 1984),与珊瑚礁和红树林同为三大典型海洋生态系统,在浅海生态系统中发挥着重要的生态功能。然而,自20世纪开始,由于各种自然因素和人为扰动的影响,大叶藻海草床处于不断退化的状态(Lorus et al, 1951),到目前为止,已有约29%的海草床消失(Waycott et al, 2009)。
桑沟湾(37°01'~37°09'N, 122°24'~122°35'E)位于山东半岛东端,水域广阔,海岸线长,资源丰富,南端楮岛海区分布有桑沟湾面积最大、分布最为集中的大叶藻床。据报道,1983年,桑沟湾楮岛海区大叶藻分布面积约为100 hm2,至2008年初,增加至200 hm2,2009年底,大叶藻分布面积接近400 hm2(高亚平, 2009)。在全球海草床资源日益衰退的背景下,桑沟湾楮岛海区的大叶藻分布面积和资源量却呈现逐年扩大与恢复的趋势,一方面得益于该地区实施的大叶藻保护措施(2009年山东省在荣成市楮岛建立了“楮岛藻类种质资源保护区”,并将其列入山东省渔业资源修复行动计划,大叶藻也被列为保护对象),另一方面,大叶藻床区周边分布的大量的菲律宾蛤仔(Ruditapes philippinarum)资源也可能扮演着非常重要的生态角色。
菲律宾蛤仔具有很强的滤水能力,可以将大量悬浮物从水体中清除,其中,包括沉积物、有机碎屑、细菌、无脊椎幼虫、浮游动物和浮游植物(Davenport et al, 2000; Mazzola et al, 2001),从而净化水体,提高光照透射率。另一方面,菲律宾蛤仔通过排泄作用释放的N(NH4-N)和P(PO4-P),可以为海洋中的浮游植物、大型藻类、沉水植物提供营养盐,维持了海洋重要的初级生产力。
桑沟湾大叶藻分布区内蛤仔量较大,可收获生物量约700 g/m2·yr(高亚平等, 2013),为探讨大叶藻海区菲律宾蛤仔的生态作用,本研究选取桑沟湾楮岛海草床菲律宾蛤仔为研究对象,在摸清菲律宾蛤仔种群结构和生物量的基础上,利用模拟现场流水法,研究了菲律宾蛤仔的摄食、代谢生理,并基于现场围隔实验法探讨大叶藻与蛤仔间物质的相互利用,以期揭示蛤仔在海草床生态系统中的作用,为海草床的生态恢复提供理论依据。
1 材料与方法 1.1 实验地点及材料2016年5月,现场模拟流水实验在桑沟湾楮岛海钓码头进行,实验所需大(壳长为3.50~4.10 cm)、中(壳长为3.00~3.50 cm)、小(壳长为2.00~3.00 cm)规格菲律宾蛤仔均取自桑沟湾楮岛海域(37°02'38.3"N, 122°33'30.3"E)(围隔实验所需中等规格的菲律宾蛤仔以及菲律宾蛤仔的生物量调查都是在此区域),并暂养于海钓码头附近的海上,暂养期间,温度为19.00℃~20.25℃,pH为7.90~8.00,溶氧为7.10~7.50 mg/L。7月群体水平的围隔实验在楮岛码头进行,10月进行了蛤仔的生物量调查。
1.2 实验方法 1.2.1 菲律宾蛤仔的生物量统计2016年10月,在楮岛海域(37°02'38.3"N, 122°33'30.3"E)随机选取5个大小为0.5 m×0.5 m样方,将样方内的菲律宾蛤仔全部采集,蛤仔清洗干净后测量壳长并计数。
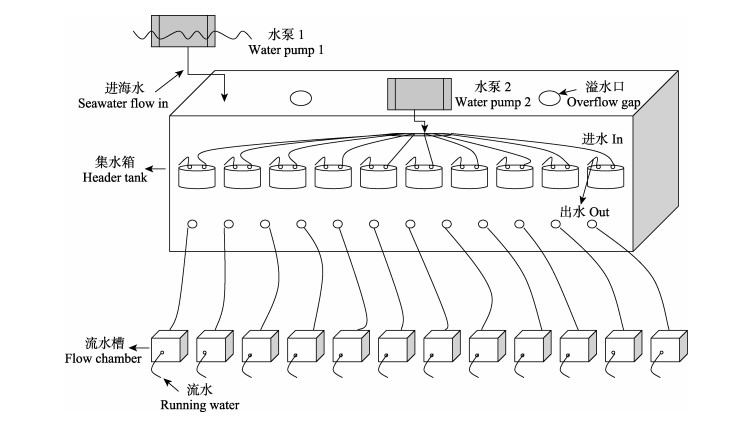
1.2.2 现场模拟流水实验将暂养的大、中、小规格菲律宾蛤仔各取出9个,标号后分批次放入容积约为3.3 L的流水槽内(图 1),使菲律宾蛤仔的进水口正对水槽进水方向(Eckman et al, 1989),实验设9个平行,3个对照,进水孔位于槽顶下方2.3 cm处,出水孔位于另一端的槽底上方6.2 cm处。利用水泵1抽取海水到高位集水箱,溢水口保持集水箱水位,海水经过12个带阀门的硅胶管流入流水槽,调整流速为200 ml/min左右,驯化1 h。驯化结束后开始实验,每种规格的蛤仔实验持续3 h,每隔1 h测各个流水槽流速,用100 ml的水样瓶同时收集各水槽流水,利用便携式颗粒计数器PAMAS(型号S4031GO, 德国)测定水样瓶中水体颗粒物数量(测定粒径范围为2~200 μm),并用2 L的聚乙烯瓶收集对照组水样,经预先烧好的孔径为1.2 μm的GF/C玻璃纤维滤膜(预先经450℃灼烧4 h,称重,精确到小数点后4位)抽滤,并用蒸馏水润洗除去盐分,将滤膜用锡纸包裹,在-20℃以下的冰箱内冷冻保存。耗氧实验共设9个平行,1个对照,打开水泵2,集水箱中的海水通过进水管抽到圆柱形容器中,并通过出水管流出,将标号的蛤仔分批次放入0.4 L圆柱形容器内,密封,驯化1 h后,关闭水泵2,并关闭盖子上阀门,开始实验,实验持续1 h,期间水泵1持续运行保持水浴状态,实验结束后,测各圆柱形容器内的溶氧,并用200 ml的水样瓶取水样,采集的水样迅速带回实验室进行氨氮测定。实验期间,水浴温度变化为19.20℃~20.10℃,pH变化为7.90~8.00,溶氧变化为7.15~7.50 mg/L。溶氧、pH、水温和盐度等指标使用In-Situ Inc.,Andersonville (美国)测定。
|
图 1 菲律宾蛤仔的滤水、耗氧实验示意 Fig.1 Diagram of R. philippinarum filtration, oxygen consumption experiment |
围隔实验装置为金属支架撑起的帆布桶(2.5 m×2.5 m×1 m),将12个自主设计且主体材质为聚甲基丙烯酸甲酯的圆柱形容器(直径为24 cm、高为49 cm、体积为22 L)放在帆布桶内注满水。实验设4个组(蛤仔组、大叶藻组、大叶藻+蛤仔组和空白组)(大叶藻30茎枝左右、蛤仔15个左右),每组3个平行,实验所用蛤仔的平均壳长为(3.42±0.16) cm,平均湿重为(5.08±0.99) g,平均组织干重为(0.35±0.06) g,平均肥满度为7.44。抽取沿岸的自然海水于帆布桶内(水域恒温),先暂养1 d。实验开始时,各组初始溶氧浓度约为6.60 mg/L,当实验蛤仔开壳进行自然滤水后,盖上桶盖密封,进行耗氧、排氨实验,持续4 h,测定实验结束时的溶氧,取水样(2份, 各500 ml),1份水样进行氨氮测定,1份水样经预先烧好的孔径为1.2 μm的GF/C玻璃纤维滤膜(预先经450℃灼烧4 h, 称重, 精确到小数点后4位)抽滤,并用蒸馏水润洗除去盐分,将滤膜用锡纸包裹,在‒20℃以下的冰箱内冷冻保存。实验期间,水浴温度变化为24℃~25℃,pH变化为7.90~ 8.00,溶氧变化为7.50~7.80 mg/L。溶氧、pH、水温和盐度等指标使用In-Situ Inc.,Andersonville (美国)测定。
1.2.4 样品测定按《海洋监测规范》GB17378-2007规定的方法,进行样品的采集、处理和保存。实验水样经0.45 μm醋酸纤维滤膜过滤后,采用次溴酸钠氧化法对NH4-N进行测定;GF/C玻璃纤维滤膜65℃烘箱中烘至恒重称重(W65),450℃灼烧后称重(W450) (都精确到小数点后4位);测量蛤仔壳长,分离软体组织,60℃烘干至恒重,称量软体组织干重(g)。
1.2.5 各参数的计算方法滤水率的计算公式如下:
滤水率[Clearance rate, CR, L/(ind.·h)] =
流速(L/h)×(C0-C1)/C0 (Widdows et al, 1992)
式中,C1和C0分别代表实验组和空白组颗粒物浓度(个/ml)。
水体颗粒物浓度计算公式如下:
| $ \text{TPM}(总颗粒物)=({W_{65}} - {W_0})/V \\ \text{POM}(颗粒有机物)= ({W_{65}} - {W_{450}})/V $ |
式中,W0为预先在马弗炉中经450℃灼烧4 h处理后的GF/C玻璃纤维滤膜重量(g),W65为水样经GF/C玻璃纤维滤膜过滤后在65℃烘箱中烘至恒重,用天平(精确到小数点后4位)称重所得,W450为65℃烘箱中烘至恒重的滤膜再经马弗炉灼烧4 h后用天平(精确到小数点后4位)称重所得,V为抽滤水体的体积(L)。
耗氧率的计算公式如下:
| $ 耗氧率\left[ {{\rm{Oxygen\ consumption\ rate, OR, mg/}}\left( {{\rm{ind}}{\rm{.}} \cdot {\rm{h}}} \right)} \right] \\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ = [({\rm{D}}{{\rm{O}}_0} - {\rm{D}}{{\rm{O}}_t}) \times V] /(N \times t) $ |
式中,DO0和DOt分别为空白组、实验组在t时水中溶氧量(mg/L);t为实验持续时间(h);N为实验蛤仔个数(ind.);V为实验用水的体积(L)。
排氨率的计算公式如下:
| $ \begin{array}{l} 排氨率{\rm{[Ammonia}}\;{\rm{excretion}}\;{\rm{rate, NR,}}\\ \;\;\;{\rm{\mu mol/}}\left( {{\rm{ind}}{\rm{.}} \cdot {\rm{h}}} \right)] = [({N_t} - {N_0}) \times V]/(N \times t) \end{array} $ |
式中,Nt和N0分别为实验组、空白组在t时水中氨氮浓度(μmol/L);t为实验持续时间(h);N为蛤仔个数(ind.);V为实验用水的体积(L)。
1.2.6 数据处理数据统计分析采用SPSS19.0,对所得数据用单因素方差分析(One-way ANOVA),存在显著差异时用Duncan方法做组间多重比较,以P < 0.05作为差异显著水平。
2 结果与分析 2.1 蛤仔生物量统计蛤仔的生物量在480~600 ind./m2,平均为(572.00± 20.23) ind./m2。其中,大规格蛤仔(壳长为3.50~ 4.10 cm)占9.01%,中规格蛤仔(壳长为3.00~3.50 cm)占43.60%,小规格蛤仔(壳长为2.00~3.00 cm)占47.38%。
2.2 不同规格菲律宾蛤仔的生理代谢3种规格蛤仔壳长差异显著,实验期间,水体总颗粒物和颗粒有机物浓度范围为(10.78±2.31)~ (10.91±1.97)和(3.72±0.52)~(4.11±0.57) mg/L。实验测得单位个体菲律宾蛤仔的排氨率、耗氧率、滤水率和摄食率变化范围(表 1)。由表 1可知,蛤仔排氨率、耗氧率、滤水率、摄食率都随个体规格增大而增加。
|
|
表 1 菲律宾蛤仔生物学及生理学参数 Tab.1 Biological and physiological parameters of R. philippinarum |
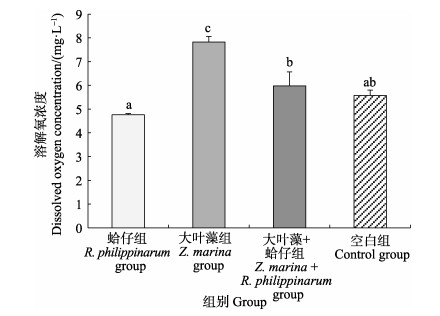
实验结束时,水体溶氧浓度,蛤仔组 < 空白组 < 大叶藻+蛤仔组 < 大叶藻组,蛤仔组、大叶藻+蛤仔组和大叶藻组间存在显著差异(P < 0.05),空白组与大叶藻组存在显著差异(P < 0.05),与大叶藻+蛤仔组差异不显著(P > 0.05)(图 2)。
|
图 2 水体溶解氧浓度 Fig.2 Concentration of dissolved oxygen in seawater 字母相同代表差异不显著(P > 0.05),不同代表差异显著(P < 0.05)。下同 Values with same letters mean no significant differences (P > 0.05), different letters mean significant differences (P < 0.05). The same as below |
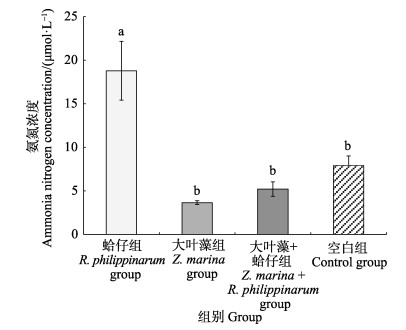
水体氨氮浓度,大叶藻组 < 大叶藻+蛤仔组 < 空白组 < 蛤仔组,蛤仔组与其他3组存在显著差异(P < 0.05),大叶藻组、大叶藻+蛤仔组和空白组差异不显(P > 0.05)(图 3)。
|
图 3 水体氨氮浓度 Fig.3 Concentration of ammonia nitrogen in seawater |
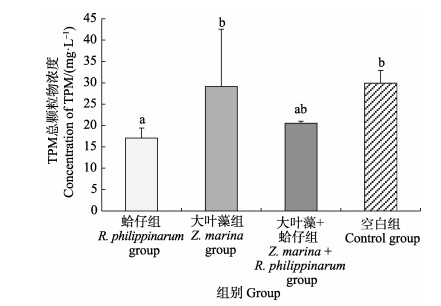
水体中颗粒物浓度,空白组 > 大叶藻组 > 大叶藻+蛤仔组 > 蛤仔组,大叶藻组与空白组浓度基本一致,蛤仔组、大叶藻+蛤仔组与空白组存在显著差异(P < 0.05),大叶藻组与空白组差异不显著(P > 0.05) (图 4)。
|
图 4 水体总颗粒物浓度 Fig.4 Concentration of TPM in seawater |
光照是决定海草植株密度、分布及生产力的首要因素(Gaeckle et al, 2002),而水下光的减弱被认为是海草床衰退的最主要因素之一(郑杏雯, 2007)。海水养殖设施和大叶藻叶片上附生单细胞藻类对太阳光线的遮挡及水体浑浊度增加是造成大叶藻光可获得性减弱的潜在原因。研究表明,海水养殖是海草资源衰退的重要因素之一(吴钟解等, 2015),养殖设施对太阳光线的物理遮挡能够导致海草的分布面积减少高达75%,与没有养殖设施的对照海区相比,牡蛎筏式养殖区(养殖密度3.2 kg/m2)表层到底层水体的光辐射减少了37.5%,相对电子传递速率(ETR)减少了81.5%,平均光合光量子通量(μmol quanta/m2·s)密度(PPFD)减少了85.2%(Skinner et al, 2014)。一方面,大量附生单细胞藻类覆盖在海草叶片表面,可导致海草的可利用光能大幅度减少63% (Silberstein et al, 1986),进而出现光合作用能力下降(Irlandi et al, 2004),另一方面,附生藻类并非单纯地覆盖在海草表面遮挡有效光合辐射,而是显示出像叶绿体一样的吸收特性,优先的吸收蓝光和红光,从而形成了与海草叶片表面竞争可利用光子的局面,在一定程度上加剧了对海草光合作用的限制。菲律宾蛤仔具有很强的滤水能力,可以滤食水体中的浮游植物、有机碎屑等悬浮物,不仅可以净化水体,提高水体透明度,而且可以降低单细胞藻类在大叶藻叶片的附着率,进而减少附生单细胞藻类对大叶藻光合作用的影响。本研究结果显示,桑沟湾楮岛海区底栖自然野生菲律宾蛤仔面积约为0.5 km2,蛤仔密度为(572.00±20.23) ind./m2,大、中、小规格菲律宾蛤仔的滤水率分别为(0.83±0.66)、(0.75±0.60)、(0.69±0.38) L/(ind.·h),取3种规格蛤仔平均滤水率和摄食率来估算,蛤仔每天将过滤4.2×106 t海水,摄食约46 t悬浮颗粒物。围隔实验中的各组颗粒物浓度,空白组 > 大叶藻组 > 蛤仔组 > 大叶藻+蛤仔组,空白组与蛤仔组、大叶藻+蛤仔组存在显著差异(P < 0.05),有蛤仔组颗粒物浓度最低(图 4),并且实验期间也可以观察到,有蛤仔组的海水非常清澈,体现了菲律宾蛤仔对颗粒物的滤除效果。
除了光照对海草的影响外,从世界六大海草床区系的调查中总结得出,营养盐是温带海草床所受的主要胁迫与限制的另一个影响因子(Short et al, 2007),营养盐可以限制海草的生长和降低海草有性繁殖(Agawin et al, 1996; Duarte et al, 1996)。在以砂质和有机质为主的底质环境中(楮岛是砂质和有机质为主的底质环境),限制海草生长的主导因子是氮(Williams, 1990),海草可以利用的无机氮源主要包括水体中的NO3-、NH4+和底质间隙水中的NH4+,氨氮被认为是海草主要的氮营养盐吸收利用形式(Burkholder et al, 1992),在相同浓度氨氮和硝氮条件下,海草对氨氮的吸收高于对硝氮的吸收(Ahn et al, 1998; Alexandre et al, 2011; Alexandre et al, 2010)。贝类主要的排泄物是氨,直接来源于蛋白质的脱氨基作用(Cockcroft, 1990; Hammen, 1968),此外还有氨基酸、尿酸、尿素等,氮的代谢终产物主要为氨(Cockcroft, 1990),所以,目前对双壳贝类氮排泄的研究大都集中在氨的排泄方面。桑沟湾楮岛海草床中3种规格菲律宾蛤仔的排氨率分别为(0.44±0.15)、(0.70±0.25)和(1.40±0.35) μmol/(ind.·h),刘鹏(2013)用呼吸瓶法于2012年5月~2013年1月测得的3种规格菲律宾蛤仔的排氨率范围分别为0.325~1.469、0.496~1.693和0.476~2.459 μmol/(ind.·h),与本研究数据相吻合。桑沟湾楮岛海区菲律宾蛤仔的密度为(572.00±20.23) ind./m2,取3种规格蛤仔平均排氨率估算,蛤仔每天将排泄0.84 g氨氮,大叶藻平均生物量为256 g/(DW·m2) (刘旭佳, 2011),大叶藻叶片氨氮吸收效率为20.5 μmol/(g·DW·h) (Thursby et al, 1982),每平方米大叶藻每天吸收4.16 g氨氮,约5 m2蛤仔排泄氨氮的量可以满足1 m2大叶藻的营养需求。围隔实验中的水体氨氮浓度,蛤仔组 > 空白组 > 大叶藻+蛤仔组 > 大叶藻组,并且蛤仔组与大叶藻组、大叶藻+蛤仔组存在显著差异(P < 0.05),大叶藻组与大叶藻+蛤仔组差异不显著(P > 0.05),说明,蛤仔排泄的氨氮能被大叶藻有效利用。
本研究中,3种规格菲律宾蛤仔的耗氧率范围为(0.21±0.02)~(0.33±0.08) mg/(ind.·h),与刘鹏(2013)在天鹅湖海草床中测得的菲律宾蛤仔的耗氧率一致。大叶藻的最大净光合速率为(8.16±0.17) mg O2/(gDW·h) (李勇, 2014),平均生物量为256 g/m2(刘旭佳, 2011),取3种规格蛤仔的平均耗氧率估算,蛤仔耗氧量为164.38 mg/(m2·h),根据单位面积(m2)大叶藻产氧量与单位面积菲律宾蛤仔耗氧量,计算得出,每平方米大叶藻释放的氧可供约13 m2内的蛤仔呼吸所用。围隔实验中的水体溶解氧含量大叶藻组 > 大叶藻+蛤仔组 > 空白组 > 蛤仔组,并且蛤仔组、大叶藻组和大叶藻+蛤仔组存在显著差异(P < 0.05),说明,大叶藻光合作用产氧被蛤仔利用。
海草既能通过地上叶片摄取海水中的营养盐,也能通过地下根吸收沉积物间隙水中的营养盐。Lemmens等(1996)研究表明,大量的贝类生物沉积物会导致海底沉积物中的有机质含量增加,沉积物通过微生物降解释放大量的营养盐,可以满足海草的营养需求。但Terrados等(1999)研究指出,在有机质丰富的底泥中,可能有大量的硫酸盐被硫酸盐还原菌还原,硫酸盐还原形成的主要产物之一是硫化氢,硫化物已经被证明对大叶藻有剧毒,是影响大叶藻生长和存活的重要因素之一。贝类生物沉积物对大叶藻的正负效应将在后续的研究中重点关注。
Agawin NSR, Duarte CM, Fortes MD. Nutrient limitation of Philippine seagrasses (Cape Bolinao, NW Philippines): in situ experimental evidence. Marine Ecology Progress Series, 1996, 138(1-3): 233-243 |
Ahn O, Petrell RJ, Harrison PJ. Ammonium and nitrate uptake by Laminaria saccharina and Nereocystis luetkeana originating from a salmon sea cage farm. Journal of Applied Phycology, 1998, 10(4): 333-340 DOI:10.1023/A:1008092521651 |
Alexandre A, Silva J, Bouma TJ, et al. Inorganic nitrogen uptake kinetics and whole-plant nitrogen budget in the seagrass Zostera noltii. Journal of Experimental Marine Biology and Ecology, 2011, 401(1-2): 7-12 DOI:10.1016/j.jembe.2011.03.008 |
Alexandre A, Silva J, Santos R. Inorganic nitrogen uptake and related enzymatic activity in the seagrass Zostera noltii. Marine Ecology, 2010, 31(4): 539-545 DOI:10.1111/mae.2010.31.issue-4 |
Burkholder JM, Mason KM, Glasgow HB. Water-column nitrate enrichment promotes decline of eelgrass Zostera marina L.: Evidence from seasonal mesocosm experiments. Marine Ecology Progress Series, 1992, 81(2): 163-178 |
Chinese Academy of Sciences, Editorial Board of Chinese Flora. Chinese flora: Volume 8. Beijing: Science Press, 1992 [ 中国科学院中国植物志编辑委员会. 中国植物志:第八卷. 北京: 科学出版社, 1992]
|
Cockcroft AC. Nitrogen excretion by the surf zone bivalves Donax serra and D. sordidus. Marine Ecology Progress Series, 1990, 60(1-2): 57-65 |
Davenport J, Smith RJJW, Packer M. Mussels Mytilus edulis: Significant consumers and destroyers of mesozooplankton. Marine Ecology Progress Series, 2000, 198(1): 131-137 |
Duarte CM, Sand-Jensen K. Nutrient constraints on establishment from seed and on vegetative expansion of the Mediterranean seagrass Cymodocea nodosa. Aquatic Botany, 1996, 54(4): 279-286 DOI:10.1016/0304-3770(96)01050-9 |
Eckman JE, Peterson CH, Cahalan JA. Effects of flow speed, turbulence, and orientation on growth of juvenile bay scallops Argopecten irradians concentricus (Say). Journal of Experimental Marine Biology and Ecology, 1989, 132(2): 123-140 DOI:10.1016/0022-0981(89)90219-0 |
Gaeckle JL, Short FT. A plastochrone method for measuring leaf growth in eelgrass, Zostera marina L.. Bulletin of Marine Science, 2002, 71(3): 1237-1246 |
Gao YP. A study on sexual reproductive characteristics and epiphytes of eelgrass (Zostera marina L.) in Sango Bay. Master s Thesis of East China University of Science and Technology, 2009, 5-14 [高亚平.桑沟湾大叶藻有性繁殖生物学及附着生物研究.华东理工大学硕士研究生学位论文, 2009, 5-14] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1650404
|
Gao YP, Fang JG, Tang W, et al. Seagrass meadow carbon sink and amplification of the carbon sink for eelgrass bed in Sanggou Bay. Progress in Fishery Sciences, 2013, 34(1): 17-21 [ 高亚平, 方建光, 唐望, 等. 桑沟湾大叶藻海草床生态系统碳汇扩增力的估算. 渔业科学进展, 2013, 34(1): 17-21 DOI:10.3969/j.issn.1000-7075.2013.01.003] |
Hammen CS. Aminotransferase activities and amino acid excretion of bivalve mollusks and brachiopods. Comparative Biochemistry and Physiology, 1968, 26(2): 697-705 DOI:10.1016/0010-406X(68)90661-0 |
Irlandi EA, Orlando BA, Biber PD. Drift algae-epiphyte-seagrass interactions in a subtropical Thalassia testudinum meadow. Marine Ecology Progress Series, 2004, 279(1): 81-91 |
Lemmens JWTJ, Clapin G, Lavery P, et al. Filtering capacity of seagrass meadows and other habitats of Cockburn Sound, Western Australia. Marine Ecology Progress Series, 1996, 143(1-3): 187-200 |
Li Y. Study on the carbon fixation function of seagrasses in the coastal area of Shandong Peninsula: A case study of Zostera marina L. in Swan Lake in Rongcheng. Master's Thesis of Ocean University of China, 2014, 34-35 [李勇.山东近岸海草植被固碳功能研究——以荣成天鹅湖大叶藻为例.中国海洋大学硕士研究生学位论文, 2014, 34-35] http://cdmd.cnki.com.cn/Article/CDMD-10423-1014203807.htm
|
Liu P. A Study on ecophysiological characteristics of bivalves in seagrass meadow and ecological restoration of the eelgrass Zostera marina L.. Master's Thesis of University of Chinese Academy of Sciences, 2013, 3-4 [刘鹏.海草床双壳贝类生理生态学特征及大叶藻生态恢复研究.中国科学院大学硕士研究生学位论文, 2013, 3-4] http://cdmd.cnki.com.cn/Article/CDMD-80068-1013279771.htm
|
Liu XJ. Ecological preliminary study on eelgrass of inshore areas in Shandong. Master s Thesis of Ocean University of China, 2011, 65-66 [刘旭佳.山东近岸海域大叶藻的生态学初步研究.中国海洋大学硕士研究生学位论文, 2011, 65-66] http://cdmd.cnki.com.cn/article/cdmd-10423-1011230504.htm
|
Lorus J, Milne MJ. The eelgrass catastrophe. Scientific American, 1951, 184(1): 52-55 DOI:10.1038/scientificamerican0151-52 |
Mazzola A, Sarà G. The effect of fish farming organic waste on food availability for bivalve molluscs (Gaeta Gulf, Central Tyrrhenian, MED): Stable carbon isotopic analysis. Aquaculture, 2001, 192(2-4): 361-379 DOI:10.1016/S0044-8486(00)00463-4 |
Short F, Carruthers T, Dennison W, et al. Global seagrass distribution and diversity: A bioregional model. Journal of Experimental Marine Biology and Ecology, 2007, 350(1-2): 3-20 DOI:10.1016/j.jembe.2007.06.012 |
Silberstein K, Chiffings AW, McComb AJ. The loss of seagrass in cockburn sound, Western Australia. Ⅲ. The effect of epiphytes on productivity of Posidonia australis Hook. F. Aquatic Botany, 1986, 24(4): 355-371 DOI:10.1016/0304-3770(86)90102-6 |
Skinner MA, Courtenay SC, McKindsey CW, et al. Experimental determination of the effects of light limitation from suspended bag oyster (Crassostrea virginica) aquaculture on the structure and photosynthesis of eelgrass (Zostera marina L.). Journal of Experimental Marine Biology and Ecology, 2014, 459(1): 169-180 |
Terrados J, Duarte CM, Kamp-Nielsen L, et al. Are seagrass growth and survival constrained by the reducing conditions of the sediment?. Aquatic Botany, 1999, 65(1-4): 175-197 DOI:10.1016/S0304-3770(99)00039-X |
Thursby GB, Harlin MM. Leaf-root interaction in the uptake of ammonia by Zostera marina L. Marine Biology, 1982, 72(2): 109-112 DOI:10.1007/BF00396910 |
Ward LG, Kemp WM, Boynton WR. The influence of waves and seagrass communities on suspended particulates in an estuarine embayment. Marine Geology, 1984, 59(1): 85-103 |
Ward LG. The influence of wind waves and tidal currents on sediment resuspension in middle Chesapeake Bay. GeoMarine Letters, 1985, 5(1): 71-75 |
Waycott M, Duarte CM, Carruthers TJ, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377-12381 DOI:10.1073/pnas.0905620106 |
Widdows J, Salkeld PN. Practical procedures for the measurement of scope for growth. Map Technical Reports, 1992
|
Williams SL. Experimental studies of caribbean seagrass bed development. Ecological Monographs, 1990, 60(4): 449-469 DOI:10.2307/1943015 |
Wu ZJ, Chen SQ, Cai ZF, et al. The health assessment of the seagrass bed ecosystem in Xincun Lagoon of Hainan Island. Environmental Monitoring in China, 2015, 31(2): 98-103 [ 吴钟解, 陈石泉, 蔡泽富, 等. 新村港海草床生态系统健康评价. 中国环境监测, 2015, 31(2): 98-103 DOI:10.3969/j.issn.1002-6002.2015.02.019] |
Zheng XW. Study on photosynthesis of seagrass Zostera japonica in Fangcheng of Guangxi. Master's Thesis of Guangxi University, 2007, 180-185 [郑杏雯.广西防城海草光合作用研究.广西大学硕士研究生学位论文, 2007, 180-185] http://cdmd.cnki.com.cn/Article/CDMD-10593-2007141800.htm
|



