应激是一种常见的动物生理状态,是动物机体对外界环境或自身内部产生异常刺激时做出的各种生理应答反应的总和(李红军等, 2006)。生活在水中的鱼类,容易受到水环境变化的刺激,主要的环境因子包括水温、溶解氧、盐度、氨和重金属离子等,其中,水温是重要的因素之一。当养殖环境的温度高于或低于最适生长温度时,会引起一系列的生理或病理变化,导致血液中各项生理生化指标改变,此时,可通过测定生化指标来反映机体代谢和健康状况(宁军号等, 2017)。温海深等(2016)研究发现,急性高温胁迫可以引起许氏平鲉(Sebastes schlegelii)机体血清中的皮质醇、葡萄糖和蛋白等指标变化。邵彦翔等(2017)发现,水温变化会引起云龙石斑鱼(Epinephelus moara♀×Epinephelus lanceolatus♂)血清总胆固醇和葡萄糖等指标变化。何福林等(2007)研究发现,水温变化会使虹鳟(Oncorhynchus mykiss)的红细胞、血红蛋白和血糖等指标改变。黄正澜懿等(2016)研究发现,热应激会引起齐口裂腹鱼(Schizothorax prenati)髓过氧化物酶和谷草转氨酶等的改变。热激蛋白(Heat shock proteins, HSPs)是一类在进化上高度保守的蛋白,广泛存在于生物体中。研究表明,应激诱导表达热应激蛋白与生物体的适应能力有重要的相关性(刘秀荣, 2015; 生安志等, 2016)。热休克蛋白70 (HSP70),作为目前研究最广泛的和最保守的一族热休克蛋白(Basu et al, 2002),能在应激情况下迅速合成,并对应激产生保护耐受作用(Morimoto, 1993)。近年来,鱼类HSP70在各种应激条件下的表达情况受到广泛关注。
银鲫(Carassius auratus gibelio),俗称鲫瓜子或红鲫,鲫的近缘亚种。隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)(马波等, 2013),是一种重要的经济鱼类,主要分布于欧、亚大陆的温带水域,其经济性状、适应能力都优于鲫鱼(Carassius auratus)。目前,银鲫在我国养殖范围广,市场需求旺盛、价格稳定、养殖效益明显。在生产实践中,鱼类应对环境胁迫如高温、高密度、缺氧和细菌等的能力存在种间特异性。本研究分析了持续热应激对银鲫血浆葡萄糖、血浆乳酸等生化指标及HSP70 mRNA表达的影响,旨在为探究银鲫高温应激作用机制及调控机理提供参考数据,为进一步探究鱼类应激研究提供理论基础。
1 材料与方法 1.1 实验动物与设计实验动物购自重庆市荣昌区双河鱼技中心,挑选体格健康、大小均匀的银鲫300尾,平均体重为(72.8± 10.1) g。用4%的食盐水浸泡10 min后,随机平均放入6个已消毒的室内玻璃缸(130 cm×55 cm×55 cm)内,暂养驯化1个月,水温为(25±1)℃,饲料采用通威152饲料(粗蛋白32%),每天投喂2次(09:00和17:00)。
1.2 实验设计及样品采集本研究设置(25±1)℃的常温对照组、(32±1)℃的高温热应激实验组和(25±1)℃的高温热应激后恢复至常温的实验组,每组设3个重复,每个重复50尾鱼。实验期间,于25℃随机选取4尾鱼作为空白对照,3个实验缸采用加热棒(加热棒的最高温度为32℃),以3℃/h(经过预实验表明,3个加热棒每小时能提高3℃)的升温速度使水温升至32℃,在温度达32℃后(温度保持在32℃不变)的0 h、2 h、6 h、10 h,每个缸各采集4尾鱼作为不同时间点的热应激组,3个实验缸中剩余样本快速使用冰袋降温至25℃,6 h后,从每个缸中随机取4尾作为恢复组。采样时,将鱼投入浓度为40 mg/L的丁香酚水溶液快速深度麻醉,静脉取血,置于有肝素抗凝剂的EP管中,4℃、3000 r/min离心10 min,制备血浆,收集上清液,保存于-80℃。采血后解剖,取约100 mg肝胰脏,冻存于液氮中。
1.3 生化指标的测定方法取-80℃保存的血浆,使用南京建成生物工程研究所试剂盒,比色法测定乳酸浓度、己糖激酶活力和丙酮酸激酶活力;葡萄糖氧化酶-过氧化物酶法测定血浆葡萄糖浓度;蒽酮法测定肝糖原含量。
1.4 实时荧光定量PCR (qRT-PCR) 1.4.1 RNA提取及反转录Trizol法提取总RNA,用紫外分光光度计确定RNA浓度及OD值,通过琼脂糖凝胶电泳检测RNA完整性。参照反转录试剂盒说明书(TaKaRa, 大连)进行反转录。
1.4.2 引物设计与合成银鲫与鲫鱼具有高同源性,依据GenBank公布的鲫鱼HSP70 (GenBank序列号为AB092839.2)和β-actin mRNA全序列(GenBank序列号为AB039726),使用软件Primer 5.0设计qRT-PCR引物:HSP70 F,5'-TGATGGAGGGAAGCC GAAAG-3';HSP70 R,5'-GAAATAGGCAGGAACTG TGAT-3';β-actin F,5'-ATGCGGAAACTGGAAAGG- 3';β-actin R,5'-TGAGGGCAGAGTGGTAGA-3'。引物由华大基因科技股份有限公司合成。
1.4.3 qRT-PCR反应采用SYBR Green (TaKaRa, 大连)染料法,参照荧光定量说明书(Bio-Rad)进行。对PCR产物进行熔解曲线分析,同时,PCR产物1%琼脂糖凝胶电泳检测引物特异性。以1个样品的cDNA为模板,进行10倍梯度稀释,分别取每个数量级稀释液2 μl作为模板进行qRT-PCR。反应体系为(25 μl):Premix Ex Taq (2×),12.5 μl;上下游引物各为0.5 μl;无菌水9.5 μl;cDNA模板2 μl。反应程序:95℃预变性30 s,95℃变性5 s,60℃退火30 s,72℃延伸30 s,共45个循环。每个样品设3个重复,以β-action为内参基因,采用2-ΔΔCt法计算相对表达量。
1.5 数据统计分析实验中所涉及的数据均用平均值±标准差(Mean± SD)表示,采用SPSS 21.0软件处理实验数据。在经过方差同质性检验后,使用单因方差分析(One-way ANOVA)对数据进行分析,P < 0.05为差异显著,P < 0.01为差异极显著。
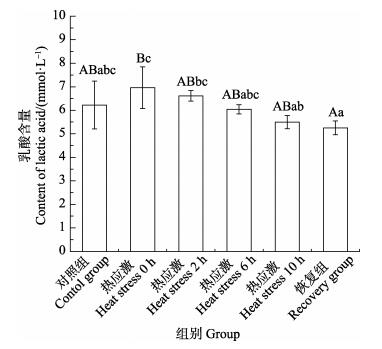
2 结果 2.1 热应激对血浆乳酸的影响热应激后0 h,血浆中乳酸含量升高并达最大值(图 1),随着时间的增加,乳酸含量在热应激后2 h、6 h、10 h逐渐降低,10 h时,乳酸含量显著低于热应激后0 h (P < 0.05),恢复适温6 h后,恢复组血浆乳酸含量与对照组差异不显著(P > 0.05)。
|
图 1 热应激对血浆乳酸含量的影响 Fig.1 The effects of heat stress on the content of lactic acid 不同小写字母代表差异显著(P < 0.05),不同大写字母代表差异极显著(P < 0.01),下同 Different lowercase letters mean significant difference (P < 0.05), different capital letters mean highly significant difference(P < 0.01), the same as below |
与对照组相比,热应激后0 h、2 h、6 h和10 h的血浆葡萄糖含量升高(图 2),且在0 h、2 h和6 h极显著高于热应激前(P < 0.01),恢复至适温6 h后,恢复组血浆葡萄糖含量与对照组差异不显著(P > 0.05)。

|
图 2 热应激对血浆葡萄糖含量的影响 Fig.2 The effects of heat stress on the content of glucose |
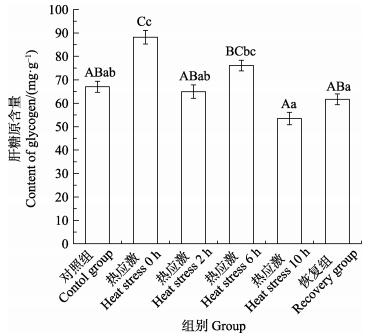
热应激后0 h,肝糖原含量极显著高于对照组(P < 0.01);热应激后2 h和10 h低于热应激后0 h,差异极显著(P < 0.01),但与对照组无显著差异(P > 0.05)。恢复至适温6 h后,肝糖原含量低于对照组,但差异不显著(P > 0.05) (图 3)。
|
图 3 热应激对肝糖原含量的影响 Fig.3 The effects of heat stress on the content of glycogen |
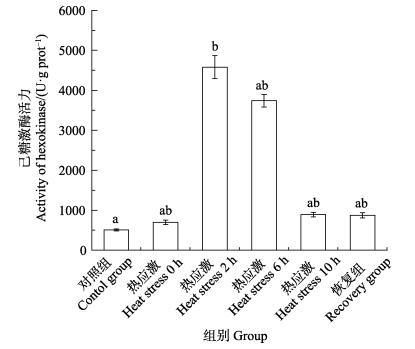
己糖激酶活力在热应激后2 h达到最大值(图 4),显著高于应激前(P < 0.05);热应激后6 h,仍显著高于对照组(P < 0.05)。恢复后6 h,恢复组己糖激酶活力与对照组差异不显著(P > 0.05)。
|
图 4 热应激对己糖激酶活力的影响 Fig.4 The effects of heat stress on hexokinase activity |
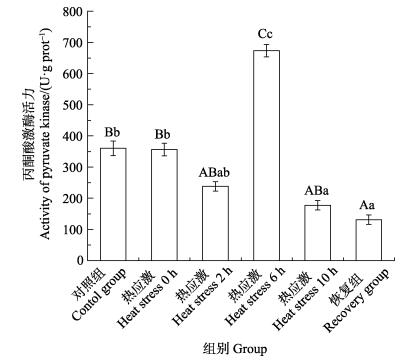
热应激处理后,丙酮酸激酶活力呈下降趋势(图 5)。热应激后2 h,丙酮酸激酶活力低于对照组,但差异不显著(P > 0.05),而后逐渐升高,在热应激后6 h达到最大值,极显著高于对照组(P < 0.01);恢复适温6 h时,恢复组丙酮酸激酶活力低于对照组,且差异极显著(P < 0.01)。
|
图 5 热应激对丙酮酸激酶活力的影响 Fig.5 The effects of heat stress on pyruvate kinase activity |
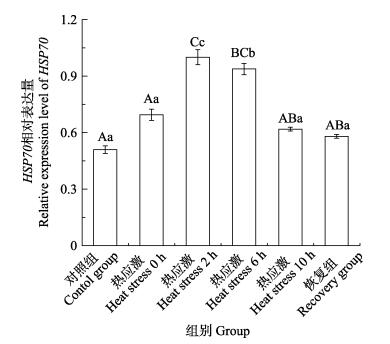
银鲫遭受热应激时,肝脏中HSP70 mRNA表达量升高(图 6),热应激2 h后表达量达到最高,为对照组的1.96倍,差异极显著(P < 0.01),热应激6 h后仍极显著高于对照组(P < 0.01);恢复适温6 h后,恢复组HSP70 mRNA表达量略高于对照组,但差异不显著(P > 0.05)。
|
图 6 热应激对银鲫HSP70 mRNA表达的影响 Fig.6 The effect of heat stress on HSP70 mRNA expression in C. auratus gibelio |
乳酸是机体无氧代谢的产物(邹思湘, 2012),本研究中,热应激后,银鲫的血浆乳酸含量先升高,后逐渐降低,说明机体在热应激后首先会进行无氧运动,然后机体进行自身代谢调整,减缓无氧运动,刘凤华等(2002)对仔鸡(Gallus gallus)的研究结果也支持这一论点。另外,热应激初期,银鲫运动较为剧烈,随后逐渐平静,此时,乳酸浓度也随运动剧烈程度先升高后降低,说明鱼类血浆乳酸的浓度与其应激后的活动强度有关(Fanouraki et al, 2011),这与Vijayan (1992)和Vijayan等(1997)对应激条件下莫桑比克罗非鱼(Oreochromis spp)和虹鳟的研究结果一致。应激反应是一种耗能过程,会导致血浆葡萄糖水平的变化,因此,葡萄糖水平常被作为可靠的生理应激指标之一(Silbergeld, 1974; Sun et al, 1992)。热应激处理后,乳酸含量升高时,糖原降低;接着乳酸含量降低,血浆葡萄糖含量增加;随后肝糖原降低,葡萄糖继续升高,说明鱼类机体代谢水平易受外界温度的影响,随着温度的升高,银鲫体内物质代谢逐渐加快,导致糖的利用率加快,糖原等转化成葡萄糖的速率也加快,从而使得血浆葡萄糖的浓度显著升高,此研究结果与Hyndman等(2003)的研究结果一致。随着热应激时间延长,血浆葡萄糖含量逐渐降低,机体代谢虽减缓但仍在继续,这是由于垂体-肾上腺皮质激素(ACTH)能对热应激生理过程起到一定的调节作用(王启军等, 2006),如糖异生作用加强,维持血浆葡萄糖恒定。同时,肝糖原表达量在热应激后先降低再升高,最后逐渐降低,说明肝糖原是应激过程中的重要能量物质。热应激后,肝糖原含量降到最低时,血浆中葡萄糖却显著升高,说明糖原是鱼体内糖的主要储存形式,是鱼类应激反应的重要能量来源,应激后,鱼体可通过分解肝糖原来提供血糖,Wendelaar Bonga (1997)对热应激后鱼类机体的研究也与上述结论相符。
己糖激酶和丙酮酸激酶是糖酵解反应过程中的关键酶,其活性的变化对机体血糖水平具有重要影响,己糖激酶和细胞膜上葡萄糖转运蛋白功能相互偶联,影响机体细胞内葡萄糖流量和代谢(Allert et al, 1991)。丙酮酸激酶可通过调节细胞中ATP、ADP和糖酵解的中间产物,来控制糖酵解速率(邹思湘, 2012)。机体内主要供能的是葡萄糖,并且葡萄糖的流量与己糖激酶活力紧密相关(Allert et al, 1991),本研究结果显示,热应激后0~2 h,己糖激酶活力与葡萄糖含量都显著增加(P < 0.05),变化趋势几乎一致,说明热应激后,机体通过己糖激酶的刺激提高血糖的流量来满足机体的需要,机体葡萄糖的大量消耗,通过糖异生作用来补充。本研究中,热应激后2 h,银鲫的己糖激酶活力达到最高水平,糖酵解作用加剧,糖异生作用抑制,以维持机体的血糖水平,满足代谢的需要,说明银鲫葡萄糖水平是通过糖酵解和糖异生这2个相对立的过程来保持的,Metón(2003)对金头鲷(Sparus aurata)的研究也支持这一论点。
丙酮酸激酶(PK)在糖酵解过程中能够起到关键作用(郭彪等, 2008),本研究中,丙酮酸激酶活力在热应激后先降低后升高,说明随着应激时间的增加,耗氧率也会升高,机体供氧不足,糖酵解作用加强。热应激6 h时,丙酮酸激酶活力显著高于对照组,这是由于机体的代谢活动减慢,糖酵解作用降低,氧化磷酸化作用加强,致使丙酮酸激酶活力下降,这与郭彪等(2008)对对虾的研究结果一致。恢复组的丙酮酸激酶活力显著低于对照组(P < 0.01),是由于糖酵解作用抑制太大,机体受影响较大,而酶活力的恢复是一个漫长的过程,所以丙酮酸激酶活力无法迅速恢复至正常值。
3.2 热应激对肝脏中HSP70 mRNA表达量的影响本研究中,热应激后HSP70 mRNA表达量显著增加,并在2 h后达到最高,应激后6 h和10 h,表达逐渐降低,恢复后表达量与对照组无差异,此变化趋势与此前报道的其他水生生物研究结果一致,如:鲫鱼在应激后1 h HSP70 mRNA表达量有所升高,4 h时达到最高值后逐渐降低,48 h降至最初值(苏岭等, 2010);34℃持续24 h热应激团头鲂(Megalobrama amblycephala)肝脏中HSP70 mRNA相对表达量呈先上升后降低的趋势(Ming et al,2010);地中海贻贝(Mytilus edulis)在35℃热激1 h,16℃恢复3 h后,消化腺HSP70 mRNA的含量达到最大值,随后5~24 h内逐渐减少(Franzellitti et al, 2005);虹鳟RTG-2细胞在28℃持续应激24 h后,2种HSP70 mRNA的表达量均呈现先上升后降低的趋势,应激后3 h表达量达最大值(王艳妮等, 2015);大正三色锦鲤(Taisho sanshoku)32℃应激后2 h和26 h,HSP70 mRNA的相对表达量与应激前相比显著上升,应激后6~22 h,相对表达量与应激前无显著差异(P > 0.05)(张崇英等, 2012)。以上结果说明,调节热应激蛋白的表达量是机体细胞应对热应激的反应之一(曲凌云等, 2005),瞬时热刺激诱导机体内变性蛋白、异常蛋白量增加,正常状态的蛋白平衡被打破,从而引发一些维持正常生命功能的酶活减弱甚至丧失。HSP70基因通过相关途径的调节,细胞中HSP70 mRNA含量升高,表达的蛋白增加。作为“分子伴侣”,HSP70结合变性蛋白折叠、装配中的中间产物,促进多肽链向天然构象转变,修复应激给机体带来的损害。应激后恢复时间增长,蛋白质变性现象减少,HSP70的表达量回落。HSP70 mRNA表达受热应激调节,从而保护机体内部功能不受损伤。另有学者指出,HSP70具有高度保守的序列和在受胁迫后能够大量表达的特性,使其可能成为一种诊断鱼类生理状态的生物指标(祝璟琳等, 2007)。
综上所述,热应激会引起银鲫强烈的应激反应,血浆中乳酸含量、葡萄糖含量、肝糖原含量、己糖激酶活力和丙酮酸激酶活力先升高后恢复,表明机体通过调节以上指标对抗热应激。热应激下HSP70基因的表达受热应激调节,诱导表达的HSP70使机体具备一定的高温耐受力,对应激起到一定的保护作用。本研究为了解银鲫抗热应激的调控机理提供一定的参考数据,为研究抗热应激预防措施等提供新的思路。
Allert S, Ernest I, Poliszczak A, et al. Molecular cloning and analysis of two tandemly linked genes for pyruvate kinase of Trypanosoma brucei. European Journal of Biochemistry, 1991, 200(1): 19-27 |
Basu N, Todgham AE, Ackerman PA, et al. Heat shock protein genes and their functional significance in fish. Gene, 2002, 295(2): 173-183 |
Fanouraki E, Mylonas CC, Papandroulakis N, et al. Species specificity in the magnitude and duration of the acute stress response in Mediterranean marine fish in culture. General and Comparative Endocrinology, 2011, 173(2): 313-322 DOI:10.1016/j.ygcen.2011.06.004 |
Franzellitti S, Fabbri E. Differential HSP70 gene expression in the Mediterranean mussel exposed to various stressors. Biochemical and Biophysical Research Communications, 2005, 336(4): 1157-1163 DOI:10.1016/j.bbrc.2005.08.244 |
Guo B, Wang F, Hou CQ, et al. Effects of acute temperature fluctuation on HK and PK activity, HSP70 relative content in Litopenaeus vannamei. Journal of Fishery Sciences of China, 2008, 15(5): 885-889 [ 郭彪, 王芳, 侯纯强, 等. 温度突变对凡纳滨对虾己糖激酶和丙酮酸激酶活力以及热休克蛋白表达的影响. 中国水产科学, 2008, 15(5): 885-889 DOI:10.3321/j.issn:1005-8737.2008.05.024] |
He FL, Xiang JG, Li CJ, et al. Preliminary study on the effect of water temperature on hematology indices of rainbow trout. Acta Hydrobiologica Sinica, 2007, 31(3): 363-369 [ 何福林, 向建国, 李常健, 等. 水温对虹鳟血液学指标影响的初步研究. 水生生物学报, 2007, 31(3): 363-369 DOI:10.3321/j.issn:1000-3207.2007.03.010] |
Huang ZLY, Chen SJ, Zhang ZS, et al. Effects of heat stress on some non-specific immune factors and blood cell apoptosis in Schizothorax prenati. Acta Hydrobiologica Sinica, 2016, 40(6): 1152-1157 [ 黄正澜懿, 陈世静, 张争世, 等. 热应激对齐口裂腹鱼非特异性免疫功能及细胞凋亡的影响. 水生生物学报, 2016, 40(6): 1152-1157] |
Hyndman CA, Kieffer JD, Benfey TJ. The physiological response of diploid and triploid brook trout to exhaustive exercise. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2003, 134(1): 167-179 DOI:10.1016/S1095-6433(02)00245-3 |
Li HJ, Tian XQ, Xu MJ. Recent advance in animal stress research. Feed Research, 2006(10): 6-11 [ 李红军, 田夏清, 徐美娟. 动物应激的研究进展. 饲料研究, 2006(10): 6-11 DOI:10.3969/j.issn.1002-2813.2006.10.003] |
Liu FH, Wu GJ, Wang ZH, et al. Effect on chicken serum biochemical and immune parameters in acute heat-stress. Journal of Beijing Agricultural College, 2002, 17(4): 51-54 [ 刘凤华, 吴国娟, 王占贺, 等. 热应激对仔鸡血清生化及免疫指标的影响. 北京农学院学报, 2002, 17(4): 51-54 DOI:10.3969/j.issn.1002-3186.2002.04.011] |
Liu XR. Gene cloning, sequence analysis and cold adaptation studies on Hsp70 and Hsp90β genes from Chionodraco hamatus and Trematomus bernacchii. Masterxs Thesis of Shanghai Ocean University, 2015 [刘秀荣.独角雪冰鱼和伯氏肩孔南极鱼HSP70和HSP90β基因的克隆、序列分析以及低温适应性研究.上海海洋大学硕士研究生学位论文, 2015] http://cdmd.cnki.com.cn/Article/CDMD-10264-1015974744.htm
|
Ma B, Huo TB, Li J, et al. Comparative analysis between two types of female silver crucian carp Carassius auratus gibelio in the Irtysh River using morphology and mitochondrial control regions. Journal of Fishery Sciences of China, 2013, 20(1): 157-165 [ 马波, 霍堂斌, 李喆, 等. 额尔齐斯河2种类型雌性银鲫的形态特征及D-loop基因序列比较. 中国水产科学, 2013, 20(1): 157-165] |
Metón I, Fernández F, Baanante IV. Short-and long-term effects of refeeding on key enzyme activities in glycolysis-gluconeogenesis in the liver of gilthead seabream (Sparus aurata). Aquaculture, 2003, 225(1-4): 99-107 DOI:10.1016/S0044-8486(03)00281-3 |
Ming JH, Xie J, Xu P, et al. Molecular cloning and expression of two HSP70 genes in the Wuchang bream (Megalobrama amblycephala Yih). Fish and Shellfish Immunology, 2010, 28(3): 407-418 DOI:10.1016/j.fsi.2009.11.018 |
Morimoto RI. Cells in stress: Transcriptional activation of heat shock genes. Science, 1993, 259(5100): 1409-1410 DOI:10.1126/science.8451637 |
Ning JH, Qin YB, Hu LC, et al. Effects of abrupt and gradual decreases in water temperature on blood physiological and biochemical parameters in dusty rabbit fish Siganus fuscescens. Journal of Dalian Ocean University, 2017, 32(3): 294-301 [ 宁军号, 秦宇博, 胡伦超, 等. 水温骤降和缓降胁迫对褐篮子鱼血液生理生化指标的影响. 大连海洋大学学报, 2017, 32(3): 294-301] |
Qu LY, Xiang JH, Sun XQ, et al. Expression analysis of HSP70 in various tissues of Chlamys farreri under thermal stress. Chinese High Technology Letters, 2005, 15(5): 96-100 [ 曲凌云, 相建海, 孙修勤, 等. 温度刺激下栉孔扇贝不同组织热休克蛋白HSP70的表达研究. 高技术通讯, 2005, 15(5): 96-100 DOI:10.3321/j.issn:1002-0470.2005.05.021] |
Shao YX, Chen C, Li YL, et al. Effects of low temperature stress on serum biochemical indices of the juvenile hybrid of Epinephelus moara♀×Epinephelus lanceolatus♂. Progress in Fishery Sciences, 2017, 38(2): 70-76 [ 邵彦翔, 陈超, 李炎璐, 等. 低温胁迫对云纹石斑鱼(♀)×鞍带石斑鱼(♂)杂交后代血清生化指标的影响. 渔业科学进展, 2017, 38(2): 70-76] |
Sheng AZ, Ju HM, Li GY, et al. Expression patterns of Hsp90 of Paralichthys olivaceus in response to temperature treatment and Vibrio anguillarum infection. Progress in Fishery Sciences, 2016, 37(5): 1-8 [ 生安志, 鞠辉明, 李贵阳, 等. 牙鲆(Paralichthys olivaceus) Hsp90 mRNA在温度刺激和鳗弧菌感染下的表达特征. 渔业科学进展, 2016, 37(5): 1-8] |
Silbergeld EK. Blood glucose: A sensitive indicator of environmental stress in fish. Bulletin of Environmental Contamination and Toxicology, 1974, 11(1): 20-25 |
Su L, Li SW, Wang D, et al. Semi-quantitative RT-PCR method of detection of heat stress on fish liver content of HSP70 mRNA. Acta Agriculturae Boreali-Sinica, 2010, 25(Sup): 100-104 [ 苏岭, 李绍戊, 王荻, 等. 半定量RT-PCR方法检测热应激对鲫鱼肝脏中HSP70 mRNA含量的影响. 华北农学报, 2010, 25(Sup): 100-104] |
Sun LT, Chen GR, Chang CF. The physiology responses of tilapia exposed to low temperature. Journal of Thermal Biology, 1992, 17(3): 149-153 DOI:10.1016/0306-4565(92)90026-C |
Vijayan M. Acute handling stress alter hepatic glycogen metabolism in food-deprived rainbow trout (Oncorhynchus mykiss). Canadian Journal of Fisheries and Aquatic Sciences, 1992, 49: 2260-2266 DOI:10.1139/f92-247 |
Vijayan MM, Pereira C, Grau EG, et al. Metabolic responses associated with confinement stress in tilapia: The role of cortisol. Comparative Biochemistry and Physiology Part C: Pharmacology Toxicology and Endocrinology, 1997, 116(1): 89-95 DOI:10.1016/S0742-8413(96)00124-7 |
Wang QJ, Zhang HF, Lu QP, et al. Effect of heat exposure on body fat deposition and some biochemical indices of broiler blood. Journal of Anhui Agricultural Science, 2006, 34(9): 1886-1887, 1890 [ 王启军, 张宏福, 卢庆萍, 等. 热应激对肉仔鸡脂肪沉积及血液生化指标的影响. 安徽农业科学, 2006, 34(9): 1886-1887, 1890 DOI:10.3969/j.issn.0517-6611.2006.09.063] |
Wang YN, Liu Z, Kang YJ, et al. Effects of heat stress on some non-specific immunity parameters in rainbow trout (Oncorhynchus mykiss). Journal of Agricultural Biotechnology, 2015, 23(5): 634-642 [ 王艳妮, 刘哲, 康玉军, 等. 热应激对虹鳟部分非特异性免疫指标的影响. 农业生物技术学报, 2015, 23(5): 634-642 DOI:10.3969/j.issn.1674-7968.2015.05.009] |
Wen HS, Lv LK, Li LM, et al. Effect of temperature on physiological and biochemical parameters and gene expression of male Sebastes schlegelii. Periodical of Ocean University of China, 2016, 46(11): 44-51 [ 温海深, 吕里康, 李兰敏, 等. 急性高温胁迫对雄性许氏平鲉血液生理生化及相关基因表达的影响. 中国海洋大学学报, 2016, 46(11): 44-51] |
Wendelaar Bonga SE. The stress response in fish. Physiological Reviews, 1997, 77(3): 591-625 DOI:10.1152/physrev.1997.77.3.591 |
Zhang CY, Xing W, Li TL, et al. Effects of heat stress on nonspecific immune parameters and HSP70 gene expression in Taisho Sanke koi (Cyprinus carpio). Journal of Fisheries of China, 2012, 36(3): 336-342 [ 张崇英, 邢薇, 李铁梁, 等. 热应激对大正三色锦鲤非特异性免疫指标及HSP70基因表达的影响. 水产学报, 2012, 36(3): 336-342] |
Zhu JL, Wang GL. The research progress on HSP70 in fish species. Journal of Ningbo University (NSEE), 2007, 20(4): 446-450 [ 祝璟琳, 王国良. 鱼类HSP70的研究进展. 宁波大学学报(理工版), 2007, 20(4): 446-450 DOI:10.3969/j.issn.1001-5132.2007.04.007] |
Zou SX. Animal biochemistry. Beijing: China Agriculture Press, 2012 [ 邹思湘. 动物生物化学. 北京: 中国农业出版社, 2012]
|



