2. 上海海洋大学 水产科学国家级实验教学示范中心 上海 201306;
3. 广东省水产动物免疫技术重点实验室 广州 510380
2. National Demonstration Center for Experimental National Demonstration Center for Experimental, Shanghai Ocean University, Shanghai 201306;
3. Key Laboratory of Aquatic Animal Immune Technology, Guangdong Province, Guangzhou 510380
罗非鱼(Oreochromis sp.)因其食性广、生长快、抗病力强以及环境适应性强而著称,被誉为未来动物性蛋白质的主要来源之一,已被联合国粮农组织向全世界推广。但是,随着我国罗非鱼养殖规模的扩大、养殖密度的提高以及养殖环境的恶化,近年来,各种病害的暴发也越来越频繁,其中,链球菌病是我国罗非鱼主要的细菌性疾病,该病的连年暴发给罗非鱼养殖业带来了巨大的经济损失(朱洁莲等, 2017)。流行病学研究发现,罗非鱼链球菌病的主要病原是无乳链球菌(Streptococcus agalactiae)(方伟等, 2016; 张德锋等, 2017),该病的流行时间为每年的5~10月,其中,7~ 9月为流行高峰期。当水温在28℃以上时易发病,当水温高于32℃时极易暴发,死亡率可高达80%~ 95%(卢迈新等, 2010; 张新艳等, 2008)。如,2009年的高温季节,广东、海南、福建和广西等罗非鱼主养区链球菌病的发病率为20%~50%,死亡率高达50%~70%(卢迈新, 2010),这表明罗非鱼链球菌病的暴发与水温密切相关。
目前,国内外关于罗非鱼链球菌病的研究主要集中在病情描述、病原菌的分离鉴定(黄艳华等, 2014; 谭晶晶等, 2010; 张德锋等, 2015)、疫苗研发(Evans et al, 2004; Klesius et al, 2000; Sun et al, 2010; 王蓓等, 2014; 吴斌等, 2016)和药物防治(邓恒为等, 2014; 王德强等, 2017)等研究领域,而无乳链球菌在不同水温下罗非鱼体内主要器官组织中增殖和消除规律的研究鲜见报道。由于水温是罗非鱼链球菌病发病或暴发极为重要的诱因之一,因此,了解无乳链球菌在罗非鱼体内的组织动态分布以及增殖、消除规律对有效防治罗非鱼链球菌病是十分重要的。
本研究以人工感染无乳链球菌的尼罗罗非鱼(Oreochromis niloticus, GIFT strain)为研究对象,采用平板计数法分析不同水温条件下罗非鱼感染无乳链球菌后的脑、肝脏、脾脏和肾脏等主要器官组织中病原菌的动态分布以及增殖、消除规律,以期为罗非鱼链球菌病的预防、诊断和药物防控提供科学依据。
1 材料与方法 1.1 实验材料 1.1.1 实验鱼实验鱼为尼罗罗非鱼,由中国水产科学研究院珠江水产研究所高要水产种质中心提供。本研究选取健康罗非鱼1980尾,体重为40~60 g/尾,实验前进行抽样检测,结果显示,该批次罗非鱼未携带无乳链球菌。
1.1.2 菌株无乳链球菌WC1535菌株由本实验室分离、鉴定并保存,该菌株对罗非鱼具有强致病性。根据预实验获得30℃时无乳链球菌对罗非鱼的半数致死剂量(LD50)为5.0×107 CFU/ml。实验前,在血琼脂平板上进行活化培养,并挑取单克隆接种于脑心浸出液肉汤(BHI)液体培养基中,在28℃培养箱中培养至对数生长期,收集菌体,用无菌PBS缓冲液将菌液稀释至5.0×107 CFU/ml备用。
1.2 方法 1.2.1 人工感染实验选取540尾健康罗非鱼,分为25℃、29℃和33℃ 3个实验组,25℃、29℃和33℃3个对照组,每组90尾,在循环水玻璃缸中暂养1周后用于实验。实验养殖条件:实验组和对照组的水温分别调至25℃、29℃和33℃,实验期间,各组水温变动幅度为±0.5℃;为保证良好的水质条件及溶氧,整个实验过程采用循环水养殖,并不间断充气;每天投喂饲料2次,每日投喂量约为鱼体重的3.0%。实验组罗非鱼每尾腹腔注射0.1 ml浓度为5.0× 107 CFU/ml的无乳链球菌,对照组罗非鱼腹腔注射等体积的无菌PBS缓冲液。感染后,每天观察实验鱼的发病情况,并及时清除死鱼,记录各组的死鱼数量,持续观察7 d后,统计各组实验鱼的死亡数。
1.2.2 无乳链球菌的分离培养选取1440尾健康罗非鱼,分25℃、29℃和33℃ 3个实验组,25℃、29℃和33℃ 3个对照组,每组设置3个重复,25℃和29℃各组每个重复60尾鱼,33℃实验组和对照组每个重复120尾鱼(为保证能够连续取样),分别于循环水玻璃缸中暂养1周后用于实验。
实验组罗非鱼每尾腹腔注射0.1 ml浓度为5.0×107 CFU/ml的无乳链球菌,对照组注射等体积的无菌PBS缓冲液。分别在感染后3 h、6 h、12 h、24 h、2 d、4 d、6 d、10 d、15 d、20 d和30 d,从各实验组的每个重复中随机选取3尾体表症状相似且尚未死亡的罗非鱼,无菌条件下取脑、肝脏、脾脏和肾脏等组织,称重后以0.20 g/ml的比例加入PBS缓冲液,用高通量组织研磨仪(北京鼎昊源科技有限公司,型号TL-2010S)充分研磨,然后1500 r/min低速离心30 s沉淀组织碎片,取上清液,进行10倍系列梯度稀释,吸取10 μl涂布于BHI琼脂平板上,每个样品6个重复,28℃培养箱中培养36 h,观察菌落形态,统计菌落数量,并根据相应菌落数计算各组织中单位质量的菌体浓度。同样地,无菌条件下分别取对照组的脑、肝脏、脾脏和肾脏等组织,称重、研磨、短暂离心,稀释后涂布于BHI平板上进行无乳链球菌培养和菌落计数。
1.2.3 菌落的形态判定和分子鉴定每个时间点取样统计菌落数时,随机挑取10个形态相近的单克隆菌落用无乳链球菌特异基因cfb的引物(cfb-F: 5'-TAGCTTAGTTATCCCAAATCCC-3', cfb-R: 5'- TAAAGACTTCATTGCGTGCC-3')进行PCR扩增,PCR产物经1%的琼脂糖凝胶电泳分析(刘志刚等, 2013)。PCR扩增程序:95℃预变性4 min;95℃变性30 s,57℃退火30 s,72℃延伸1 min,进行35个循环,72℃延伸10 min。
1.2.4 数据处理与分析采用SPSS 22.0软件的单因素方差分析法(One-way ANOVA)、卡方检验分析法(Chi-square test),分别对不同温度下罗非鱼体内无乳链球菌浓度和感染无乳链球菌后罗非鱼累积死亡率进行差异显著性分析,P < 0.05为差异显著,P < 0.01为差异极显著。采用GraphPad Prism 6的Survival和Column-Mean±SD对累积死亡率及病原菌浓度进行作图和分析。
2 结果 2.1 人工感染实验结果不同实验组罗非鱼感染无乳链球菌后,25℃、29℃和33℃组的累积死亡率分别为6.67%、25.56%和78.90%,对照组均未出现死亡。从生存曲线可以看出(图 1),25℃组的罗非鱼在感染后48 h内未出现死亡,48 h后开始出现少量死亡;29℃实验组在感染24 h后开始死亡,24~48 h的死亡量缓慢增加,之后死亡量逐渐减少;33℃高温组的罗非鱼感染9 h后即出现死亡,在12~24 h内的死亡量急剧升高,为发病高峰期,48 h后的死亡量逐渐趋于稳定。

|
图 1 尼罗罗非鱼感染无乳链球后的生存曲线 Fig.1 The survival curve of O. niloitcus infected with S. agalactiae **为差异极显著(P < 0.01) ** denoted highly significant differences (P < 0.01) |
实验组罗非鱼感染无乳链球菌后,不同发病时期的症状存在差异。发病初期(< 9 h),各实验组罗非鱼体表无明显症状,25℃实验组的罗非鱼内脏器官无明显病变,29℃和33℃实验组罗非鱼的肝脏、脾脏轻微肿大。感染后12~24 h,25℃实验组无症状,29℃实验组部分出现侧翻、打转症状,33℃实验组表现出明显的侧翻、打转和离群独游等现象,并出现大量死亡。进入发病期后(12~72 h),25℃实验组发病罗非鱼的症状仍不明显,29℃实验组和33℃实验组部分病鱼眼球突出或浑浊、眼眶充血、肛门红肿、腹部膨大、体表发黑,并出现侧翻、打转和离群独游等现象,解剖可见脑膜炎,肝脏充血肿大发黑、肾脏肿大、脾脏充血发暗,为典型的无乳链球菌感染症状。
2.2 病原菌的分离培养和菌落数统计分析各实验组罗非鱼的脑、肝脏、脾脏和肾脏组织中的病原菌浓度(表 1~表 3)可知,感染后3 h,实验组罗非鱼脑、肝脏、脾脏和肾脏组织内均可分离到无乳链球菌,但是各组织中的病原菌浓度均处于较低水平(5.29×103~1.96×106 CFU/g)。感染后6 h,3个实验组罗非鱼各组织中病原菌的浓度逐渐增加,其中,33℃实验组罗非鱼各组织中的无乳链球菌增殖速度极快(最高可达3.84×109 CFU/g·h)。所有对照组罗非鱼体内未分离到无乳链球菌。
|
|
表 1 25℃水温条件下尼罗罗非鱼4种组织中无乳链球菌平均浓度与感染时间的关系 Tab.1 Relationship between infection time and average abundance of S. agalactiae in the four tissues of O. niloticus at 25℃ water temperature(CFU/g) |
|
|
表 2 29℃水温条件下尼罗罗非鱼4种组织中无乳链球菌平均浓度与感染时间的关系 Tab.2 Relationship between infection time and average abundance of S. agalactiae in the four tissues of O. niloticus at 29℃ water temperature(CFU/g) |
|
|
表 3 33℃水温条件下尼罗罗非鱼4种组织中无乳链球菌平均浓度与感染时间的关系 Tab.3 Relationship between infection time and average abundance of S. agalactiae in the four tissues of O. niloticus at 33℃ water temperature (CFU/g) |
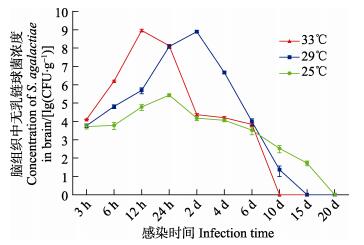
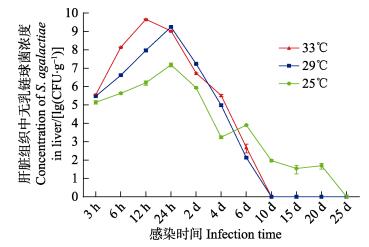
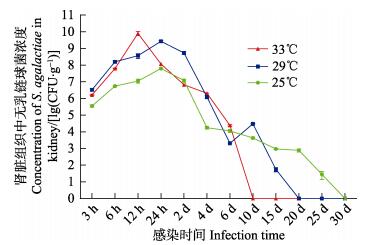
感染后12 h,33℃实验组各组织中无乳链球菌浓度即可达到峰值,其脑、肝脏、脾脏和肾脏组织中无乳链球菌含量分别为(9.18×108±1.44×108)、(4.60× 109±2.19×108)、(3.46×1010±2.06×109)、(8.08×109±2.19× 109) CFU/g (表 3)。感染后24 h,25℃实验组罗非鱼体内脑、肝脏、脾脏和肾脏组织中的无乳链球菌浓度均达到峰值,其含量分别为(2.73×105±5.20×104)、(1.55×107±3.64×106)、(8.18×107±1.26×107)、(6.26×107± 7.52×106) CFU/g (表 1)。29℃实验组罗非鱼肝脏、脾脏和肾脏中无乳链球菌浓度同样在感染后24 h达到峰值,其含量分别为(1.76×109±1.97×108)、(3.56×109± 4.93×108)和(2.70×109±3.65×108) CFU/g,但是,脑组织中无乳链球菌浓度峰值出现在感染后48 h,其含量为(7.87× 108±8.87×107) CFU/g (表 2)。
分析无乳链球菌在罗非鱼体内的平均增殖速度可知,33℃组罗非鱼4个组织中无乳链球菌的平均增殖速度均比29℃组和25℃组的要快。本研究中,罗非鱼脾脏中无乳链球菌的平均增殖速度最大,33℃组、29℃组和25℃组脾脏组织中无乳链球菌的平均增殖速度分别为3.84×109、1.69×108和3.56×106 CFU/g·h。脑组织中的平均增殖速度最小,分别为1.02×108、1.75×107和1.27×104 CFU/g·h (表 4)。
|
|
表 4 不同实验组罗非鱼体内不同组织中无乳链球菌的平均增殖速度 Tab.4 Average propagation speed of S. agalactiae in various infected tissues of O. niloticus in different experimental groups [CFU/(g·h)] |
各实验组罗非鱼体内无乳链球菌浓度达到峰值后,随着感染时间的延长,体内无乳链球菌浓度逐渐下降(表 1~表 3)。感染2 d后,33℃实验组的4个组织(脑、肝脏、脾脏和肾脏)中无乳链球菌浓度即明显下降(降低2~4个数量级),而25℃和29℃实验组在感染4 d后,4个组织(脑、肝脏、脾脏和肾脏)中无乳链球菌浓度才呈现明显下降趋势;感染6 d后,各实验组存活罗非鱼体内无乳链球菌浓度均降至较低水平(1.38×102~2.44×104 CFU/g),感染10 d后,33℃实验组存活罗非鱼体内已分离不到无乳链球菌;29℃实验组感染15 d后,只能从存活罗非鱼肾脏中分离到少量无乳链球菌,但是感染20 d后,则分离不到无乳链球菌;感染25 d后,25℃实验组存活罗非鱼肾脏中能够分离到少量的无乳链球菌,但感染30 d后,存活的罗非鱼体内分离不到无乳链球菌。
2.3 病原菌浓度、累积生存率与感染时间的关系分析尼罗罗非鱼感染无乳链球菌后,脑、肝脏、脾脏和肾脏组织中病原菌浓度、累积生存率与感染时间之间的关系(图 1~图 5)可知,水温越高,罗非鱼感染的累积死亡率越高,各组织中病原菌的增殖速度越快,组织中病原菌的浓度也越高。实验表明,高温组(33℃)罗非鱼的脾脏和肾脏中无乳链球菌的浓度峰值极显著高于25℃和29℃实验组(P < 0.01)。研究发现,同一温度组罗非鱼感染无乳链球菌后,不同组织中无乳链球菌的增殖速度却不相同,肝脏、脾脏和肾脏中病原菌增殖速度较快,脑组织中无乳链球菌的增殖速度相对较慢(表 4)。相同温度组的罗非鱼体内各组织中的无乳链球菌最大浓度也不相同,感染初期(0~2 d)脑组织中无乳链球菌的浓度通常低于同时期肝脏、脾脏和肾脏等组织中无乳链球菌的浓度。
|
图 2 尼罗罗非鱼脑组织中无乳链球菌浓度随感染时间的变化趋势 Fig.2 Variation of the concentration of S. agalactiae with infection time in the brain of O. niloticus |
|
图 3 尼罗罗非鱼肝脏组织中无乳链球菌浓度随感染时间的变化趋势 Fig.3 Variation of the concentration of S. agalactiae with infection time in the liver of O. niloticus |

|
图 4 尼罗罗非鱼脾脏组织中无乳链球菌浓度随感染时间的变化趋势 Fig.4 Variation of the concentration of S. agalactiae with infection time in the spleen of O. niloticus |
|
图 5 尼罗罗非鱼肾脏组织中无乳链球菌浓度随感染时间的变化趋势 Fig.5 Variation of the concentration of S. agalactiae with infection time in the kidney of O. niloticus |
对每个时间点取样涂布过夜培养的平板进行菌落观察,其中,表面光滑、湿润、圆形、边缘整齐、乳白色、直径为0.5~2.0 mm的菌落即为疑似无乳链球菌。挑取疑似单菌落,将无乳链球菌特异基因cfb作为检测对象,每组随机挑取10个单菌落进行PCR扩增,PCR产物经1%的琼脂糖凝胶电泳检测,得到170 bp的目的条带,与预期相符,则确定疑似菌落为无乳链球菌。
3 讨论罗非鱼链球菌病作为国家三类动物性疫病,是一种高温高发、高传染性、高死亡率的细菌性疾病(可小丽等, 2013)。近年来,链球菌病在我国南方罗非鱼主养区呈现暴发性流行,其发病率和死亡率均较高,特别是在高温季节(卢迈新, 2010)。因此,研究水温与罗非鱼链球菌病暴发之间的关系具有重要的理论和现实意义。本研究为了解不同水温条件下,无乳链球菌在罗非鱼体内的动态分布规律,选取33℃、29℃和25℃3个温度组,分别代表了高温期间链球菌病极易暴发的温度、罗非鱼最适生长温度和低温时几乎无链球菌病发病的温度,以人工注射感染的方式,通过对感染后罗非鱼的脑、肝脏、脾脏和肾脏组织中无乳链球菌的分离、鉴定以及菌落数统计分析,以期模拟不同发病过程中,无乳链球菌在罗非鱼群体体内的动态分布及其增殖、消除规律。由于实验过程中样本量不够大以及罗非鱼存在个体差异的原因,本研究中罗非鱼体内无乳链球菌动态变化主要是指群体中病原菌的动态分布。
本研究表明,水温越高罗非鱼链球菌病的发病越快,死亡率越高。水温由25℃升至33℃时,罗非鱼感染无乳链球菌后的发病死亡时间从48 h缩短至9 h,而且高温组罗非鱼的累积死亡率(78.90%)极显著高于低温组(6.67%)(P < 0.01)。高温组患病罗非鱼的临床症状如打转、侧翻、离群狂游、体色发黑等,与前人所报道的结果十分相似(邝伟键等, 2017; 王均等, 2011; 魏顺等, 2016)。然而,低温组发病罗非鱼仅出现体色发黑、游动缓慢的症状。以上结果表明,水温显著影响了罗非鱼链球菌病的发病进程和临床症状。高水温条件下,罗非鱼感染无乳链球菌后发病迅速、死亡率高,这与每年高温季节罗非鱼链球菌病易暴发、发病快和死亡率高等特征十分吻合。可能是因为高温时无乳链球菌在罗非鱼的体内繁殖快、毒力强,无乳链球菌在罗非鱼体内的增殖速度大于消除速度,导致了罗非鱼链球菌病发病迅速、死亡率高、病程长、治/自愈慢等现象。在高温条件下,无乳链球菌毒力相关基因、嘌呤代谢和铁摄取相关基因表达与低温相比呈上升趋势,而且高温时,无乳链球菌对宿主的侵袭力(包括黏附、定植、入侵、繁殖、扩散及抵抗宿主防御的能力等)和产毒素能力均比低温条件下的高(Freitas Lione et al, 2010; Mereghetti et al, 2008; 石洁等, 2012),以上这些因素导致了无乳链球菌对罗非鱼的致病力增强。此外,研究发现,高温能够引起罗非鱼免疫力降低,如抗氧化酶活性、巨噬细胞溶菌酶活性、补体活性下降和血清溶菌酶活性受到抑制等,导致鱼体对病原菌的易感性增强(陈家长等, 2011)。以上综合因素共同作用致使罗非鱼在高温时感染无乳链球菌的死亡率显著升高,这也暗示水温可显著影响无乳链球菌对罗非鱼的致病力。
本研究发现,水温越高无乳链球菌在罗非鱼体内的增殖速度越快。菌落统计结果显示,高温组(33℃)罗非鱼体内无乳链球菌的浓度在感染后12 h即达到峰值;然而,29℃组和25℃组罗非鱼体内无乳链球菌达到峰值需要24 h,甚至48 h。25℃实验组、29℃实验组和33℃实验组无乳链球菌在罗非鱼体内的最大平均增殖速度分别为3.56×106、1.69×108和3.84× 109 CFU/g·h。水温从25℃升到33℃,无乳链球菌在罗非鱼体内的平均增殖速度提高了1079.5倍,这表明,水温可显著影响无乳链球菌在罗非鱼体内的增殖速度,而且水温越高,无乳链球菌在罗非鱼体内的增殖速度越快。
与其增殖速度相比,当实验组罗非鱼体内无乳链球菌浓度达到峰值后,其消除速度均较慢。数据分析表明,无乳链球菌的消除速度随着温度的升高而加快,水温越高消除速度越快,所需消除时间越短,例如:25℃组罗非鱼体内无乳链球菌完全被清除需要30 d,而29℃组和33℃组分别需要20和10 d。而且无乳链球菌在肾脏中的滞留时间最长,肾脏可能是无乳链球菌侵染罗非鱼的主要靶器官。此外,通过分析无乳链球菌在罗非鱼体内的增殖速度和消除速度发现,水温越高无乳链球菌在罗非鱼体内的增殖速度和消除速度均较快,并且明显快于低温组。研究表明,无乳链球菌可以在巨噬细胞内存活(Guo et al, 2014),其通过转录调控以适应吞噬体内的环境,形成胞内寄生,使得无乳链球菌逃避宿主的免疫监视(Zlotkin et al, 2003),这也解释了为何无乳链球菌可以在罗非鱼体内长期存活。然而,水温可以明显影响无乳链球菌在罗非鱼体内的存活时间,即逃逸时间,本研究将为进一步揭示其免疫逃逸机制提供科学依据。
本研究发现,罗非鱼感染无乳链球菌后,水温越高,单位质量组织(脑、肝脏、脾脏和肾脏)中无乳链球菌的浓度越高。分析不同实验组罗非鱼各组织中的最大载菌量可以发现,33℃组脾脏中的最大载菌量分别是29℃和25℃组的9.7倍和422.8倍;33℃组肾脏中的最大载菌量分别是29℃和25℃组的3.0倍和129.1倍;33℃组脑中的最大载菌量分别是29℃和25℃组的1.2倍和3361.1倍;33℃组肝脏中的最大载菌量分别是29℃和25℃组的2.6倍和296.5倍,表明水温可以显著影响无乳链球菌在罗非鱼体内的浓度。高温组罗非鱼体内无乳链球菌的浓度高,其死亡率也高;低温组罗非鱼体内无乳链球菌的浓度低,其死亡率也低。表明高温条件下罗非鱼体内无乳链球菌浓度的增加也是导致罗非鱼死亡率升高的重要原因之一,这也表明罗非鱼体内无乳链球菌的浓度与其死亡率存在密切的关系。本研究结果显示,与高温组相比,低温组(25℃)罗非鱼脑、肝脏、脾脏和肾脏组织中无乳链球菌的最大载菌量均较低,表明低温条件下无乳链球菌对罗非鱼的以上4种组织的侵染能力降低,尤其是脑组织,这解释了低温组发病罗非鱼的链球菌病症状(如侧翻、打转游动)不明显的原因。此外,本研究中,发病时期罗非鱼脾脏的无乳链球菌浓度通常比其他3个组织中的高,暗示脾脏也可能是无乳链球菌侵袭罗非鱼的重要靶器官。
综上可知,尼罗罗非鱼感染无乳链球菌后,养殖水温越高,其感染死亡率越高,单位质量的脑、肝脏、脾脏和肾脏组织中无乳链球菌的最大载菌量也越高。本研究发现,水温能够影响无乳链球菌在罗非鱼体内的增殖速度和存活时间,可显著影响无乳链球菌在罗非鱼体内的浓度,进而影响无乳链球菌对罗非鱼的致病性,这表明,温度是罗非鱼链球菌病暴发的关键因子之一。本研究较好地解释了高温季节罗非鱼链球菌病易暴发、死亡率高这一现象。本研究表明,在罗非鱼养殖过程中,应注意链球菌病暴发时期的水温,建议根据不同的养殖水温采取不同的防控措施和施药策略。本研究也将为罗非鱼链球菌病的弱毒活疫苗研发提供参考依据,即免疫时期水温的高低将影响弱毒株在罗非鱼体内的存活时间,进而影响疫苗株对机体免疫刺激的时间。
Chen JZ, Zang XL, Qu JH, et al. The immune response of tilapia (GIFT Oreochromis niloticus) and its susceptibility to Streptococcus iniae under temperatures stress. Journal of Agro-Environment Science, 2011, 30(9): 1896-1901 [ 陈家长, 臧学磊, 瞿建宏, 等. 温度胁迫下罗非鱼(GIFT Oreochromis niloticus)机免疫力的变化及其对海豚链球菌易感性的影响. 农业环境科学学报, 2011, 30(9): 1896-1901] |
Deng HW, Guo WL, Sun XF, et al. Optimization of the extraction conditions of active components for inhibition of Streptococcus agalactiae from Salvia miltiorrhiza Bge. using response surface methodology. Progress in Fishery Sciences, 2014, 35(4): 132-140 [ 邓恒为, 郭伟良, 孙晓飞, 等. 响应面法优化丹参中抗无乳链球菌活性成分的提取工艺. 渔业科学进展, 2014, 35(4): 132-140] |
Evans JJ, Klesius PH, Shoemaker CA. Efficacy of Streptococcus agalactiae (group B) vaccine in tilapia (Oreochromis niloticus) by intraperitoneal and bath immersion administration. Vaccine, 2004, 22(27-28): 3769-3773 DOI:10.1016/j.vaccine.2004.03.012 |
Fang W, Liang YH, Ning D, et al. Molecular epidemiology of Streptococcus agalactiae in tilapia in Guangdong. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016, 55(2): 97-101, 110 [ 方伟, 梁宇恒, 宁丹, 等. 广东地区感染养殖罗非鱼的无乳链球菌分子分型研究. 中山大学学报(自然科学版), 2016, 55(2): 97-101, 110] |
Freitas Lione VO, Bittencourt Dos Santos MH, Ulisses Carvalho TM, et al. Fever temperature enhances mechanisms of survival of Streptococcus agalactiae within human endothelial cells. International Journal of Molecular Medicine, 2010, 26(4): 511-516 |
Guo CM, Chen RR, Kalhoro DH, et al. Identification of genes preferentially expressed by highly virulent piscine Streptococcus agalactiae upon interaction with macrophages. PLoS One, 2014, 9(2): e87980 DOI:10.1371/journal.pone.0087980 |
Huang YH, Peng Y, Liu J, et al. Isolation, identification and drug susceptibility test of tilapia pathogen Streptococcus agalactiae. Journal of Southern Agriculture, 2014, 45(3): 498-504 [ 黄艳华, 彭亚, 刘杰, 等. 罗非鱼致病性无乳链球菌的分离鉴定及药敏试验. 南方农业学报, 2014, 45(3): 498-504 DOI:10.3969/j.issn.2095-1191.2014.3.498] |
Ke XL, Lu MX, Li QY, et al. Identification and phylogenetic analysis of tilapia Streptococcus agalactiae based on cfb and 16S rRNA gene. Chinese Agricultural Science Bulletin, 2013, 29(20): 52-62 [ 可小丽, 卢迈新, 李庆勇, 等. 罗非鱼无乳链球菌鉴定及基于cfb和16S rRNA基因同源性分析. 中国农学通报, 2013, 29(20): 52-62 DOI:10.11924/j.issn.1000-6850.2013-0331] |
Klesius PH, Shoemaker CA, Evans JJ. Efficacy of single and combined Streptococcus iniae isolate vaccine administered by intraperitoneal and intramuscular routes in tilapia (Oreochromis niloticus). Aquaculture, 2000, 188(3-4): 237-246 DOI:10.1016/S0044-8486(00)00345-8 |
Kuang WJ, Huang LZ, Liu MJ, et al. Isolation, identification and drug sensitivity of Streptococcus agalactiae from Nile tilapia. Animal Husbandry and Veterinary Medicine, 2017, 49(9): 62-66 [ 邝伟键, 黄良宗, 刘明杰, 等. 罗非鱼源无乳链球菌的分离鉴定及药敏试验. 畜牧与兽医, 2017, 49(9): 62-66] |
Liu ZG, Ke XL, Lu MX, et al. Effect of temperature on the virulence of Streptococcus agalactiae from Nile tilapia (Oreochromis niloticus). Journal of Fisheries of China, 2013, 37(11): 1733-1741 [ 刘志刚, 可小丽, 卢迈新, 等. 温度对尼罗罗非鱼无乳链球菌毒力的影响. 水产学报, 2013, 37(11): 1733-1741] |
Lu MX, Li J, Ye X, et al. Identification and characterizations of Streptococcus agalactiae isolated from tilapia cultured in Guangdong and Hainan Provinces. Microbiology China, 2010, 37(5): 766-774 [ 卢迈新, 黎炯, 叶星, 等. 广东与海南养殖罗非鱼无乳链球菌的分离, 鉴定与特性分析. 微生物学通报, 2010, 37(5): 766-774] |
Lu MX. Review of research on Streptococcosis in tilapia. South China Fisheries Science, 2010, 6(1): 75-79 [ 卢迈新. 罗非鱼链球菌病研究进展. 南方水产科学, 2010, 6(1): 75-79 DOI:10.3969/j.issn.1673-2227.2010.01.013] |
Mereghetti L, Sitkiewicz I, Green NM, et al. Remodeling of the Streptococcus agalactiae transcriptome in response to growth temperature. PLoS One, 2008, 3(7): e2785 DOI:10.1371/journal.pone.0002785 |
Shi J, Wang CJ. Bacterial strategies for overcoming the defense of host cells. Microbiology China, 2012, 39(1): 90-98 [ 石洁, 王长军. 病原菌逃避宿主细胞防御的策略. 微生物学通报, 2012, 39(1): 90-98] |
Sun Y, Hu YH, Liu CS, et al. Construction and analysis of an experimental Streptococcus iniae DNA vaccine. Vaccine, 2010, 28(23): 3905-3912 DOI:10.1016/j.vaccine.2010.03.071 |
Tan JJ, Chen CF, Gao Y, et al. Identification, pathogenicity and drug sensitivity of Streptococcus agalactiae from hybrid tilapia, Oreochromis niloticus×Oreochromis aureus. Journal of Huazhong Agricultural University, 2010, 29(6): 745-751 [ 谭晶晶, 陈昌福, 高宇, 等. 奥尼罗非鱼无乳链球菌的鉴定、致病性及药物敏感性研究. 华中农业大学学报, 2010, 29(6): 745-751] |
Wang B, Li GH, Wang P, et al. Expression and immunogenicity analysis of hemolysin gene in Streptococcus agalactiae isolated from Oreochromis niloticus. Progress in Fishery Sciences, 2014, 35(6): 60-67 [ 王蓓, 李桂欢, 王培, 等. 罗非鱼源无乳链球菌溶血素基因体外表达及其免疫原性. 渔业科学进展, 2014, 35(6): 60-67] |
Wang DQ, Tong YN, Li FY, et al. Study on combination of Chinese herbal medicine against tilapia Streptococcus disease in vitro. Journal of Aquaculture, 2017, 38(1): 47-51 [ 王德强, 佟延南, 李芳远, 等. 中草药联用对罗非鱼无乳链球菌作用的研究. 水产养殖, 2017, 38(1): 47-51 DOI:10.3969/j.issn.1004-2091.2017.01.010] |
Wang J, Wang KY, Xiao D, et al. Development of double PCR for rapid detection of Streptococcus agalactiae isolated from tilapia. Chinese Veterinary Science, 2011, 41(5): 496-502 [ 王均, 汪开毓, 肖丹, 等. 罗非鱼源无乳链球菌双重PCR快速检测方法的建立. 中国兽医科学, 2011, 41(5): 496-502] |
Wei S, Zhang Z, Li YH, et al. Epidemic and antibiotic resistance of Streptococcus agalactiae isolated from tilapia (GIFT Oreochromis niloticus) in Guangdong Province. Journal of Fisheries of China, 2016, 40(3): 503-511 [ 魏顺, 张泽, 李宇辉, 等. 广东地区吉富罗非鱼无乳链球菌病的流行情况与耐药性. 水产学报, 2016, 40(3): 503-511] |
Wu B, Fan HP, Zhang XY, et al. Preparation of the oral microencapsulated vaccine of Streptococcus agalaciate from tilapia and its immunological effect. Journal of Fisheries of China, 2016, 40(8): 1258-1264 [ 吴斌, 樊海平, 张新艳, 等. 罗非鱼无乳链球菌微胶囊口服疫苗的研制及其免疫效果. 水产学报, 2016, 40(8): 1258-1264] |
Zhang DF, Liu LH, Ren Y, et al. Isolation, identification, and molecular characteristics of a new genotype of Streptococcus agalactiae from cultured tilapia in China. Journal of Fishery Sciences of China, 2015, 22(5): 1044-1054 [ 张德锋, 刘礼辉, 任燕, 等. 我国罗非鱼源新型无乳链球菌的分离, 鉴定及其分子特征. 中国水产科学, 2015, 22(5): 1044-1054] |
Zhang DF, Yuan W, Ke XL, et al. Molecular characteristics and transmission of Streptococcus agalactiae in a major tilapia culturing area of China. Journal of Fishery Sciences of China, 2017, 24(3): 606-614 [ 张德锋, 袁伟, 可小丽, 等. 中国罗非鱼主养区无乳链球菌的分子流行特征及其传播方式. 中国水产科学, 2017, 24(3): 606-614] |
Zhang XY, Fan HT, Zhong QF, et al. Isolation, identification and pathogenicity of Streptococcus agalactiae from tilapia. Journal of Fisheries of China, 2008, 32(5): 772-779 [ 张新艳, 樊海平, 钟全福, 等. 罗非鱼无乳链球菌的分离, 鉴定及致病性研究. 水产学报, 2008, 32(5): 772-779] |
Zhu JL, Gao TT, Zhong XJ, et al. Immunoprotection of the inactivated vaccine against Streptococcus agalactiae infection in tilapia. Chinese Veterinary Science, 2017, 47(5): 636-643 [ 朱洁莲, 高婷婷, 钟孝俊, 等. 罗非鱼源无乳链球菌灭活疫苗免疫效果的研究. 中国兽医科学, 2017, 47(5): 636-643] |
Zlotkin A, Chilmonczyk S, Eyngor M, et al. Trojan horse effect: Phagocyte-mediated Streptococcus iniae infection of fish. Infection and Immunity, 2003, 71(5): 2318-2325 DOI:10.1128/IAI.71.5.2318-2325.2003 |



