2. 青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室 青岛 266071;
3. 辽渔集团有限公司 大连 116113
2. Laboratory for Marine Drugs and Bioproducts, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
3. Liaoyu Group Co. Ltd, Dalian 116113
南极磷虾(Euphausia superba)广泛分布于环南极大陆架海域(Siegel et al, 2013)。南极磷虾资源量巨大,已成为世界渔业发达国家竞相开发利用的海洋新资源(陈雪忠等, 2009)。我国于2009年开始对南极磷虾进行商业化捕捞和加工,已初步形成以冻虾、虾粉、虾油等产品类型为主的产业模式(黄洪亮等, 2015)。
南极磷虾体内具有活性极高的自溶酶系(Sjödahl et al, 2002),捕获死亡后的南极磷虾肌肉蛋白会发生快速降解,造成原料品质的劣化。因此,南极磷虾捕获后一般需尽快冷冻或加工处理。南极磷虾的流通运输也需要在低温条件下进行。国内外学者对南极磷虾冷链流通的多个环节进行了研究,如冻结(刘会省等, 2013)、冻藏(迟海等, 2012)、解冻(曹荣等, 2015)、冷藏(李学英等, 2010),但多数研究是以历经长途、长时运输的冷冻磷虾作为实验材料,研究结果具有一定的局限性。
在南极磷虾作业船上,往往存在捕捞过于集中、原料量大、加工不及时的情况,长时间暂存会导致原料品质的劣化,因此,有必要对南极磷虾起捕后的品质变化进行研究。但该部分研究需要以鲜活的南极磷虾样品作为实验材料,而我国目前的南极磷虾作业船尚不具备开展大规模科学实验的条件,有关南极磷虾起捕后品质变化的研究几乎空白。另外,目前中国的南极磷虾捕捞船均采用拖网的作业方式,会造成大量的原料挤压破损,在何种程度上对原料品质造成影响也尚未可知。
在世界近海渔业资源普遍衰退的背景下,南极磷虾的开发利用具有重要的战略意义,而目前我国在南极磷虾高效利用方面的基础研究还比较薄弱(黄洪亮等, 2015)。尤其是受科考条件的限制,目前,尚没有足够的实验数据阐明南极磷虾起捕后在暂存过程中的品质变化情况。本研究旨在证实南极磷虾中非蛋白氮含量的变化是否可以表征蛋白自溶进程,且可以实现海上处理样品、运至陆地实验室后进行分析的目的,在此基础上研究了南极磷虾起捕后蛋白自溶进程以及挤压破损对该过程的影响。研究结果有助于阐明南极磷虾起捕后的自溶进程,为保持南极磷虾原料品质及其高效利用提供参考。
1 材料与方法 1.1 材料南极磷虾冷冻虾块由辽渔集团有限公司提供,系2014年由运输船正常运至国内的南极磷虾样品。
鲜活南极磷虾样品,系“南极磷虾资源分布与冷链技术”课题组人员于2015年随辽渔集团“福荣海”号南极磷虾作业船在南极海域现场采集。
1.2 样品制备 1.2.1 实验室条件下样品制备块状冻虾样品真空包装,历经3个月左右的冷链运输,运抵实验室后,立即置于自来水流下流水解冻(水温约为12℃),磷虾个体间基本分离为解冻终点。
解冻后的样品置于10℃恒温培养箱(模拟南极磷虾作业船的船舱温度),分别在0、1、2、4、6、8 h取样,将磷虾按照1:10(m/v)比例匀浆。称取匀浆液100 g,加入质量分数为10%的三氯乙酸(TCA)100 ml,震荡2 min,静置15 min,8000 r/min离心20 min,取上清液。
1.2.2 船上样品制备南极磷虾随捕捞船的拖网到达甲板后,立即选取体长为5~6 cm、形态完整的南极磷虾作为组Ⅰ,另选取体长为5~6 cm、破损(表现为虾体受挤压严重,头胸部部分脱离)的南极磷虾作为组Ⅱ。
2组样品分别在0、1、2、4、6、8 h取样。将南极磷虾按照1:10(m/v)比例匀浆。称取匀浆液10 g,加入质量分数为10%的TCA溶液10 ml,震荡1 min,静置30 min,快速滤纸过滤。取上清液,置于50 ml冻存管中,船上-25℃冰柜保存。
1.3 指标检测 1.3.1 非蛋白氮(NPN)含量测定取1.2.1制备的上清液10 ml,参照食品安全国家标准食品中蛋白质的测定(GB5009.5-2010),采用凯氏定氮法测定其中的氮元素含量,即非蛋白氮。将1.2.1制备的剩余上清液贮存于-20℃冰柜中,分别在30、60、90 d取样,测NPN含量变化。船上制备的样品,随远洋运输船运抵实验室后,继续保存于-80℃超低温冰箱中备用。测定指标时,取出冻存管流水快速解冻,取10 ml上清液,参照GB5009.5-2010,采用凯氏定氮法测定NPN含量。
1.3.2 TCA可溶性蛋白含量测定取1.2.1制备的上清液,采用双缩脲法测定蛋白含量,即为TCA可溶性蛋白含量。
1.3.3 氨基酸态氮含量测定取1.2.1制备的上清液,参照酱油卫生标准的分析方法(GB/T5009. 39-2003),采用比色法测定。
1.4 数据处理采用SPSS 17.0软件对数据进行处理,结果以平均值±标准差(Mean±SD)表示,显著性以P < 0.01为极显著,P < 0.05为显著,P > 0.05为不显著。
2 结果与分析 2.1 冷冻南极磷虾原料蛋白自溶过程中相关指标变化 2.1.1 冷冻南极磷虾NPN含量随时间的变化情况以南极磷虾冷冻虾块作为实验原料,通过凯氏定氮法测得其总氮含量为25.36 mg/g,推算出蛋白质含量为158.50 mg/g。近几年,有关南极磷虾基本化学组成的研究报道较多(Yoshitomi, 2004; 孙雷等, 2008; 刘丽等, 2010; Liu et al, 2012),但数值相差较大,这可能与所选用原料的捕捞海域、季节、年龄以及性成熟等多种因素有关,同时,原料所历经的物流过程对实验数据也可能有较大的影响。
分析蛋白质降解程度可以通过检测大分子蛋白质的减少或是检测降解产物(如肽、氨基酸等)的增加来实现。NPN是指大分子蛋白质以外的含氮化合物的总称,既包含了酰胺类、氨以及铵盐等含氮化合物,也包括了蛋白质降解所产生的小分子肽类和游离氨基酸(Sakaguchi, 2001)。当南极磷虾肌肉组织在蛋白酶系的作用下发生自溶降解时,会产生多肽、寡肽、氨基酸等分子量相对较小的化合物,NPN会相应增加。
实验数据表明,块状冻虾的初始NPN为5.25 mg/g,占总氮的20.70%,这说明历经长时间冷链运输的磷虾原料,其肌肉蛋白已经有相当比例发生了降解。由图 1可知,在实验室10℃条件下,南极磷虾NPN随存放时间的延长迅速增加,在8 h内几乎呈线性变化,相关性系数达到0.9891。
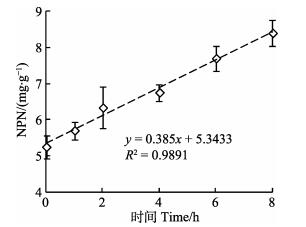
|
图 1 实验室条件下南极磷虾NPN含量随存放时间的变化 Fig.1 Changes in NPN content of Antarctic krill during storage at 10℃ in the laboratory 所用原料为历经3个月冷链运输的块状冷冻南极磷虾,图 2和图 3同 The raw materials are frozen Antarctic krill, which had been in transportation in cold chain for 3 months. The same as in Fig. 2 and Fig. 3 |
|
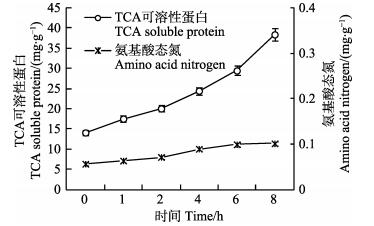
图 2 实验室条件下南极磷虾TCA可溶性蛋白与氨基酸态氮随存放时间的变化 Fig.2 Changes in TCA-soluble protein and amino acid nitrogen of Antarctic krill during storage at 10℃ in the laboratory |
|
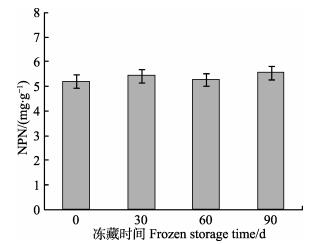
图 3 制备的南极磷虾样品在冷冻保存过程中NPN含量的变化 Fig.3 Changes in NPN content of Antarctic krill during frozen storage in the laboratory |
TCA可以沉淀大分子蛋白质,分子量小于10 kDa的多肽组分则可以溶解在TCA溶液中,因此,TCA可溶性蛋白含量的增加可以表征南极磷虾自溶时蛋白质发生的降解作用。由图 2可以看出,TCA可溶性蛋白含量随时间延长迅速增加,8 h后,TCA可溶性蛋白已由初始的14.06 mg/g增至38.37 mg/g,这是造成NPN快速增加的主要原因。氨基酸态氮的变化趋势与TCA可溶性蛋白基本一致,但氨基酸态氮的含量较低,初始值为0.056 mg/g,8 h后也仅为0.101 mg/g,与TCA可溶性蛋白含量相比显著偏低(P < 0.01),这说明南极磷虾自溶初期主要是大分子蛋白被降解为肽类,而自溶酶系分解蛋白质产生的游离氨基酸非常有限,因此,NPN的组分以TCA可溶性蛋白为主。
2.1.3 南极磷虾样品在冷冻保存过程中NPN含量的变化情况在实验室条件下提取南极磷虾的NPN,样品在-20℃保存,90 d内的变化情况见图 3。从图 3可以看出,所制备样品的NPN含量在冷冻保存过程中无明显变化,样品冻藏0、30、60、90 d对应的NPN含量之间无显著差异(P > 0.05)。由此,船上制备的NPN样品经冷链运输至实验室后,NPN总量不会在运输途中发生变化。
综上,NPN含量与南极磷虾蛋白自溶密切相关。尽管NPN的组成较为复杂,且有可能在贮存期间发生进一步的降解,但NPN总量稳定,可以表征南极磷虾蛋白自溶进程,且可以实现在船上制备样品、陆基实验室分析的目的。
2.2 新鲜南极磷虾自溶过程NPN含量变化以及挤压破损对自溶进程的影响 2.2.1 南极磷虾起捕后NPN随存放时间的变化鲜活南极磷虾的NPN仅为0.81 mg/g,占总氮含量的3.19%,这与块状冻虾的NPN(5.25 mg/g)相比,有极显著差异(P < 0.01)。南极磷虾起捕死亡后,在1 h内NPN无显著变化(P > 0.05)(图 4),这与实验室条件下冷冻磷虾原料NPN含量随存放时间迅速增加的现象有所不同(图 1)。起捕1 h后,在自溶酶系的作用下,南极磷虾的NPN含量迅速增加,至8 h时达到1.31 mg/g。从品质保持的角度,南极磷虾起捕后应尽快进行冷冻或加工处理。
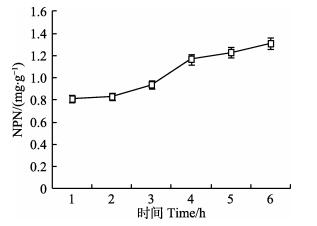
|
图 4 作业船上南极磷虾起捕后NPN含量随存放时间的变化 Fig.4 Changes in NPN content of Antarctic krill after being captured on the fishing vessel |
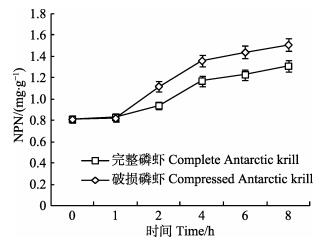
我国目前的南极磷虾捕捞船均采用拖网的作业方式,不可避免会造成原料的挤压破损。由图 5可以看出,挤压破损磷虾原料的NPN含量在起捕后最初的1 h内与完整态磷虾相比无显著差异(P > 0.05),但1 h后的各个取样点,破损磷虾的NPN含量均显著高于完整磷虾(P < 0.01)。Ellingsen等(1987)研究发现,造成南极磷虾蛋白降解的酶系主要来源于消化器官,该酶系包含了类胃蛋白酶、羧肽酶A和类胰蛋白酶(杭虞杰等, 2011)。挤压使得南极磷虾消化器官中的蛋白酶在磷虾体内得以扩散,这可能是加速磷虾自溶的主要原因。从品质保持的角度,目前的拖网作业方式还有待改进。
|
图 5 作业船上挤压破损对南极磷虾NPN含量变化的影响 Fig.5 Effect of compression damage on the NPN content of Antarctic krill on the fishing vessel |
南极磷虾NPN含量可以表征其蛋白自溶进程,实验室条件下存放8 h内NPN的组分以TCA可溶性蛋白为主。所制备样品的NPN在90 d冷冻保存过程中,含量无明显变化。由此,NPN这一指标可以实现船上提取、陆基实验室分析的目标,适宜用来评定南极磷虾起捕死亡后的品质变化。
块状冻虾的初始NPN为5.25 mg/g,而鲜活磷虾的NPN仅为0.81 mg/g,二者存在极显著差异(P < 0.01)。南极磷虾起捕死亡后的1 h内,NPN无显著变化,1 h后NPN迅速增加,从品质保持的角度,南极磷虾起捕后应尽快进行冷冻或加工处理。挤压加速了南极磷虾的自溶,目前的拖网作业方式有待改进。
Cao R, Chen Y, Zhao YR, et al. Effect of thawing methods on processing quality of Antarctic krill. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(17): 289-294 [ 曹荣, 陈岩, 赵玉然, 等. 解冻方式对南极磷虾加工品质的影响. 农业工程学报, 2015, 31(17): 289-294 DOI:10.11975/j.issn.1002-6819.2015.17.038] |
Chen XZ, Xu ZL, Huang HL. Development strategy on Antarctic krill resource utilization in China. Journal of Fishery Sciences of China, 2009, 16(3): 451-458 [ 陈雪忠, 徐兆礼, 黄洪亮. 南极磷虾资源利用现状与中国的开发策略分析. 中国水产科学, 2009, 16(3): 451-458 DOI:10.3321/j.issn:1005-8737.2009.03.019] |
Chi H, Li XY, Yang XS, et al. Analysis of quality changes and shelf-life of Antarctic krill (Euphausia superba) at frozen temperature. Journal of Fisheries of China, 2012, 36(1): 153-160 [ 迟海, 李学英, 杨宪时, 等. 南极磷虾冻藏温度下的品质变化及其货架期分析. 水产学报, 2012, 36(1): 153-160] |
Ellingsen TE, Mohr V. Biochemistry of the autolytic processes in Antarctic krill post mortem. Autoproteolysis. Biochemical Journal, 1987, 246(2): 295-305 DOI:10.1042/bj2460295 |
Hang YJ, Li XY, Yang XS, et al. Properties of autolysis enzymes from Antarctic krill. Food Science, 2011, 32(13): 198-200 [ 杭虞杰, 李学英, 杨宪时, 等. 南极磷虾自溶酶性质的初步研究. 食品科学, 2011, 32(13): 198-200] |
Huang HL, Chen XZ, Liu J, et al. Analysis of the status and trend of the Antarctic krill fishery. Chinese Journal of Polar Research, 2015, 11061106(1): 25-30 [ 黄洪亮, 陈雪忠, 刘健, 等. 南极磷虾渔业近况与趋势分析. 极地研究, 2015, 11061106(1): 25-30] |
Li XY, Chi H, Yang XS, et al. Quality change of Antarctic krill during chilling storage. Food Science, 2010, 31(20): 464-468 [ 李学英, 迟海, 杨宪时, 等. 南极磷虾冷藏过程中的品质变化. 食品科学, 2010, 31(20): 464-468] |
Liu HX, Hai C, Yang XS, et al. Effects of freezing methods on the quality of Antarctic krill (Euphausia superba). Modern Food Science & Technology, 2013, 29(7): 1601-1605 [ 刘会省, 迟海, 杨宪时, 等. 冻结方式对南极磷虾品质的影响. 现代食品科技, 2013, 29(7): 1601-1605] |
Liu L, Liu CC, Li JL. Comparison of biochemical composition and nutritional value of Antarctic krill (Euphausia superb) with several species of shrimps. Advanced Materials Research, 2012, 361-363: 799-803 |
Liu L, Liu CC, Zhao Y, et al. Recent advances in the healthcare function and food safety of Antarctic krill. Food Science, 2010, 31(17): 443-447 [ 刘丽, 刘承初, 赵勇, 等. 南极磷虾的营养保健功效以及食用安全性评价. 食品科学, 2010, 31(17): 443-447] |
Sakaguchi M. Nitrogenous low-molecular-weight components and palatability of fish and shellfish. Nihon-Suisan-Gakkai-Shi, 2001, 67(5): 787-793 DOI:10.2331/suisan.67.787 |
Siegel V, Reiss CS, Dietrich KS, et al. Distribution and abundance of Antarctic krill (Euphausia superba) along the Antarctic Peninsula. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2013, 77(4): 63-74 |
Sjödahl J, Åsa Emmer, Vincent J, et al. Characterization of proteinases from Antarctic krill (Euphausia superba). Protein Expression & Purification, 2002, 26(1): 153-161 |
Sun L, Zhou DQ, Sheng XF. Nutrition and safety evaluation of Antarctic krill. Marine Fisheries Research, 2008, 29(4): 57-64 [ 孙雷, 周德庆, 盛晓风. 南极磷虾营养评价与安全性研究. 海洋水产研究, 2008, 29(4): 57-64] |
Yoshitomi B. Utilization of Antarctic krill for food and feed. Developments in Food Science, 2004, 42(4): 45-54 |
Yu SY, Bao JQ, Li YH, et al. Quality changes of Antarctic krill (Euphausia superba) stored at different frozen temperatures. Food & Fermentation Industries, 2014, 40(1): 232-237 [ 俞所银, 包建强, 李越华, 等. 南极磷虾在不同冻藏温度下品质变化. 食品与发酵工业, 2014, 40(1): 232-237] |



