2. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛卓越海洋集团有限公司 青岛 266400
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Qingdao Excellence Ocean Group Co. Ltd, Qingdao 266400
凡纳滨对虾(Litopenaeus vannamei)生长速度快、耐盐范围广、抗病力强,其产量约占全球对虾产量的70%。自1987年引入我国以来,凡纳滨对虾迅速成为我国主要的对虾养殖品种之一,养殖产量占全球总产量的21%(黄志坚等, 2016)。目前,凡纳滨对虾养殖模式主要有池塘养殖、高位池养殖和工厂化养殖(岑伯明, 2010; 王峰等, 2013; 高欣等, 2017; 沈明明等, 2017)。池塘和高位池养殖模式存在水资源浪费严重、单位水体对虾产量低、病毒性疾病频发、污染周围水体等缺点(董双林等, 2000; 曲克明等, 2000);而工厂化养殖具有换水量少、养殖密度高、可避免病原微生物侵袭等优点(吴晨等, 2011)。因此,我国对虾工厂化养殖规模呈逐年增加的趋势。
在工厂化养殖中,为提高对虾饲料利用率和促进对虾快速生长,通常需要对虾苗种进行中间培育,即对体长为0.3~0.5 cm的凡纳滨对虾虾苗进行集中饲养管理,使其快速生长至1~2 cm仔虾的养殖过程。在对虾苗种中间培育期间,放养密度、水质、水体细菌数量及菌落组成的控制通常是决定对虾苗种中间培育成败的关键。放养密度过高会导致水质恶化,加速细菌快速生长繁殖,改变水体中微生物群落结构,进而影响养殖对虾的患病概率和发病速度(丁美丽等, 1997; 陈琛等, 2016; Apún-Molina et al, 2017)。同时,放养密度还会对凡纳滨对虾的生理行为、免疫指标和能量转化等产生重要影响,进而改变其生长速度和养殖产量(李纯厚等, 2006; 李玉全等, 2007; 张天时等, 2008; 衣萌萌等, 2012)。目前,关于放养密度对凡纳滨对虾苗种中间培育效果的研究较为有限。本研究通过凡纳滨对虾养殖场实际苗种中间培育实验,探究了放养密度对凡纳滨对虾生长性能、主要水质指标及微生物群落结构的影响,以期为凡纳滨对虾工厂化养殖提供生产性技术指导。
1 材料和方法 1.1 实验设施本研究选取12个有效容积为25 m3的水泥池(5 m × 5 m × 1 m)作为凡纳滨对虾苗种中间培育池,池底均匀布设100个气石,采用空气增氧;养殖用水为经砂滤、消毒后的地下海水,盐度为31;每个池体上方棚顶设置1个采光口(3 m × 1 m),光照控制在1000~1500 lx。实验所用凡纳滨对虾苗种由青岛卓越海洋集团有限公司培育,每尾平均体重为(6.0±0.5) mg。
1.2 实验设计鉴于养殖场凡纳滨对虾苗种中间培育实际放养密度一般为1.50万尾/m3,本研究设置4个实验组,放养密度分别为1.5万尾/m3 (P1组)、1.75万尾/m3 (P2组)、2.0万尾/m3 (P3组)和2.25万尾/m3 (P4组),每个实验组设3个平行。实验共进行21 d。实验前期(1~7 d),每天投喂3次卤虫(Brine shrimp)无节幼体(粗蛋白含量为57%),投喂时间为08:00、16:00和24:00;投喂虾片(粗蛋白含量为48%) 6次,投喂时间为06:00、09:00、12:00、15:00、18:00和21:00,卤虫无节幼体和虾片日投喂总量为对虾总重的10%;实验中期(8~13 d),混合投喂虾片和对虾商品配合饲料(粗蛋白含量为42%),虾片所占比例由75%逐渐降到25%,日投喂总量为对虾总重的8%,投喂次数和时间与实验前期相同;实验后期(14~21 d),投喂对虾商品配合饲料,日投喂量由对虾总重的8%逐渐降到6%,投喂次数和时间同实验前期。并每天向各个池体泼洒光合细菌和乳酸多肽,使养殖池内二者浓度分别达到50、20 mg/L。
实验初始,养殖池水位为0.6 m,前3 d为虾苗适应期,不换水;从第3天开始, 每天补水0.1 m,补至0.9 m,补水时间为08:30;从第7天开始,每天换水1次,日换水量由养殖池内高度增加0.05 m,逐渐递增至0.30 m,换水时间与补水时间相同。在补、换水时,要保持较小的流量,以避免对虾苗种产生应激反应,同时,各个养殖池内补、换水量相同。实验过程中,各养殖池内水体温度、盐度、溶解氧分别保持在28~30℃、31~32、5.8~6.0 mg/L。每天08:00采集水样,测定各个养殖池内氨氮(NH4+-N)和亚硝酸氮(NO2--N)浓度以及弧菌(Vibrio)浓度;每3 d测定1次水体的化学需氧量(COD),与上述测定指标采用同一批水样。实验结束后,各池内随机抽取50尾对虾,对其生物学体长和体重进行测量,并计算平均值;同时, 检测各个养殖池内养殖水体的微生物群落。
1.3 分析方法 1.3.1 对虾生长性能实验结束后,排干养殖池水并收获对虾。分别使用游标卡尺和电子天平测量各养殖池内凡纳滨对虾的生物学体长和体重,并分别计算对虾的产率、特定增长率、存活率以及饵料转化率,公式如下:
产率(Yield rate, YR) = (收获对虾总重量-放苗对虾总重量)/放苗对虾总重量
特定生长率(Specific growth rate, SGR, %/d) = [ln(对虾收获体重)-ln(对虾初始体重)] × 100/(实验天数)
存活率(Survival rate, SR, %) =对虾收获数量/对虾放苗数量× 100
饵料转化率(Feed conversion rate, FCR, %) =饲料利用干重/对虾收获增重× 100
1.3.2 常规水质指标利用水质YSI 556检测仪(美国)监测水体温度、溶解氧、pH和盐度。NH4+-N、NO2--N和COD浓度分别采用采用靛酚蓝分光光度法、盐酸萘乙二胺分光光度法和碱性高锰酸钾法测定。弧菌浓度采用涂布平板的方法测定,将0.1 ml水样使用涂物棒均匀涂布在TCBS培养基上,24 h后观测和记录培养基上菌落数量。
1.3.3 微生物群落实验结束后,使用1 L的灭菌聚乙烯瓶采集水样,将水样放置摇床,于300 r/min摇晃10 min后,用0.22 μm孔径无菌滤膜抽滤。抽滤膜使用细菌基因组DNA提取试剂盒提取水样DNA,利用带有Barcode的特异性引物(515F和806R)对提取的水样基因组DNA的16S V4区进行PCR扩增。在PCR产物通过琼脂糖凝胶电泳检测后,使用TruSeq® DNA PCR–Free Sample Preparation Kit建库试剂盒进行文库构建。若文库合格,使用HiSeq 2500 PE250进行上机测序。
下机数据在截取Barcode和引物序列后,使用FLASH 1.2.7软件对样品Reads进行拼接,得到原始数据(Raw Tags)(Magoč et al, 2011);利用Qiime 1.9.1软件对Raw Tags进行过滤处理,得到高质量Tags数据(Clean Tags)(Caporaso et al, 2010; Bokulich et al, 2013);Clean Tags序列通过(UCHIME Algorithm)与数据库(Gold database)进行比对(Edgar et al, 2011),去除其中的嵌合体序列(Hass et al, 2011),得到有效数据(Effective Tags)。使用Uparse v7.0.1001软件将所有Effective Tags聚类(97%)成为操作分类单元(Operational Taxonomic Units,OTUs) (Edgar, 2013);通过Mothur方法与SILVA的SSUrRNA数据库OTUs对比进行物种注释(Wang et al, 2007; Quast et al, 2013)。通过香农指数(Shannon index)确定水样细菌生物多样性。使用Origin.8软件对水样细菌相对丰度(门和属)进行制图。
1.3.4 数据处理采用SPPS软件对实验数据进行统计分析、差异显著性检验分析,用t检验计算P值,P < 0.05时,为差异显著,P < 0.01时,为差异极显著。
2 结果 2.1 密度对凡纳滨对虾生长性能的影响不同放养密度对凡纳滨对虾生长性能的影响见表 1。从表 1可以看出,实验结束后,各养殖池虾苗的平均体重增加了9.3~10.5倍。在放养密度为1.50~ 2.25万尾/m3条件下,凡纳滨对虾YR、SGR、SR以及FCR均随着放养密度的增加而逐渐升高。
|
|
表 1 不同放养密度养殖池内凡纳滨对虾的生长性能 Tab.1 Performance parameters of L. vannamei in ponds with different stocking densities |
不同放养密度养殖池中水体pH随实验的进行整体呈现下降的趋势(图 1)。实验期内,各组pH由8.00分别降低至7.72、7.66、7.67和7.59,而实验后期,换水量的增加能有效抑制pH的下降。P1、P2、P4组间水体的pH存在显著差异(P < 0.05),而P2、P4组水体pH较为接近。总体而言,水体pH随着放养密度的增加而降低。

|
图 1 不同放养密度养殖池内水体pH变化 Fig.1 pH variations of aquaculture water in ponds with different stocking densities |
随着凡纳滨对虾苗种中间培育实验的进行,各实验组水体NH4+-N浓度均呈逐渐上升趋势(图 2)。实验结束时,各密度组水体NH4+-N浓度分别达到3.53、4.23、4.88和5.55 mg/L。水体NH4+-N浓度随着对虾放养密度的增加而升高,且不同放养密度组间差异显著(P < 0.05)。NO2--N浓度在实验前期(1~7 d)变化缓慢,在实验中后期(8~21 d)快速上升。实验结束时,各密度组水体NO2--N浓度分别达到0.20、0.24、0.21和0.02 mg/L,但不同放养密度组间NO2--N浓度差异并不显著(P > 0.05)。
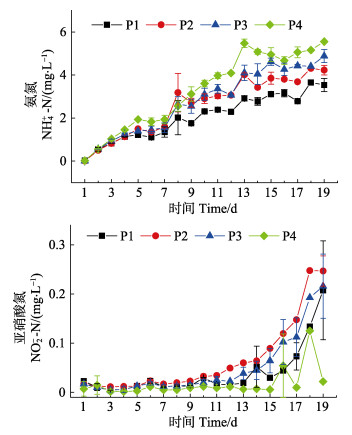
|
图 2 不同放养密度养殖池内水体氨氮和亚硝酸氮浓度变化 Fig.2 Variations of ammonia and nitrite concentrations of aquaculture water in ponds with different stocking densities |
实验前、中期(1~13 d),水体COD浓度呈上升趋势;实验后期(14~21 d),随着换水量的增加,水体COD浓度呈现下降的趋势(图 3)。实验结束时,各密度组水体COD浓度分别达到6.4、7.2、7.6和7.8 mg/L。COD浓度随放养密度的增加而有所增加,且不同密度组间差异显著(P < 0.05)。

|
图 3 不同放养密度养殖池内水体COD浓度的变化 Fig.3 Variations of COD concentrations of aquaculture water in ponds with different stocking densities |
实验前、中期,水体中弧菌浓度保持相对稳定,为(0.3~3.0)×104 CFU/ml;实验后期,受日换水量增加的影响,各实验组水体弧菌浓度存在一定程度的波动,其中,P4组波动最大(图 4)。实验结束时,各实验组水体弧菌浓度分别为2.3×104、1.8× 104、3.8×104和4.3×104 CFU/ml,弧菌浓度与养殖密度不存在相关性。
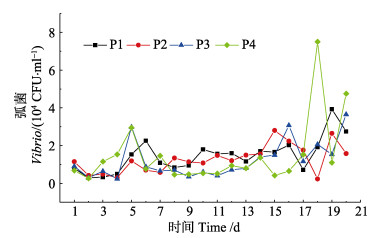
|
图 4 不同放养密度养殖池内水体弧菌浓度变化 Fig.4 Variations of Vibrio concentration of aquaculture water in ponds with different stocking densities |
香农指数在一定程度上可以反映水体中细菌的生物多样性,通常香农指数越大,说明其生物多样性越高(Cardona et al, 2016)。从图 5可以看出,各实验组间香农指数存在显著性差异(P < 0.05),其中,P1、P2组存在极显著差异(P < 0.01),P2组香农指数明显高于其他各组。总体而言,香农指数随养殖密度的升高呈现上升的趋势。
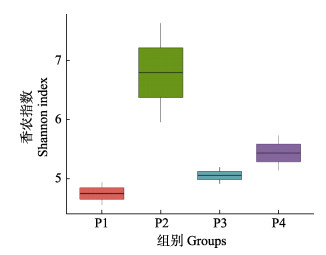
|
图 5 不同放养密度养殖池内水体细菌香农指数 Fig.5 Bacteria Shannon diversity index of aquaculture water in ponds with different stocking densities |
不同放养密度养殖池内细菌群落的主要组成见表 2。从表 2可以看出,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为各组水体的主要细菌门类。α-变形菌纲(Alphaproteobacteria)红杆菌科(Rhodobacteraceae)和γ-变形菌纲(Gammaproteobacteria)弧菌科(Vibrio)在变形菌门中分别占46%~81%和2%~23%。黄杆菌纲(Flavobacteriales)黄杆菌科(Flavobacteriales)、鞘氨醇杆菌纲(Sphingobacteriales)腐螺旋菌科(Saprospiraceae)和噬纤维菌纲(Cytophagales)Algorriphogus菌科分别占拟杆菌门的3%~13%、21%~44%和8%~62%。
|
|
表 2 不同放养密度养殖池内细菌群落的主要成分(门水平) Tab.2 Major component of the bacterial community in ponds with different stocking densities (Phyla) |
实验结束时,各实验组水体主要菌属的相对丰度见图 6。从图 6可以看出,P1组Algorriphogus的相对丰度最高(13.5%),弧菌属次之(5.1%);P2和P4组弧菌属的相对丰度最高(9.4%、8.1%),栖东海菌属(Donghicola)次之(5.3%、8.0%);P3组弧菌属相对丰度最高(2.3%),海命菌属(Marivita)次之(1.8%)。弧菌属在不同放养密度养殖池水体中均为优势菌属。
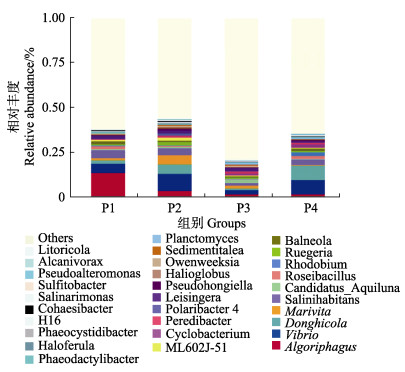
|
图 6 不同放养密度养殖池内主要细菌菌属的相对丰度 Fig.6 Relative abundance of major bacterial genus in ponds with different stocking densities |
SR及SGR是影响凡纳滨对虾YR的直接因素。因此,本研究以对虾YR来衡量凡纳滨对虾苗种中间培育效果。结果显示,在放养密度为1.5~2.25万尾/m3条件下,随着放养密度的增加,凡纳滨对虾SR、SGR及YR均逐渐升高。这与李纯厚等(2006)、李玉全等(2007)、衣萌萌等(2012)研究结果相悖,这主要是由于对虾苗种中间培育阶段对虾规格小、密度低,同时,因密度胁迫所产生的空间拥挤效应并不明显(Nga et al, 2005)。本研究结果显示,当放养密度为1.5~2.25万尾/m3时,适当提高养殖密度有利于提升凡纳滨对虾苗种中间培育效果。其主要原因在于本研究设定的放养密度范围内,当放养密度较高时,单位水体饵料投喂量较大,有利于对虾对饵料的摄取。因此,在凡纳滨对虾苗种中间培育实际工厂化养殖中,也可以将对虾苗种中间培育实际放养密度由1.5万尾/m3增加至2.25万尾/m3,以提高养殖对虾产量和增加养殖效益。
3.2 放养密度对养殖水体水质的影响养殖水体水质受饵料投喂、凡纳滨对虾生理活动(摄食、排泄、呼吸代谢等)以及水体微生物代谢的影响(刘娇等, 2008)。在对虾苗种中间培育过程中,对虾及微生物呼吸代谢产生的CO2积累,导致水体pH逐渐下降。放养密度和微生物丰度越高,水体pH下降越快。饵料是水体有机物负荷的主要来源,随着对虾养殖个体的增大和养殖密度的加大,饲喂量逐步提高,从而导致水体COD浓度的上升。饵料中蛋白质含量较高则是导致水体中NH4+-N和NO2--N浓度升高的主要原因。在对虾苗种中间培育期间,随着对虾养殖个体的增大和养殖密度的加大,饵料投喂量进一步加大,从而导致水体NH4+-N和NO2--N浓度的上升。本研究表明,放养密度较大的养殖池内水体pH较低,而NH4+-N和COD浓度较高,与丁美丽等(1997)研究的结果相吻合。
为避免水质恶化,换水是调节水质指标的有效措施,也是养殖企业最常用的方法。实验期间,随着凡纳滨对虾养殖个体的增大和养殖密度的加大而逐步提升换水量,最大换水量占总水体的33%,在一定程度上抑制水体pH的下降和COD浓度的升高,但对调节NH4+-N和NO2--N浓度作用有限。实验结束时,NH4+-N浓度达到3.53~5.80 mg/L,超出了姚庆祯等(2002)研究的对虾养殖安全浓度(0.79 mg/L),但是,实验过程中,尚未发现该浓度对凡纳滨对虾苗种生长和SR构成影响。结果显示,在本研究条件下,换水对养殖水体水质的调节能力有限。然而,增大换水量在增加生产成本的同时,也可能造成凡纳滨对虾产生应激反应,对其生长存活产生负面影响,因此,需要引入更加高效的对虾养殖模式(如生物絮团养殖、循环水养殖)为凡纳滨对虾养殖提供稳定的水质保证(张许光等, 2013)。
在对虾养殖过程中,弧菌往往作为致病菌或者条件致病菌存在,因而成为养殖水体检测的重要微生物指标(张彬等, 2015; 黄志坚等, 2016)。本研究表明,对虾放养密度与水体弧菌浓度无显著相关,这与Cao等(2013)的研究结果较吻合。实验后期,各实验组水体的弧菌浓度波动较大,这可能是由实验后期换水量较大所致。整个实验过程中,各养殖池水体弧菌浓度始终处在安全浓度以内(1.0×107 CFU/ml) (Gullian et al, 2004)。但是,弧菌浓度超标依然是工厂化养殖中对虾死亡的重要原因之一,其致病机理和安全浓度值得进一步研究。
3.3 放养密度对水体细菌多样性和群落结构的影响养殖水体细菌生物多样性和菌落结构受养殖生物种类、数量以及水体、水质等因素的影响。本研究结果表明,随放养密度的增大,养殖水体中细菌生物多样性总体上呈现上升趋势。这是因为放养密度较高时,水体中COD、NH4+-N和NO2--N浓度较高,为多种类型细菌的生长繁殖提供了较丰富的C源和N源(王以尧等, 2011; 陈琛等, 2016)。对虾放养密度不仅会影响养殖水体中细菌生物多样性,还会改变细菌的群落结构。本研究结果显示,在水体细菌属水平上,P1组内相对丰度最大的菌属为Algorriphogus属,而P2、P3、P4组为弧菌属;P1~P4组内相对丰度处在第2位的菌属分别为弧菌属、栖东海菌属、海命菌属和栖东海菌属。
养殖水体中,细菌生物多样性和菌落结构对凡纳滨对虾内部细菌的生长具有重要影响,并在对虾的营养利用、提高免疫力等方面发挥着重要作用(Luo et al, 2006; 李玉宏等, 2014)。在放养密度较高的养殖池水体中,细菌生物多样性也较高,这可以提高养殖系统的稳定性,降低致病菌或条件致病菌成为优势菌群的可能性,从而可能在一定程度上降低凡纳滨对虾的发病率。而且,良好的菌落组成可以降低水体有机物负荷,改善对虾肠道环境,从而提高对虾的免疫力和抗病力(Apún-Molina et al, 2017)。
4 结论在凡纳滨对虾苗种中间培育期间,放养密度(1.5~ 2.25万尾/m3)的增加提高了凡纳滨对虾的生长性能(产率、特定生长率、存活率及饵料转化率)。
随着放养密度的增加,养殖水体pH有所降低,而COD和NH4+-N浓度呈现上升的趋势。换水量较大时,稀释作用可以在一定程度上抑制养殖水体pH的下降及COD浓度的升高,但难以有效控制NH4+-N和NO2--N浓度的升高。
在凡纳滨对虾苗种中间培育期间,放养密度提高能有效提升养殖池内的细菌生物多样性;养殖池内主要的细菌门类为变形菌门和拟杆菌门,弧菌为养殖水体中的优势菌属。
Apún-Molina JP, Robles-Romo A, Alvarez-Ruiz P, et al. Influence of stocking density and exposure to white spot syndrome virus in biological performance, metabolic, immune, and bioenergetics response of whiteleg shrimp Litopenaeus vannamei. Aquaculture, 2017, 479: 528-537 DOI:10.1016/j.aquaculture.2017.06.027 |
Bokulich NA, Subramanian S, Faith JJ, et al. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing. Nature Methods, 2013, 10(1): 57-59 DOI:10.1038/nmeth.2276 |
Cao YC, Wen GL, Li ZJ, et al. Effects of dominant microalgae species and bacterial quantity on shrimp production in the final culture season. Journal of Applied Phycology, 2014, 26(4): 1749-1757 DOI:10.1007/s10811-013-0195-0 |
Caporaso JG, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336 DOI:10.1038/nmeth.f.303 |
Cardona E, Gueguen Y, Magré K, et al. Bacterial community characterization of water and intestine of the shrimp Litopenaeus stylirostris in a biofloc system. BMC Microbiology, 2016, 16(1): 157-165 DOI:10.1186/s12866-016-0770-z |
Cen BM. Analysis of production technology of Penaeus vannamei in pond culturing. Journal of Ningbo University (Natural Science and Engineering Edition), 2010, 23(4): 47-50 [ 岑伯明. 南美白对虾池塘养殖生产状况的调查与分析. 宁波大学学报(理工版), 2010, 23(4): 47-50 DOI:10.3969/j.issn.1001-5132.2010.04.010] |
Chen C, Yan MC, Zhang X, et al. Dynamics of the bacterial community in rearing water from an intensive pond containing different stocking densities of Litopenaeus vannamei. Journal of Fishery Sciences of China, 2016, 23(4): 985-993 [ 陈琛, 闫茂仓, 张翔, 等. 凡纳滨对虾不同养殖密度高位池水体细菌群落动态. 中国水产科学, 2016, 23(4): 985-993] |
Ding ML, Lin L, Li GY, et al. Effect of organic pollution on Penaeus chinensis body's intraenvironment and externalenvironment. Oceanologia et Limnologia Sinica, 1997, 28(1): 7-11 [ 丁美丽, 林林, 李光友, 等. 有机污染对中国对虾体内外环境影响的研究. 海洋与湖沼, 1997, 28(1): 7-11 DOI:10.3321/j.issn:0029-814X.1997.01.002] |
Dong SL, Pan KH. Review on effects of mariculture on coastal environment. Journal of Ocean University of Qingdao, 2000, 30(4): 575-582 [ 董双林, 潘克厚. 海水养殖对沿岸生态环境影响的研究进展. 青岛海洋大学学报, 2000, 30(4): 575-582 DOI:10.3969/j.issn.1672-5174.2000.04.030] |
Edgar RC, Haas BJ, Clemente JC, et al. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 2011, 27(16): 2194-2200 DOI:10.1093/bioinformatics/btr381 |
Edgar RC. UPARSE: Highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 2013, 10(10): 996-998 DOI:10.1038/nmeth.2604 |
Gao X, Jing HJ, Zhao W, et al. Community structure of plankton and water quality in marine high-place ponds with Pacific white leg shrimp Litopenaeus vannamei culture. Journal of Dalian Ocean University, 2017, 32(1): 44-50 [ 高欣, 景泓杰, 赵文, 等. 凡纳滨对虾高位养殖池塘浮游生物群落结构及水质特征. 大连海洋大学学报, 2017, 32(1): 44-50] |
Gullian M, Thompson F, Rodriguez J. Selection of probiotic bacteria and study of their immunostimulatory effect in Penaeus vannamei. Aquaculture, 2004, 233(1): 1-14 |
Haas BJ, Gevers D, Earl AM, et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons. Genome Research, 2011, 21(3): 494-504 |
Huang ZJ, Chen YG, Weng SP, et al. Multiple bacteria species were involved in hepatopancreas necrosis syndrome (HPNS) of Litopenaeus vannamei. Acta Scientiaurum Naturalium Universitatis Sunyatseni (Natural Sciences), 2016, 55(1): 1-11 [ 黄志坚, 陈勇贵, 翁少萍, 等. 多种细菌与凡纳滨对虾肝胰腺坏死症(HPNS)爆发有关. 中山大学学报(自然科学版), 2016, 55(1): 1-11] |
Li CH, Qin HG, Jia XP, et al. The effect of density on energy conversion efficiency of juvenile shrimp Litopenaeus vannamei. South China Fisheries Science, 2006, 2(1): 30-33 [ 李纯厚, 秦红贵, 贾晓平, 等. 养殖密度对凡纳滨对虾能量转换效率的影响研究. 南方水产科学, 2006, 2(1): 30-33 DOI:10.3969/j.issn.2095-0780.2006.01.006] |
Li YH, Chai PC, Hu XG, et al. Analysis of intestinal microecology of Litopenaaeus vannamei in industrial aquaculture by RFLP and DGGE techniques. Progress in Fishery Sciences, 2014, 35(2): 83-89 [ 李玉宏, 柴鹏程, 胡修贵, 等. 应用RFLP和DGGE技术分析工厂化养殖凡纳滨对虾肠道微生物群落特征. 渔业科学进展, 2014, 35(2): 83-89 DOI:10.3969/j.issn.1000-7075.2014.02.012] |
Li YQ, Li J, Wang QY, et al. Effects of intensity-stress on the growth and non-specific immunity factors of Litopenaeus vannamei. Scientia Agricultura Sinica, 2007, 40(9): 2091-2096 [ 李玉全, 李健, 王清印, 等. 密度胁迫对凡纳滨对虾生长及非特异性免疫因子的影响. 中国农业科学, 2007, 40(9): 2091-2096 DOI:10.3321/j.issn:0578-1752.2007.09.033] |
Liu J, Qu KM, Liu HY, et al. Studies on features of water environment in industrialized shrimp culture system. Marine Fisheries Research, 2008, 29(6): 1-8 [ 刘娇, 曲克明, 刘海英, 等. 对虾工厂化养殖水环境基本特征研究. 海洋水产研究, 2008, 29(6): 1-8] |
Luo P, Hu C, Xie Z, et al. PCR-DGGE analysis of bacterial community composition in brackish water Litopenaeus vannamei culture system. Journal of Tropical Oceanography., 2006, 25(2): 49-53 |
Magoč T, Salzberg SL. FLASH: Fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963 DOI:10.1093/bioinformatics/btr507 |
Nga BT, Lürling M, Peeters E, et al. Chemical and physical effects of crowding on growth and survival of Penaeus monodon fabricius post-larvae. Aquaculture, 2005, 246(1): 455-465 |
Qu KM, Li BS. A review on ecological environment of shrimp culture. Marine Fisheries Research, 2000, 21(3): 67-71 [ 曲克明, 李勃生. 对虾养殖生态环境的研究现状和展望. 海洋水产研究, 2000, 21(3): 67-71] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: Improved data processing and web- based tools. Nucleic Acids Research, 2013, 41(1): 590-596 |
Shen MM, Li J, Wang QY, et al. Analysis of the Microalgae Community in Industrial Aquaculture Ponds of Pacific White Shrimp (Litopenaeus vannamei). Progress of Fishery Sciences, 2017, 38(5): 64-72 [ 沈明明, 李健, 王清印, 等. 凡纳滨对虾(Litopenaeus vannamei)工厂化养殖系统微藻的群落特征分析. 渔业科学进展, 2017, 38(5): 64-72] |
Wang F, Lei JL, Gao CR, et al. Review of industrial recirculating aquaculture research at home and abroad. Journal of Fishery Sciences of China, 2013, 20(5): 1100-1111 [ 王峰, 雷霁霖, 高淳仁, 等. 国内外工厂化循环水养殖研究进展. 中国水产科学, 2013, 20(5): 1100-1111] |
Wang Q, Garrity GM, Tiedje JM, et al. Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267 DOI:10.1128/AEM.00062-07 |
Wang YY, Luo GQ, Zhang ZY. Effect of feeding frequency on the NH4+-N level in the recirculating aquaculture system. Fishery Modernization, 2014, 38(5): 706-712 |
王以尧, 罗国强, 张哲勇. 投喂频率对循环水养殖系统氨氮浓度的影响. 渔业现代化, 2011, 38(1): 706-712 |
Wu C, Li KY. A comparison of industrialized culture and pond fine culture of shrimp. Chinese Fisheries Economics, 2011, 29(2): 126-133 [ 吴晨, 李孔岳. 对虾工厂化养殖与池塘精细养殖模式的比较. 中国渔业经济, 2011, 29(2): 126-133 DOI:10.3969/j.issn.1009-590X.2011.02.020] |
Yao QZ, Zang WL, Dai XL, et al. Toxic effects of nitrite and ammonia on Penaeus vannamei larvae and Penaeus japonicus larvae. Journal of Shanghai Fisheries University, 2002, 11(1): 21-26 [ 姚庆祯, 臧维玲, 戴习林, 等. 亚硝酸盐和氨对凡纳对虾和日本对虾幼体的毒性作用. 上海水产大学学报, 2002, 11(1): 21-26] |
Yi MM, Yu HN, Lin XT, et al. Effects of stocking densities on behavior and physiological activity in Litopenaeus vannamei. Journal of Jinan University(Natural Science), 2012, 33(1): 81-86 [ 衣萌萌, 于赫男, 林小涛, 等. 密度胁迫下凡纳滨对虾的行为与生理变化. 暨南大学学报(自然科学版), 2012, 33(1): 81-86] |
Zhang B, He PP, Wei PY, et al. Preliminary study on pathogeny associated with sustained death in parent shrimp of Litopenaeus vannamei. Southwest China Journal of Agricultural Sciences, 2015, 28(6): 2798-2802 [ 张彬, 何苹萍, 韦嫔媛, 等. 凡纳滨对虾亲虾持续性死亡病因的初步研究. 西南农业学报, 2015, 28(6): 2798-2802] |
Zhang TS, Kong J, Liu P, et al. Effect of diet and stocking density on growth and survivorship of juvenile shrimp Fenneropenaeus chinensis. Marine Fisheries Research, 2008, 29(3): 41-47 [ 张天时, 孔杰, 刘萍, 等. 饵料和养殖密度对中国对虾幼虾生长及存活率的影响. 海洋水产研究, 2008, 29(3): 41-47] |
Zhang XG, Zhao P, Wang GC, et al. The environmental and production effect of bio-floc aquaculture of Litopenaeus vannamei at different stocking densities. Progress in Fishery Science, 2013, 4(3): 111-119 [ 张许光, 赵培, 王国成, 等. 不同放苗密度凡纳滨对虾生物絮团养殖的环境和产出效应. 渔业科学进展, 2013, 4(3): 111-119 DOI:10.3969/j.issn.1000-7075.2013.03.015] |



