2. 广东省珍珠养殖与加工工程技术研究中心 湛江 524088
2. Pearl Breeding and Processing Engineering Technology Research Center of Guangdong Province, Zhanjiang 524088
由非碳水化合物转变为葡萄糖或糖原的过程称为糖异生(Gluconeogenesis),糖异生是增加葡萄糖产生的一个主要途径(Cota-Ruiz et al, 2015)。果糖-1, 6-二磷酸酶(Fructose 1, 6-bisphosphatase, FBP)又称果糖1, 6-二磷酸酯酶,它催化果糖-1, 6-二磷酸水解生成果糖-6-磷酸和无机磷,在糖的异生代谢过程中起关键性的作用(Lozinska-Gabska et al, 2003; Kaiser et al, 1996)。FBP几乎存在于所有生物体中,包括细菌、真菌、植物和动物,但不存在于有异源蛋白的古细菌中(Stec et al, 2000)。已有研究表明,在高温、干旱(Xiao et al, 2014; 曲玲等, 2015)和缺氧(Cota-Ruiz et al, 2016)等非生物胁迫下,FBP通过参与催化动植物体能量产生途径产生更多的能量,在动植物体度过不良环境过程中起着重要的作用。第一个被人们所知的FBP序列全长是从小鼠(Rattus norvegicus)中克隆得到(el-Maghrabi et al, 1988)。已有关于部分水产经济动物FBP的研究报道,如凡纳滨对虾(Litopenaeus vannamei)的肝胰腺具有糖异生的能力(Rosas et al, 1999);大菱鲆(Scophthalmus maximus)在不同喂食情况下,其FBP在各个组织中的表达量不同(Nie et al, 2015);银鲫(Carassius auratus gibelio)被证实存在肝脏型和肌肉型2种FBP同工酶(王锐等, 2010)等。目前,尚未有贝类FBP的报道。关于FBP在温度胁迫条件下的研究主要集中于植物(徐文亭等, 2013; 何斌等, 2015; 陈虎等, 2016; 曲玲等, 2015),贝类FBP基因的相关功能有待进一步的研究。
贝类属于变温动物,温度的变化对贝类的生命活动有显著的影响(Kim et al, 2009; Cotter et al, 2010; Ivanina et al, 2013)。马氏珠母贝(Pinctada fucata martensii)又称合浦珠母贝,是中国海水珍珠养殖的主要品种,广泛分布于广东、广西和海南沿海等地,具有重要的经济价值(田荣荣等, 2015)。昼夜温差的变化、一年四季的更替及无法控制的自然灾害带来的温度骤变都会对马氏珠母贝造成很大的负面影响。目前,有关马氏珠母贝对温度变化的响应机制研究较少。本研究采用RACE技术获得Pm-FBP的基因序列全长,并研究了其在不同温度下的时序表达模式,以期为深入研究马氏珠母贝温度胁迫的响应机制提供基础资料。
1 材料与方法 1.1 实验材料本研究所用的马氏珠母贝采自广东省雷州市后洪村海区,将贝体表面的附着物清理干净后运回实验室,22℃暂养2 d后,选取鳞片旺盛、活力正常的马氏珠母贝用于实验,实验贝壳长为(69.23±3.80) mm。其中,随机取6只马氏珠母贝的全组织,包括闭壳肌、鳃、性腺、肝胰腺、足和外套膜,经液氮速冻后置于–80℃冰箱备用。
150只马氏珠母贝随机分为3组,分别置于3个300 L的实验桶中,微充气养殖,水温分别设为17℃(低温组)、22℃(对照组)和32℃(高温组),养殖过程中每天投喂等量的单胞藻,每天换水50%。在实验养殖开始后6 h、24 h、72 h和120 h,分别从每个实验桶中随机取8个个体,剪取鳃组织,经液氮速冻后置于–80℃冰箱保存。
1.2 主要试剂Trizol、SYBR Select Master Mix和GeneJET Gel Extraction购买于Life Technologies公司;DH5α大肠杆菌(Escherichia coli)以及RACE试剂盒(Clontech)购买于TaKaRa公司;其他试剂均为国产分析纯。
1.3 Pm-FBP全长克隆 1.3.1 总RNA提取及cDNA第一链合成采用Trizol法分别提取马氏珠母贝闭壳肌、鳃、性腺、肝胰腺、足和外套膜的总RNA。3' RACE和5' RACE模板的制备参考SMARTTM RACE cDNA Amplification Kit试剂盒说明书。
1.3.2 引物设计实验采用Primer Premier 5.0软件设计了实验所需引物,引物序列见表 1。
|
|
表 1 引物序列 Tab.1 Primer sequences |
利用引物Pm-FBP-F/Pm-FBP-R进行Pm-FBP中间片段的扩增。PCR产物用1%的琼脂糖凝胶电泳检测,将与目的片段长度一致的PCR产物和载体pMD18-T连接,连接产物转化到DH5α感受态细胞中,用氨苄青霉素选择培养基培养后,挑取阳性菌送往生工生物工程(上海)股份有限公司测序。将测序获得的Pm-FBP中间片段、3'和5'序列与马氏珠母贝基因组(Du et al, 2017)中已知的部分进行比对,利用软件将获得的Pm-FBP中间片段与3'和5'的序列片段进行拼接,最终得到Pm-FBP全长序列。
1.3.4 Pm-FBP的生物信息学分析利用SMART在线分析工具确定本研究克隆所得的cDNA序列为FBP基因;利用DNAMAN软件进行氨基酸序列推导;ORF Finder软件找到Pm-FBP的开放阅读框;ExPASy- ProtParam tool进行氨基酸的理化性质分析(王玉红等, 2018);SignalP 4.1软件进行信号肽的预测;TMHMM Server软件分析氨基酸的跨膜结构(王修芳等, 2016);SWISS-MODEL软件进行氨基酸三级结构分析(曲玲等, 2015);通过多序列比对,将Pm-FBP与部分已知物种的FBP氨基酸序列进行同源性分析;利用Mega 6.0构建生物系统进化树(王竹青等, 2018)。
1.3.5 Pm-FBP在各组织以及不同温度下鳃中的时序表达差异本研究以β-actin为内参基因,利用2–ΔΔCt法计算Pm-FBP基因在不同组织以及实验温度下各时间点的相对表达量,分别以外套膜和22℃组为对照进行标准化处理以后,利用SPSS软件以进行单因素方差分析(One-way ANOVA)、组间表达量均值比较和Duncan多重比较(P < 0.05)。
2 结果与分析 2.1 Pm-FBP序列分析本研究通过RACE技术获得了Pm-FBP的全长序列。Pm-FBP总长为1381 bp,5' UTR为54 bp,3' UTR为62 bp,开放阅读框(ORF)为1020 bp,编码339个氨基酸(图 1)。Pm-FBP无信号肽,无跨膜结构,具有FBP保守的FBPase结构域,1个潜在的N-糖基化位点,6个潜在的O-连接糖基化位点(Ser36、Ser56、Ser57、Ser76、Ser80和Thr115),46个磷酸化位点。

|
图 1 Pm-FBP的核苷酸序列分析 Fig.1 The nucleotide sequence analysis of Pm-FBP 5'和3'非编码区用小写字母表示;开放阅读框及推导的氨基酸序列用大写字母表示;阴影部分为保守结构域Pfam FBPase;下划线表示6个O-连接糖基化位点;双下划线表示N-糖基化位点;加粗字体表示金属离子结合位点 5' UTR and 3' UTR are indicated with small letters; Open reading frame and the deduced amino acid sequences are indicated with capital letters; The shaded portion is conserved domains of Pfam FBPase; The six O-linked glycosylation sites are underlined; Double underline denotes N-glycosylation site; The bold font represents the metal ion binding site |
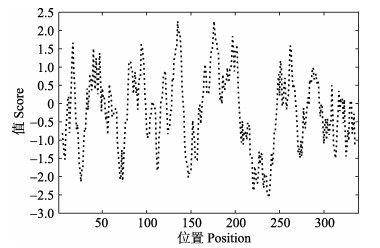
Pm-FBP的理论分子量为37.13 kDa,等电点为6.02。其中,含量较高的氨基酸有Gly (G) 8.8%,Ser (S) 8.6%,Leu (L) 8.0%;带负电的残基总数(Asp+Glu)为40个,正电的残基总数(Arg+Lys)为37个;脂溶指数是86.58,平均亲水性(Grand average of hydropathicity, GRAVY)为–0.211,为亲水性蛋白(图 2)。FBP的二级结构预测结果显示,α螺旋结构占整体的30.97%,β转角为11.50%,延伸链为22.71%,无规则卷曲为34.81%。
|
图 2 Pm-FBP的疏水性 Fig.2 The hydrophobicity of Pm-FBP |
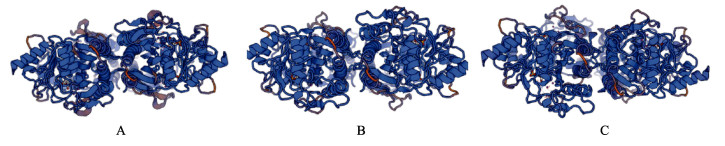
为确定Pm-FBP与其他物种的同源性,将Pm-FBP与长牡蛎(Crassostrea gigas)、虾夷扇贝(Mizuhopecten yessoensis)、文昌鱼(Branchiostoma belcheri)和果蝇(Drosophila elegans)的FBP序列进行比对,结果显示,Pm-FBP与长牡蛎FBP相似度最高,为83% (图 3)。对Pm-FBP进行三级结构的预测,与长牡蛎、虾夷扇贝FBP的三级结构进行比较分析,发现三者的相似性极高,都以无规则卷曲为主(图 4),说明FBP在三维结构上的保守性较高。

|
图 3 Pm-FBP的多序列比对 Fig.3 Multisequence alignment of Pm-FBP “*”表示保守的氨基酸;“:”表示具有强烈相似性的氨基酸;“.”表示具有弱相似性的氨基酸 "*" indicates the conserved amino acid; ":" indicates amino acids with strong similarities; "." indicates amino acids with weak similarities |
|
图 4 马氏珠母贝(A)、长牡蛎(B)和虾夷扇贝(C) FBP蛋白质分子结构 Fig.4 The spatial structure of FBP Protein molecules in P. fucata martensii (A), C. gigas (B) and M. yessoensis (C) |
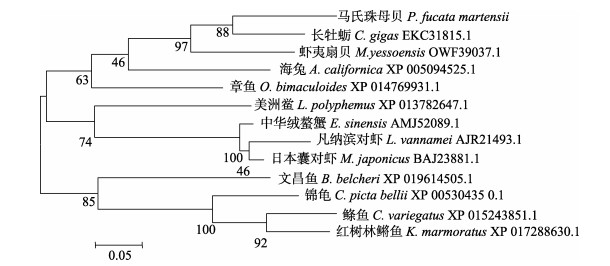
将Pm-FBP与长牡蛎、虾夷扇贝、章鱼(Octopus bimaculoides)、海兔(Aplysia californica)、美洲鲎(Limulus polyphemus)、中华绒螯蟹(Eriocheir sinensis)、凡纳滨对虾、日本囊对虾(Marsupenaeus japonicus)、文昌鱼、锦龟(Chrysemys picta bellii)、鲦鱼(Cyprinodon variegatus)、红树林鳉鱼(Kryptolebias marmoratus)的FBP基因序列建立系统进化树,结果显示,FBP先与长牡蛎、虾夷扇贝汇聚一支,再与其他软体动物汇聚成一支,节肢动物和脊椎动物分别汇聚成两支(图 5),这与传统的分类基本一致。
|
图 5 Pm-FBP的系统进化树 Fig.5 The phylogenetic tree of Pm-FBP |
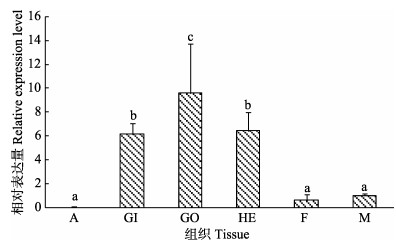
本研究通过实时荧光定量PCR技术检测Pm-FBP在马氏珠母贝闭壳肌、鳃、性腺、肝胰腺、足和外套膜的表达情况,结果如图 6所示,Pm-FBP基因在不同组织中表达量的变化从高到低依次为GO > HE > GI > M > F > A,Pm-FBP在性腺中表达量最高(P < 0.05),其次是肝胰腺和鳃,足和外套膜的表达量较低,闭壳肌中几乎不表达。
|
图 6 Pm-FBP在马氏珠母贝不同组织中的表达分布 Fig.6 Pm-FBP gene expression profiles in different tissues of P. fucata martensii A:闭壳肌;GI:鳃;GO:性腺;HE:肝胰腺;F:足;M:外套膜。不同字母代表差异显著(P < 0.05),下同 A: Adductor muscle; GI: Gill; GO: Gonads; HE: Hepatopancreas; F: Foot; M: Mantle. Different letters represent significant difference (P < 0.05), the same as below |
实验采用实时荧光定量PCR技术检测了Pm-FBP在鳃中的表达量,结果显示,Pm-FBP在高温组和低温组的表达量都出现了先升高后降低的趋势,且均在72 h时达到最大值(P < 0.05),由此可推测,该基因与马氏珠母贝环境温度胁迫存在很强的相关性;120 h时,高温组和低温组Pm-FBP表达量均显著下降(P < 0.05),说明Pm-FBP很可能主要在短期温度胁迫中起重要作用(图 7)。

|
图 7 不同温度下马氏珠母贝鳃中Pm-FBP基因的时序表达 Fig.7 Temporal expression of the Pm-FBP gene in the gills of P. fucata martensii at 17℃, 22℃, and 32℃ 大写字母表示同一时间点、不同实验组间的Pm-FBP表达量的统计结果;小写字母为不同时间点、相同实验组间Pm-FBP表达量的统计结果 Capital letters indicate the statistical results of Pm-FBP expression levels at the same time point in different experimental groups; Lowercase letters are the statistical results of the Pm-FBP expression levels in the same experimental group at different time points |
本研究利用RACE技术克隆获得Pm-FBP全长序列,该基因全长为1381 bp,共编码339个氨基酸。Pm-FBP具有FBP共有的一个保守结构域Pfam FBPase(曲玲等, 2015; Cota-Ruiz et al, 2015),证实了本研究克隆所得到的序列为Pm-FBP。FBP是糖异生过程中的关键酶,受到异构调节、共价修饰和激素等机制的共同调节(王锐等, 2010)。其中,共价修饰又包括蛋白的磷酸化和去磷酸化(Wang et al, 2017)。Pm-FBP中存在46个磷酸化位点、6个O-连接糖基化位点和1个N-糖基化位点,也说明FBP可能通过蛋白质磷酸化修饰和糖基化来行使其蛋白功能(陈虎等, 2016)。此外,Pm-FBP中存在1个FBPase序列基序DPLDGSS (Asp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Ser),此基序已被证明能够结合金属离子参与催化(York et al, 1995),与FBPase需要金属离子催化的结论相符(Serrato et al, 2009; Rakus et al, 2013)。序列比对结果表明,Pm-FBP与长牡蛎FBP同源性最高,为83%;Pm-FBP与长牡蛎、虾夷扇贝的FBP三级结构极为相似,说明Pm-FBP在双壳类动物进化过程中相对保守。
实时荧光定量PCR结果显示,Pm-FBP在肝胰腺有较高水平的表达,与大菱鲆(Nie et al, 2015)、银鲫(王锐等, 2010)的研究结果一致。此外,研究表明,贝类处于繁殖期时,需要大量的能量储备用于精卵发育。在性腺发育过程中,贝体摄食获得的粗蛋白和粗脂肪含量随着精卵细胞的发育成熟不断增加,然后在休止期大量流失,糖类的含量在增殖期开始下降,成熟期达到最低,排放期后急剧升高,贝体肥满度及生化成分变化与繁殖周期的变化有着密切的关系(程亮等, 2013; Mendo et al, 2016)。本研究发现,Pm-FBP在性腺中高表达(P < 0.05),说明FBP作为能量产生途径的关键酶,可能参与了性腺发育过程中的能量提供。
温度胁迫对贝类生理代谢具有显著影响。研究表明,海水温度剧烈变化时,急剧的水温变化对虾夷扇贝(吴彪等, 2016; 高振锟等, 2017)、栉孔扇贝(Azumapecten farreri)(Jiang et al, 2017)和文蛤(Meretrix meretrix L)(冯建彬等, 2004)等海洋贝类的摄食能力、呼吸及排泄等均有较大影响。此外,温度能够直接影响贝体的新陈代谢活动,进而影响贝体的能量收支和生长过程(姜娓娓等, 2017)。糖异生作用是在机体处于饥饿状态下,各种非糖苷底物经过一系列酶促反应合成内源性葡萄糖的过程,以保证机体的血糖处于正常水平(宫官等, 2013)。FBP作为催化糖异生过程中的限速酶,关于FBP应对温度胁迫的研究主要集中在植物(徐文亭等, 2013; 何斌等, 2015),贝类中关于温度胁迫与FBP的关系尚未明确。鳃是贝类的重要的代谢器官,具有呼吸和滤食等多种功能。作为与外界接触的器官,水温的变化能够直接影响鳃的功能以及作用。本研究采用实时荧光定量PCR技术检测了Pm-FBP在低温组、对照组和高温组马氏珠母贝鳃的时序表达模式。结果表明,Pm-FBP表达量在高温组和低温组都出现了先升高后降低的趋势,且均在72 h时达到最大值(P < 0.05),由此可推测,该基因与马氏珠母贝生存环境温度和胁迫存在很强相关性;120 h时高温组和低温组Pm-FBP表达量均显著下降(P < 0.05),这说明Pm-FBP很可能主要在短期温度胁迫中起重要作用。在植物体处于高温情况下,FBP基因在短期会有一个应激上调的过程,但在长期高温情况下,FBP表达会趋于稳定(陈虎等, 2016; 曲玲等, 2015),与本研究的高温组结果一致。推测贝体处于温度胁迫条件下,机体代谢水平下降,总糖含量处于较低水平,FBP通过参与糖异生过程使马氏珠母贝机体的糖含量处于正常水平。本研究结果证明了Pm-FBP基因可能是马氏珠母贝在适应温度骤变环境过程中的重要基因,为马氏珠母贝抗逆基因筛选以及温度胁迫响应机制的深入研究提供参考资料。
Chen H, Tan JH, Yan PD, et al. Cloning and expression analysis of PmFBP gene in Pinus massoniana. Guangxi Forestry Science, 2016, 45(1): 12-18 [ 陈虎, 谭健晖, 颜培栋, 等. 马尾松果糖-1, 6-二磷酸酶基因克隆及表达模式分析. 广西林业科学, 2016, 45(1): 12-18 DOI:10.3969/j.issn.1006-1126.2016.01.003] |
Cheng L, Xu SL, Liu F, et al. Study on the meat condition index and biochemical compositions of Mytilus coruscus in different gonad development stages. Journal of Marine Sciences, 2013, 31(4): 68-73 [ 程亮, 徐善良, 刘飞, 等. 厚壳贻贝性腺不同发育时期肥满度与生化成分分析. 海洋学研究, 2013, 31(4): 68-73 DOI:10.3969/j.issn.1001-909X.2013.04.011] |
Cota-Ruiz K, Leyva-carrillo L, Peregrino-Uriarte AB, et al. Role of HIF-1 on phosphofructokinase and fructose 1, 6-bisphosphatase expression during hypoxia in the white shrimp Litopenaeus vannamei. Comparative Biochemistry and Physiology, Part A Molecular & Integrative Physiology, 2016, 198: 1-7 |
Cota-Ruiz K, Peregrino-Uriarte AB, Felix-Portillo M, et al. Expression of fructose 1, 6-bisphosphatase and phosphofructokinase is induced in hepatopancreas of the white shrimp Litopenaeus vannamei by hypoxia. Marine Environmental Research, 2015, 106(1): 1-9 |
Cotter E, Malham SK, O′keeffe S, et al. Summer mortality of the Pacific oyster Crassostrea gigas, in the Irish Sea: The influence of growth, biochemistry and gametogenesis. Aquaculture, 2010, 303(1-4): 8-21 DOI:10.1016/j.aquaculture.2010.02.030 |
Du X, Fan G, Jiao Y, et al. The pearl oyster Pinctada fucata martensii genome and multi-omic analyses provide insights into biomineralization. GigaScience, 2017, 6(8): 1-12 |
el-Maghrabi MR, Pilkis J, Marker AJ, et al. cDNA sequence of rat liver fructose-1, 6-bisphosphatase and evidence for down-regulation of its mRNA by insulin. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(22): 8430-8434 DOI:10.1073/pnas.85.22.8430 |
Feng JB, Wang MZ, Chen HC, et al. Effects of temperature and body size on oxygen consumption rate of Meretrix meretrix. Journal of Shanghai Fisheries University, 2004, 13(2): 126-129 [ 冯建彬, 王美珍, 陈汉春, 等. 温度和规格对文蛤耗氧率的影响. 上海水产大学学报, 2004, 13(2): 126-129] |
Gao ZK, Zhang JH, Li M, et al. Effects of temperature fluctuation on physiological and immune parameters of scallop (Patinopecten yessoensis). Progress in Fishery Sciences, 2017, 38(3): 148-154 [ 高振锟, 张继红, 李敏, 等. 温度波动对不同规格虾夷扇贝(Patinopecten yessoensis)生理和免疫指标的影响. 渔业科学进展, 2017, 38(3): 148-154] |
Gong G, Xue M, Wang J, et al. Cloning and sequence analysis of full-length cDNAs of key enzymes of gluconeogenesis in Siberian sturgeon (Acipenser baerii). Chinese Journal of Animal Nutrition, 2013, 25(7): 1504-1518 [ 宫官, 薛敏, 王嘉, 等. 西伯利亚鲟糖异生途径关键酶基因全长cDNA的克隆和序列分析. 动物营养学报, 2013, 25(7): 1504-1518 DOI:10.3969/j.issn.1006-267x.2013.07.015] |
He B, Zhu JH, Long XY, et al. Cloning and expression analysis of a chloroplast fructose-1, 6-bisphosphatase gene in Hevea brasiliensis. Chinese Journal of Tropical Crops, 2015, 36(3): 448-455 [ 何斌, 朱晋恒, 龙翔宇, 等. 巴西橡胶树叶绿体型果糖-1, 6-二磷酸酶基因的全长cDNA克隆与表达分析. 热带作物学报, 2015, 36(3): 448-455 DOI:10.3969/j.issn.1000-2561.2015.03.002] |
Ivanina AV, Dickinson GH, Matoo OB, et al. Interactive effects of elevated temperature and CO2 levels on energy metabolism and biomineralization of marine bivalves Crassostrea virginica and Mercenaria mercenaria. Comparative Biochemistry and Physiology Part A Molecular & Integrative Physiology, 2013, 166(1): 101-111 |
Jiang W, Jiang Z, Du M, et al. Physiological and biochemical responses of Zhikong scallop, Chlamys farreri, to different thermal stressors. Aquaculture Research, 2017, 48(9): 4783-4797 DOI:10.1111/are.2017.48.issue-9 |
Jiang WW, Fang JG, Li JQ, et al. Effects of temperature change on physiological and biochemical activities of Haliotis discus hannai Ino. Journal of Fishery Sciences of China, 2017, 24(2): 220-230 [ 姜娓娓, 方建光, 李加琦, 等. 温度胁迫对皱纹盘鲍生理和生化活动的影响. 中国水产科学, 2017, 24(2): 220-230] |
Kaiser R, Olsson H, Erman M, et al. Fructose-1, 6-bisphosphatase. Primary structure of the rabbit liver enzyme. 'Intermediate' variability of an oligomeric protein. FEBS Letters, 1996, 389(3): 249-252 |
Kim M, Ahn IY, Cheon J, et al. Molecular cloning and thermal stress-induced expression of a pi-class glutathione S-transferase (GST) in the Antarctic bivalve Laternula elliptica. Comparative Biochemistry and Physiology Part A Molecular & Integrative Physiology, 2009, 152(2): 207-213 |
Lozinska-Gabska M, Dziewulska-Szwajkowska D, Szalagan E. Isolation of fructose-1, 6-bisphosphatase from the foot muscle of a snail Helix aspersa maxima. Zoologica Poloniae, 2003, 48(1-4): 81-91 |
Mendo T, Semmens JM, Lyle JM, et al. Reproductive strategies and energy sources fuelling reproductive growth in a protracted spawner. Marine Biology, 2016, 163: 2 DOI:10.1007/s00227-015-2785-7 |
Nie Q, Miao H, Miao S, et al. Effects of dietary glucose and dextrin on activity and gene expression of glucokinase and fructose-1, 6-bisphosphatase in liver of turbot Scophthalmus maximus. Fish Physiology and Biochemistry, 2015, 41(3): 819-832 DOI:10.1007/s10695-015-0049-6 |
Qu L, Xu Y, Ji DH, et al. Cloning and expression analysis of the cytosolic fructose-1, 6-bisphosphatase gene from Pyropia haitanensis. Journal of Applied Oceanography, 2015, 34(3): 402-410 [ 曲玲, 徐燕, 纪德华, 等. 坛紫菜细胞质型果糖1, 6-二磷酸酶基因的克隆及表达分析. 应用海洋学学报, 2015, 34(3): 402-410 DOI:10.3969/J.ISSN.2095-4972.2015.03.013] |
Rakus D, Gizak A, Kasprzak AA, et al. The mechanism of calcium-induced inhibition of muscle fructose 1, 6-bisphosphatase and destabilization of glyconeogenic complex. PLoS One, 2013, 8(10): e76669 DOI:10.1371/journal.pone.0076669 |
Rosas C, Martinez E, Gaxiola G, et al. The effect of dissolved oxygen and salinity on oxygen consumption, ammonia excretion and osmotic pressure of Penaeus setiferus (Linnaeus) juveniles. Journal of Experimental Marine Biology and Ecology, 1999, 234(1): 41-57 DOI:10.1016/S0022-0981(98)00139-7 |
Serrato AJ, de Dios Barajas-López JD, Chueca A, et al. Changing sugar partitioning in FBPase-manipulated plants. Journal of Experimental Botany, 2009, 60(10): 2923-2931 DOI:10.1093/jxb/erp066 |
Stec B, Yang H, Johnson KA, et al. MJ0109 is an enzyme that is both an inositol monophosphatase and the 'missing' archaeal fructose-1, 6-bisphosphatase. Nature Structural Biology, 2000, 7(11): 1046-1050 DOI:10.1038/80968 |
Tian RR, Tian QL, Du XD, et al. Molecular characterization and tissue specific expression of SRF gene from Pinctada martensii. Genomics & Applied Biology, 2015, 34(2): 272-278 [ 田荣荣, 田群莉, 杜晓东, 等. 马氏珠母贝SRF基因的分子特征及组织特异性表达. 基因组学与应用生物学, 2015, 34(2): 272-278] |
Wang J, Wang Z, Ling B, et al. Identification of a potential proton donor to the linking oxygen atom in a three-metal ion assisted catalysis pathway catalyzed by fructose-1, 6-bisphosphatase. Journal of Molecular Graphics & Modelling, 2017, 73: 191-199 |
Wang R, Xiao Q, Gui JF. Molecular cloning and expression analysis of fructose-1, 6-bisphosphatase in gibel carp. Acta Hydrobiologica Sinica, 2010, 34(6): 1130-1135 [ 王锐, 肖青, 桂建芳. 银鲫果糖-1, 6-二磷酸酶的分子克隆与表达分析. 水生生物学报, 2010, 34(6): 1130-1135] |
Wang XF, Liu QH, Wu Y, et al. cDNA cloning of coat-epsilon gene and its tissue distribution in Fenneropenaeus chinensis. Progress in Fishery Sciences, 2016, 37(4): 147-152 [ 王修芳, 刘庆慧, 吴垠, 等. 中国明对虾(Fenneropenaeus chinensis) coat-ε基因全长cDNA克隆及组织分布. 渔业科学进展, 2016, 37(4): 147-152] |
Wang YH, Yin XX, Ding MM, et al. Molecular cloning and expression analysis of Xbp1-S of Nile tilapia (Oreochromis niloticus). Progress in Fishery Sciences, 2018, 39(1): 73-82 [ 王玉红, 尹晓雪, 丁明媚, 等. 尼罗罗非鱼Xbp1-S基因克隆及表达分析. 渔业科学进展, 2018, 39(1): 73-82] |
Wang ZQ, Ren XY, Gao BQ, et al. cDNA cloning and expression analysis of F-ATPase β subunit gene in Portunus trituberculatus and its variation in family inbreeding. Progress in Fishery Sciences, 2018, 39(1): 97-106 [ 王竹青, 任宪云, 高保全, 等. 三疣梭子蟹F型ATP酶β亚基(F-ATPaseβ)基因的克隆、组织表达及在家系近交中的变化. 渔业科学进展, 2018, 39(1): 97-106] |
Wu B, Yang AG, Sun XJ, et al. Effects of acute temperature stress on genome-wide DNA methylation profiles in Patinopecten yessoensis. Progress in Fishery Sciences, 2016, 37(5): 140-146 [ 吴彪, 杨爱国, 孙秀俊, 等. 急性温度胁迫对虾夷扇贝(Patinopecten yessoensis)基因组DNA甲基化的影响. 渔业科学进展, 2016, 37(5): 140-146] |
Xiao HD, Chen CS, Xu Y, et al. Cloning and expression analysis of the chloroplast fructose-1, 6-bisphosphatase gene from Pyropia haitanensis. Acta Oceanologica Sinica, 2014, 33(4): 92-100 DOI:10.1007/s13131-014-0455-0 |
Xu WT, Wang C, Xu XY, et al. Cloning and expression analysis of a novel gene encoding fructose-1, 6-bisphosphatase in cotton. Cotton Science, 2013, 25(6): 549-556 [ 徐文亭, 王诚, 徐晓洋, 等. 一个棉花果糖-1, 6-二磷酸酶基因的克隆与表达特征. 棉花学报, 2013, 25(6): 549-556 DOI:10.3969/j.issn.1002-7807.2013.06.011] |
York JD, Ponder JW, Majerus PW. Definition of a metal-dependent/Li(+)-inhibited phosphomonoesterase protein family based upon a conserved three-dimensional core structure. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(11): 5149-5153 DOI:10.1073/pnas.92.11.5149 |



