2. 中国水产科学研究院黄海水产研究所 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071
蛋白质是构成生命的基础物质,是由氨基酸组成的含氮高分子化合物。饲料蛋白质被鱼体摄食后,必须在鱼消化道中各种消化酶的作用下,分解成氨基酸后才能被鱼体吸收利用。因此,氨基酸构成决定了蛋白质的质量。在鱼类中的必须氨基酸组成中,蛋氨酸是含硫氨基酸,是鱼类10种必须氨基酸的一种。在鱼类的生长发育过程中,蛋氨酸广泛的参与鱼类的代谢过程,例如可以参与形成S-腺苷甲硫氨酸的形成,然后以此作为甲基供体参与机体的生理代谢过程(Baker et al, 2006)。还可以参与牛磺酸、硫酸酯、磷酸胆碱和其他磷脂的形成(Brosnan et al, 2006)。同时也是很多植物性原料的第一限制性氨基酸(Goff et al, 2004),和其他营养素一样,投喂低水平的蛋氨酸饲料会导致饲料效率和生长下降(Mai et al, 2006)。而且在虹鳟(Oncorhynchus mykiss)等鲑科鱼类中发现,投喂蛋氨酸缺乏的饲料后,还会患上白内障(Cowey 1992)。摄食非常高含量的蛋氨酸则可能对虹鳟的生长产生负面影响(Poppi et al, 2011)。相关研究表明,适宜的蛋氨酸水平可显著提高大口黑鲈(Micropterus salmoides)(陈乃松等, 2010)、大黄鱼(Larimichthys crocea)(Mai et al, 2006)、建鲤(Cyprinus carpiovar Jian)(Xiao et al, 2010)等的特定生长率、饲料转化效率。目前,国内外已经进行了很多关于鱼类蛋氨酸营养需求的研究,确定了牙鲆(Paralichthys olivaceus) (Alam et al, 2015)、斑点叉尾(Ictalurus punctatus) (Harding et al, 1977)、日本鳗鱼(Anguilla japonica) (NRC, 1993)、大黄鱼(Mai et al, 2006)、鲈鱼(Lateolabrax japonicus)、(Zhou et al, 2011)军曹鱼(Rachycentron canadum) (Zhou et al, 2006)、建鲤(Xiao et al, 2010)等多种养殖鱼类的蛋氨酸需求量。
红鳍东方鲀(Takifugu rubripes)俗称河豚,目前对于河鲀营养学方面的研究主要需求集中在蛋白质(王淑敏, 2008; Sungsam, 2009)和脂肪(孙阳等, 2013; Takii et al, 1995)等方面,对于蛋氨酸适宜需求量的研究还未见报道。鉴于此,本研究采用剂量-效应法,探讨不同蛋氨酸水平对于红鳍东方鲀生长性能、鱼体组成和相关生化指标的影响,为河鲀专用配合饲料的研发提供理论依据。
1 材料与方法 1.1 实验设计本实验通过向基础饲料中等梯度添加0.3%、0.6%、0.9%、1.2%、1.5%的DL-蛋氨酸。其中,蛋氨酸的有效含量为99.3%。以谷氨酸作为蛋氨酸的等氮替代物,配制成6种不同蛋氨酸梯度水平的等氮等脂的半精制饲料,实验饲料配方及氨基酸组成如表 1、表 2。其中,蛋白、脂肪水平分别参照Kin等(2009)和Kikuchi等(2009),氨基酸混合物的添加参照红鳍东方鲀肌肉氨基酸组成(高露姣等,2011)。经测定,各组饲料的实际蛋氨酸含量分别为0.61%、0.85%、1.10%、1.39%、1.60%、1.84%,对应占饲料蛋白质的1.20%、1.67%、2.16%、2.72%、3.14%、3.61%。饲料原料经粉碎过80目筛,按照从小量到大量的顺序,逐步混合均匀,加水搅匀后通过小型颗粒饲料机制成直径为3~4 mm,长度为3~5 mm的颗粒饲料,55℃烘干后,保存于–20℃冰箱中。
|
|
表 1 实验饲料配方及化学组成(%干物质) Tab.1 Formulation and chemical composition of the experimental diet (% dry matter) |
|
|
表 2 实验饲料的氨基酸组成(%干物质) Tab.2 The amino acid composition of the experiment diets (% dry matter) |
红鳍东方鲀为海阳黄海水产有限公司的当年鱼苗。投喂对照组实验饲料驯化7 d,使其适应养殖系统和实验饲料。实验开始时,统一让实验鱼饥饿24 h,随后随机挑选体质健康、体格均匀的鱼。称重后放入18个桶(500 L)中,每个桶中放入30尾鱼[平均体重为(13.83±0.61) g]。将6种饲料随机分派到18个桶,每种饲料3个重复。实验期间,每天分别于07:00、12:00、16:00、20:00表观饱食投喂,投喂量按实验鱼体重的3%投喂,收集残饵并计数,每2 d刷桶1次,保持桶壁和桶底清洁,实验持续67 d。
养殖用水为浅井海水,经二级沉淀、砂滤后进入蓄水池,采用室内流水系统(每天流水总量为4 m3),并换1/2水;实验期间,溶氧高于6 mg/L,采取纸板遮挡窗户以降低室内光线强度。实验期间,水温为22℃~27℃,盐度为24~26,pH为7.90~8.05。
1.3 实验取样实验开始前随机取10尾红鳍东方鲀幼鱼作为初始鱼,用于常规营养成分分析。实验结束时,饥饿24 h,然后对每桶鱼进行计数、称重。每桶随机取4尾实验鱼,-20℃保存,用于体成分分析;每缸随机取6尾鱼,尾静脉取血,血样暂存于1.5 ml离心管中,静置过夜后3000 r/min离心获得血清样,保存于-20℃冰箱备用。取6尾鱼在冰盘上解剖,取出肝脏和肌肉,分装于2个冷冻管,迅速放入液氮中,之后转移到-80℃冰箱中,用以实验相关要求的测定。
1.4 生化分析实验饲料、饲料原料和鱼体的粗蛋白、粗脂肪、灰分、水分的测定,均参照(AOAC, 1995)方法进行,水分含量用(105±2)℃常温干燥法;粗灰分含量用马弗炉550℃高温灼烧法;粗脂肪含量用索氏抽提法测定(Foss Tecator, Hoganas, 瑞典);粗蛋白的含量用凯氏定氮仪测定(VELP, UDK142 automatic distillation unit, VELP, Usmate, MB, 意大利)。饲料氨基酸分析采用盐酸水解法通过氨基酸分析仪(日立L-8900,日本)测定。
血清酶活利用深圳迈瑞(Mindray)公司生产的LX-20型Beckman全自动生化分析仪及其配套试剂进行分析。肝脏谷丙转氨酶、谷草转氨酶酶活均采用南京建成生物工程研究所研制的试剂盒。
1.5 计算方法及统计分析方法特定生长率(Specific growth rate, SGR, %/d)= 100×[ln(终末体重)-ln(初始体重)]/实验天数
摄食率(Feeding intake, FI, %/d)=100×总干物质摄食量/[实验天数×(初始体重+终末体重)/2]
饲料效率(Feed efficiency, FE)=鱼体增重(湿重)/总干物质摄食量
蛋白效率比(Protein efficiency ratio, PER)=(终末体重-初始体重)/蛋白摄入量
蛋白质沉积率(Protein productive value, PPV, %)= 100×鱼体蛋白质贮存量/蛋白摄入量
肥满度(Condition factor, CF)=体重/体长3 (体重单位:g;体长单位:cm)
肝体比(Hepatosomatic index, HSI, %) = 100 ×肝重/鱼体重
脏体比(Viscerosomatic index, VSI, %) = 100 ×内脏重/鱼体重
实验数据以平均值±标准误(Mean±SE)表示,使用SPSS 16.0进行单因素方差分析(One-way ANOVA),当差异达到显著水平(P 0.05),则采用邓肯多重比较(Duncan’s multiple range tests)。
2 结果 2.1 饲料中蛋氨酸水平对红鳍东方鲀生长、饲料利用和鱼体组成的影响表 3为饲料蛋氨酸水平对红鳍东方鲀生长性能的影响,饲料中的蛋氨酸水平显著影响红鳍东方鲀的成活率、摄食率、特定生长率、饲料效率和蛋白质效率(P < 0.05)。特定生长率、饲料效率和蛋白效率比随着蛋氨酸水平的升高先升高后下降,到蛋氨酸水平为1.60%时达到最高,显著高于0.61%处理组(P < 0.05)。其中,特定生长率在1.39%组和1.60%组无显著差异;对于成活率,1.10%处理组显著高于1.60%处理组(P < 0.05),其他各组无显著差异(P>0.05);摄食率随饲料蛋氨酸水平的升高先升高后下降,蛋氨酸1.39%处理组达到最高,显著高于0.61%处理组(P < 0.05),与其他各组无显著差异(P>0.05);饲料蛋氨酸水平对蛋白沉积率没有显著影响(P>0.05)。
|
|
表 3 饲料蛋氨酸水平对红鳍东方鲀生长性能的影响 Tab.3 Effect of dietary methionine levels on growth performance of T. rubripes |
表 4为饲料蛋氨酸水平对鱼体组成和形体指标的影响。饲料的蛋氨酸水平对全鱼的粗蛋白、灰分、肥满度无显著影响(P>0.05);对于鱼体粗脂肪、肝体比、脏体比,蛋氨酸1.60%组显著高于0.61%处理组(P < 0.05),但随着蛋氨酸水平的进一步升高,呈现出下降的趋势,但与其他各组差异不显著(P>0.05)。
|
|
表 4 饲料蛋氨酸水平对鱼体组成和形体指标的影响(%湿重) Tab.4 Effect of dietary methionine levels on body composition and physical indicators of T. rubripes (%wet weight) |
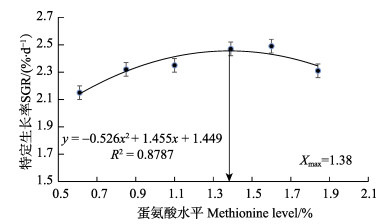
将红鳍东方鲀的特定生长率数据与饲料中的蛋氨酸水平进行二次回归曲线分析,得到特定生长率与蛋氨酸水平的二次曲线关系为:y =–0.526x2+1.455x+1.449(R2= 0.8787)。由图 1可知,当蛋氨酸水平为1.38%,即占饲料蛋白的2.71%时,红鳍东方鲀的特定生长率达到最高。
|
图 1 红鳍东方鲀特定生长率与饲料中蛋氨酸水平的二次曲线关系 Fig.1 Second-order polynomial relationship between SGR of T. rubripes and dietary methionine levels |
表 5为饲料蛋氨酸水平对红鳍东方鲀血清和肝脏生理生化指标的影响。如表 5所示,饲料蛋氨酸水平对肝脏中的谷丙转氨酶没有显著影响(P>0.05),1.10%处理组中的肝脏谷草转氨酶活性显著高于0.85%和1.60%处理组(P < 0.05),与其他处理组无显著差异;饲料蛋氨酸水平显著影响血清中甘油三酯的含量,蛋氨酸含量为1.39%的处理组最高,蛋氨酸含量为1.10%、1.39%、1.60%处理组显著高于1.84%处理组(P < 0.05),其他各组间无显著差异(P>0.05);饲料蛋氨酸水平还对血清中的胆汁酸含量产生显著影响,蛋氨酸含量为1.39%、1.60%处理组显著高于0.61%、0.85%、1.84%处理组(P < 0.05),其他组间无显著差异(P>0.05);饲料蛋氨酸水平还对血清中的血糖含量产生显著差异,0.61%组显著高于0.85%、1.10%、1.60%、1.84%处理组(P < 0.05);蛋氨酸水平对红鳍东方鲀中血清中的总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、总蛋白、谷丙转氨酶、谷草转氨酶无显著影响(P>0.05)。
|
|
表 5 饲料蛋氨酸水平对红鳍东方鲀血清和肝脏生理生化指标的影响 Tab.5 Effect of dietary methionine levels on physiological and biochemical parameters in serum and liver |
表 6为饲料蛋氨酸水平对红鳍东方鲀肌肉氨基酸组成的影响。如表 6所示,饲料蛋氨酸水平对肌肉中的半胱氨酸的含量没有显著影响(P>0.05),对其他的氨基酸均随饲料蛋氨酸水平增加先升高,然后趋于平稳。
|
|
表 6 饲料蛋氨酸水平对红鳍东方鲀肌肉氨基酸组成的影响(%) Tab.6 Effects of dietary methionine levels on amino acid composition in muscle of T. rubripes |
本研究采用剂量-效应法来确定红鳍东方鲀饲料中最适蛋氨酸需求量。在实验中,蛋氨酸缺乏组显示较低的生长速度,而随着蛋氨酸水平的提高,其特定生长率、饲料转化效率和蛋白质效率均得到了显著的提高,但随着蛋氨酸水平的进一步升高,则呈现出下降的趋势,这与红鳍东方鲀血清中的甘油三酯、胆汁酸含量和肌肉氨基酸组成的变化趋势一致。在本研究中,当蛋氨酸的需求量超过或者低于最适需求量时,其生长遭到抑制。这与五条(Ruchimat et al, 1997)、大黄鱼(Mai et al, 2006)、军曹鱼(Zhou et al, 2006)等结果一致。原因则可能是蛋氨酸缺乏时,引起了氨基酸的不平衡,限制了其他氨基酸的充分利用,导致了生长受到了抑制,也使得饲料和蛋白的利用受到了影响(任和等, 2006)。当蛋氨酸过量时,过量的蛋氨酸可能会氧化产生酮或者其他代谢产物,引起了毒害作用而导致了鱼类生长受阻(Murthy et al, 2015)。
由于蛋氨酸能够转化成半胱氨酸,所以,半胱氨酸的含量会影响鱼类对于蛋氨酸的需要量。因此,有研究者认为将此表示为动物对于含硫氨基酸的总需要量或者表述为蛋氨酸+半胱氨酸的形式。但有一些研究发现,饲料中的半胱氨酸的含量低于3g/kg(0.3%)时,才能作为鱼类含硫氨基酸的有效补给源,这就表明当半胱氨酸的含量超过该用量时,半胱氨酸就不存在节省蛋氨酸需要量的作用(Kim et al, 1992; Pack et al, 1995)。在本研究中,半胱氨酸的含量为0.86%左右,占饲料蛋白的1.67%左右。本次结果显示,初始体重为13.83g的红鳍东方鲀,以特定生长率为评价指标通过二次曲线回归分析,得出对蛋氨酸的需求量为占饲料干物质的1.38%,占饲料蛋白的2.71%(胱氨酸0.86%,占饲料蛋白的1.67%)。高于初始体重为11.61g,以特定生长率为评价指标的军曹鱼(Zhou et al, 2006)蛋氨酸需求量占饲料蛋白2.64%(胱氨酸1.49%);同样也低于初始重量为1.23g,以特定生长率为评价指标,得出蛋氨酸需求量占饲料蛋白的大黄鱼(Mai et al, 2006)的3.34%(胱氨酸0.67%);同初始体重为37.88g,以特定生长率为评价指标得出蛋氨酸需求量占饲料蛋白的大口黑鲈(陈乃松等, 2010)的2.75%(胱氨酸0.30%)接近。现有报道的鱼类蛋氨酸的需求量的差异是多方面的因素,其一可能是不同种属间的差异,同时也可能是受到不同养殖环境的影响,如鱼的大小、年龄、水温、养殖密度和饲料的种类,水流、投喂频率、氨基酸模式和饲料中其他营养物质的相互作用等(Chiu et al, 1988; Cowey, 1995; Simmons et al, 2015)。
3.2 蛋氨酸水平对于鱼体组成和形体指标的影响本研究中,蛋氨酸水平对于鱼体粗蛋白、灰分、水分没有显著性差异(P>0.05),但对鱼体的粗脂肪含量产生了显著差异,表明了蛋氨酸可能参与了红鳍东方鲀体内的脂肪调控过程,同在大菱鲆(Psetta maxima)中(Ma et al, 2013)的发现相似,随着蛋氨酸的水平的上升,鱼体粗脂肪也随之增高;但是在大黄鱼(Mai et al, 2006)和军曹鱼(Zhou et al, 2006)的蛋氨酸需求研究中蛋氨酸水平并没有显著影响鱼体粗脂肪含量;而在斜带石斑鱼(Epinephelus coioides)(Luo et al, 2005)中发现,蛋氨酸水平的升高会降低鱼体粗脂肪的含量。本研究发现,鱼体中的肝体比和脏体比随着蛋氨酸水平呈现先升高后下降的趋势,蛋氨酸水平为1.60%时达到最高。这与在大菱鲆中(Klatt et al, 2016)的发现一致,肝体比会随着蛋氨酸水平的上升而随之增大;与在大口黑鲈(陈乃松等, 2010))和大西洋鲑(Salmo salar)(Espe et al, 2008)研究中的不一致,饲料的蛋氨酸水平较低时,肝体比、脏体比较大。Espe等(2008)认为蛋氨酸引起的肝体比降低是对机体的有益行为;Walton等(1982)在虹鳟中的研究认为,肝体比的增加是因为饲料中过多的游离氨基酸转化为肝糖原的结果。
鱼体对于蛋白质的沉积是通过外源氨基酸的供给来合成的。本研究中,肌肉中的氨基酸基本呈现出一种先升高再趋于平稳的趋势。Alam(2015),研究证实,饲料的不同氨基酸模式会影响到牙鲆(Paralichthys olivaceus)的生长和体蛋白结合态氨基酸的组成。在大黄鱼(Mai et al, 2006)的研究中发现,肌肉中的蛋氨酸水平会随着饲料中蛋氨酸水平的升高呈现出一种先升高后稳定的趋势;在胭脂鱼(Myxocyprinus asiaticus) (林郁葱,2012)中发现,肌肉中的精氨酸、组氨酸、亮氨酸和赖氨酸都会随着饲料中蛋氨酸水平的增加而呈现出一种先升后降的趋势;在吉富罗非鱼(Oreochromis niloticus) (向枭等, 2014)中,肌肉中的半胱氨酸、丝氨酸和组氨酸没有表现出显著差异,其余的氨基酸含量都基本呈现了一种先升高后降低的趋势,上述结果与本研究结果基本一致。鱼体肌肉中各种氨基酸含量的上升,说明了随着饲料中蛋氨酸含量的上升,饲料中的氨基酸含量会趋于平衡,所摄食的这些的氨基酸就能够更大比例的用于体内蛋白质的合成。
3.3 蛋氨酸水平对血清和肝脏中相关生化指标的影响通过研究胆汁酸、甘油三酯、血糖、总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇来研究饲料中蛋氨酸水平对红鳍东方鲀机体脂肪代谢的影响。胆汁酸是胆固醇代谢过程产生的一系列固醇类物质,胆汁酸能促进脂肪乳化,促进脂类物质的消化吸收,调节脂类代谢(Romański et al, 2007; Sirvent et al, 2004)。在牛蛙(Rana catesbiana shaw)(胡田恩等, 2015)中发现,添加适量胆汁酸能够降低血清中血糖的含量,在本研究中,也发现了随着蛋氨酸水平的升高,胆汁酸含量会上升,血清中的血糖则呈现出下降的趋势。血清中甘油三酯含量的上升,表明蛋氨酸水平的上升能够加速脂肪代谢的过程,同罗非鱼(向枭等, 2014)相似,适量的蛋氨酸能够显著提高甘油三酯的含量,但在异育银鲫(Carassius auratus gibeilo) (Wang et al, 2016)中发现,随着蛋氨酸含量的上升,血清中的甘油三酯则没有显著差异。血清中的血糖,随着蛋氨酸水平的增加则呈现了一种降低的趋势,这同胭脂鱼(林郁葱, 2012)中随着蛋氨酸水平的升高,血清中的血糖含量呈现的趋势一致。
谷丙转氨酶和谷草转氨酶常用来评价机体肝脏功能的受损情况,其酶活性升高说明肝脏功能出现了问题。在本研究中,血清中的谷草转氨酶、谷丙转氨酶均无显著差异,但是在肝脏中的谷草转氨酶则呈现了一种先升高再降低的趋势,这同在异育银鲫(Wang et al, 2016)中的发现类似,随着蛋氨酸水平的升高,也是呈现了一种先升高再降低的趋势,说明蛋氨酸的升高会加速脂肪调控,加大肝脏的负担;有研究证明,在蛋氨酸不足或者过量时,都会影响鱼类的转氨酶活性,例如建鲤(Feng et al, 2011)和金鲳鱼(Xenobrama) (Niu et al, 2013)。
4 结论本研究结果表明,饲料中的蛋氨酸水平对红鳍东方鲀幼鱼的生长、饲料利用效率、蛋白质效率产生了显著的影响。在本次实验中,以特定生长率为评价指标,经过二次回归曲线分析:体重为(13.83~82.47) g的红鳍东方鲀幼鱼对饲料中的蛋氨酸需求量为1.38%,占饲料蛋白的2.71%。
Alam MS, Teshima S, Ishikawa M, et al. Methionine requirement of juvenile Japanese flounder Paralichthys olivaceus estimated by the oxidation of radioactive methionine. Aquaculture Nutrition, 2015, 7(3): 201-209 |
AOAC. Official methods of analysis of the association of official analytical chemists, 14th edn. Williams S(Eds), Association of Official Analytical Chemists, Arlington, VA. 1984, 1141
|
Baker DH. Comparative species utilization and toxicity of sulfur amino acids. Journal of Nutrition, 2006, 136(6 Suppl): 1636S |
Brosnan JT, Brosnan ME. The sulfur-containing amino acids: An overview. Journal of Nutrition, 2006, 136(6 Suppl): 1636S |
Chen NS, Ma JZ, Zhou HY, et al. Assessment of dietary methionine requirement in largemouth bass, Micropterus salmoides. Journal of Fisheries of China, 2010, 34(8): 1244-1253 [ 陈乃松, 马建忠, 周恒永, 等. 大口黑鲈对饲料中蛋氨酸需求量的评定. 水产学报, 2010, 34(8): 1244-1253] |
Chiu YN, Austic RE, Rumsey GL. Effect of feeding level and dietary electrolytes on the arginine requirement of rainbow trout (Salmo gairdneri). Aquaculture, 1988, 69(1-2): 79-91 DOI:10.1016/0044-8486(88)90188-3 |
Cowey CB. Protein and amino acid requirements: A critique of methods. Journal of Applied Ichthyology, 1995, 11(3-4): 199-204 DOI:10.1111/jai.1995.11.issue-3-4 |
Cowey CB. Nutrition: Estimating requirements of rainbow trout. Aquaculture, 1992, 100(1-3): 177-189 DOI:10.1016/0044-8486(92)90370-Z |
Espe M, Hevrøy EM, Liaset B, et al. Methionine intake affect hepatic sulphur metabolism in Atlantic salmon, Salmo salar. Aquaculture, 2008, 274(1): 132-141 DOI:10.1016/j.aquaculture.2007.10.051 |
Feng L, Xiao WW, Liu Y, et al. Methionine hydroxy analogue prevents oxidative damage and improves antioxidant status of intestine and hepatopancreas for juvenile Jian carp (Cyprinus carpio, var. Jian). Aquaculture Nutrition, 2011, 17(6): 595-604 DOI:10.1111/anu.2011.17.issue-6 |
Gao LJ, Huang YQ, Xia LJ, et al. Comparison of flesh quality of farmed fugu, Takifugu rubripes from different culture models. Journal of Fisheries of China, 2011, 35(11): 1668-1676 [ 高露姣, 黄艳青, 夏连军, 等. 不同养殖模式下红鳍东方鲀的品质比较. 水产学报, 2011, 35(11): 1668-1676] |
Goff JB, Dmiii G. Evaluation of different sulfur amino acid compounds in the diet of red drum, Sciaenops ocellatus, and sparing value of cystine for methionine. Aquaculture, 2004, 241(1-4): 465-477 DOI:10.1016/j.aquaculture.2004.08.002 |
Harding DE, Jr AO, Wilson RP. Sulfur amino acid requirement of channel catfish:L-methionine and L-cystine. The Journal of nutrition, 1977, 107(11): 2031-2035 DOI:10.1093/jn/107.11.2031 |
Hu TE, Wang L, Zhang CX, et al. Effects of dietary bile acid supplementation on the growth, whole-body composition and apparent nutrient digestibility of Bullfrog (Rana Catesbelana). Acta Hydrobiology Sinica, 2015, 39(4): 677-685 [ 胡田恩, 王玲, 张春晓, 等. 饲料中添加胆汁酸对牛蛙生长性能、体组成和营养物质表观消化率的影响. 水生生物学报, 2015, 39(4): 677-685] |
Kikuchi K, Furuta T, Iwata N, et al. Effect of dietary lipid levels on the growth, feed utilization, body composition and blood characteristics of tiger puffer Takifugu rubripes. Aquaculture, 2009, 298(1-2): 111-117 DOI:10.1016/j.aquaculture.2009.10.026 |
Kim KI, Kayes TB, Amundson CH. Requirements for sulfur amino acids and utilization of D-methionine by rainbow trout (Oncorhynchus mykiss). Aquaculture, 1992, 101(1-2): 95-103 DOI:10.1016/0044-8486(92)90235-D |
Kim SS, Lee KJ. Dietary protein requirement of juvenile tiger puffer (Takifugu rubripes). Aquaculture, 20009, 287(1-2): 219-222 |
Klatt SF, Danwitz AV, Hasler M, et al. Determination of the lower and upper critical concentration of Methionine + Cystine in diets of juvenile turbot (Psetta maxima). Aquaculture, 2016(452): 12-23 |
Lin YC. Study on lysine and methionine requirements for juvenile Chinese sucker, Myxocypinus asiaticus. Master's Thesis of Huazhong Agricultural University, 2012 [林郁葱.胭脂鱼幼鱼对赖氨酸和蛋氨酸的最适需要量.华中农业大学硕士研究生学位论文, 2012]
|
Luo Z, Liu YJ, Mai KS, et al. Dietary L-methionine requirement of juvenile grouper Epinephelus coioides at a constant dietary cystine level. Aquaculture, 2005, 249(1-4): 409-418 DOI:10.1016/j.aquaculture.2005.04.030 |
Ma R, Hou H, Mai KS, et al. Comparative study on the effects of L-methionine or 2-hydroxy-4-(methylthio) butanoic acid as dietary methionine source on growth performance and anti-oxidative responses of turbot (Psetta maxima). Aquaculture, 2013, 412-413(6): 136-143 |
Mai KS, Wan JL, Ai QH, et al. Dietary methionine requirement of juvenile yellow croaker Pseudosciaena crocea R. Aquaculture, 2006, 251: 564-572 |
Murthy HS, Varghese TJ. Total sulphur amino acid requirement of the Indian major carp, Labeo rohita (Hamilton). Aquaculture Nutrition, 2015, 4(1): 61-65 |
National Research Council (NRC). Nutrient requirements of Fishes. National Academy of Sciences, Washington, DC. 1993
|
Niu J, Du Q, Lin HZ, et al. Quantitative dietary methionine requirement of juvenile golden pompano Trachinotus ovatus at a constant dietary cystine level. Aquaculture Nutrition, 2013, 19(5): 677-686 DOI:10.1111/anu.2013.19.issue-5 |
Pack M, Rodehutscord M, Jacobs S, et al. Amino acid requirements of rainbow trout (Oncorhynchus mykiss) Ⅱ. Protein deposition as function of dietary methionine, threonine and arginine. Journal of Applied Ichthyology, 1995, 11(3-4): 390-393 DOI:10.1111/jai.1995.11.issue-3-4 |
Poppi DA, Quinton VM, Hua K, et al. Development of a test diet for assessing the bioavailability of arginine in feather meal fed to rainbow trout (Oncorhynchus mykiss). Aquaculture, 2011, 314(1-4): 100-109 DOI:10.1016/j.aquaculture.2011.01.016 |
Ren H, Zhan XA. Advances in amino acid nutrition of aquatic animals. Feed Research, 2006(2): 41-43 [ 任和, 占秀安. 水产动物氨基酸营养研究进展. 饲料研究, 2006(2): 41-42 DOI:10.3969/j.issn.1002-2813.2006.02.015] |
Romański KW. The role and mechanism of action of bile acids in the digestive system - Bile acids in the gut. Advances in Clinical & Experimental Medicine, 2008, 17(1): 83-89 |
Ruchimat T, Masumoto T, Hosokawa H., et al. Quantitative methionine requirement of yellowtail (Seriola quinqueradiata). Aquaculture, 1997, 150(1-2): 113-122 DOI:10.1016/S0044-8486(96)01465-2 |
Sungsam K. Dietary protein requirement of juvenile tiger puffer (Takifugu rubripes). Aquaculture, 2009, 287(1-2): 219-222 DOI:10.1016/j.aquaculture.2008.10.021 |
Sun Y, Jiang ZQ, Li YQ, et al. Effects of dietary lipid on the liver antioxidant capacity and histology of Takifugu rubripes juvenile. Journal of Guangdong Ocean University, 2013, 33(3): 27-32 [ 孙阳, 姜志强, 李艳秋, 等. 饲料脂肪水平对红鳍东方鲀幼鱼肝脏抗氧化酶活力及组织结构的影响. 广东海洋大学学报, 2013, 33(3): 27-32 DOI:10.3969/j.issn.1673-9159.2013.03.005] |
Simmons L, Moccia RD, Bureau DP, et al. Dietary methionine requirement of juvenile Arctic charr Salvelinus alpinus (L.). Aquaculture Nutrition, 2015, 5(2): 93-100 |
Sirvent A, Claudel T, Martin G, et al. The farnesoid X receptor induces very low density lipoprotein receptor gene expression. FEBS Letters, 2004, 566(1-3): 173-177 DOI:10.1016/j.febslet.2004.04.026 |
Takii K, Ukawa M, Nakamura M, et al. Suitable lipid level in brown fish meal diet for tiger puffer (Takifugu rubripes). Fisheries Science, 1995, 61(5): 841-844 DOI:10.2331/fishsci.61.841 |
Walton MJ, Cowey CB, Adron JW. Methionine metabolism in rainbow trout fed diets of differing methionine and cystine content. Journal of Nutrition, 1982, 112(8): 1525-35 DOI:10.1093/jn/112.8.1525 |
Wang XM. Study on the optimum dietary protein level of juvenile tiger puffer, Takifugu rubripes. Master's Thesis of Hebei Normal University, 2018, 14-27 |
Wang X, Xue M, Figueiredo-Silva C, et al. Dietary methionine requirement of the pre-adult gibel carp (Carassius auratus gibeilo) at a constant dietary cystine level. Aquaculture Nutrition, 2016, 22(3): 509-516 DOI:10.1111/anu.2016.22.issue-3 |
Xiang X, Zhou XH, Luo L, et al. Effects of dietary methionine levels on the growth performance, feed utilization and body composition of GIFT tilapia (Oreochromis niloticus). Journal of Fisheries of China, 2014, 38(4): 538-549 [ 向枭, 周兴华, 罗莉, 等. 饲料蛋氨酸水平对吉富罗非鱼生长、饲料利用率和体成分的影响. 水产学报, 2014, 38(4): 538-54] |
Xiao WW, Feng L, Liu Y, et al. Effects of dietary methionine hydroxyl analogue supplement on growth, protein deposition and intestinal enzymes activities of juvenile jian carp (Cyprinus carpiovar. jian). Aquaculture Nutrition, 2010, 17(4): 408-417 |
Zhou F, Xiao JX, Hua Y, et al. Dietary L-methionine requirement of juvenile black sea bream (Sparus macrocephalus) at a constant dietary cystine level. Aquaculture Nutrition, 2011, 17(5): 469-481 DOI:10.1111/anu.2011.17.issue-5 |
Zhou QC, Wu ZH, Tan BP, et al. ptimal dietary methionine requirement for Juvenile Cobia (Rachycentron canadum). Aquaculture, 2006, 258(1-4): 551-557 DOI:10.1016/j.aquaculture.2006.03.035 |



