2. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 威海市文登区海洋与渔业局 威海 264400;
4. 山东省乳山市水产技术推广站 威海 264500;
5. 烟台市海洋经济研究院 烟台 264003
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071;
3. Wendeng Ocean and Fisheries Administration, Weihai 264400;
4. Fisheries Technology Extension Center of Rushan, Rushan 264500;
5. Yantai Marine Economic Research Institute, Yantai 264003
我国于20世纪80年代初步建立了刺参苗种繁育技术,之后在很长一段时间内,用于刺参苗种繁育的亲参多采用池塘养殖或自然海区的成参,亲参的采捕受到严重的季节限制。刺参性腺发育成熟至进入夏眠之间的时间较短,因为错过了亲参的采捕时机或采捕的亲参质量较差而耽误苗种繁育工作的现象时有发生。另一方面,自然界或人工养殖的刺参最早在4月底或5月初性腺达到成熟,此时采卵,当苗种进入稚参阶段时,海水水温达到20℃左右,海水中的桡足类开始大量繁殖,争夺稚参的饲料,同时对稚参造成伤害。到当年秋季苗种投放季节,苗种的规格小,投放后成活率低。在室内进行亲参的人工控温促熟可有效解决以上问题。亲体的人工促熟技术在贝类和甲壳类中得到广泛研究和应用,包括海湾扇贝(Argopecten irradians)(吕豪等, 2008)、紫贻贝(Mytilus edulis) (Pronker et al, 2008)、紫扇贝(Argopecten purpuratus) (Palma-Fleming et al, 2010)、欧洲平牡蛎(Ostrea edulis)(Araya et al, 2012)和凡纳滨对虾(Litopenaeus vannamei)(Xu et al, 2017)等。
环境因素对海洋无脊椎动物的季节性繁殖行为具有重要影响,其中最主要的2个因素为温度和食物(Martinez et al, 2003)。研究表明,即使在非繁殖季节,适当地控制培育水温也能诱导贝类的配子发生(Heasman et al, 1996)。因此,确定最有利于刺参性腺发育的培育水温是进行亲参人工促熟的第一步。适宜的水温启动配子发生,但亲体的繁殖力主要受可获得的食物数量和质量的影响。不同动物性腺发育的营养需求也不相同(Martinez et al, 2000a)。目前,有关刺参性腺发育时期的营养需求的研究鲜有报道。
本文研究了不同培育水温和饲料对刺参亲参繁殖力和子代质量的影响,同时,对培育过程中亲参的体壁粗成分变化和培育结束时雌参性腺粗成分进行分析,以期为刺参人工促熟技术的建立提供参考依据。
1 材料与方法 1.1 实验材料实验所用刺参于12月初采捕自山东乳山海渊水产养殖公司的养殖池塘。亲参采捕后,运至室内培育池进行培育,培育密度为15头/m3。培育期间,持续充气,保持溶解氧在5 mg/L以上。每天上午06:00换水一次,换水时将池水排空,清除池底的粪便和残饵,之后加入新的与原池温度相同的海水。每日早晚各投喂1次金牌配合饲料(粗蛋白25.4%,粗脂肪4.9%,粗灰分39.3%,粗纤维8.0%),早晨与傍晚投喂量比例为3:7,日投喂量为刺参体重的5%~10%,根据摄食情况进行调整。亲参培育期间,室内光照强度控制在500 lx以下。亲参入池时,水温为5℃,亲参在此水温下暂养7 d后,开始水温和饲料实验。实验开始前解剖5头刺参,取得性腺,经显微镜观察,确定性腺中尚未出现卵子和精子。
1.2 水温实验12℃和15℃是目前刺参苗种生产中进行亲参人工促熟常采用的培育水温。因此,本实验采用2种水温控制方案:1)培育水温每天升高0.5℃,升至12℃后保持恒定;2)培育水温每天升高0.5℃,升至15℃后保持水温恒定。每个水温控制方案设置3个平行,每个平行150头亲参。实验期间,亲参投喂金牌配合饲料,混合1:1的海泥投喂。
1.3 饲喂实验鼠尾藻(Sargassum thunbergii)和海带(Laminaria japonica)是刺参配合饲料常采用的原料,本研究采用3种饲料投喂亲参:1)鼠尾藻粉组:50%鼠尾藻粉+50%海泥;2)海带粉组:50%海带粉+50%海泥;3)混合藻粉组:25%鼠尾藻粉+25%海带粉+50%海泥,每个实验组设置3个平行,每个平行150头亲参。根据预实验结果(未发表数据),用15℃水温培育的亲参性腺发育优于用12℃水温培育的亲参,为节省实验时间与成本,本实验部分采用15℃水温培育亲参。实验开始后水温每天升高0.5℃,升至15℃后保持恒定。实验开始前,对鼠尾藻粉、海带粉和混合藻粉粗成分进行测定。
1.4 体壁和性腺的粗成分分析在实验开始前和实验第30、60和90天,每个培育池解剖3头刺参获得体壁,于-80℃保存,用于体成分分析。每个培育池在诱导催产之前,取5头雌参,测量性腺指数,之后将性腺于-80℃保存,用于粗成分分析。粗蛋白的测定采用凯氏定氮法(Dorsey et al, 1977),粗脂肪的测定采用索氏抽提法(Mann et al, 1985),总碳水化合物的测定参考Dubois等(1956)的方法。
性腺指数=性腺湿重/体壁重×100%。
1.5 雌参繁殖力和子代质量分析在实验过程中,如果任意一个实验组中的刺参表现出临近排放的迹象,如夜间个别雄参自然排精,大量亲参在水体表层沿池壁活动频繁、昂首摇头等,则该实验组继续保持培育水温7 d,之后每天升温0.5℃,升至17℃后,采用阴干流水法进行人工诱导产卵。
亲参阴干1 h后,水流冲击15 min,然后向池中注入22℃的砂滤海水。当观察到亲参开始排精或产卵后,立刻将其从池中取出,置于盛满海水的10 L水桶中,单独排放。
每个培育池中随机取出100头亲参进行催产,统计排卵雌参头数,计算雌参的排放率。
雌参排放率=排卵雌参数/催产亲参数×100%。
待所有雌参停止排卵后,计算雌参平均排卵量。将每个池中的雌参所排卵子混合,随机测量100个卵子的卵径,然后用同一培育池中的雄参所排精子进行人工授精。2 h后,计算受精率。
受精率=发生卵裂的受精卵数/总卵子数×100%。
各培育池所获得的受精卵分别在21℃水温中孵化,孵化密度为3个/ml。受精48 h后,统计孵化率,并随机测量30个幼体的体长。
孵化率=小耳幼体数/受精卵数×100%。
各组在统计受精率和孵化率时取样3次,每次统计的个体数为100个。
1.6 数据分析实验结果用平均值±标准误(Mean±SE)表示,采用SPSS 20.0软件进行统计分析,对刺参体壁成分数据作培育时间×培育水温的双因素方差分析(Two-way ANOVA),并利用Tukeyxs test进行各实验组平均值之间的多重比较,P < 0.05表示差异显著。
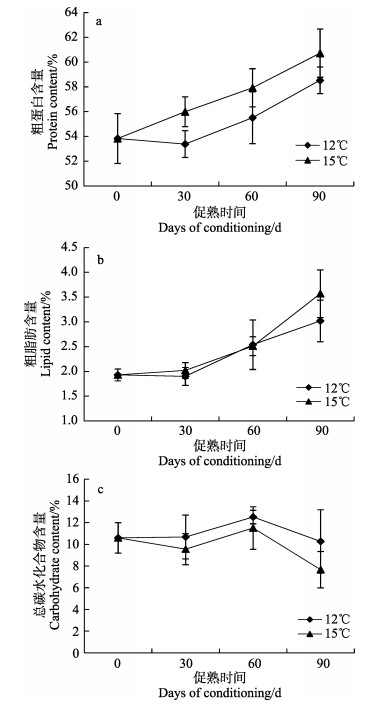
2 结果 2.1 温度实验 2.1.1 体壁成分变化当培育水温为12℃时,亲参体壁中粗蛋白和粗脂肪含量均呈先短暂降低而后逐渐升高的趋势。当培育水温为15℃时,在整个培育过程中,亲参体壁中粗蛋白和粗脂肪含量逐渐升高。整个实验过程中,2种培育温度下亲参体壁中粗蛋白含量变化均不显著(图 1a)。在12℃实验组,亲参体壁中粗脂肪含量在整个实验过程中变化不显著,而在15℃实验组,实验第90天,刺参体壁中的粗脂肪含量显著高于其他时间点(P < 0.05)(图 1b)。双因素方差分析显示,培育水温和时间的交互作用对亲参体壁中粗蛋白和粗脂肪含量影响不显著。
|
图 1 不同培育水温对刺参体壁中粗蛋白(a)、粗脂肪(b)和总碳水化合物(c)含量的影响 Fig.1 Percentage of proteins(a), lipids(b) and carbohydrates(c) in the body wall of A. japonicus conditioned at two different temperature regimes |
当培育水温为12℃时,亲参体壁中的总碳水化合物含量先逐渐升高,至实验第60天,又逐渐降低。当培育水温为15℃时,刺参体壁中的总碳水化合物含量呈先降低后升高、然后再降低的趋势。方差分析显示,在2个实验组中,亲参体壁中总碳水化合物含量在整个培育过程中没有发生显著变化(图 1c)。
2.1.2 雌参性腺粗成分2个实验组中,雌参性腺中各粗成分含量没有显著差异。但采用15℃水温培育的雌参其性腺中粗蛋白和粗脂肪含量高于采用12℃水温培育的雌参,而性腺中总碳水化合物含量后者高于前者(表 1)。
|
|
表 1 培育水温对雌性刺参性腺粗成分的影响 Tab.1 Percentage of proteins, lipids and carbohydrates in the female gonad of A. japonicus conditioned at two different temperature regimes |
根据亲参的培育情况,分别在实验第119天和第92天对12℃和15℃培育的亲参进行了人工催产,催产之前解剖部分亲参,测量了性腺指数。在15℃水温培育的雌性刺参的性腺指数、卵子受精率和受精卵孵化率高于12℃实验组,但二者之间没有显著差异。12℃实验组的雌参排出的卵子卵径和幼体体长高于15℃实验组,但二者之间没有显著差异。在15℃水温培育的雌参的平均排卵量和排放率均显著高于在12℃水温培育的雌参(P < 0.05)(表 2)。
|
|
表 2 培育水温对雌参繁殖力、卵子与幼体质量的影响 Tab.2 Reproductive capacity and offspring quality of A. japonicus females conditioned at two different temperature regimes |
实验中采用的藻粉粗成分如表 3所示,其中,鼠尾藻粉的粗蛋白含量最高,为(18.28±0.03)%,海带粉的粗脂肪和碳水化合物含量最高,为(0.74±0.08)%和(72.05±5.40)%。
|
|
表 3 亲参培育饲料粗成分 Tab.3 Biochemical composition of A. japonicus conditioning diets |
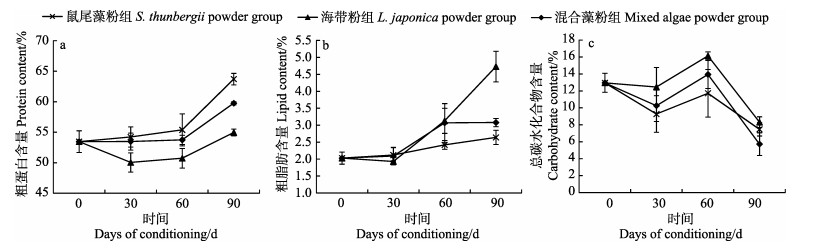
在实验过程中,投喂鼠尾藻粉和混合藻粉的亲参,体壁中的粗蛋白和粗脂肪含量逐渐升高,而投喂海带粉的亲参体壁中粗蛋白和粗脂肪含量呈先降低、后逐渐升高的趋势。在整个实验过程中,投喂海带粉和混合藻粉的亲参体壁中粗蛋白含量变化不显著;投喂鼠尾藻粉和混合藻粉的亲参体壁中的粗脂肪含量变化不显著。投喂鼠尾藻粉的亲参在实验第90天,体壁中的粗蛋白含量显著高于其他时间点(P < 0.05),并且显著高于投喂海带粉和混合藻粉的亲参(P < 0.05, 图 2a)。投喂海带粉的亲参在实验第90天,体壁中的粗脂肪含量显著高于初始值(P < 0.05),并且显著高于投喂鼠尾藻粉和混合藻粉的亲参。培育时间和饲料种类对亲参体壁中的粗脂肪含量均具有显著影响,且二者的交互作用显著(F=4.299; P < 0.05, 图 2b)。
|
图 2 不同饲料对亲参体壁粗成分的影响 Fig.2 Body wall chemical composition of A. japonicus conditioned with three different diets |
3个饲料实验组的亲参体壁中的总碳水化合物含量都呈先降低、后升高、然后又降低的趋势。饲料种类对亲参体壁中的总碳水化合物含量没有显著影响,培育时间对亲参体壁中总碳水化合物含量影响显著(P < 0.05),二者之间不存在交互作用。投喂混合藻粉的亲参,在实验第90天,体壁中总碳水化合物含量显著低于初始值(P < 0.05)。投喂海带粉的亲参在实验第90天,体壁中总碳水化合物的含量显著低于实验第60天时的值(P < 0.05, 图 2c)。
2.2.3 雌参性腺粗成分投喂鼠尾藻粉和混合藻粉的雌参性腺中粗蛋白的含量显著高于海带粉组(P < 0.05)。投喂海带粉的雌参性腺中粗脂肪含量最高,投喂混合藻粉的雌参性腺中粗脂肪含量最低,但3组之间没有显著差异。投喂海带粉的雌参性腺中总碳水化合物含量最高,投喂混合藻粉的雌参性腺中总碳水化合物含量最低,但3组之间没有显著差异(表 4)。
|
|
表 4 不同饲料对雌参性腺粗成分的影响 Tab.4 Gonad chemical composition of female A.japonicus conditioned with three different diets |
3个饲料实验组的雌参的性腺指数、平均排卵量、排放率、卵子卵径和受精率没有显著差异。混合藻粉组的受精卵孵化率和早期幼体体长显著高于海带粉组(P < 0.05, 表 5)。
|
|
表 5 不同饲料对亲参繁殖力和子代质量的影响 Tab.5 Reproductive capacity and larvae quality of A. japonicus conditioned with three different diets |
很多研究表明,温带海域海洋无脊椎动物的配子发生受海水温度影响和调控(Fabioux et al, 2005; Marshall et al, 2012)。高水温可以加快冰岛扇贝(Chlamys islandica) (Thorarinsdottir, 1993)、紫扇贝(Wolff, 1998)和绿海胆(Strongylocentrotus droebachiensis) (Siikavuopio et al, 2006)的性腺发育。本研究中,采用15℃水温培育的亲参在实验第82天观察到个别雄参自然排精,而采用12℃水温培育的亲参在实验第103天才观察到个别雄参自然排精。这表明,提高水温也能加快刺参的性腺发育。也有研究表明,升高培育水温并不能缩短紫扇贝配子发育所需的时间(Martinez et al, 2000a)。Griffond等(1992)认为,在卵黄发生前期,水温过高会加速机体的新陈代谢,部分储存的用于卵黄发生的能量被消耗,造成产生的卵子数量减少,质量下降。张鹏(2012)研究发现,当水温为16℃时,刺参用于生长能的比例占摄食所获总能量的比例最高。这说明,可能当水温为16℃时,刺参摄食所获得的能量转化为性腺的效率更高,性腺发育更快。而16℃~20℃为刺参的自然产卵水温(于东祥等, 2010),采用16℃水温进行亲参培育,易导致亲参流产。本研究中,采用15℃水温培育的亲参,其排放率和平均排卵量均显著高于在12℃水温培育的亲参。因此,综合考虑,15℃可能为刺参人工促熟的最佳水温。
对性腺发育的生物学零度和性成熟的有效积温的研究可以为水产动物人工促熟技术的建立提供基础(夏长革等, 2006;吕豪等, 2008;徐永江等, 2011)。国内已有多位学者对刺参的生物学零度和有效积温展开了研究。张玉勇(2005)报道,俄罗斯刺参性腺发育的生物学零度为6.64℃,生殖腺发育有效积温为759℃·d。李爽等(2016)报道,渤海湾地区刺参生殖腺发育的生物学零度为6.14℃,而有效积温为800.19℃·d。曹增名等(2017)报道,刺参生殖腺发育的生物学零度为6.88℃,有效积温为717.31℃·d。经计算,本研究中,刺参生殖腺发育的生物学零度为4.81℃,而有效积温为881.11℃·d,生物学零度比上述研究低,而有效积温较上述研究高。上述研究中,亲参培育温度的平均值范围为13.07℃~15.80℃,而在本研究的水温实验中,亲参培育温度的平均值分别为11.85℃和14.02℃,这可能是造成本研究中刺参性腺发育生物学零度低而有效积温高的原因。
亲体培育饲料的营养成分对海洋动物繁殖力和卵子质量具有重要影响(Uriarte et al, 2004)。提高亲贝培育饲料中的粗蛋白水平,能加快紫扇贝的性腺发育,提高雌性扇贝的繁殖力(Farias et al, 2001)。采用粗蛋白含量高的饲料培育太平洋牡蛎(Crassostrea gigas)亲体,可提高亲体性腺中的粗脂肪含量和受精卵的孵化率(Uriarte et al, 2004)。本研究中,投喂不同饲料的刺参所产受精卵的孵化率差异显著。混合藻粉和鼠尾藻粉中的粗蛋白含量均显著高于海带粉,采用前2种饲料培育的亲参排放率和平均产卵量以及所产受精卵的孵化率和早期幼体体长均高于采用海带粉培育的亲参,这说明一定程度上提高饲料中的粗蛋白水平,有利于亲参的性腺发育和提高卵子质量。
本研究中,采用海带粉培育的雌参繁殖力低于另外2组,其所产受精卵孵化率和幼体体长也显著低于采用混合藻粉培育的雌参,这可能是因为海带粉中总碳水化合物含量较高,而粗蛋白含量较低。Hammer等(2006)研究了饲料中蛋白和总碳水化合物水平对海胆(Lytechinus variegatus)性腺发育的影响,研究表明,随着饲料中的粗蛋白水平升高和总碳水化合物水平降低,海胆性腺中的生殖细胞比例升高,同时,卵子的卵径增大。Heflin等(2012)认为,饲料中的总碳水化合物水平过高会妨碍海胆对蛋白质的消化利用。
饲料中粗脂肪含量对海洋无脊椎动物繁殖力和卵子质量也具有重要影响,一些不饱和脂肪酸是配子发生以及由受精卵发育至幼体的过程中所必需的营养成分(Navarro et al, 2000)。本研究中,海带粉中的粗脂肪含量显著高于鼠尾藻粉,这可能是采用混合藻粉培育的亲参性腺指数、雌参排放率、平均排卵量以及受精卵孵化率和小耳幼体体长高于另外2组的主要原因之一。除了饲料的粗成分以外,饲料中含有的其他微量成分如矿物质、维生素、固醇和天然色素等,也一定程度上决定了其营养价值(Kian et al, 2004)。所以,采用多种饲料原料混合投喂所获得的效果一般要好于单独投喂某一种饲料原料的效果(Martinez et al, 2000a)。
在贝类配子发生过程中,肌肉或消化腺内的碳水化合物代谢加速,为性腺中蛋白质和脂类的合成提供能量和前体(Martinez et al, 1998; Vite-García et al, 2008)。Barber等(1985)对海湾扇贝在配子发生阶段的排氨率和耗氧率以及闭壳肌中肝糖原水平进行了测量,研究表明,扇贝在配子发生过程中,闭壳肌中的总碳水化合物转化为脂肪储藏在卵黄中。在本研究所有实验组中,亲参在培育后期体壁内的总碳水化合物含量都表现出明显的下降趋势,至实验后期,亲参体壁中的总碳水化合物含量均低于初始值,而性腺中粗脂肪含量高于其在体壁中的含量。这说明,和扇贝一样,在配子发生过程中,刺参体壁中的总碳水化合物转化为卵子中的脂肪,为受精卵的发育储备能量。
本研究中,12℃培育的亲参以及饲料实验中以海带粉为饲料的亲参在实验开始后,体壁中粗蛋白和粗脂肪含量都出现短暂的降低。Martinez等(2000b)的研究表明,当饲料不足或者培育水温过高时,扇贝闭壳肌内蛋白质和粗脂肪含量也会出现短暂的降低,这是因为此时闭壳肌中的碳水化合物提供的能量不足,扇贝消耗蛋白质和粗脂肪来获得能量,造成闭壳肌中二者含量出现短暂的降低。同样,在刺参的配子发生过程中,刺参优先从食物和代谢体壁中的碳水化合物来获得能量,当获得的能量不足以支持性腺发育,则代谢蛋白质和脂肪来获得能量。当水温不适宜时,刺参摄食水平和消化率降低(包杰, 2008),因此,消耗体壁或肌肉内的蛋白质和脂肪来为性腺发育提供能量。而当以海带粉为饲料时,因为海带粉蛋白质含量较低,同时,过高的碳水化合物含量妨碍了刺参对蛋白质的消化利用,摄食获得的能量不足,因此,消耗体壁或肌肉内的蛋白质和脂肪来为性腺发育提供能量。
Araya RG, Mingant C, Petton B, et al. Influence of diet assemblage on Ostrea edulis broodstock conditioning and subsequent larval development. Aquaculture, 2012, 364-365: 272-280 DOI:10.1016/j.aquaculture.2012.08.036 |
Barber BJ, Blake NJ. Substrate catabolism related to reproduction in the bay scallop Argopecten irradians concentricus, as determined by O/N and RQ physiological indexes. Marine Biology, 1985, 87(1): 13-18 DOI:10.1007/BF00397001 |
Bao J. Effects and mechanism of environment on growth of green and red sea cucumber, Apostichopus japonicus. Doctoral Dissertation of Ocean University of China, 2008 [包杰.环境因子对青刺参和红刺参(Apostichopus japonicus)代谢与生长及其机制的影响.中国海洋大学博士研究生学位论文, 2008]
|
Cao ZM, Cheng ZX. The relationship between effective accumulated temperature and fecundity of sea cucumber. Shandong Fisheries, 2017, 34(7): 5-6 [曹增名, 程朝霞. 有效积温与刺参产卵量关系的初步探究. 齐鲁渔业, 2017, 34(7): 5-6] |
Dorsey TE, McDonald PW, Roels OA. A heated biuret-Folin protein assay which gives equal absorbance with different proteins. Analytical Biochemistry, 1977, 78(1): 156-164 DOI:10.1016/0003-2697(77)90019-7 |
Dubois M, Gilles KA, Hamilton JK, et al. Colorimetric method for determination of sugars and related substances. Analytical Chemistry, 1956, 28(3): 350-356 DOI:10.1021/ac60111a017 |
Fabioux C, Huvet A, Souchu PL, et al. Temperature and photoperiod drive Crassostrea gigas reproductive internal clock. Aquaculture, 2005, 250(1-2): 458-470 DOI:10.1016/j.aquaculture.2005.02.038 |
Farias A, Uriarte Ⅰ. Effect of microalgae protein on the gonad development and physiological parameters for the scallop Argopecten purpuratus (Lamarck, 1819). Journal of Shellfish Research, 2001, 20(1): 97-105 |
Griffond B, Gomot P, Gomot L. Influence de la temperature sur le deroulement de l'ovogenese chez l'escargot Helix aspersa. Journal of Thermal Biology, 1992, 17(3): 185-190 DOI:10.1016/0306-4565(92)90031-A |
Hammer H, Hammer B, Watts S, et al. The effect of dietary protein and carbohydrate concentration on the biochemical composition and gametogenic condition of the sea urchin Lytechinus variegatus. Journal of Experimental Marine Biology and Ecology, 2006, 334(1): 109-121 DOI:10.1016/j.jembe.2006.01.015 |
Heasman MP, O'Connor WA, Frazer AW. Temperature and nutrition as factors in conditioning broodstock of the commercial scallop Pecten fumatus Reeve. Aquaculture, 1996, 143(1): 75-90 |
Heflin LE, Gibbs VK, Powell ML, et al. Effect of dietary protein and carbohydrate levels on weight gain and gonad production in the sea urchin Lytechinus variegatus. Aquaculture, 2012, 358-359: 253-261 DOI:10.1016/j.aquaculture.2012.06.009 |
Kian AYS, Mustafa S, Rahman RA. Broodstock condition and egg quality in tiger prawn, Penaeus monodon, resulting from feeding bioencapsulated live prey. Aquaculture International, 2004, 12(4-5): 423-433 |
Li S, Li G, Pan YZ, et al. Study on the biological zero point and effective accumulated temperature for the gonad development of sea cucumber. Journal of Anhui Agriculture Sciences, 2016, 44(1): 81-82 [李爽, 李耕, 潘玉洲, 等. 刺参生殖腺发育的生物学零度和有效积温研究. 安徽农业科学, 2016, 44(1): 81-82 DOI:10.3969/j.issn.0517-6611.2016.01.027] |
Lü H, Li X, Dong YC, et al. The relation between effective accumulated temperature and gonad development period of scallop, Argopecten irradians. Marine Sciences, 2008, 32(4): 57-60 [吕豪, 李霞, 董义超, 等. 海湾扇贝种贝人工促熟条件下积温和性腺发育周期的关系. 海洋科学, 2008, 32(4): 57-60] |
Mann R, Gallager SM. Physiological and biochemical energetics of larvae of Teredo navalis L. and Bankia gouldi (Bartsch) (Bivalvia: Teredinidae). Journal of Experimental Marine Biology and Ecology, 1985, 85(3): 211-228 DOI:10.1016/0022-0981(85)90159-5 |
Marshall R, Mckinley RS, Pearce CM. Effect of temperature on gonad development of the Pacific geoduck clam (Panopea generosa Gould, 1850). Aquaculture, 2012, 338-341: 264-273 DOI:10.1016/j.aquaculture.2012.01.004 |
Martinez G, Mettifogo L. Mobilization of energy from adductor muscle for gametogenesis of the scallop, Argopecten purpuratus Lamarck. Journal of Shellfish Research, 1998, 17(1): 113-116 |
Martinez G, Aguilera C, Mettifogo L. Interactive effects of diet and temperature on reproductive conditioning of Argopecten purpuratus broodstock. Aquaculture, 2000a, 183(1-2): 149-159 DOI:10.1016/S0044-8486(99)00291-4 |
Martinez G, Brokordt K, Aguilera C, et al. Effect of diet and temperature upon muscle metabolic capacities and biochemical composition of gonad and muscle in Argopecten purpuratus Lamarck 1819. Journal of Experimental Marine Biology and Ecology, 2000b, 247(1): 29-49 DOI:10.1016/S0022-0981(00)00143-X |
Martinez G, Perez H. Effect of different temperature regimes on reproductive conditioning in the scallop Argopecten purpuratus. Aquaculture, 2003, 228(1-4): 153-167 DOI:10.1016/S0044-8486(03)00321-1 |
Navarro JM, Leiva GE, Martinez G, et al. Interactive effects of diet and temperature on the scope for growth of the scallop Argopecten purpuratus during reproductive conditioning. Journal of Experimental Marine Biology and Ecology, 2000, 247(1): 67-83 DOI:10.1016/S0022-0981(00)00140-4 |
Palma-Fleming H, Navarro JM, Peña E, et al. Effect of three conditioning diets on the fatty acid composition of gonads and muscle of Argopecten purpuratus. New Zealand Journal of Marine and Freshwater Research, 2010, 36(3): 605-620 |
Pronker AE, Nevejan NM, Peene F, et al. Hatchery broodstock conditioning of the blue mussel Mytilus edulis (Linnaeus 1758). Part Ⅰ. Impact of different micro-algae mixtures on broodstock performance. Aquaculture International, 2008, 16(4): 297-307 DOI:10.1007/s10499-007-9143-9 |
Siikavuopio SI, Christiansen JS, Dale T. Effects of temperature and season on gonad growth and feed intake in the green sea urchin (Strongylocentrotus droebachiensis). Aquaculture, 2006, 255(1-4): 389-394 DOI:10.1016/j.aquaculture.2005.12.021 |
Thorarinsdottir GG. The iceland scallop, Chlamys islandica (O.F. Müller), in Breidafjördur, west Iceland: Ⅱ. Gamete development and spawning. Aquaculture, 1993, 110(1): 87-96 DOI:10.1016/0044-8486(93)90436-3 |
Uriarte I, Farías A, Hernandez J, et al. Reproductive conditioning of Chilean scallop (Argopecten purpuratus) and the Pacific oyster (Crassostrea gigas): Effects of enriched diets. Aquaculture, 2004, 230(1-4): 349-357 DOI:10.1016/S0044-8486(03)00419-8 |
Vite-García N, Saucedo PE. Energy storage and allocation during reproduction of pacific winged pearl oyster Pteria sterna at Bahia de la Paz, Baja California Sur, Mexico. Journal of Shellfish Research, 2008, 27(2): 375-383 DOI:10.2983/0730-8000(2008)27[375:ESAADR]2.0.CO;2 |
Wolff M. Spawning and recruitment in the Peruvian scallop Argopecten purpuratus. Marine Ecology Progress Series, 1998, 42(3): 213-217 |
Xia CG, Su YM, Chang YQ. Biological zero temperature and effective accumulated temperature of embryonic development in sea urchin Strongylocentrous nudus. Fisheries Science, 2006, 25(8): 379-382 [夏长革, 苏延明, 常亚青. 光棘球海胆胚胎发育生物学零度和有效积温的初步研究. 水产科学, 2006, 25(8): 379-382 DOI:10.3969/j.issn.1003-1111.2006.08.001] |
Xu HG, Zhang YL, Luo K, et al. Arachidonic acid in diets for early maturation stages enhances the final reproductive performances of Pacific white shrimp (Litopenaeus vannamei). Aquaculture, 2017, 479: 556-563 DOI:10.1016/j.aquaculture.2017.06.037 |
Xu YJ, Liu XZ, Liu JG, et al. Histological and morphometric studies on the annual gonadal maturation cycle of spotted halibut Verasper variegatus. Progress in Fishery Sciences, 2011, 32(3): 7-15 [徐永江, 柳学周, 刘君刚, 等. 圆斑星鲽卵巢发育的组织学和数量形态特征研究. 渔业科学进展, 2011, 32(3): 7-15 DOI:10.3969/j.issn.1000-7075.2011.03.002] |
Yu DX, Sun HL, Chen SQ, et al. Health culture technology of sea cucumber. Beijing: China Ocean Press, 2010 [于东祥, 孙慧玲, 陈四清, 等. 海参健康养殖技术. 北京: 海洋出版社, 2010]
|
Zhang P. Effect of salinity, light intensity and temperature on growth and energy metabiolism of red and green variants of Apostichopus japonicus. Doctoral Dissertation of Ocean University of China, 2012, 1–140 [张鹏.盐度、光照强度、温度对青色系、红色系仿刺参(Apostichopus japonicus)生长和能量分配的影响.中国海洋大学博士研究生学位论文, 2012, 1–140]
|
Zhang YY. Hybridization of Chinese and Russian populations of Apostichopus japonicus and comparison on main traits of F1. Masterxs Thesis of Dalian Ocean University, 2005 [张玉勇.中国与俄罗斯不同地理种群刺参杂交育种及杂交子一代性状的比较研究.大连水产学院硕士研究生学位论文, 2005]
|



