2. 江苏省海洋生物产业技术协同创新中心 连云港 222005;
3. 江苏省农业种质资源保护与利用平台 南京 210014;
4. 江苏省海洋资源开发研究院(连云港) 连云港 222005
2. Co-Innovation Center of Jiangsu Marine Bio-Industry Technology, Lianyungang 222005;
3. Jiangsu Provincial Infrastructure for Conservation and Utilization of Agricultural Germplasm, Nanjing 210014;
4. Marine Resource Development institute of Jiangsu(Lianyungang), Lianyungang 222005
丝氨酸羟甲基转移酶(Serine hydroxyl methyl- transferase, SHMT)是一类广泛存在于原核生物和真核生物中含有磷酸吡哆醛(PLP)四聚体的蛋白质(Schirch et al, 2005),其主要功能是在亚甲基四氢叶酸存在时,催化甘氨酸–丝氨酸相互转化为许多生物合成反应提供一碳单元,一碳单位代谢是所有生物尤其是植物体内重要的初级代谢反应,将氨基酸代谢与核苷酸及一些重要物质的生物合成关联起来(Bauwe et al, 2003),线粒体为单碳供体如丝氨酸、甘氨酸、肌氨酸和二甲基甘氨酸提供氧化的场所(Tibbetts et al, 2010)。目前,关于SHMT的研究在微生物、植物和动物中均有报道(McClung et al, 2000; Garrow et al, 1993; Bauwe et al, 2003; 林颖辉等, 2018)。仅在拟南芥(Arabidopsis thaliana)中就发现SHMT基因的7种亚型:SHMT1、SHMT2、SHMT3、SHMT4、SHMT5、SHMT6和SHMT7,其中,SHMT1和SHMT2被认为可能为线粒体型,SHMT3为胞质型,但胞浆型(SHMT4和SHMT5)和细胞核(SHMT6和SHMT7)中的定位仍有待证实(Wei et al, 2013; McClung et al, 2000)。
关于SHMT酶活性质和性能等方面的研究多集中在微生物领域(冯炎, 2002; 孔庆胜等, 2010)。在细胞生理学上,SHMT是叶酸代谢过程中的关键酶之一,参与DNA、RNA合成、甲基供体及甲硫氨酸和辅酶等多种终端产物的合成。SHMT也能够催化5, 10-亚甲基四氢叶酸水解生成5-甲基四氢叶酸。5-甲基四氢叶酸的合成过程被认为是一碳单元和还原性叶酸在细胞中短暂保存的形式。SHMT基因在植物中的研究多与生长、抗逆和抗病虫害有关(Weinstock, 1970; 朱晓岚, 2017; 孙洁等, 2016; Sonnewald, 2008)。除此在外,SHMT还可通过影响机体的异常甲基化而引起致癌基因的激活和抑癌基因的失活,促进肿瘤的发生,因此,其在人类中的研究多与肿瘤有关(王益民等, 2006)。已有研究证实,在癌细胞增殖过程中,线粒体型SHMT2的表达显著升高,胞质型SHMT1的表达没有明显变化(Deberardinis, 2011; Koppenol et al, 2011)。但该基因在甲壳生物中还未见报道,其生物学功能尚不清楚。在前期获得的不同饥饿胁迫条件下的脊尾白虾转录组序列中发现了该基因,本研究旨在通过克隆该基因并进一步阐释其在脊尾白虾中的生物学功能。
1 材料与方法 1.1 实验材料本实验所用脊尾白虾取自实验室同一个母本繁育而来的家系成体,选取正常条件下体格健壮、大小均匀的脊尾白虾3只,分别取其眼柄、胃、肝胰腺、心脏、鳃、肠、肌肉、腹索神经、皮下脂肪以及卵巢10个组织用于RNA的提取。
1.2 Cd2+胁迫条件的设置根据预实验结果,采用单因子实验设计的方法,设置对照组和4个不同浓度梯度的实验组:实验组1 (0.0100 mmol/L)、实验组2 (0.0175 mmol/L)、实验组3 (0.0210 mmol/L)和实验组4 (0.0278 mmol/L),各梯度以1 mol/L的CdCl2原液进行调配。胁迫实验在室内独立养殖箱(长×高×宽为80 cm×60 cm×60 cm)中进行,实验前在该环境(室温20~25℃,盐度25)下暂养7 d,期间每天换水1次,早晚投喂饵料及吸污各1次。实验时,每组选择大小均匀、健壮的脊尾白虾70尾,期间为避免水环境中Cd2+浓度变化幅度较大,采取不投饵、不换水的方式。胁迫实验共进行96 h,分别在0、3、6、12、24、48、72和96 h共8个时间点取样,每组每次共取3个平行样品。
1.3 总RNA的提取和cDNA合成 1.3.1 总RNA的提取用滤纸吸干脊尾白虾表面的海水后,分别选取脊尾白虾各组织样品用于RNA的提取。RNA提取采用UNIQ-10柱式Trizol总RNA提取试剂盒[生工生物工程(上海)],为防止RNA污染以及降解,提取过程需全程佩戴口罩,勤换手套,并采用RNase Free的实验器材。1%琼脂糖凝胶电泳验证RNA完整性,微量分光光度计UV-Vis测定RNA纯度,RNA于–80℃保存。
1.3.2 cDNA第一链的合成以脊尾白虾各组织混合RNA为模板,一部分直接反转录为cDNA,合成试剂盒选用PrimerScriptTM RT Master Mix(TaKaRa)。另一部分利用SMARTTM RACE cDNA amplification试剂盒(TaKaR),分别合成5'和3'RACE-ready cDNA,余下RNA于–80℃保存。
1.4 引物及其序列实验所用引物由生工生物工程(上海)有限公司合成,序列见表 1。
|
|
表 1 实验所用引物 Tab.1 Primers used in the experiment |
以脊尾白虾转录组序列为模板,设计SHMT核心序列引物(表 1)。以脊尾白虾各组织混合cDNA为模板,PCR扩增SHMT核心片段,克隆产物通过1.5%琼脂糖凝胶验证。切胶纯化回收目的产物,胶回收试剂盒选自生工生物工程(上海)有限公司。回收纯化后产物经克隆转化后送至生工生物工程(上海)有限公司进行测序。
1.5.2 脊尾白虾SHMT基因cDNA 5'和3'末端的快速扩增根据获得的脊尾白虾SHMT基因的核心片段,设计特异性引物IS-DNMT-GSP-1-1用于5'端的快速扩增,IS-DNMT-GSP2-1、IS-DNMT-GSP-2-2和IS-DNMT-GSP2-5用于3'端的快速扩增(表 1)。25 μl反应体系,PCR反应程序按照TaKaRa RACE扩增试剂盒中的要求进行。反应完成后,1.5%琼脂糖凝胶电泳验证,切取目的条带并回收,克隆测序,方法同上。测序结果在DNAMAN v6软件完成拼接,拼接序列在NCBI (https://www.ncbi.nlm.nih.gov/)进行比对,获得完整的cDNA序列。
1.5.3 脊尾白虾SHMT基因DNA全序列的克隆根据已获得的脊尾白虾SHMT基因cDNA序列设计覆盖全序列的5对内含子验证引物,分别以脊尾白虾cDNA、DNA为模板进行PCR扩增,扩增产物以1%凝胶电泳验证不同DNA模板中同一引物扩增产物条带大小是否一致,以此来判定DNA序列中是否存在内含子。
1.6 脊尾白虾SHMT基因的生物信息学分析基因的生物信息学分析主要通过以下程序或软件进行:利用NCBI对所获得基因序列进行检测和氨基酸序列比对;利用ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)软件进行SHMT基因的开放阅读框预测以及其所编码氨基酸序列的分析;利用在线软件ExPASy Prot Param (http://web.expasy.org/protparam/)进行蛋白质理化性质分析;利用Compute pI/Mw软件(http://web.expasy.org/compute_pi/)进行理论等电点和分子量的计算;利用SMART软件(http://smart.embl-heidelberg.de/index2.cgi)进行信号肽预测及蛋白结构域的预测分析;通过在线软件Cell-PLoc 2.0 (http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)对SHMT基因进行亚细胞定位;用MEGA6.0软件进行氨基酸序列的多重比对及NJ系统进化树的构建。
1.7 脊尾白虾SHMT基因组织表达水平分析根据已获得的脊尾白虾SHMT基因cDNA全序列设计荧光定量引物,并以脊尾白虾18S rRNA作为内参基因(表 1)进行组织表达分析(薛蓓等, 2017)。
qRT-PCR分析所用试剂选自SYBR Premix Ex TaqⅡ试剂盒(TaKaRa),每个反应设3个平行样,反应体系20 μl:2×SYBR Premix Ex TaqTMⅡ 10 μl,dd H2O 4 μl,cDNA模板4 μl,Rox Reference DyeⅠ(50×) 0.4 μl,正反向引物(10 μmol/L)各0.8 μl,反应程序按照试剂盒要求进行,qRT-PCR扩增在Step One Plus仪器上进行。
1.8 数据分析实验最终各定量结果采用SPSS 18.0和Excel软件进行统计分析,并采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异,P < 0.05表示差异显著,P < 0.01表示极显著差异。
2 结果 2.1 脊尾白虾SHMT基因序列全长及分析脊尾白虾SHMT cDNA全长为1855 bp (GenBank登录号:MH013225),开放阅读框为1407 bp,5'非编码区为39 bp,3'非编码区为409 bp,共编码468个氨基酸,预测蛋白质的分子质量为152.55 kDa,理论等电点为4.90。7对内含子验证引物在脊尾白虾cDNA和DNA中的扩增结果一致,表明该基因不含内含子。应用SignalIP软件对SHMT预测蛋白信号肽分析,显示该蛋白不含信号肽序列。亚细胞定位软件Cell-PLoc 2.0预测脊尾白虾SHMT定位于线粒体中。
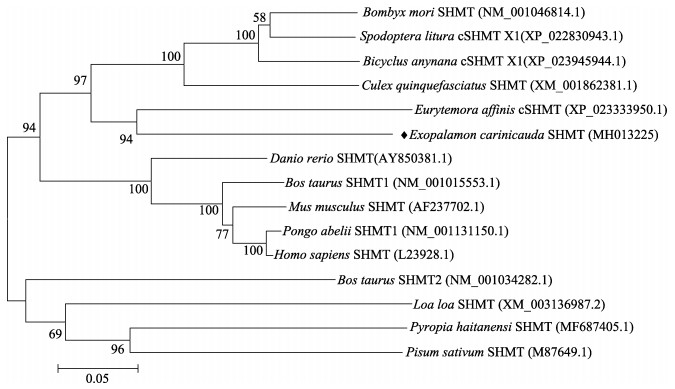
2.2 脊尾白虾SHMT基因同源性分析为了解脊尾白虾SHMT基因与其他物种的同源性关系,从NCBI的GenBank数据库中选取15条不同物种的SHMT氨基酸序列,使用MEGA 6.0软件(Neighbor-Joining法)对脊尾白虾SHMT进行聚类分析,构建进化树。如图 2所示,脊尾白虾SHMT与甲壳类动物真宽水蚤(Eurytemora affinis)聚为一类,且同源性较高,之后与昆虫类聚为一类。脊椎动物中智人(Homo sapiens)和猩猩(Pongo abelii)聚为一类,随后与小鼠(Mus musculus)、牛(Bos taurus)和斑马鱼(Danio rerio)聚为一类。最后,牛的SHMT2和植物类、原生动物单独聚为一类。该聚类结果符合传统分类学结果。

|
图 1 脊尾白虾SHMT基因的DNA全长序列及其编码的氨基酸序列
Fig.1 The full-length cDNA sequence of Exopalaemon carinicauda SHMT gene and its deduced amino acid sequence
加粗部位为起始密码(ATG)和终止密码(TGA),方框内为甘氨酸富集区域(GLQGGP),下划线部位为加尾信号(AATAA)
The bold sections were the start codon (ATG) and the stop codon (TGA), the letters in box indicated conserved glycine rich region, and the underlined sections were the tailing signal (AATAA) |
|
图 2 脊尾白虾SHMT系统进化树分析 Fig.2 NJ phylogenetic tree based on SHMT amino acid sequences of Exopalaemon carinicauda and other species |
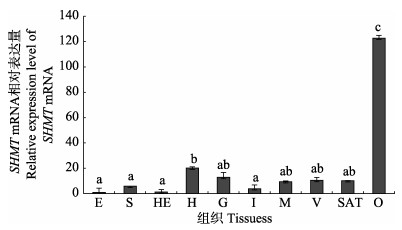
为了解SHMT在脊尾白虾不同组织间的表达特征,利用荧光定量PCR技术对脊尾白虾10个组织中SHMT mRNA水平进行检测。结果显示(图 3),SHMT在10个组织中均有表达,但不同组织间差异显著,其中,在卵巢中表达量最高,显著高于其他各组织(P < 0.01),心脏次之。
|
图 3 脊尾白虾SHMT在不同组织中的表达特征 Fig.3 Relative expression of SHMT in various tissues of Exopalaemon carinicauda E:眼柄; S:胃; HE:肝胰腺; H:心脏; G:鳃; I:肠; M:肌肉; V:腹索神经; SAT:皮下脂肪组织; O:性腺不同字母表示不同组织SHMT的表达量差异显著(P < 0.05) E: Eyestalk; S: Stomach; HE: Hepatopancreas; H: Heart; G: Gill; I: Intestines; M: Muscle; V: Ventricular nerve; SAT: Subcutaneous fat tissue; O: Ovary bar of each column with different small letters mean significant difference (P < 0.05) |
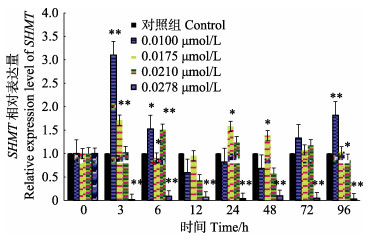
不同浓度的Cd2+胁迫下,脊尾白虾SHMT的qRT-PCR结果见图 4。脊尾白虾SHMT含量在对照组中显示出相对平稳的趋势,实验组1 (0.0100 mmol/L)和实验组2 (0.0175 mmol/L)均表现出自3 h开始升高后下降再升高的趋势,不同的是,实验组1 (0.0100 mmol/L)经下降后,相对于对照组,在96 h极显著升高(P < 0.01),实验组2 (0.0175 mmol/L)经下降后在24 h表现出相对于对照组极显著升高(P < 0.01);实验组3 (0.0210 mmol/L)在6 h开始有相对于对照组的极显著升高(P < 0.01),随后下降再升高;实验组4 (0.0278 mmol/L)表现出相对于对照组的极显著降低(P < 0.01),几乎不表达。
|
图 4 不同浓度Cd2+胁迫下脊尾白虾体内SHMT基因的表达量随时间的变化
Fig.4 Expression of SHMT gene in Exopalaemon carinicauda after being exposed to different concentrations of cadmium
*表示与对照组相比差异显著(P < 0.05),**表示与对照组相比差异极显著(P < 0.01)
*and** represent significant difference (P < 0.05) and highly significant difference (P < 0.01) between test and control, respectively |
SHMT通过将丝氨酸和四氢叶酸转化为甘氨酸和N5, N10亚甲基四氢叶酸,为核苷酸、蛋白质和甲基的生物合成过程提供活化的一碳单元。研究表明,丝氨酸羟甲基转移酶中均含有一个保守的甘氨酸富集区域GLQGGP,可能在与5'-磷酸吡哆醛结合过程中发挥重要作用,说明SHMT是以磷酸吡哆醛为辅酶进行反应的(Usha et al, 1994)。进化树分析发现,其与甲壳动物真宽水蚤胞质型SHMT聚为一类,而亚细胞定位软件预测脊尾白虾SHMT定位于线粒体,因此,还需要进一步的研究进行验证。
在研究脊尾白虾SHMT组织表达特异性中发现,其在卵巢中表达量极显著高于其他各组织,该表达模式与SHMT在斑马鱼中的表达模式相似,同时,支持了SHMT可能是母系必需基因的观点(Chang et al, 2007; Vatcher et al, 1998)。除此之外,有研究发现,SHMT在家蚕(Bombyx mori)的脂肪体和表皮中表达量最高,可能在丝素合成过程中有重要作用(李俊龙, 2014)。据此,推测脊尾白虾卵巢中SHMT的高表达可能也与其发育有关。
重金属镉(Cd)是目前近海主要污染物之一,在水体中不易降解,水生物通过食物链的富集可达到数千乃至万倍,且不易排出体外(张瑞等, 2013; 冼健安等, 2012; van Hattum et al, 1989)。脊尾白虾养殖和繁育近海海域区域受到重金属镉污染的问题越来越受到关注(李先超, 2011)。研究表明,镉可对甲壳动物产生的不利影响是多方面的,主要表现在体内主要抗氧化酶活、代谢酶活、细胞结构的损伤以及抑制卵巢发育(Wu et al, 2004; Zhang et al, 2014; 李文艳等, 2008)。除此之外,还会影响多种生物出现异常甲基化以及某些功能基因的表达(王子成等, 2009; 王丙莲等, 2006; Zhang et al, 2015),因此,希望通过脊尾白虾体内SHMT在应对Cd2+胁迫的表达特征,来分析其可能具备的生物学功能。本研究发现,在低浓度实验组(实验组1、实验组2和实验组3)中均表现出波动状态;但在高浓度实验组(实验组4),其表达量明显下降,这说明长时间低浓度Cd2+的胁迫可能导致机体的适应,这与李文艳等(2008)的研究结果一致。但高浓度的Cd2+胁迫可能对机体损伤较大,使其代谢机制出现异常,直接表现为氨氮排泄量增加,耗氧量(O/N)降低(Zhang et al, 2014),SHMT的表达相应受到抑制。其内在的作用机制还有待进一步研究。
Bauwe H, Kolukisaoglu U. Genetic manipulation of glycine decarboxylation. Journal of Experimental Botany, 2003, 54(387): 1523-1535 DOI:10.1093/jxb/erg171 |
Chang WN, Tsai JN, Chen BH, et al. Serine hydroxymethyl- transferase isoforms are differentially inhibited by leucovorin: Characterization and comparison of recombinant zebrafish serine hydroxymethyltransferases. Drug Metabolism and Disposition: the Biological Fate of Chemicals, 2007, 35(11): 2127 DOI:10.1124/dmd.107.016840 |
Deberardinis R. Serine metabolism: Some tumors take the road less traveled. Cell Metabolism, 2011, 14(3): 285-286 DOI:10.1016/j.cmet.2011.08.004 |
Feng Y. Expression and cloning of the glyA gene encoding the serine hydroxymethyltransferase. Masterxs Thesis of Nanjing Tech University, 2002 [冯炎.丝氨酸羟甲基转移酶基因的克隆与表达.南京工业大学硕士研究生学位论文, 2002]
|
Garrow TA, Brenner AA, Whitehead VM, et al. Cloning of human cDNAs encoding mitochondrial and cytosolic serine hydroxymethyltransferases and chromosomal localization. Journal of Biological Chemistry, 1993, 268(16): 11910 |
Kong QS, Zhang XY, Han XL, et al. Molecular cloning and expression of a glyA gene from Methylobacterium. sp SDM11. Biotechnology Bulletin, 2010(5): 141-144 [孔庆胜, 张向阳, 韩晓琳, 等. 甲醇利用菌SDM11中glyA基因的克隆及其在大肠杆菌中的表达. 生物技术通报, 2010(5): 141-144] |
Koppenol WH, Bounds PL, Dang CV. Otto Warburg's contributions to current concepts of cancer metabolism. Nature Reviews Cancer, 2011, 11(5): 325-337 DOI:10.1038/nrc3038 |
Li JL. Identification and enzymatic properties of Serine hydroxymethyltransferase from the silkworm, Bombyx mori. Masterxs Thesis of Southwest University, 2014 [李俊龙.家蚕丝氨酸经甲基转移酶BmSHMT的鉴定及酶活性质研究.西南大学硕士研究生学位论文, 2014]
|
Li WY, Kang XJ, Mu SM, et al. Research advance of toxicological effects of cadmium on shrimps and crabs. Fisheries Science, 2008, 27(1): 47-50 [李文艳, 康现江, 穆淑梅, 等. 镉对虾蟹毒性效应的研究进展. 水产科学, 2008, 27(1): 47-50] |
Li XC. The study on the current ecological environment situation and its developmental feather in off-shore area of Shandong Province (focus on Yellow Sea). Doctoral Dissertation of Ocean University of China, 2011 [李先超.山东近岸海域(黄海部分)生态环境现状及演变特征研究.中国海洋大学博士研究生学位论文, 2011]
|
Lin YH, Wang WL, Xu Y, et al. Cloning and expression analysis of serine hydroxyl methyltransferase (SHMT) genes from Pyropia haitanensis. Progress in Fishery Sciences, 2018, 39(5): 122-129 [林颖辉, 王文磊, 徐燕, 等. 坛紫菜丝氨酸羟甲基转移酶基因的克隆及表达特征. 渔业科学进展, 2018, 39(5): 122-129] |
McClung CR, Hsu M, Painter JE, et al. Integrated temporal regulation of the photorespiratory pathway. Circadian regulation of two Arabidopsis genes encoding serine hydroxymethyltransferase. Plant Physiology, 2000, 123(1): 381-392 |
Schirch V, Szebenyi DM. Serine hydroxymethyltransferase revisited. Current Opinion in Chemical Biology, 2005, 9(5): 482-487 DOI:10.1016/j.cbpa.2005.08.017 |
Sonnewald U. Serine hydroxymethyltransferase as target for herbicides. BASF Aktiengesellschaft, 2008
|
Sun J, Pang SZ, Xuan WY, et al. Proteomics analysis of banana seedlings under drought stress. Journal of Southern Agriculture, 2016, 47(12): 2020-2026 [孙洁, 庞昇泽, 禤维言, 等. 干旱胁迫下香蕉幼苗蛋白质组学分析. 南方农业学报, 2016, 47(12): 2020-2026] |
Tibbetts AS, Appling DR. Compartmentalization of mammalian folate-mediated one-carbon metabolism. Annual Review of Nutrition, 2010, 30(1): 57-81 DOI:10.1146/annurev.nutr.012809.104810 |
Usha R, Savithri HS, Rao AN. The primary structure of sheep liver cytosolic serine hydroxymethyltransferase and an analysis of the evolutionary relationships among serine hydroxymethyltransferases. Biochimica et Biophysica Acta, Protein Structure and Molecular Enzymology, 1994, 1204(1): 75-83 DOI:10.1016/0167-4838(94)90035-3 |
van Hattum B, de Voot P, van der Bosch L, et al. Bioaccumulation of cadmium by the freshwater isopod Asellus aquaticus (L. ) from aqueous and dietary sources. Environmental Pollution, 1989, 62(2): 129-151 |
Vatcher GP, Thacker CM, Kaletta T, et al. Serine hydroxymethyltransferase is maternally essential in Caenorhabditis elegans. Biological Chemistry, 1998, 273: 6066-6073 DOI:10.1074/jbc.273.11.6066 |
Wang BL, Zhang YM, Tan YF, et al. Influence of cadmium and lead on the DNA methylation level of loach Misgurnus anguillicaudatus. Journal of Toxicology, 2006, 20(2): 78-80 [王丙莲, 张迎梅, 谭玉凤, 等. 镉铅对泥鳅DNA甲基化水平的影响. 毒理学杂志, 2006, 20(2): 78-80 DOI:10.3969/j.issn.1002-3127.2006.02.005] |
Wang YM, Guo W, Zhang XF, et al. Correlations between serine hydroxymethyltransferase1 C1420T polymorphisms and susceptibilities to esophageal squamous cell carcinoma and gastric cardiac adenocarcinoma. Chinese Journal of Cancer, 2006, 25(3): 281-286 [王益民, 郭炜, 张秀凤, 等. 丝氨酸羟甲基转移酶基因C1420T多态性与食管鳞癌、贲门腺癌易感性的关系. 癌症, 2006, 25(3): 281-286] |
Wang ZC, Ma HX, He YX. Effects of cadmium on Arabidopsis thaliana DNA methylation. Plant Physiology Communications, 2009, 45(2): 115-118 [王子成, 马洪霞, 何艳霞. 重金属镉对拟南芥DNA甲基化的影响. 植物生理学报, 2009, 45(2): 115-118] |
Wei Z, Sun K, Sandoval FJ, et al. Folate polyglutamylation eliminates dependence of activity on enzyme concentration in mitochondrial serine hydroxymethyltransferases from Arabidopsis thaliana. Archives of Biochemistry and Biophysics, 2013, 536(1): 87-96 DOI:10.1016/j.abb.2013.06.004 |
Weinstock J. The biochemistry of folic acid and related pteridines. American Scientist, 1970, 72(4): 431 |
Wu JP, Chen HC. Effects of cadmium and zinc on oxygen consumption, ammonium excretion, and osmoregulation of white shrimp (Litopenaeus vannamei). Chemosphere, 2004, 57(11): 1591-1598 DOI:10.1016/j.chemosphere.2004.07.033 |
Xian JA, Wang AL, Miao YT, et al. Toxic effects of cadmium on haemocytes of Litopenaeus vannamei in vitro. Journal of Hydroecology, 2012, 33(1): 112-115 [冼健安, 王安利, 苗玉涛, 等. 镉对凡纳滨对虾离体血细胞的毒性影响. 水生态学杂志, 2012, 33(1): 112-115] |
Xue B, Zhang P, Li ZH, et al. Cloning, expression and stability analysis of the reference gene glyceraldehyde-3-phosphate dehydrogenase (GAPDH) in Exopalaemon carinicauda. Journal of Fishery Sciences of China, 2017, 24(5): 1003-1012 [薛蓓, 张培, 李志辉, 等. 脊尾白虾GAPDH基因的克隆及其内参基因稳定性分析. 中国水产科学, 2017, 24(5): 1003-1012] |
Zhang C, Li F, Xiang J. Acute effects of cadmium and copper on survival, oxygen consumption, ammonia-N excretion, and metal accumulation in juvenile Exopalaemon carinicauda. Ecotoxicology and Environmental Safety, 2014, 104: 209-214 DOI:10.1016/j.ecoenv.2014.01.008 |
Zhang JQ, Gui TS, Wang J, et al. The ferritin gene in ridgetail white prawn Exopalaemon carinicauda: Cloning, expression and function. International Journal of Biological Macromolecules, 2015, 72: 320-325 DOI:10.1016/j.ijbiomac.2014.08.036 |
Zhang R, Zhang F, Liu FC, et al. History of heavy metal pollution from tidal flat in Haizhou Bay. Environmental Science, 2013, 34(3): 1044-1054 [张瑞, 张帆, 刘付程, 等. 海州湾潮滩重金属污染的历史记录. 环境科学, 2013, 34(3): 1044-1054] |
Zhu XL. Sequence diversity and functional analysis of SHMT gene of small black soybean cyst nematode. Masterxs Thesis of Shenyang Agricultural University, 2017 [朱晓岚.小黑豆抗胞囊线虫SHMT基因序列多样性及功能分析.沈阳农业大学硕士研究生学位论文, 2017]
|



