2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 青岛 266071
2. Pilot National Laboratory for Marine Science and Technology Qingdao, Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao 266071;
3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs, Qingdao 266071
中国对虾为我国近海特有的品种,主要分布在黄海、渤海和朝鲜西部沿海,是我国海水养殖的主要种类(Deng et al, 1990;林群等, 2018)。为了满足人们的需求,水产养殖业的规模化迅速发展,高密度养殖成为提高对虾养殖产量、降低养殖成本的重要途径。然而,随着密度增加,种群个体之间对资源和空间的竞争将导致动物在生长、能量、生理及免疫功能等一系列变化,最终可能会导致动物生存能力降低(Piekcing et al, 1989)。中国对虾缺乏获得性免疫系统,它主要依靠各种类型的非特异性免疫因子来抵抗外部环境胁迫和各种病原感染,抗氧化系统在消除环境胁迫产生的过量活性氧(ROS)方面起着重要作用。
邓勇辉等(2001)采用大棚温室将罗氏沼虾(Macrobrachium rosenbergii)幼虾暂养30 d左右再移于外塘养成,认为中间暂养能够有限提高对虾的生长和成活率。张嘉萌等(1989)和Li等(2006)虽然报道了密度胁迫对中国对虾生长性状的影响,但对于中国对虾幼虾在小水体(中间暂养)条件下的生长规律及合适的养殖密度的相关研究较少。
作者研究了密度胁迫对中国对虾生长、抗氧化系统功能及水质指标的影响,以期为进一步研究中国对虾在不同密度胁迫下的适应机制提供参考,并为中国对虾的养殖提供相应的技术支撑。
1 材料与方法 1.1 材料健康中国对虾于2018年5月取于山东昌邑市海丰水产养殖有限责任公司,育苗后暂养,用随机抽样的方法挑选健壮无病、平均体长为(2.0±0.1) cm、平均体重为(0.08±0.01) g的虾苗,暂养于32 cm×38 cm×50 cm的水箱,实验用水为过滤净化后的天然海水,盐度为33.47,水温为24.1℃,pH为8.19,溶解氧为6.62 mg/L。
1.2 实验设计与饲养管理根据前期预实验结果(张天时等, 2008),共设置4个密度组,记为G0(对照组)、G1、G2和G3,分别对应实验密度12、25、50、100尾/箱,相当于中国对虾养殖密度为250、500、1000、2000尾/m3,每组设置3个平行。整个实验周期为40 d,24 h持续充氧,每天饲料投喂活卤虫,投喂量为中国对虾体重的8%,分4次投喂(08:00、12:00、16:00和22:00),每天换水1/3。养殖过程中及时将死亡的中国对虾捞出,并通过调整实验水体的大小来保持实验密度。每10 d测1次水质及体长和体重,记录每个实验组的死亡个数,统计死亡率,分别在实验前、养殖20 d和结束时取样。
1.3 实验方法 1.3.1 样品的采集用1 ml一次性注射器吸取在4℃预冷的抗凝剂0.5 ml,从对虾的围心腔抽取0.5 ml的血淋巴液,混合均匀后加入无RNA酶的1.5 ml离心管中,4500 r/min离心15 min,取上清液,置于80℃冰箱保存; 鳃、肝胰腺、肌肉组织样品分别取0.2 g,肝胰腺、鳃,剪碎,加入1:9的预冷生理盐水,超声波冰浴破碎组织,4℃下4000 r/min离心20 min后,取上清液置于-80℃冰箱保存,用于组织酶活测定。
1.3.2 生长指标的测定增重率(WGR, %)=100×(W2-W1)/W1;
相对增长率(AGR, %/d)=100×(W2-W1)/d;
特定生长率(SGR, %/d)=100×(lnW2-lnW1)/d;
体重差异系数(CV, %)=100×体重标准差/平均体重;
成活率(SR, %)=100×N2/N1
式中,W1,W2分别为各测量阶段的初始体重和末体重,N1,N2分别为实验初始尾数和结束尾数,d为养殖天数。
1.3.3 抗氧化指标的测定总抗氧化能力(T-AOC)、超氧化歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)和谷胱甘肽过氧化物酶(GPx)指标,均采用上海酶联生物科技有限公司生产的试剂盒测定,测定方法参照说明书进行。
1.3.4 水质的测量温度、盐度、pH和DO含量借助于YSI 556型水质分析仪测定。采用次溴酸盐氧化法测定氨氮,萘乙二胺分光光度法测定亚硝酸盐氮,锌镉还原法测定硝酸氮,高锰酸钾分光光度法测定化学需氧量。
1.4 实验数据的统计分析实验数据用平均值±标准误(Mean±SE)表示,数据分析采用SPSS17.0单因素方差分析(One-way ANOVA)进行处理,以P < 0.05为差异显著,以P < 0.01为差异极显著,用Origin软件作图。
2 结果与分析 2.1 密度对中国对虾幼虾生长的影响由图 1可见,养殖密度对中国对虾体长、体重的影响存在显著差异(P < 0.05),随养殖密度的增加而降低。养殖10 d时,体长和体重在4个密度中无显著差异(P > 0.05);20 d时,G3显著低于G0(P < 0.05),G1和G2差异不显著(P > 0.05);30 d时,G1、G2和G3均显著低于G0(P < 0.05);40 d时,G3的体长和体重与对照组差异极显著(P < 0.01),G1和G2与对照组差异显著(P < 0.05)。

|
图 1 密度胁迫在各养殖阶段对中国对虾体长和体重的影响
Fig.1 Effects of density stress on length and weight of F. chinensis during different culture stages
G0~G3分别为250、500、1000和2000尾/m3 *表示同一时间实验组与对照组差异显著(P < 0.05);**表示同一时间实验组与对照组差异极显著(P < 0.01),下同 G0~G3 are 250, 500, 1000, and 2000 ind./m3 respectively *indicated significant difference (P < 0.05); ** indicated highly significant difference (P < 0.01). The same as below |
通过对实验过程中养殖成活率的统计(表 1)可以看出,中国对虾的成活率随着养殖密度的增加而降低。养殖10 d时,存活率在4个密度中差异不显著(P > 0.05);20 d时,G3显著低于G0组(P < 0.05),G1和G2与对照组差异不显著(P > 0.05);30 d时,G3成活率下降为65%,与对照组差异极显著(P < 0.01),G1和G2差异显著(P < 0.05);40 d时,G2和G3成活率均达极显著水平(P < 0.01),分别下降为60%和55%,G1达显著水平(P < 0.05),由对照组的85%下降为74%。
|
|
表 1 密度胁迫在各养殖阶段对中国对虾成活率的影响 Tab.1 Effects of density stress on survival rate of F. chinensis during different culture stages |
养殖40 d后(表 2),中国对虾的增重率、相对增长率和特定生长率均随养殖密度的增加而降低,体重差异系数随养殖密度增加而增加。G3的各项生长指标与对照组相比,均达极显著水平(P < 0.01),G1和G2差异显著(P < 0.05),说明养殖密度的增加严重影响了中国对虾的生长。
|
|
表 2 密度胁迫下养殖40 d时对中国对虾生长指标的影响 Tab.2 Effects of density stress on growth indicators of F. chinensis for 40 days |
从图 2可以看出,中国对虾体内T-AOC活力为肝胰腺 > 肌肉 > 血淋巴 > 鳃,各组织T-AOC活力随密度增加整体呈先升高后降低的趋势,最后活力均低于对照组。G1和G2在20 d时,血淋巴、肝胰腺组织T-AOC活性升高达最高值,显著高于G0(P < 0.05);40 d时,G1与G0差异不显著(P > 0.05),G2显著低于G0(P < 0.05)。随着密度的增加,G3在血淋巴、肝胰腺组织T-AOC活性始终低于G0,差异极显著(P < 0.01);鳃和肌肉组织中T-AOC活性无显著性差异(P > 0.05)。
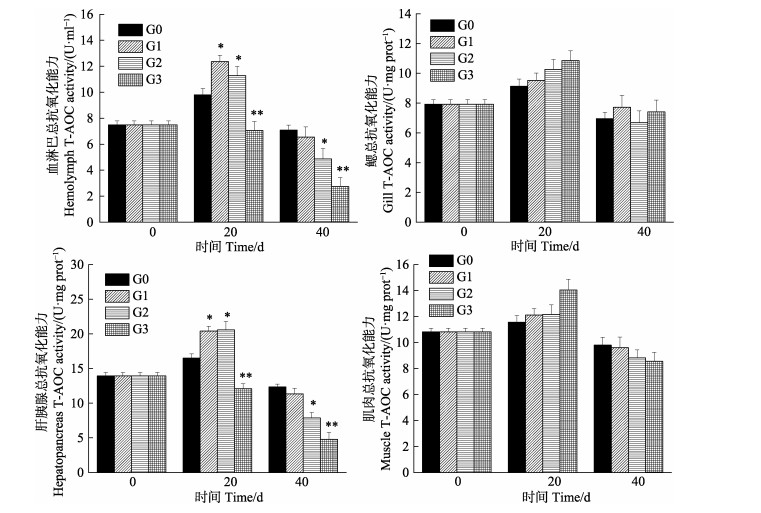
|
图 2 中国对虾不同组织总抗氧化能力(T-AOC)随密度胁迫时间的变化 Fig.2 Changes of total antioxidation activity (T-AOC) in different tissues of F. chinensis after exposure to density stress |
从图 3可以看出,中国对虾体内SOD活力为肌肉 > 肝胰腺 > 血淋巴 > 鳃,SOD活力随密度增加整体呈先上升后下降的趋势,最后活力均低于对照组。G1和G2在20 d时SOD活性升高,G1在鳃和肌肉组织、G2在4种组织中SOD活力均显著高于G0(P < 0.05)。40 d时,SOD活性降低,G1与G0差异不显著(P > 0.05),G2显著低于G0(P < 0.05);G3在4种组织T-AOC活力始终低于G0,差异极显著(P < 0.01)。
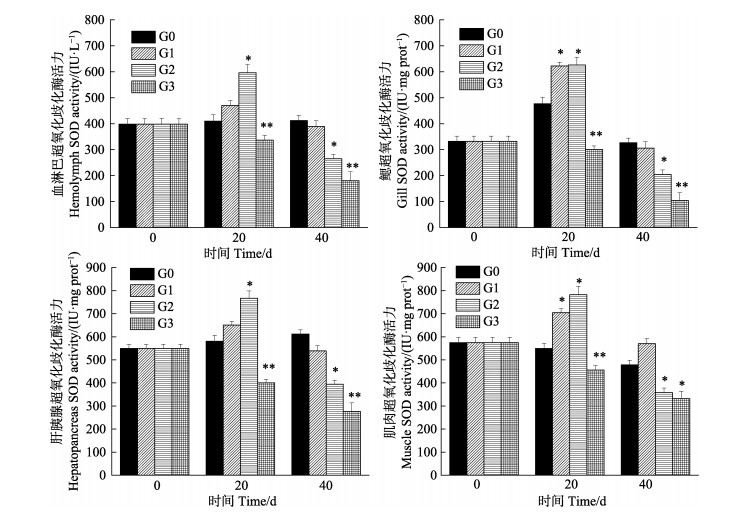
|
图 3 中国对虾不同组织SOD活性随密度胁迫时间的变化 Fig.3 Changes of superoxide dismutase activity in different tissues of F. chinensis after exposure to density stress |
从图 4可以看出,中国对虾体内CAT活力为肝胰腺 > 血淋巴 > 肌肉 > 鳃,CAT活力随密度增加整体呈先上升后下降的趋势。20 d时,G1、G2和G3在血淋巴、鳃和肝胰腺中CAT活力均显著高于G0(P < 0.05),G3在肝胰腺中差异极显著(P < 0.01);40 d时,CAT活力下降,G2和G3在3种组织中的CAT活力显著低于G0(P < 0.05)。肌肉的不同密度组之间差异不明显(P > 0.05)。

|
图 4 中国对虾不同组织CAT活性随密度胁迫时间的变化 Fig.4 Changes of catalase activity in different tissues of F. chinensis after exposure to density stress |
从图 5可以看出,中国对虾体内GPx活力为肝胰腺 > 鳃 > 血淋巴 > 肌肉,GPx活力随着密度的增加整体呈先上升后下降的趋势。20 d时,GPx活力升高:G1在鳃中显著高于G0(P < 0.05),G2在肝胰腺中显著高于G0(P < 0.05),其余均差异不显著(P > 0.05);40 d时,GPx活力下降,G2在肝胰腺中显著低于G0(P < 0.05)。G3在血淋巴、鳃、肝胰腺组织中GPx活力始终低于G0,差异显著(P < 0.05)。肌肉GPx活性在不同密度组之间无显著差异(P > 0.05)。
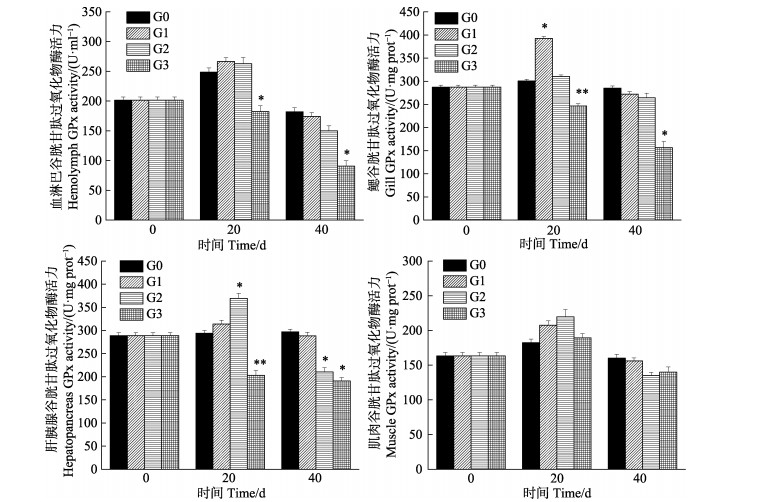
|
图 5 中国对虾不同组织GPx活性随密度胁迫时间的变化 Fig.5 Changes of glutathione peroxidases activity in different tissues of F. chinensis after exposure to density stress |
从图 6可以看出,中国对虾体内MDA含量为肝胰腺 > 血淋巴 > 鳃 > 肌肉,密度越大,MDA含量越高,均高于对照组。20 d时,G1和G2各组织内MDA含量与G0差异不显著(P > 0.05);40 d,时MDA含量升高,G1在肝胰腺中显著高于G0(P > 0.05),G2在血淋巴和肝胰腺中均显著高于G0(P < 0.05);G3在血淋巴和肝胰腺MDA含量随养殖时间逐渐升高,20 d、40 d始终高于G0(P < 0.05);鳃、肌肉组织的MDA含量变化不明显,与G0差异不显著(P > 0.05)。
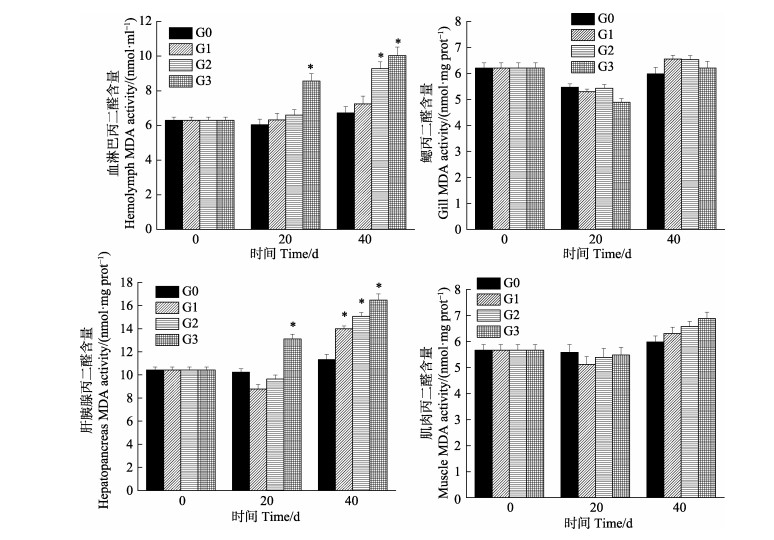
|
图 6 中国对虾不同组织MDA活性随密度胁迫时间的变化 Fig.6 Changes of malondialdehyde activity in different tissue of F. chinensis tissues after exposure to density stress |
表 3记录了实验期间水质因子的变动,水温随季节变化整体呈上升趋势,盐度变化较稳定,在32.05~ 34.22范围内,溶解氧(DO)的质量浓度为5.98~ 6.82 mg/L,pH随密度增加整体是下降的趋势,亚硝态氮(NO2-N)、硝态氮(NO3-N)、氨态氮(NH3-N)和化学需氧量(COD)随密度增加整体呈上升趋势,统计分析表明,不同实验组之间差异不显著(P > 0.05),均处于中国对虾生长安全阈值内(李旭光等, 2004)。
|
|
表 3 实验期间水质因子的变动 Tab.3 Variations of water quality parameters during the experiment |
密度影响对虾生长和死亡率的机制有不同的解释,Ray等(1992)认为,高密度通过引起水质恶化,产生更多氨氮等毒性物质,造成水体环境质量下降,从而影响对虾的生长和存活。本研究中,理化因子及NO2-N、NO3-N、NH3-N和COD等水质因子均在对虾生长的安全范围内,说明水质并不是影响对虾生长及成活率的主要原因,而是养殖密度过大导致的种内对生存空间和领地的竞争,能量消耗程度不同,进而影响对虾生长等,与杨国梁(2008)、Tseng(1998)和Nga(2005)等的研究结果一致。刘国兴等(2014)对克氏原螯虾(Procambarus clarkii)的研究结果表明,高密度养殖会使对虾残肢率升高,生长指标及存活率下降。本研究表明,养殖40 d后,中国对虾随密度增大,其增重率、相对增长率、特定生长率逐渐下降,与Marques等(2000)对凡纳滨对虾(Litopenaeus vannamei)的研究结果一致。同时还发现,中国对虾的体重差异数随密度增大而上升,密度越高,对虾个体间差异趋于增大,说明密度对对虾体重增量均一性也有显著影响(张天时等, 2008)。另外,本研究发现,在养殖20 d过程中,在密度250(G0)~1000尾/m3 (G2)范围内,中国对虾幼虾体长、体重和成活率未发现显著差异,Marques等(2000)也有相似结论,0.05 g罗氏沼虾在暂养60 d后,100~800尾/m2密度间成活率无显著差异,采用800尾/m2密度养殖成本最低。因此,推测不同规格的对虾在不同阶段都有一个对空间的利用率最高的密度范围,所以,确定最适宜的密度可降低对虾的养殖成本。本研究中,0.08 g中国对虾养殖20 d时的最大适宜密度为1000尾/m3(G2)。
3.2 密度胁迫对中国对虾抗氧化系统的影响在环境胁迫条件下,机体会产生大量的活性氧如超氧阴离子自由基(O2-·)、羟自由基(·OH)和过氧化氢(H2O2)等,对其生理机能和免疫功能造成损害(Duan et al, 2013)。适量的活性氧对机体具有一定的保护作用,但活性氧过量可导致氧化胁迫(乔顺风等, 2006),机体通过抗氧化系统发挥作用,将过量的活性氧清除,保护各组织免受氧化损伤(Mathew et al, 2007)。其中,T-AOC能够反映机体自由基的代谢状态和抗氧化系统的工作能力,有很强的代表性,因此,可以作为反映体内组织抗氧化功能的一个良好指标(Lewis et al, 1996),并且SOD能将超氧阴离子转变为H2O2,进而阻止活性氧、自由基对机体的直接伤害,然后,机体通过CAT途径(催化H2O2生成H2O和O2)和GPx途径(催化H2O2生成H2O)进一步清除有毒的H2O2(Fridovich, 1989),而MDA是脂类过氧化作用的最终分解产物,可以反映机体脂质过氧化的程度,间接地反映出细胞损伤的程度(彭士明等, 2010)。
本研究中,密度胁迫20 d后,T-AOC、SOD和GPx活力的变化趋势大体一致,随密度的增加先升高后下降,CAT活力随密度增加而升高。G1和G2密度组在20 d时,T-AOC、SOD、GPx和CAT活力均显著高于对照组,表明在此阶段密度胁迫下,抗氧化酶活性受到诱导而升高,可以看出4种抗氧化酶在共同发挥作用,从而消除过量H2O2和活性氧,与彭士明等(2010)对银鲳(Pampus argenteus)幼鱼的研究结论相似,并且此时MDA含量与G0差异不显著,间接体现了对虾机体未受到损伤; 而G3组在20 d时,T-AOC、SOD和GPx活力显著低于对照组,同时,MDA含量显著高于对照组,说明密度过高,造成虾体内自由基增加太多,超出了其清除能力,使抗氧化系统酶活力受到抑制,但CAT还处在工作状态,继续发挥作用,活力高于对照组,推测在GPx在受到抑制后,CAT继续清除多余活性氧,GPx和CAT在清除自由基过程中发挥着相互补充的作用(Wang et al, 2008),结合此时G1、G2和G3对虾的成活率,表明养殖20 d时,G3超出了对虾承受的密度范围,G1和G2为中国对虾适宜密度。
随着密度胁迫时间的延长,中国对虾幼虾的规格不断增大,空间会越来越限制对虾的生长,抗氧化系统也会发生变化。密度胁迫40 d时,只有G0的抗氧化能力处于稳定状态,G1、G2和G3的T-AOC、SOD、GPx和CAT酶活力随密度增加基本处于下降趋势,G1和G2酶活力未恢复到对照水平,3组密度活力均显著低于对照组,可能由于密度引起对虾个体斗争加剧,高密度养殖导致了虾体内抗氧化系统紊乱,无法恢复到原态,与Kommaly(2016)和陈勇(2016)等研究密度胁迫对T-AOC、SOD和CAT的影响变化规律一致。在亓成龙(2016)研究中,团头鲂幼鱼的血清和肝脏的MDA含量随着养殖密度的升高发生了显著性上升。本研究中,G1、G2和G3组MDA含量在40 d时急剧升高,均高于对照组,表明密度越大,会更早引起膜质过氧化,导致机体损害更严重(Winston et al, 1991),能够反映对虾受密度胁迫的程度,表明养殖40 d时,只有G0处于中国对虾的适宜密度。
本研究发现,密度胁迫对中国对虾抗氧化酶活力存在组织差异性,对血淋巴、鳃、肝胰腺和肌肉4种组织T-AOC、GPx、CAT、SOD和MDA的变化有不同程度的影响。在密度胁迫下,肝胰腺中5种酶活力较血淋巴、鳃和肌肉3个组织变化最显著,其中,肌肉组织的T-AOC、CAT、GPx、MDA和鳃组织的T-AOC、MDA变化在各密度间差异不显著,这可能与组织的功能定位有关。肝胰腺是虾类消化和代谢中心,其组织内抗氧化酶活性处于较高水平,能够清除多余活性氧(段亚飞等, 2015),但长时间的密度胁迫会对其抗氧化系统造成损伤。因此,可以检测肝胰腺组织T-AOC、GPx、CAT、SOD和MDA的变化,作为密度胁迫抗氧化的监测指标。
3.3 中国对虾适宜的养殖密度适宜的饲养密度应该是充分考虑到投放规格的大小,最大限度地发挥其生长潜能、提高其成活率的饲养密度(陈勇, 2016)。本研究表明,中国对虾幼虾初始体重为0.08 g养殖20 d时,适宜养殖密度应该为1000尾/m3(G3),此时养殖密度在这个水平时中国对虾的体长、体重及成活率(86%)和机体的抗氧化系统功能均较高,与250尾/m3(G0)差异不显著; 中国对虾幼虾初始体重为0.08 g,养殖周期为40 d时,建议250尾/m3作为适宜的养殖密度,生长指标及抗氧化系统功能最高。另外,Forster等(1974)研究了0.1 g中国对虾养殖密度为25和166尾/m2,养殖112 d,平均成活率达到67%和41%,可能养殖周期的不同,造成了成活率之间的差异,所以,随养殖周期长短及对虾规格的大小,及时调整中国对虾密度,可以有效降低成本、增加效益。
Chen Y. Effect of stocking density on survival rate and immune enzyme in liver of Procambarus clarkill. Hubei Agricultural Sciences, 2016, 55(16): 4237-4240 [陈勇. 饲养密度对克氏原螯虾成活率和肝胰腺三种免疫酶的影响. 湖北农业科学, 2016, 55(16): 4237-4240] |
Deng J, Yie C, Liu Y. Shrimp in Bohai Sea and Yellow Sea and its resource management. Beijing: Ocean Publishing House, 1990: 48-91
|
Deng YH, Chen WJ, Zhou ZY, et al. Breeding technology of Macrobrachium rosenbergii juvenile. Jiangxi Fishery Sciences and Technology, 2001(3): 29-30 [邓勇辉, 陈文静, 周智勇, 等. 罗氏沼虾幼虾培育技术. 江西水产科技, 2001(3): 29-30] |
Duan YF, Zhang JS, Dong HB, et al. The non-specific immune response of Penaeus monodon to Vibrio parahaemolyticus challenge. Journal of Fisheries of China, 2014, 38(9): 1557-1564 [段亚飞, 张家松, 董宏标, 等. 副溶血弧菌对斑节对虾非特异性免疫酶活性的影响. 水产学报, 2014, 38(9): 1557-1564] |
Duan YF, Liu P, Li JT, et al. Expression profiles of selenium dependent glutathione peroxidase and glutathione S-transferase from Exopalaemon carinicauda in response to Vibrio anguillarum and WSSV challenge. Fish and Shellfish Immunology, 2013, 35(3): 661-670 |
Forster JRM, Beard TW. Experiment to assess the suitability of nine species of prawn for incensive cultivation. Aquaculture, 1974, 4: 357-397 |
Fridovich I. Superoxide dismutase: An adaptation to a paramagnetic gas. Journal of Biological Chemistry, 1989, 264: 7761-7764 |
Kommaly O. Effect of stocking density on body composition and antioxidant system in yellow catfish (Pelteobagrus fulvidraco). Master s Thesis of Huazhong Agricultural University, 2016 [Kommaly O.不同养殖密度对黄颡鱼组份和抗氧化系统产生的相关影响.华中农业大学硕士研究生学位研究论文, 2016]
|
Lewis SEM, Young IS, Boyle PM, et al. Total antioxidant capacity of seminal plasma is different in fertile and infertilemen. Fertility and Sterility, 1996, 64: 868 |
Li YQ, Li J, Wang QY. The effects of dissolved oxygen concentration and stocking density on growth and non-specific immunity factors in Chinese shrimp, Fenneropenaeus chinensis. Aquaculutre, 2006, 256: 608-616 |
Lin Q, Shan XJ, Wang J, et al. Changes in Chinese shrimp (Fenneropenaeus chinensis) carrying capacity of the Bohai Sea. Progress in Fishery Sciences, 2018, 39(4): 19-29 [林群, 单秀娟, 王俊, 等. 渤海中国对虾生态容量变化研究. 渔业科学进展, 2018, 39(4): 19-29] |
Liu GX, Li L, Peng G, et al. Effects of stocking density on growth of Procambarus clarkii and aquaculture water quality. Acta Agriculture Jiangxi, 2014, 26(4): 86-89 [刘国兴, 李玲, 彭刚, 等. 放养密度对克氏原螯虾生长和养殖水质的影响. 江西农业学报, 2014, 26(4): 86-89] |
Marques HL de A, Lombardi JV, Boock MV. Stocking densities for nursery phase culture of the freshwater prawn Macrobrachium rosenbergii in cages. Aquaculture, 2000, 187(1-2): 127-132 |
Mathew S, Ashok K, Anandan R, et al. Changes in tissue defence system in white spot syndrome virus (WSSV) infected Penaeus monodon. Compartive Biochemistry Physiology Part C: Toxicology and Pharmacology, 2007, 145(3): 315-320 |
Nga BT, Lürling M, Peeters ETHM, et al. Chemical and physical effects of crowding on growth and survival of Penaeus monodon Favricius post-larvae. Aquaculture, 2005, 246: 455-465 |
Peng SM, Shi ZH, Sun P, et al. Effects of breeding density on the growth and tissues biochemical indices of juvenile silver pomfret (Pampus argenteus). Chinese Journal of Ecology, 2010, 29(7): 1371-1376 [彭士明, 施兆鸿, 孙鹏, 等. 养殖密度对银鲳幼鱼生长及组织生化指标的影响. 生态学杂志, 2010, 29(7): 1371-1376] |
Qi CL. Effect of stocking density and nitrite on physiological functions and muscle quality of blunt snout Bream megalobrama amblycephala juveniles. Master's Thesis of Huazhong Agricultural University, 2016 [亓成龙.养殖密度和亚硝酸盐胁迫对团头鲂幼鱼生理机能和肌肉品质的影响.华中农业大学硕士研究生学位论文, 2016]
|
Qiao SF, Liu HY, Jin XY. Ammonia nitrogen accumulation damage and biological utilization in aquaculture water. HeBei Fishery, 2006(1): 20-22 [乔顺风, 刘恒义, 谨秀云. 养殖水体氨氮积累危害与生物利用. 河北渔业, 2006(1): 20-22] |
Ray WM, Chien YH. Effects of stocking density and aged sediment on tiger prawn, Penaeus monodon, nursery system. Aquaculture, 1992, 104: 231-248 |
Tseng KF, Su HM, Su MS. Culture of Penaeus monodon in a recirculating system. Aquacultural Engineering, 1998, 17(2): 138-147 |
Wang W, Wu J, Su S. Effects of salinity stress on antioxidant enzymes of Penaeus monodon of two different life stages. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2008, 148(4): 466 |
Winston GW, Di Giulio RT. Prooxidant and antioxidant mechanism in aquatic organism. Aquatic Toxicology, 1991, 19(2): 1373-161 |
Yang GL, Luo K, Kong J, et al. Correlation of growth and survivorship for Macrobrachium rosenbergii in different culture conditions. Marine Fisheries Research, 2008, 29(3): 74-79 [杨国梁, 罗坤, 孔杰, 等. 罗氏沼虾不同养殖条件松下的生长和成活率相关分析. 海洋水产研究, 2008, 29(3): 74-79] |
Yang XG, Yang WL, Zhang Q. Influence and regulation of water quality factors in shrimp culture. China Fisheries, 2004(1): 47-47 [李旭光, 杨文亮, 张琦. 对虾养殖过程中水质因子的影响与调控. 中国水产, 2004(1): 47-47] |
Zhang JM, Zhang WQ. Prelimniary studies on the grot and survival of the Chinese prawn Penaeus orentalis kishniouye. Journal of Ocean University of Qingdao, 1989, 19(2): 49-60 [张嘉萌, 张伟权. 中国对虾存活和生长的初步研究. 青岛海洋大学学报, 1989, 19(2): 49-60] |
Zhang TS, Kong J, Liu P, et al. Effect of diet and stocking density on growth and survivorship of juvenile shrimp Fenneropenaeus chinensis. Marine Fisheries Research, 2008, 29(3): 41-47 [张天时, 孔杰, 刘萍, 等. 饵料和养殖密度对中国对虾幼虾生长及成活率的影响. 海洋水产研究, 2008, 29(3): 41-47] |



