2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 南京农业大学无锡渔业学院 无锡 214081;
5. 中国海洋大学生命学院 青岛 266003;
6. 青岛金沙滩水产开发有限公司 青岛 266000
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214081;
5. College of Marine Life Sciences, Ocean University of China, Qingdao 266003;
6. Qingdao Jinshatan Aquatic Product Development Co., Ltd., Qingdao 266000
端粒是真核细胞线性染色体末端的一段特殊DNA-蛋白复合体,使染色体的天然末端有别于一般性的损伤断端,对维持细胞正常生命活动的生理内稳态起关键作用(Moyzis et al, 1988; Verdun et al, 2007; Deng et al, 2007; Mergny et al, 2002)。衰老的端粒学说(Telomere theory)认为端粒在细胞老化过程中起重要作用,每次细胞分裂都会因DNA聚合酶功能障碍而不能完全复制它们的染色体,端粒DNA序列长度逐渐缩短,最终造成细胞衰老死亡。端粒决定了细胞分裂的次数,故端粒又被称作生命体的“分子时钟”,端粒损耗的速度则是衡量“生物衰老”的方法之一(Spivak et al, 2016)。端粒酶(Telomerase)能延长端粒重复序列,维持染色体稳定,确保细胞复制能力(Wright et al, 1996)。因此,端粒酶具有保持端粒稳定、染色体完整、细胞活性和增殖能力等重要作用。端粒酶由端粒酶模板RNA(Telomerase RNA, TR)、端粒酶逆转录酶(Telomerase reverse transcriptase, TERT)和端粒酶相关蛋白构成(Wright et al, 1995)。TERT基因是端粒酶起作用的关键结构和主要调控亚单位,通过逆转录端粒酶RNA模板序列,合成端粒DNA重复序列并添加到染色体末端,从而弥补了端粒在细胞分裂中的消耗。研究表明,在正常细胞中导入TERT基因载体并表达,能够促进细胞生长,延长细胞寿命,这些现象表明端粒酶在阻止细胞衰老的过程中具有重要作用(Bodnar et al, 1998)。
金乌贼(Sepia esculenta)是头足类鞘亚纲(Coleoidea)的代表种,一年生且终生仅繁殖1次,生殖后快速死亡,属于一次生殖类型。这种在短时间内发生的生殖和死亡现象可以作为研究生殖、衰老和死亡之间错综复杂关系的切入点。依据衰老的端粒学说,金乌贼生殖后快速死亡是否与端粒DNA序列长度缩短有关?生殖前后至自然死亡过程中,TERT基因表达有什么规律?TERT基因表达量是否存在组织差异性和性别差异?为了回答这些问题,本研究从课题组前期获得的金乌贼卵巢转录组数据(Zhang et al, 2019)中筛选出TERT基因,并选取了金乌贼的生长期(Growth Stage, GS)、产卵期(Spawning Stage, SS)、濒死期(Aging Stage, AS) 3个关键生长发育阶段样品,运用qRT-PCR技术分析不同发育阶段、不同组织和不同性别的TERT基因表达规律,为揭示金乌贼生殖与衰老的关系奠定基础。
1 材料与方法 1.1 实验材料金乌贼野生幼体于2016年9月捕捞自山东青岛沿海,经过近1年人工培育性成熟并自然交配,于2017年7月获得受精卵。受精卵在水温19℃~20℃、盐度29~30条件下孵化30 d后,获得初孵幼体。幼体和成体培育水温为20℃~23℃,盐度为29~30,0~30日龄投喂活体糠虾(Opossum shrimp),30日龄后投喂活体小虾和小鱼,每天投喂2次,每次投饵至饱食。从2017年7月~2018年7月跟踪采集金乌贼样品。选取生长期、产卵期、濒死期3个关键时期的金乌贼样品,每个时期雌、雄各取3只,共采集18只金乌贼的肝脏、胰脏、性腺、鳃、食道上神经团(除去视腺和视叶后的脑组织)、心脏等组织样品,将18组样品液氮速冻后,随即转入-80℃冰箱冻存备用。
1.2 实验方法 1.2.1 TERT基因的筛选与鉴定从课题组前期获得的金乌贼卵巢转录组数据(Zhang et al, 2019)中筛到疑似TERT基因片段序列信息。将疑似金乌贼TERT基因序列信息与NCBI数据库(https://www.ncbi.nlm.nih.gov)下载的已知物种TERT基因序列比对分析(表 1)。用ClustalX对所有序列进行比对排序并去除两端冗余序列,保留共有序列2415 bp。使用MEGA 6.0软件分析序列的核苷酸组成、变异位点数等,采用邻接法(Neighbour-joining, NJ)构建分子系统进化树,经1000次重复抽样(Bootstraps)检测其置信度(图 1)。同时,使用DNAman软件,保留共有序列,对金乌贼以及其相物种进行同源序列分析,确定该序列与已知TERT基因的同源性。
|
|
表 1 TERT基因序列信息 Tab.1 TERT gene sequence information |

|
图 1 TERT基因NJ系统进化树 Fig.1 NJ phylogenetic tree of TERT gene |
使用TaKaRaTM Mini BEST Universal RNA Extraction Kit提取RNA,1%琼脂糖凝胶电泳检测RNA完整性。使用NanoDrop2000 (Thermo)检测RNA浓度与纯度,选择条带清晰纯度高RNA样品。
按照Vazyme公司HiScript ⓇⅡ Q RT SuperMix for qPCR (+gDNA wiper)试剂盒推荐反应体系,以前期提取合格RNA为模板,反转录合成cDNA。
1.2.3 引物设计使用Primer 5.0设计TERT基因特异性扩增引物QTERT1、QTERT2和内参基因18S的特异性扩增引物Q18S,用于定量分析(表 2)。
|
|
表 2 TERT与内参基因18S qRT-PCR引物信息 Tab.2 qRT-PCR primer information of TERT and 18S |
本研究采用非特异性荧光标记SYBR Green对TERT基因在金乌贼各发育阶段的组织样品中进行相对荧光定量PCR检测。使用ABI 7500型实时荧光定量PCR系统,TaKaRaTM TB Green Premix Ex TaqTM Ⅱ试剂盒,反应体系20 μl:ROXⅡ 0.4 μl; 上游引物0.4 mmol/L; 下游引物0.8 mmol/L; TB Green 10 μl; H2O 6 μl。使用18S作为qPCR内参基因。
反应条件为两步法PCR扩增标准程序:95℃预变性30 s; 95℃ 5 s,60℃ 34 s,40个循环。
1.3 数据处理根据荧光实时定量PCR测得的Ct值,运用2-ΔΔCt法计算TERT基因的表达量。每个处理组的数据独立分析,即同一个处理组内每个样品的ΔΔCt值为该样品ΔCt值减去组内最大ΔCt值,通过计算得出2-ΔΔCt值便可以估算在同一处理组内各个样品的相对表达量的差异。
分析结果均以平均值±标准误(Mean±SE)表示,并利用SPSS 16.0软件中的单因素方差(One-way ANOVA)分析TERT mRNA表达量在不同组织及各发育时期间的差异水平。使用GraphPad Prism 5软件绘制每个处理组相对表达量的差异图。
2 结果与分析 2.1 TERT基因的筛选与鉴定在NJ系统进化树中(图 1),金乌贼的疑似TERT基因首先与同为头足纲的加州双班蛸(Octopus bimaculoides)的TERT基因聚为一支,自展支持率为100;然后,与其他软体动物聚为一个大的类群。脊索动物门的5个种则聚成另外一个独立分支,与无脊椎动物形成2个并列分支。DNAman软件同源序列分析结果表明,金乌贼TERT基因序列与加州双班蛸TERT基因序列一致性为58.28%。NJ系统进化树分析与同源序列分析将金乌贼转录组数据中筛选到的疑似TERT基因鉴定为金乌贼TERT基因。
2.2 不同组织TERT基因表达规律雌性金乌贼卵巢的TERT基因相对表达量最高,食道上神经团次之,接下来是心脏。随着金乌贼生长发育过程的推进,性腺和心脏的TERT基因表达量呈逐渐下调的趋势(P < 0.05),而食道上神经团在产卵期的表达量显著高于生长期和濒死期(P < 0.05),肝、胰、鳃等组织的表达量则一直很低(图 2)。
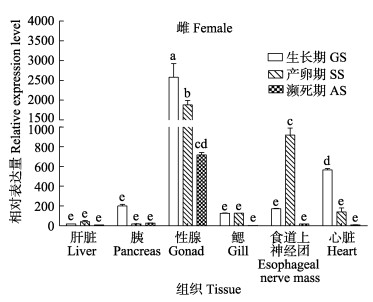
|
图 2 雌性金乌贼TERT基因在不同组织3个时期的表达 Fig.2 Female S. esculenta TERT gene expression in different tissues at three stages 上方字母不同表示差异显著(P < 0.05)。下同 Different letters indicate significant difference (P < 0.05). The same as below |
与雌性金乌贼相似,雄性的性腺也是TERT基因相对表达量最高的组织,食道上神经团次之,接下来是心脏。但雄性金乌贼的胰脏TERT基因表达量较高,与心脏相当。在雄性金乌贼的生长发育过程中,性腺的生长期和产卵期该基因表达水平均较高(P > 0.05),濒死期却显著下降(P < 0.05);胰脏和心脏的TERT基因表达量呈逐渐下调的趋势(P < 0.05);食道上神经团在3个阶段呈先上升后下降的趋势,且产卵期的表达量极显著高于生长期和濒死期(P < 0.01);虽然肝脏和鳃的表达量较低,但呈现出与食道上神经团类似的趋势(图 3)。
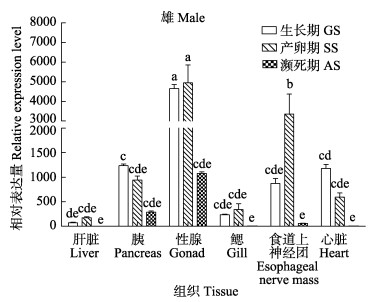
|
图 3 雄性金乌贼TERT基因在不同组织3个时期的表达 Fig.3 Male S. esculenta TERT gene expression in different tissues at three stages |
比较雌、雄金乌贼相同组织的TERT基因表达量,生长期,仅有胰脏和食道上神经团雄性表达量高于雌性(P < 0.05),肝脏、性腺、鳃、心脏在雌、雄间均无显著性差异(P > 0.05)(图 4)。产卵期,卵巢TERT基因表达量极显著高于精巢(P < 0.01),其他5个组织TERT基因的表达量均较低,且不存在性别差异(P > 0.05) (图 5)。濒死期,卵巢组织的TERT基因表达量急剧下降,导致卵巢中该基因表达量极显著低于精巢组织(P < 0.01),其他5个组织的表达量依旧较低,且不存在性别差异(P > 0.05)(图 6)。
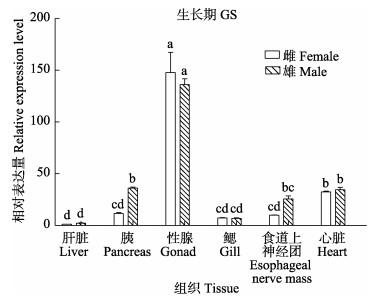
|
图 4 生长期金乌贼不同组织TERT基因雌、雄表达差异比较 Fig.4 Comparison of TERT gene expression in different tissues of male and female S. esculenta at growth stage |
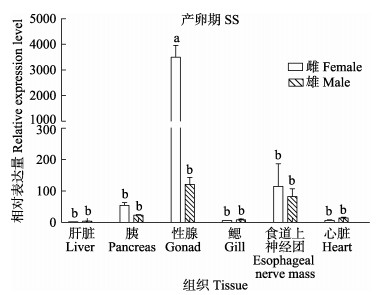
|
图 5 产卵期金乌贼不同组织TERT基因雌、雄表达差异比较 Fig.5 Comparison of TERT gene expression in different tissues of male and female S. esculenta at spawning stage |

|
图 6 濒死期金乌贼不同组织TERT基因雌、雄表达差异比较 Fig.6 Comparison of TERT gene expression in different tissues of male and female S. esculenta at aging stage |
衰老又称老化,是生物发育成熟后的一个持续发展的、动态的、缓慢的自身机能减退,结构、组分逐步退行性病变并趋向死亡的不可逆转的现象(马少缔等, 2017)。金乌贼以其生殖后快速衰老、死亡的特点,成为研究衰老的一个理想物种。近年来,科研工作者主要从繁殖生物学、遗传育种学、胚胎发育学等方面展开研究(王亮等, 2017; 何暮春等, 2018; 刘长琳等2018;尹亚南等, 2018; 汪金梅等, 2017)。如果能充分了解金乌贼的衰老过程及其分子调控机制,并应用于生产,则能为渔业产量增长做出巨大贡献,并对人类衰老研究提供一个新的视角。
TERT基因是端粒酶维持端粒长度的关键结构和主要调控亚单位。虽然端粒酶活性变化规律在人、小鼠、大鼠等物种的不同组织中已得到确认(Kim et al, 1994; Wright et al, 1996; Ulaner et al, 1997)。但是,关于海洋生物该基因的转录和调控规律却所知甚少,其中一个复杂的问题是调控可能具有组织和细胞特异性(Cong et al, 2002; Ducrest et al, 2002; Mergny et al, 2002; Liu et al, 2004)。本研究发现,不同发育阶段的金乌贼TERT基因在肝、胰腺、性腺、鳃、食道上神经团和心脏中均有表达,并随着生长阶段变化,性腺、心脏、胰等组织的基因表达量呈持续下降趋势。据Kong等(2008)研究报道,TERT基因表达的差异化与目标组织细胞的增殖能力有关。组织细胞增殖能力的高低也是体现其衰老状态的一个重要因素。因此,TERT基因表达量的下降,揭示在金乌贼生命周期中,其性腺、心脏和胰脏等器官组织的分裂和增殖能力处于下降趋势。金乌贼性腺等组织的TERT基因表达下降与细胞增殖分裂能力的变化是否与其产卵后快速自然死亡存在有一定相关性,尚需要进一步工作来证实。
值得注意的是,雌、雄金乌贼食道上神经团的TERT基因相对表达量是在产卵期均大幅上调,濒死期却又大幅下调。研究发现,动物繁殖性能的高低很大程度上取决于下丘脑一垂体一性腺(HPG)轴的调节。在鱼类中,鱼类的性腺发育和生殖活动是由脑下垂体控制和调节的,而脑下垂体又在下丘脑控制之下(王良臣, 1987)。而头足类中枢神经系统的食道上神经团支配视腺调节性腺发育与成熟,视腺类似于脊椎动物的脑垂体,而食道上神经团类似于脊椎动物的下丘脑(Wells et al, 1959、1972)。推测产卵盛期的金乌贼受中枢神经系统的食道上神经团调控,激活TERT基因,从而增强性腺细胞的增殖能力,促进金乌贼性腺成熟和产卵,以适应金乌贼产卵期的生理需求。
通过实验发现,TERT基因在金乌贼不同组织中具有明显的组织特异性,食道上神经团与性腺中高表达,在其他组织中低表达,尤其在肝、鳃和心脏组织中表达量最低,说明金乌贼各组织衰老状态并不一致。这一结果与青鳉(Oryzias latipes)的相关研究结果相似。在青鳉中胚胎期和成体分化组织中均有TERT基因表达,在成体组织中性腺和脑发现了TERT基因高表达(Frank et al, 2008)。同时,黑点青鳉(Oryzias melastigma) (Yu et al, 2006)和河豚(Takifugu rubripes) (Yap et al, 2005)中的TERT基因组织间差异表达与本研究结果相似,均表现为性腺TERT基因高表达,而肝脏、鳃、心脏等组织均低表达。本研究结果显示的性腺与其他组织的表达差异更大。
本研究结果还显示,金乌贼TERT基因表达具有雌、雄性别间差异。产卵期,雌性金乌贼性腺组织TERT基因相对表达量显著高于雄性(P < 0.05);濒死期,雄性金乌贼性腺组织TERT基因相对表达量显著高于雌性(P < 0.05),其他组织低表达,无显著差异(P > 0.05)。这种性别差异与大西洋鳕(Gadus morhua)和欧洲鳕(Merluccius merluccius) (López de et al, 2014)的研究结果并不一致,大西洋鳕与欧洲鳕TERT基因在性腺表达不具有显著差异,这种差异可能是物种差异性造成的。
4 小结本研究从金乌贼转录组数据中成功筛选出端粒酶TERT基因,鉴定出的序列长度为2415 bp,NJ系统进化树分析显示,金乌贼与加州双班蛸的TERT基因遗传距离较近,二者同源性为58.28%。金乌贼生活史关键阶段的TERT基因相对表达差异分析表明,与产卵期相比,濒死期的心、肝、胰、鳃、性腺、食道上神经团(除去视腺和视叶后的脑组织)等6个组织TERT基因表达量呈显著下调趋势,推测与濒死期的器官组织分裂和增殖能力下降有关。TERT基因在金乌贼不同组织中具有明显的组织特异性,说明金乌贼各组织器官的衰老状态并不一致。
Bodnar AG, Ouellette M, Frolkis M, et al. Extension of life-span by introduction of telomerase into normal human cells. Science Magazine, 1998, 279(5349): 349-352 |
Cong YS, Wright WE, Shay JW. Human telomerase and its regulation. Microbiology and Molecular Biology Reviews, 2002, 66(3): 407-425 DOI:10.1128/MMBR.66.3.407-425.2002 |
Deng Y, Chang S. Role of telomeres and telomerase in genomic instability, senescence and cancer. Laboratory Investigation, 2007, 87(11): 1071-1076 DOI:10.1038/labinvest.3700673 |
Ducrest A, Szutorisz H, Lingner J, et al. Regulation of the human telomerase reverse transcriptase gene. Oncogene, 2002, 21(4): 541-552 DOI:10.1038/sj.onc.1205081 |
Frank P, Barbara K, Freia Z, et al. Tert expression and telomerase activity in gonads and somatic cells of the Japanese medaka (Oryzias latipes). Development, Growth and Differentiation, 2008, 50(3): 131-141 DOI:10.1111/j.1440-169X.2008.00986.x |
He MC, Zhang JY, Liu CL, et al. DNA methylation level and pattern in growing Sepia esculenta Hoyle. Progress in Fishery Sciences, 2018, 39(4): 46-55 [何暮春, 张金勇, 刘长琳, 等. 金乌贼生长期DNA甲基化水平和模式. 渔业科学进展, 2018, 39(4): 46-55] |
Kim NW, Piatyszek MA, Prowse KR, et al. Specific association of human telomerase activity with immortal cells and cancer. Science, 1994, 266(5193): 2011-2015 DOI:10.1126/science.7605428 |
Kong RY, Giesy JP, Wu RS, et al. Development of a marine fish model for studying in vivo molecular responses in ecotoxicology. Aquatic Toxicology, 2008, 86(2): 131-141 DOI:10.1016/j.aquatox.2007.10.011 |
López de AE, Bilbao E, Soto M, et al. Molecular cloning and measurement of telomerase reverse transcriptase (TERT) transcription patterns in tissues of European hake (Merluccius merluccius) and Atlantic cod (Gadus morhua) during aging. Gene, 2014, 541(1): 8-18 |
Liu L, Lai S, Andrews LG, et al. Genetic and epigenetic modulation of telomerase activity in development and disease. Gene, 2004, 340(1): 1-10 |
Liu CL, Zhao FZ, Bian L, et al. Ultrastructure of the accessory nidamental gland of adult Sepia esculenta. Progress in Fishery Sciences, 2018, 39(3): 137-143 [刘长琳, 赵法箴, 边力, 等. 金乌贼成体副缠卵腺的超显微结构. 渔业科学进展, 2018, 39(3): 137-143] |
Ma SD, Lü DH, Hu J, et al. Cellular senescence and its role in individual aging. Heilongjiang Medical Science, 2017, 40(6): 14-15 [马少缔, 吕东鹤, 霍健, 等. 细胞衰老及在个体衰老中的作用. 黑龙江医药科学, 2017, 40(6): 14-15 DOI:10.3969/j.issn.1008-0104.2017.06.006] |
Mergny JL, Riou JF. Survey and summary: Natural and pharmacological regulation of telomerase. Nucleic Acids Research, 2002, 30(4): 839 DOI:10.1093/nar/30.4.839 |
Moyzis RK, Buckingham J, Cram L, et al. A highly conserved repetitive DNA sequence, (TTAGGG)n, present at the telomeres of human chromosomes. Proceedings of National Academy of Sciences of USA, 1988, 85: 6622-6626 DOI:10.1073/pnas.85.18.6622 |
Spivak IM, Mikhelson VM, Spivak DL. Telomere length, telomerase activity, stress, and aging. Advances in Gerontology, 2016, 6(1): 29-35 DOI:10.1134/S2079057016010136 |
Ulaner GA, Giudice LC. Developmental regulation of telomerase activity in human fetal tissues during gestation. Molecular Human Reproduction, 1997, 3(9): 769-773 DOI:10.1093/molehr/3.9.769 |
Verdun RE, Karlseder J. Replication and protection of telomeres. Nature, 2007, 447(7147): 924-931 DOI:10.1038/nature05976 |
Wang LC. Control of the pituitary gland in the hypothalamus of bony fish. Freshwater Fishery, 1987(1): 45-48 [王良臣. 硬骨鱼下丘脑对腺垂体的控制. 淡水渔业, 1987(1): 45-48] |
Wang L, Zhang XM, Ding PW, et al. Reproductive behavior and mating strategy of Sepia esculenta. Acta Ecologica Sinica, 2017, 37(6): 1871-1880 [王亮, 张秀梅, 丁鹏伟, 等. 金乌贼繁殖行为与交配策略. 生态学报, 2017, 37(6): 1871-1880] |
Wang JH, Han S, Zheng XD. Molecular identification of reproduction patterns of Sepia esculenta. Oceanologia et Limnologia Sinica, 2017, 48(1): 184-189 [汪金海, 韩松, 郑小东. 金乌贼(Sepia esculenta)繁殖模式的分子学鉴定. 海洋与湖沼, 2017, 48(1): 184-189] |
Wells MJ, Wells J. Optic glands and the state of the testis in octopus. Marine and Freshwater Behaviour and Physiology, 1972, 1(1-4): 71-83 DOI:10.1080/10236247209386890 |
Wells MJ, Wells J. Hormonal control of sexual maturity in octopus. Journal of Experimental Biology, 1959, 36(1): 1-33 |
Wright WE, Piatyszek MA, Rainey WE, et al. Telomerase activity in human germline and embryonic tissues and cells. Developmental Genetics, 1996, 18(2): 173-179 DOI:10.1002/(SICI)1520-6408(1996)18:2<173::AID-DVG10>3.0.CO;2-3 |
Yap WH, Yeoh E, Brenner S, et al. Cloning and expression of the reverse transcriptase component of pufferfish (Fugu rubripes) telomerase. Gene, 2005, 353(2): 207-217 DOI:10.1016/j.gene.2005.04.038 |
Yin YN, Liu CL, Hu P, et al. Histology of oogenesis and ovarian development in cultured Sepia esculenta. Journal of Fishery Sciences of China, 2018, 25(3): 503-511 [尹亚南, 刘长琳, 胡鹏, 等. 养殖金乌贼卵子发生和卵巢发育的组织学观察. 中国水产科学, 2018, 25(3): 503-511] |
Yu RMK, Chen EXH, Kong RYC, et al. Hypoxia induces telomerase reverse transcriptase (TERT) gene expression in non-tumor fish tissues in vivo: The marine medaka (Oryzias melastigma) model. BMC Molecular Biology, 2006, 7: 27 DOI:10.1186/1471-2199-7-27 |
Zhang JY, Liu CL, He MC, et al. A full-length transcriptome of Sepia esculenta using a combination of single-molecule long-read (SMRT) and Illumina sequencing. Marine Genomics, 2019, 54-57 |



