2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 山东省海洋生物研究院 青岛 266104
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
3. Marine Biology Institute of Shandong Provincial, Qingdao 266104
大黄鱼(Larimichthys crocea)是我国的重要经济鱼种之一,其产业链为我国带来了巨大的经济和社会效益。据统计,2017年,我国大黄鱼产量为177640 t,是2016年的1.11倍,仅福建省产量高达150542 t,占全国大黄鱼总产量的84.75%(农业农村部渔业渔政管理局等, 2018)。可见,福建省是我国大黄鱼重要的养殖产地。但是,随着养殖规模的不断壮大,养殖密度胁迫、养殖用水和饲料质量等各种问题不断涌现,导致大黄鱼养殖病害频发,包括弧菌病、细菌性肠炎病、刺激隐核虫病等在内的细菌性疾病、寄生虫病等病害种类呈现上升趋势,成为限制产业健康持续发展的一大“瓶颈”(杜明洋等, 2017)。由于细菌具有种类多、繁殖快、传播途径多样化等特点,因此,养殖过程中仍以细菌性疾病为主。
随着人们对健康、环保意识的不断增强,在对细菌性疾病的治疗方面,疫苗、益生菌等生物防治措施备受关注(Nayak, 2010; Cai et al, 2013; Li et al, 2016)。这些生物产品仍以微生物为主,而消化道内居住着数以万亿计的微生物,其携带的基因数量远超宿主基因组的上百倍,并且可通过结构变化调整自身功能基因在某一代谢通路中的富集,从而在营养、免疫等多方面参与并影响宿主的生理活动(Shabat et al, 2016; Zhang et al, 2016; Dwivedi et al, 2017)。同时,消化道菌群的动态平衡是维持消化道健康的一个重要保障,也是菌群协同宿主进行各种生理功能的必要前提。因此,对消化道菌群组成信息、分布特征进行系统分析是后续开展“土著”益生菌筛选、结构有效调控及其机理等相关研究的重要基础。
本研究以工厂化和网箱模式养殖大黄鱼为研究对象,针对其胃、幽门盲囊和肠道中的菌群分布特征、组成信息及其参与营养和免疫相关代谢功能的基因信息进行对比分析,明确消化道菌群结构特征;结合环境菌群信息,解析消化道菌群与环境的关系,以期为大黄鱼养殖产业中消化道菌群的健康调控及病害的有效防控提供基础数据。
1 材料与方法 1.1 实验鱼样本采集与处理2018年3月23日,在水温为13℃~16℃的条件下,对宁德市富发水产有限公司养殖的来源于同批苗种的1龄大黄鱼进行实验用鱼样本的采集。其中,工厂化养殖大黄鱼体重为(96.13±38.23) g、体长为(20.75±2.98) cm,养殖密度为60尾/m3;网箱养殖大黄鱼体重为(110.21±31.77) g、体长为(21.08±2.98) cm,养殖密度为1.5尾/m3。
消化道样本:2种养殖模式分别作为2个实验组,每组分别随机挑选6尾大黄鱼作为实验用鱼,饥饿处理12 h后,采用MS-222 (Fluka, 美国)麻醉处理。无菌环境下,采用75%酒精擦拭体表,解剖,提取消化道,分离胃、幽门盲囊和肠道组织,去除内容物,采用预冷的灭菌生理盐水冲洗各组织,分装、液氮保存,用于微生物多样性、消化酶和免疫酶活性分析。
水环境样本:分别采集工厂化养殖模式的进水口水样和网箱水样,每种模式采集3次作为3个平行样本,每次通过采水器收集3 L水,采用0.22 μm的滤膜进行真空抽滤,滤膜分装后置于液氮中保存,用于微生物多样性分析。
饲料样本:2种模式养殖大黄鱼均为1龄鱼,投喂的配合饲料完全相同。因此,分别称取3份0.1 g的配合饲料作为3个平行样本,于液氮中保存,用于微生物多样性分析。
1.2 样本微生物总DNA提取与高通量测序将液氮中保存的样本取出,冰上自然解冻,随机选取3条鱼的消化道作为平行样本,每个消化道组织均匀剪取一部分用于DNA提取,剩余部分用于酶活检测。采用QIAamp DNA Mini Kit (QIAGEN, 德国)试剂盒提取组织样本和饲料样本微生物总DNA;采用OMEGA Soil DNA Kit (Omega Bio-Tek, 美国)试剂盒提取处理水样所得滤膜的微生物总DNA。共27个生物样本用于微生物总DNA的提取,具体信息见表 1。将通过各试剂盒提取的微生物总DNA进行PCR扩增,扩增序列为16s rDNA V3~V4高变区的序列,选取引物338F (5′-ACTCCTACGGGAGGCAGCA-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′),经琼脂糖凝胶电泳检测合格后,构建文库,通过Illumina MiSeq PE300平台进行高通量测序。
|
|
表 1 高通量测序生物样本信息 Tab.1 The information of biology samples used for high throughput sequencing |
将消化道各组织样本分别称重,按1:9(w/v)比例加入适量预冷匀浆液,冰浴条件下采用T 10 Basic S25 (IKA, 德国)组织匀浆机匀浆,4℃ 5000 r/min离心30 min,取上清液,作为粗酶提取液,分别按照南京建成的消化酶(胃蛋白酶、胰蛋白酶、淀粉酶、脂肪酶)和非特异性免疫酶(酸性磷酸酶ACP、碱性磷酸酶AKP、超氧化物歧化酶SOD、溶菌酶LZM)检测试剂盒说明书测定酶活力。
1.4 数据处理通过高通量测序获得原始的下机数据,运用Trimmomatic (v 0.35)软件对双端序列去杂、Flash (v 1.2.11)软件拼接(overlap的范围为10~200 bp)、Uchime (v 4.2)去嵌合体序列等一系列处理得到有效序列。采用Vsearch(v 2.4.2)根据序列的相似性,将相似度≥97%的序列被归为1个可操作分类单元(Operational taxonomic units, OTU),并选取每个OTU的代表性序列。用RDP Classifer (v 2.2)与Silva数据库(v 123)对OTUs代表序列进行物种注释,保留置信区间 > 0.7的注释结果。采用tax4fun(0.3.1)对微生物组基因参与的KEGG通路进行比对分析。
采用单因素方差分析(One-way ANOVA)对数据进行统计分析,利用Duncan’s检验对同一养殖模式下大黄鱼不同消化道组织间的差异性进行多重比较,采用T-test检验对不同养殖模式下大黄鱼相同消化道组织进行差异性分析,显著性水平为P < 0.05。所有数值均采用平均值±标准误(Means±SE)表示。
2 结果本研究共采集27个生物样本,经高通量测序及对测序数据的一系列处理,共获得916483条Effective tags,经归类操作得到2829个OTUs。
2.1 大黄鱼消化道菌群结构特征工厂化养殖条件下,大黄鱼消化道中幽门盲囊和肠道菌群chao 1指数(314.44、364.34)和香农指数(6.48、6.23)差异不显著(P > 0.05),但二者均显著低于胃中菌群的多样性指数(P < 0.05)(表 2)。说明,菌群多样性伴随大黄鱼消化道的延伸整体呈现下降趋势。
|
|
表 2 2种养殖模式大黄鱼消化道菌群多样性 Tab.2 The gastrointestinal microbiota diversity of large yellow croaker cultured in different patterns |
网箱模式下,菌群多样性指数同样随消化道的延伸整体呈现下降趋势。但幽门盲囊和肠道菌群chao 1指数(465.79、327.02)均显著低于胃中菌群的chao 1指数(744.64)(P < 0.05),而香农指数在消化道各部位间则差异不显著(P > 0.05)(表 2)。
由表 2可以看出,2种养殖模式下大黄鱼消化道同一部位间的菌群chao 1和香农指数差异均不显著(P > 0.05)。
图 1A为样本中相对丰度排列前十的优势菌属。工厂化养殖条件下,大黄鱼胃中拟杆菌属(Bacteroides)的相对丰度最高(平均为23.70%),而在幽门盲囊和肠道中的丰度显著下降(1.16%~1.32%) (P < 0.05);Bacteroidales_S24_7_group(f)、Parabacteroides、Alistipes、Anaerostipes、Candidatus_ Soleaferrea所代表的菌属在胃中的丰度均显著高于其他组织中的丰度(P < 0.05)(图 1B)。而乳杆菌科(Lactobacillaceae(f))代表的菌属在幽门盲囊和肠道中为优势菌属,其相对丰度显著高于在胃中的丰度(P < 0.05);幽门盲囊和肠道中黄杆菌属(Flavobacterium)、Fructobacillus、醋杆菌科(Acetobacteraceae(f))、E01_9C_26_marine_group (o)等菌属的丰度均显著高于在胃中的丰度(P < 0.05)。可见,工厂化养殖条件下,大黄鱼幽门盲囊和肠道中的菌群结构较为相近,与胃部的存在显著差异。
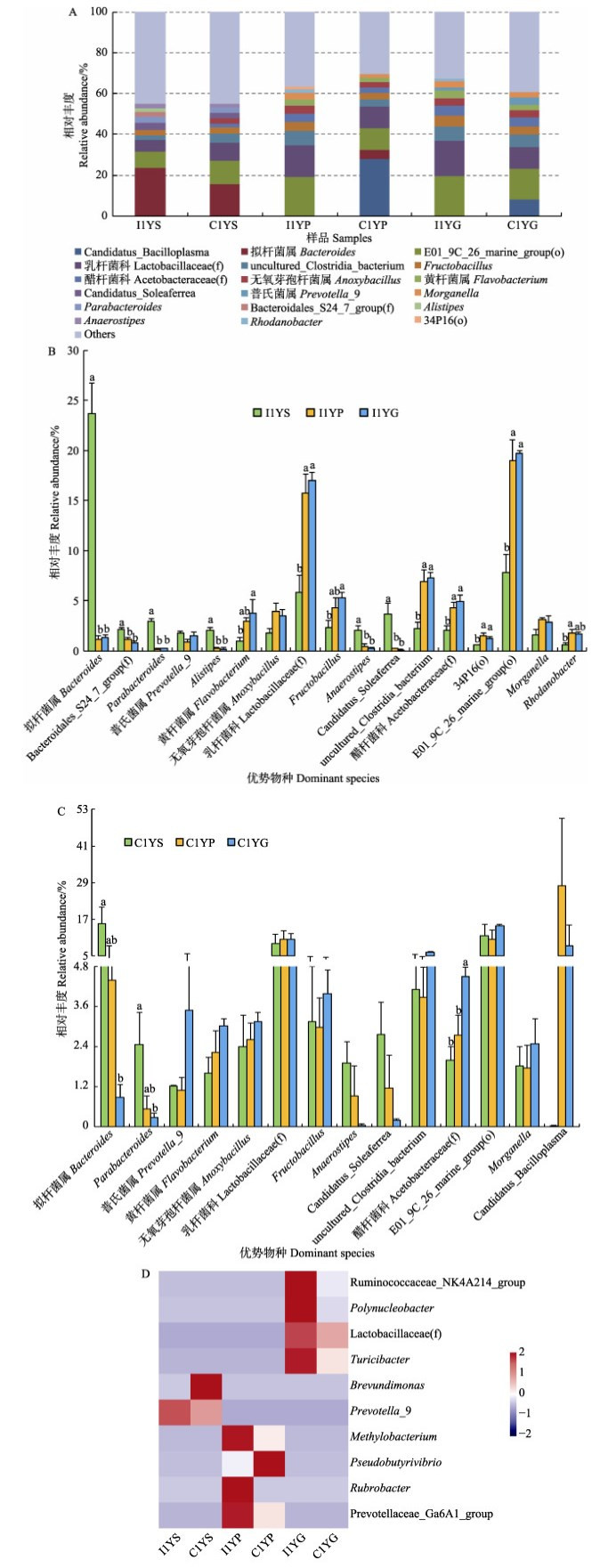
|
图 1 大黄鱼消化道菌群属水平结构特征(n=3, P < 0.05)
Fig.1 The structural characteristics of microbiota in the gastrointestinal tract of large yellow croaker at the genus level (n=3, P < 0.05)
A:2种养殖模式下大黄鱼消化道各部位优势菌属组成;B、C:分别为工厂化和网箱模式下大黄鱼 消化道各部位优势菌属的丰度特征;D:不同养殖模式下大黄鱼同一消化道组织差异菌属 I1YS、I1YP和I1YG分别表示工厂化模式养殖大黄鱼胃、幽门盲囊和肠道; C1YS、C1YP和C1YG分别表示网箱模式养殖大黄鱼胃、幽门盲囊和肠道。下同 A: The composition of dominant microbiota in gastrointestinal tract for large yellow croaker cultured by two patterns; B and C: The abundances characteristics of dominant microbiota in different gastrointestinal tract tissues of large yellow croaker cultured in industrialized pattern and net cage, respectively; D: The significantly different genera of the same gastrointestinal tract tissue of large yellow croaker cultured in two different aquaculture patterns I1YS, I1YP and I1YG represent stomach, pyloric caecum and gut of large yellow croaker cultured in industrialized pattern, while C1YS, C1YP and C1YG represent those of large yellow croaker cultured in net cage. The same as below |
网箱养殖大黄鱼胃部的最优势菌属依然是拟杆菌属(平均丰度为15.68%),但与工厂化养殖大黄鱼相比,其消化道不同部位间优势菌属差异较小(图 1A和图 1C)。其中,优势菌属中拟杆菌属、Parabacteroides的相对丰度从胃到肠道逐渐降低,在胃部的丰度显著高于在肠道中的丰度(P < 0.05);醋杆菌科代表的菌属则呈相反趋势,肠道中的丰度显著高于胃和幽门盲囊中的丰度(P < 0.05)(图 1C)。乳杆菌科、无氧芽孢杆菌属(Anoxybacillus)、E01_9C_26_marine_group(o)等优势菌属在消化道不同部位间的丰度接近。
乳杆菌科、Fructobacillus、黄杆菌属、E01_9C_ 26_marine_group(o)、拟杆菌属、Parabacteroides和Anaerostipes等所代表的菌属为2种模式养殖大黄鱼消化道共有的优势菌群。其中,拟杆菌属、Parabacteroides和Anaerostipes等所代表的菌属丰度从胃到肠道呈下降趋势,而乳杆菌科、黄杆菌属等代表的菌属则呈相反趋势(图 1A、图 1B和图 1C)。由图 1D可以看出,不同模式养殖大黄鱼消化道同一部位间均存在差异显著的菌属(P < 0.05)。其中,优势菌群中的普氏菌属(Prevotella_9)、乳杆菌科代表的菌属分别在胃和肠道中差异显著(P < 0.05)。
2.2 大黄鱼消化道菌群功能特征通过KEGG分析,在二级水平下,对菌群参与的与营养、免疫功能相关的环境信息处理、新陈代谢、器官系统代谢通路的基因数目进行统计分析(表 3)。
|
|
表 3 2种模式养殖大黄鱼消化道各部位菌群参与各代谢通路的基因丰度 Tab.3 Microbiota gene abundances participating in metabolic pathways in different gastrointestinal tract parts of large yellow croaker cultured in two patterns |
综合对比发现,消化道中参与膜转运的菌群基因丰度最高(3386400~5409400),其次为碳水化合物代谢(2542000~3712600)、氨基酸代谢(2153000~3156900)等。工厂化模式下,大黄鱼肠道和幽门盲囊中菌群参与膜转运、氨基酸代谢、碳水化合物代谢、能量代谢等基因数目均高于胃部,仅在神经系统、免疫系统和内分泌系统功能方面呈相反趋势。幽门盲囊和肠道的菌群参与的相关代谢通路的基因丰度差异不显著(P > 0.05),但是二者与胃部的相关基因丰度存在显著差异(P < 0.05)。网箱养殖大黄鱼消化道菌群参与膜转运、氨基酸代谢、碳水化合物代谢和能量代谢等基因数目与其他功能相比依然较多,但在消化道各部位间的差异均不显著(P > 0.05)。在2种养殖模式的对比中发现,工厂化养殖大黄鱼幽门盲囊中菌群参与循环系统的基因丰度为5800,显著高于网箱模式大黄鱼的相关基因丰度(3300)(P < 0.05),其他差异均不显著(P > 0.05)。
2.3 大黄鱼消化道菌群与环境菌群的相关性PCA分析中,每一个点代表了1个样本中菌群的组成信息,点与点之间的距离越近表示2样本间菌群结构较为相近。幽门盲囊与肠道样本相距较近;与环境水样本相比,消化道样本与饵料样本相距较近(图 2A)。说明,工厂化养殖大黄鱼消化道中幽门盲囊和肠道的菌群组成相似,均与胃部的菌群组成存在较大差异;同时,3个部位的菌群组成与饲料中的相关性较大。以各平行样本间的共有菌群为基础,图 2C显示了工厂化模式下大黄鱼消化道与环境菌群共有及特有菌属情况,胃与幽门盲囊共有菌属55个,占胃中菌属总量的28.95%;而肠道与幽门盲囊共有菌属为46个,占肠道菌属总量的56.79%;饲料与消化道共有的菌属数目占饲料总数的42.06%,高于与水样的共有菌属比例(33.88%)。
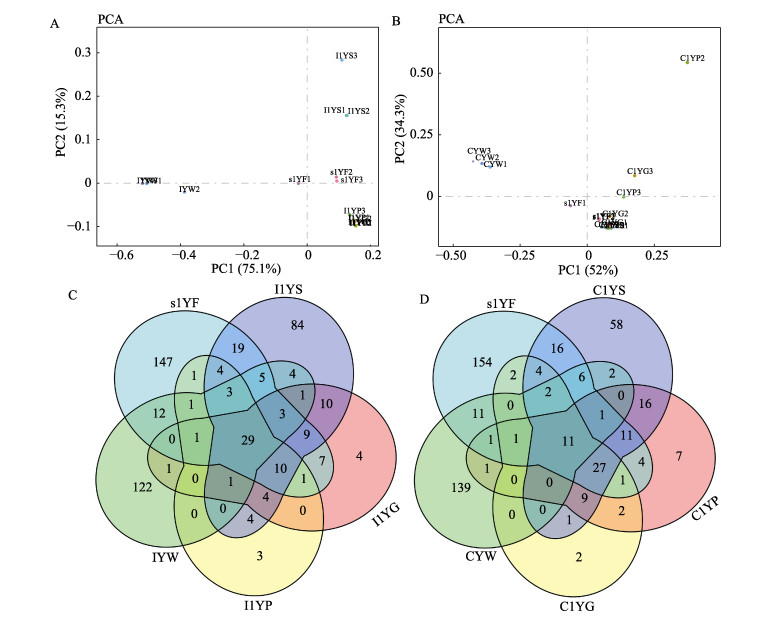
|
图 2 大黄鱼消化道菌群与环境菌群的相似性 Fig.2 The similarity of microbiota between the gastrointestinal tract and environment A、B分别代表工厂化和网箱模式下的菌群PCA分析;C、D分别代表工厂化和网箱模式下不同样本间菌群共有分析 A and B represent the principal components analysis (PCA) of gastrointestinal tract microbiota in large yellow croaker cultured by industrialized pattern and net cage, respectively; C and D represent the analysis of shared microbiota among different samples from large yellow croaker cultured by industrialized pattern and net cage, respectively |
网箱养殖模式下,大黄鱼胃、幽门盲囊、肠道间的菌群组成均相近,并且三者与饲料菌群组成相近(图 2B)。与工厂化养殖情况相似,胃和幽门盲囊共有菌属75个,占胃中菌属总量的45.73%;肠道与幽门盲囊的共有菌属51个,占肠道菌属总量的82.26%;与环境菌群相关性分析中,消化道与饲料的共有菌属比例(38.89%)仍然高于消化道与水的共有菌属比例(21.02%)(图 2D)。说明,在大黄鱼消化道中,幽门盲囊与肠道的菌群组成相近,消化道菌群整体与饲料菌群组成相近。
2.4 大黄鱼消化道消化酶和非特异性免疫酶活力特征工厂化模式养殖大黄鱼消化道中,除胰蛋白酶外,其他消化酶活力均高于网箱养殖大黄鱼,工厂化养殖大黄鱼幽门盲囊的胃蛋白酶(24.78 U/mg prot)和淀粉酶(0.16 U/mg prot)活力均显著高于网箱养殖大黄鱼(15.24和0.07 U/mg prot)(P < 0.05)(表 4)。同时,工厂化养殖大黄鱼幽门盲囊和肠道中的淀粉酶活力(0.16和0.14 U/mg prot)显著高于胃中淀粉酶活力(0.08 U/mg prot)(P < 0.05)。
|
|
表 4 不同模式养殖大黄鱼消化道各部位消化酶和非特异性免疫酶活力 Tab.4 The activity of digestive and nonspecific immunity enzyme of the gastrointestinal tract of large yellow croaker cultured in different patterns |
整体上,工厂化养殖大黄鱼消化道中的包括ACP、AKP、SOD和LZM在内的非特异性免疫酶活力高于网箱养殖大黄鱼;除肠道中LZM外,不同养殖模式下相同消化道组织及同一养殖模式不同消化道组织的SOD和LZM活力均差异显著(P < 0.05)。
3 讨论 3.1 大黄鱼消化道菌群特征分析水产动物易受环境条件的影响造成自身的不稳定,从而影响消化道微生物群。王程程等(2014)对同一养殖海区的1龄大黄鱼的肠道菌群进行分析,发现肠壁中拟杆菌属优势度最高。本研究中,拟杆菌属为大黄鱼胃中的优势细菌,而在肠道中其丰度仅为0.88%~1.32%,这可能是取样时间不同造成的环境条件差异引起的,当然也有来自鱼体自身的差异。在同一取样时间,对来源于同一养殖场繁育的0龄大黄鱼消化道菌群特征进行研究,发光杆菌属(Photorhabdus)、弧菌属(Vibrios)、乳杆菌属(Lactobacillus)等为2种模式养殖大黄鱼消化道的共有优势菌群,而假单胞菌属(Pseudomonas)、气单胞菌属(Aeromonas)和Escherichia_ Shigella为主要差异菌属(姜燕等, 2019)。然而,本文中对1龄大黄鱼消化道菌群的研究却发现,乳杆菌科、Fructobacillus和黄杆菌属等所代表的菌属为2种模式养殖大黄鱼消化道共有的优势菌群,其中,拟杆菌属、黄杆菌属和普氏菌属_9为0龄和1龄大黄鱼消化道共存的优势菌属;2种模式的大黄鱼消化道差异菌属则不存在共有情况。这也反映出鱼体的生理阶段、生存环境等均可对消化道菌群结构特征形成一定的影响(Banerjee et al, 2017; Jiang et al, 2019a; Kelly, 2010; Shabat et al, 2016; Sullam et al, 2012; Zhang et al, 2016)。同时也说明,鱼体自身及其生存环境对其消化道菌群存在影响,但一些主要菌群依然定植于消化道。Jiang等(2019a、b)在对牙鲆(Paralichthys olivaceus)和大菱鲆(Scophthalmus maximus)早期生长阶段消化道菌群结构特征和演替的研究中发现,从1日龄仔鱼开始,经过生物饵料(轮虫、卤虫)期,至颗粒饵料稳定期,同样存在一些共有菌属始终以优势菌群的地位定植于消化道中。可见,每种鱼都有几个优势菌属始终定植于消化道。
不同养殖模式对鱼类消化道菌群结构特征具有一定影响。在池塘与工厂化养殖模式的对比中发现,池塘养殖牙鲆肠道菌群多样性高于工厂化养殖牙鲆,且优势菌属中的芽孢杆菌属和弧菌属的丰度在2种养殖模式下差异显著(李存玉等, 2015)。Wang等(2017)研究发现,网箱和养殖池养殖的罗非鱼(Oreochromis niloticus)肠道菌群存在一定差异。本研究中,详细对比各优势菌属分别在2种模式养殖大黄鱼消化道不同部位间的显著性差异,而且还针对工厂化和网箱养殖模式下大黄鱼消化道每一个部位间的差异菌属进行对比分析,发现幽门盲囊和肠道的菌属组成相似,二者与胃的菌属差异较大,并且工厂化条件下的差异相对明显。同时,普氏菌属、乳杆菌科代表的菌属为2种模式养殖大黄鱼的主要差异菌属。推测,这可能与养殖鱼类自身特性及其养殖环境有关。同时,水和饵料是水产养殖过程中必不可少的两大外部要素,对养殖动物或消化道的菌群结构具有一定的影响(De Schryver et al, 2010; Bakke et al, 2013; Li et al, 2017; 刘增新等, 2017; 何娇娇等, 2018; Jiang et al, 2018)。本研究发现,与养殖水体相比,养殖大黄鱼消化道菌群结构与饲料菌群结构更相近,而2种养殖模式的大黄鱼采用同种饲料投喂,且2种养殖模式大黄鱼的消化道菌群结构存在一定的差异,这可能与养殖模式不同造成的环境差异相关。
3.2 大黄鱼消化道菌群功能分析消化道是营养代谢的主要场所,而菌群对宿主营养相关功能方面发挥着重要作用(Cantarel et al, 2009; Flint et al, 2012; Ray et al, 2012; Semova et al, 2012)。在反刍动物的研究中显示,消化道菌群在能量代谢方面能够协同宿主更好地适应生存环境(Shabat et al, 2016; Zhang et al, 2016)。本研究中,结合2种模式下大黄鱼消化道各部位菌群结构特征分析,发现菌群功能与结构呈正相关关系。工厂化条件下,大黄鱼胃部菌群功能与幽门盲囊和肠道菌群功能差异显著,而网箱条件下该差异减弱,并且二级水平下2种模式间的菌群功能差异不显著。推测,这可能与工厂化条件下养殖密度较高有关。在与营养相关的代谢功能中,与参与其他代谢通路的基因丰度相比,消化道各部位菌群参与碳水化合物代谢、氨基酸代谢、膜转运、能量代谢等的基因数目相对较高,说明,菌群主要参与了大黄鱼对营养消化、吸收和转运的过程。这与不同模式养殖0龄大黄鱼的消化道菌群功能研究结果相似(姜燕等, 2019)。
另外,消化道菌群能够通过产物抑制等竞争性作用阻止外源微生物的入侵,有效提高宿主的免疫功能(Tagg et al, 1976; Noonpakdee et al, 2003; Qian et al, 2007; Chen et al, 2010)。本研究中,大黄鱼消化道菌群中参与免疫相关功能的基因数目与其他功能的基因数相比较少,并且不同部位间差异不显著,这可能与实验鱼处于健康状态、菌群基因主要富集在与营养相关的代谢通路中相关。
3.3 大黄鱼消化道消化酶和非特异性免疫酶活力分析摄入体内的食物消化主要依赖于消化腺和消化器官分泌的消化酶,而消化酶活力受生存环境、pH、鱼体生理阶段、鱼种类、食性和营养水平等多种因素的影响(赵志刚等, 2017; 王常安等, 2017; 杨婳等, 2014; 周景祥等, 2001)。而消化酶活力的大小则代表消化能力的强弱。研究指出,有胃鱼类特别是肉食性鱼类,摄入体内的蛋白主要在胃中进行消化(周景祥等, 2001)。肠道中的蛋白酶主要来源于肠粘膜、肝胰脏、幽门垂等分泌的胰蛋白酶(王海英, 2004)。鱼类的各消化器官均存在淀粉酶,而幽门盲囊中一般不存在脂肪酶(李瑾等, 2001)。而相关报道指出,大菱鲆、亚东鲑(Salmo trutta fario)等的幽门盲囊具有相对较高的脂肪酶活力(王海英, 2004; 王常安等, 2017)。本研究中,通过对比也发现,蛋白酶、脂肪酶、淀粉酶存在于消化道的各部位。出现这种现象可能与鱼的食性、生存环境等相关。研究还发现,除胰蛋白酶外,工厂化养殖的大黄鱼消化道各消化酶活力均高于网箱养殖大黄鱼,可能与工厂化条件下养殖密度较高及定植于消化道内壁的菌群结构相关。
本研究发现,消化道中的胃和幽门盲囊均具有相对较高的ACP、AKP、SOD和LZM活力,说明,大黄鱼的整个消化道不仅具有微生物免疫屏障作用,而且还具有一定的化学免疫屏障作用。相关报道指出,摄食和生存环境因子等均可在一定程度上影响鱼类的免疫酶活力(Liu et al, 2017; Zhang et al, 2012; 卓丽欣等, 2018)。相对于工厂化模式,网箱养殖密度相对较低,养殖环境相对开放,这些因素综合导致工厂化养殖大黄鱼提高自身的非特异性免疫酶活力来适应生存环境。因此,本研究中,鱼类整个消化道都存在ACP和SOD等非特异性免疫酶,工厂化养殖条件下,鱼的非特异性免疫酶活力高于网箱养殖大黄鱼,推测与养殖密度和养殖模式相关。王孝杉等(2018)对放养密度基本一致的循环水和网箱模式养殖黄姑鱼的生长、免疫、血清生化等指标进行对比分析,发现循环水系统对黄姑鱼的胁迫大于网箱系统。然而,密度胁迫可能会导致养殖鱼类体内免疫酶活性的降低,并影响鱼类的生长(薛宝贵等, 2013; Barcellos et al, 2004)。
4 结论通过对比分析,明确了大黄鱼消化道共有的优势菌群为乳杆菌科、Fructobacillus、黄杆菌属、E01_9C_ 26_marine_group(o)、拟杆菌属、Parabacteroides和Anaerostipes等所代表的菌属。工厂化模式养殖大黄鱼消化道各组织间菌群结构与功能存在一定差异,2种模式养殖大黄鱼消化道菌群与饲料菌群更相近。同时发现,大黄鱼整个消化道均具有一定的非特异性免疫酶活性,不同分组间的消化酶和免疫酶活力存在一定差异。
Bakke I, Skjermo J, Vo TA, et al. Live feed is not a major determinant of the microbiota associated with cod larvae (Gadus morhua). Environmental Microbiology Reports, 2013, 5(4): 537-548 DOI:10.1111/1758-2229.12042 |
Banerjee G, Ray AK. Bacterial symbiosis in the fish gut and its role in health and metabolism. Symbiosis, 2017, 72(1): 1-11 DOI:10.1007/s13199-016-0441-8 |
Barcellos LJG, Kreutz LC, Quevedo RM, et al. Nursery rearing of jundiá, Rhamdia quelen (Quoy and Gaimard) in cages: Cage type, stocking density and stress response to confinement. Aquaculture, 2004, 232(1): 383-394 |
Cai SH, Lu YS, Jian JC, et al. Protection against Vibrio alginolyticus in crimson snapper Lutjanus erythropterus immunized with a DNA vaccine containing the OmpW gene. Diseases of Aquatic Organisms, 2013, 106(1): 39-47 DOI:10.3354/dao02617 |
Cantarel BL, Coutinho PM, Rancurel C, et al. The carbohydrate-active enzymes database (CAZy): An expert resource for glycogenomics. Nucleic Acids Research, 2009, 37(Database issue): D233-D238 |
Chen JG, Yang JF, Xiong J, et al. The innate immune response in Lateolabrax japonicus induced by lipopolysaccharide from Glaciecola polaris strain ARK149 (LMG21854). Agricultural Sciences in China, 2010, 9(10): 1504-1511 DOI:10.1016/S1671-2927(09)60245-5 |
De Schryver P, Sinha AK, Kunwar PS, et al. Poly-β- hydroxybutyrate (PHB) increases growth performance and intestinal bacterial range-weighted richness in juvenile European sea bass, Dicentrarchus labrax. Applied Microbiology and Biotechnology, 2010, 86: 1535-1541 DOI:10.1007/s00253-009-2414-9 |
Du MY, Ye SG, Liu J, et al. Research advances on antagoistic microbes and application in aquatic animal pathogens: A review. Journal of Dalian Ocean University, 2017, 32(6): 753-758 [杜明洋, 叶仕根, 刘娟, 等. 水产动物病原拮抗微生物及其应用研究进展. 大连海洋大学学报, 2017, 32(6): 753-758] |
Dwivedi M, Ansarullah, Radichev I, et al. Alteration of immune- mechanisms by human microbiota and development and prevention of human diseases. Journal of Immunology Research, 2017, ID 6985256 |
Fisheries and Fisheries Administration Bureau of Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook. Beijing: China Agriculture Press, 2018: 18-26 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴. 北京: 中国农业出版社, 2018: 18-26]
|
Flint HJ, Scott KP, Duncan SH, et al. Microbial degradation of complex carbohydrates in the gut. Gut Microbes, 2012, 3(4): 289-306 DOI:10.4161/gmic.19897 |
He JJ, Wang P, Feng J, et al. Effects of replacing fish meal with corn gluten meal on growth, intestinal histology, and intestinal microbiota of large yellow croaker, Larimichthys crocea. Journal of Fishery Sciences of China, 2018, 25(2): 361-372 [何娇娇, 王萍, 冯建, 等. 玉米蛋白粉对大黄鱼生长、肠道组织结构及肠道菌群的影响. 中国水产科学, 2018, 25(2): 361-372] |
Jiang Y, Liu Z, Liu X, et al. Structural characteristics and succession of intestinal microbiota for Paralichthys olivaceus during the early life stage. Aquaculture Research, 2019a, 50: 529-540 |
Jiang Y, Wang Y, Zhang Z, et al. Responses of microbial community structure in turbot (Scophthalmus maximus) larval intestine to the regulation of probiotic introduced through live feed. PLoS ONE, 2019b, 14(5): e0216590 DOI:10.1371/journal.pone.0216590 |
Jiang Y, Xu YJ, Liu XZ, et al. Analysis of the structure and function for gastrointestinal microbiota of large yellow croaker (Larimichthys crocea) juveniles cultured in indoor tank and cage. Feed Industry, 2019, 40(6): 35-43 [姜燕, 徐永江, 柳学周, 等. 工厂化和网箱养殖大黄鱼幼鱼消化道微生物群落结构与功能分析. 饲料工业, 2019, 40(6): 35-43] |
Jiang Y, Zhang Z, Wang Y, et al. Effects of probiotic on microfloral structure of live feed used in larval breeding of turbot Scophthalmus maximus. Chinese Journal of Oceanology and Limnology, 2018, 36(3): 1002-1012 DOI:10.1007/s00343-018-7049-1 |
Kelly P. Nutrition, intestinal defence and the microbiome. Proceedings of the Nutrition Society, 2010, 69(2): 261-268 |
Li CY, Xu YJ, Liu XZ, et al. Comparative analysis of composition, diversity and origin of intestinal bacterial community in pond- and indoor tank-culture Japanese flounder (Paralichthys olivaceus). Journal of Fisheries of China, 2015, 39(2): 245-255 [李存玉, 徐永江, 柳学周, 等. 池塘和工厂化养殖牙鲆肠道菌群结构的比较分析. 水产学报, 2015, 39(2): 245-255] |
Li J, He RG, Wang XD. Comparative studies on digestive enzymatic activities of the four alimentary organs in Acipenser sinensis. Fisheries Science and Technology Information, 2001, 28(3): 99-102 [李瑾, 何瑞国, 王学东. 中华鲟消化酶活性分布的研究. 水产科技情报, 2001, 28(3): 99-102] |
Li J, Ma SY, Woo NYS. Vaccination of Silver Sea Bream (Sparus sarba) against Vibrio alginolyticus: Protective evaluation of different vaccinating modalities. International Journal of Molecular Sciences, 2016, 17(1): E40 |
Li Y, Yang P, Zhang Y, et al. Effects of dietary glycinin on the growth performance, digestion, intestinal morphology and bacterial community of juvenile turbot, Scophthalmus maximus L. Aquaculture, 2017, 479: 125-133 DOI:10.1016/j.aquaculture.2017.05.008 |
Liu Z, Gao X, Yu J, et al. Effects of different salinities on growth performance, survival, digestive enzyme activity, immune response, and muscle fatty acid composition in juvenile American shad (Alosa sapidissima). Fish Physiology Biochemistry, 2017, 43(3): 761-773 DOI:10.1007/s10695-016-0330-3 |
Liu ZX, Liu XZ, Shi B, et al. Composition of intestinal bacterial community of Japanese flounder (Paralichthys olivaceus) during early life stages. Progress in Fishery Sciences, 2017, 38(1): 111-119 [刘增新, 柳学周, 史宝, 等. 牙鲆(Paralichthys olivaceus)仔稚幼鱼肠道菌群结构比较分析. 渔业科学进展, 2017, 38(1): 111-119] |
Nayak SK. Probiotics and immunity: A fish perspective. Fish and Shellfish Immunology, 2010, 29(1): 2-14 DOI:10.1016/j.fsi.2010.02.017 |
Noonpakdee W, Santivarangkna C, Jumriangrit P, et al. Isolation of nisin-producing Lactococcus lactis WNC 20 strain from nham, a traditional Thai fermented sausage. International Journal of Food Microbiology, 2003, 81(2): 137-145 |
Qian G, Xu Z. Effect of polysaccharide extracted from Glaciecola polaris on the protection of mouse macrophages from oxidative injury. Bioresource Technology, 2007, 98(1): 202-206 DOI:10.1016/j.biortech.2005.12.004 |
Ray AK, Ghosh K, Ringø E. Enzyme-producing bacteria isolated from fish gut: A review. Aquaculture Nutrition, 2012, 18(5): 465-492 DOI:10.1111/j.1365-2095.2012.00943.x |
Semova I, Carten JD, Stombaugh J, et al. Microbiota regulate intestinal absorption and metabolism of fatty acids in the zebrafish. Cell Host and Microbe, 2012, 12(3): 277-288 DOI:10.1016/j.chom.2012.08.003 |
Shabat SK, Sasson G, Doron-faigenboim A, et al. Specific microbiome-dependent mechanisms underlie the energy harvest efficiency of ruminants. The ISME Journal, 2016, 10(12): 2958-2972 DOI:10.1038/ismej.2016.62 |
Sullam KE, Essinger SD, Lozupone CA, et al. Environmental and ecological factors that shape the gut bacterial communities of fish: A meta-analysis. Molecular Ecology, 2012, 21(13): 3363-3378 DOI:10.1111/j.1365-294X.2012.05552.x |
Tagg JR, Dajani AS, Wannamaker LW. Bacteriocins of gram- positive bacteria. Bacteriological Reviews, 1976, 40(3): 722-756 DOI:10.1128/MMBR.40.3.722-756.1976 |
Wang CA, Hu G, Sun P, et al. Effects of dietary protein and lipid levels on growth performance, digestive enzyme activities and serum indices of Salmo trutta fario broodstock. Chinese Journal of Animal Nutrition, 2017, 29(2): 1-12 [王常安, 户国, 孙鹏, 等. 饲料蛋白质和脂肪水平对亚东鲑亲鱼生长性能、消化酶活性和血清指标的影响. 动物营养学报, 2017, 29(2): 1-12] |
Wang CC, Yan QP, Huang WQ, et al. Study on intestinal bacteria of cultured large yellow croaker (Pseudosciaena crocea) in Sansha Bay, Fujian Province. Journal of Jimei University (Natural Science), 2014, 19(1): 1-6 [王程程, 鄢庆枇, 黄伟卿, 等. 福建三沙湾养殖大黄鱼肠道菌群研究. 集美大学学报(自然科学版), 2014, 19(1): 1-6] |
Wang HY. Digestive enzyme in turbot Scophthalmus maximus L. Doctoral Dissertation of Ocean University of China, 2004, 29-46 [王海英.大菱鲆主要消化酶-蛋白酶、脂肪酶、淀粉酶的研究.中国海洋大学博士研究生学位论文, 2004, 29-46] http://d.wanfangdata.com.cn/Thesis/Y646715
|
Wang M, Liu G, Lu M, et al. Effect of Bacillus cereus as a water or feed additive on the gut microbiota and immunological parameters of Nile tilapia. Aquaculture Research, 2017, 48(6): 3163-3173 DOI:10.1111/are.13146 |
Wang XS, Zhang CJ, Peng SM, et al. Difference in growth, immunity and serum biochemical parameters of Nibea albiflora between closed recirculating aquaculture and offshore cage culture system. Marine Fisheries, 2018, 40(2): 207-216 [王孝杉, 张晨捷, 彭士明, 等. 循环水和网箱两种养殖模式下黄姑鱼生长、免疫及血清生化的差异. 海洋渔业, 2018, 40(2): 207-216] |
Xue BG, Lou B, Xu DD, et al. Impact of density stress on growth, metabolism and non-specific immune functions of juvenile Nibea albiflora. Progress in Fishery Scinces, 2013, 34(2): 45-51 [薛宝贵, 楼宝, 徐冬冬, 等. 密度胁迫对黄姑鱼幼鱼生长、代谢及非特异性免疫的影响. 渔业科学进展, 2013, 34(2): 45-51] |
Yang H, Xing XP, Huang Q, et al. Effects of temperature and pH on activities of digestive enzymes in Perca flavescens. Journal of Northwest A and F University (Nat. Sci. Ed.), 2014, 42(10): 1-6 [杨婳, 邢秀苹, 黄权, 等. 温度和pH对黄金鲈消化酶活力的影响. 西北农林科技大学学报(自然科学版), 2014, 42(10): 1-6] |
Zhang Y, Feng S, Chen J, et al. Stimulatory effects of chitinase on growth and immune defense of orange-spotted grouper (Epinephelus coioides). Fish and Shellfish Immunology, 2012, 32(5): 844-854 DOI:10.1016/j.fsi.2012.02.009 |
Zhang Z, Xu D, Wang L, et al. Convergent evolution of rumen microbiomes in high-altitude mammals. Current Biology, 2016, 26(14): 1873-1879 DOI:10.1016/j.cub.2016.05.012 |
Zhao ZG, Li JN, Xu QY, et al. Effects of different ration levels in temperature fluctuation on digestive enzyme, metabolic enzyme and antioxidase activities of juvenile Amur sturgeon (Acipenser schrenckii Brandt). Chinese Journal of Animal Nutrition, 2017, 29(1): 127-133 [赵志刚, 李晋南, 徐奇友, 等. 变温条件下不同投喂水平对施氏鲟幼鱼消化酶、代谢酶和抗氧化酶活性的影响. 动物营养学报, 2017, 29(1): 127-133] |
Zhou JX, Chen Y, Huang Q, et al. On activity of digestive ferment of fish and its change affected by the circumstances. Journal of Beihua University (National Science), 2001, 2(1): 70-73, 83 [周景祥, 陈勇, 黄权, 等. 鱼类消化酶的活性及环境条件的影响. 北华大学学报(自然科学版), 2001, 2(1): 70-73, 83] |
Zhuo LX, Zhao HX, Huang YH, et al. Influence of oxidized fish oil on the intestinal health of juvenile yellow catfish (Pelteobagrus fulvidraco) and the use of arginine as an intervention measure. Journal of Fisheries of China, 2018, 42(1): 100-111 [卓丽欣, 赵红霞, 黄燕华, 等. 氧化鱼油对黄颡鱼幼鱼肠道健康的影响及精氨酸的干预作用. 水产学报, 2018, 42(1): 100-111] |



