2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛 266071;
3. 威海长青海洋科技股份有限公司 荣成 264316
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao 266071;
3. Weihai Changqing Ocean Science & Technology Co., Ltd, Rongcheng 264316
动态能量收支(Dynamic energy budget, DEB)理论是Kooijman(1986)基于κ原则提出的,描述生物摄食同化的能量一部分(κ)用于维持身体结构生长,另一部分(1–κ)用于性腺成熟和繁殖储备(Kooijman, 2000)。依据DEB理论而建立的个体生长模型,又称动态能量收支模型、DEB模型,不仅能够量化能量在整个生物生活史阶段的分配情况(Sousa et al, 2010; Ren et al, 2001;Kooijman, 2010),而且能够模拟生物在一段时期内的生长状况。DEB理论的关键是基于物种之间代谢的相似性,且都遵循κ原则。DEB模型是参数化模型,原则上相同的基础模型结构可用于所有的生物物种,模型表现出的物种在生命史上的差异主要是由于DEB参数集合的差异(Sousa et al, 2006)。因此,参数对于DEB模型的构建十分重要,参数越准确,模型的拟合效果越好(Ren et al, 2008; 张继红等, 2016)。目前,DEB模型已成功应用于水产养殖,包括鱼类(Orestis et al, 2019)、贝类(Bourlès et al, 2009)、大型海藻(蔡碧莹等, 2019)和海参(Ren et al, 2016)等。
皱纹盘鲍(Haliotis discus hannai)是我国重要的养殖经济贝类,主要分布在辽东半岛和山东半岛(常亚青等, 1998)。皱纹盘鲍含有丰富的营养成分,深受人们喜爱(Koizumi et al, 2017; 李太武等, 1995)。随着市场需求量的增大以及水产养殖技术的成熟,皱纹盘鲍已经实现大规模人工养殖(杨义等, 2007; 张晓梅等, 2010)。通过建立皱纹盘鲍个体生长模型,并进一步建立其养殖容量模型,对于指导养殖管理和评估养殖容量具有重要意义(刘慧等, 2018)。国内外对双壳滤食性贝类DEB模型的研究已有较多报道。国外已建立贻贝(Mytilus edulis) (Saraiva et al, 2012)、长牡蛎(Crassostrea gigas) (Rico-Villa et al, 2010)、蛤类(Macoma balthica; Cerastoderma edule) (van Hare et al, 1993)等的DEB模型;国内有虾夷扇贝(Patinopecten yessoensis)(张继红等, 2017)的DEB模型。由于国外鲍养殖相较于其他海产贝类品种较少,国内对数理模型的研究起步较晚,因此,单壳舐食性贝类(如鲍)DEB模型的研究较少,主要以传统能量方程的研究为主(Fang et al, 2018)。本研究参照国内外贝类生物DEB模型的研究方法,通过生理实验确定皱纹盘鲍DEB模型的6个相关参数,包括单位体积维持耗能率(Volume-specific maintenance costs,
选取壳长为(5.91±0.26) cm的皱纹盘鲍用于饥饿实验。选取不同规格[分为3组:a组壳长为(2.37± 0.18) cm,b组为(4.65±0.11) cm,c组为(6.21±0.51) cm]分别用于温度对耗氧的影响实验和生物学测量。样品均取自山东省荣成市寻山集团。皱纹盘鲍去掉表层附着物之后置于实验室水槽中24 h充气暂养,暂养水温为(18±1)℃,盐度为30,暂养3 d,成活率稳定后开始正式实验。
实验于2018年9月~10月初、10月底~12月在威海长青海洋科技股份有限公司国家海产贝类研究中心实验室进行。
1.2 实验方法 1.2.1 饥饿实验取同一规格、壳长为(5.91± 0.26) cm皱纹盘鲍70个,进行饥饿实验。实验期间不投饵,水温为皱纹盘鲍正常呼吸代谢的温度,控制在18℃左右,每7 d换水3次,保持水槽中的海水清洁且不含杂藻。每隔5~10 d取5个皱纹盘鲍,碘量法(GB/T 7489-87)测定其呼吸耗氧率,并测定其总湿重(W)、软组织湿重(WW)、软组织干重(DW)和软组织有机物含量(%),软组织干重与呼吸耗氧率基本保持恒定时结束实验(35 d)。其中,总湿重为皱纹盘鲍体表无水后的全重量;软组织湿重为剥离壳之后,剩余全部软组织的鲜重;软组织干重为测定完软组织湿重之后,在60℃下的烘干箱烘干72 h的重量;软组织有机物含量根据灰分法(GB 5009.4-2016《食品安全国家标准食品中灰分的测定》)估算,即将称过干重的软组织进行碳化至无烟,然后转移到马弗炉中,在450℃下灼烧4 h后称重,质量差即为软组织有机物的含量。皱纹盘鲍不随饥饿时间而变化的呼吸耗氧率为单位体积维持耗能率:
| $[{\dot p_M}] = {R_t} \times {E_o} \times t/\left({{\rho _o} \times V} \right)$ | (1) |
式中,
皱纹盘鲍软组织干重不随饥饿时间变化时有机物的重量即为皱纹盘鲍单位体积结构物质所需的能量
| $[{E_G}] = k \times {W_t} \times {C_t}/\left({{T_r} \times V} \right)$ | (2) |
式中,
鲍最大储存能量
| $[{E_m}] = k \times \left({{W_0} \times {C_0} - {W_t} \times {C_t}} \right)/V$ | (3) |
式中,为有机物的能值(23000 J/g),为软组织干重的初始值(g),
储备能量含量
| ${\mu _E} = k \times \left({{W_0} \times {C_0} - {W_t} \times {C_t}} \right)/\left({{W_0} - {W_t}} \right)$ | (4) |
式中,为有机物的能值(23000 J/g),为软组织干重的初始值(g),
将暂养的3种规格的皱纹盘鲍分为5组,每组5只,由室温18℃逐步升温或降温至5℃、10℃、15℃、20℃和25℃ 5个温度梯度,防止皱纹盘鲍因温度骤变不适应而死亡。溶解氧采用碘量法测定,耗氧实验进行1~2 h,在密闭的呼吸室中测定初始和终末耗氧率(DO),并测定鲍的软组织干重(DW)。
单位干重耗氧率
| ${\rm{OR}} = \left({{\rm{D}}{{\rm{O}}_0} - {\rm{D}}{{\rm{O}}_t}} \right) \times {V_L}/\left({{\rm{DW}} \times {t_1}} \right)$ | (5) |
式中,
取100只不同规格的鲍测定其生物学参数,包括壳长(L)、总湿重(W)、软组织湿重(WW)及软组织干重(DW)。壳长用游标卡尺(精度0.01 mm)测量;重量采用电子天平(精度0.01 g)称量。体积(V)通常较难测量,一般根据软组织湿重和密度(1.1 g/cm3)的乘积得到(Sablani et al, 2004)。
| $V = {(\delta m \times L)^3}$ | (6) |
式中,V为鲍的体积(cm3);
实验结果运用Excel 2016进行数据统计与线性回归估计并作图;采用SPSS 22.0分析软件进行单因素方差分析(One-way ANOVA)得到标准差,最终结果以平均值±标准差(Mean±SD)表示。
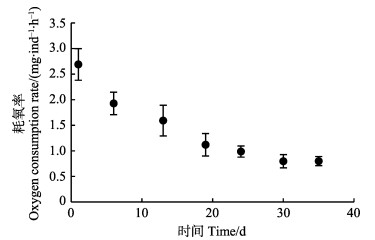
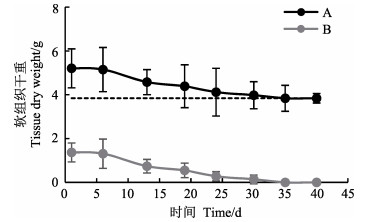
2 结果 2.1实验共进行35 d,期间不投喂。随着饥饿时间延长,皱纹盘鲍软组织干重和耗氧率逐渐降低。鲍呼吸耗氧率由最初2.69 mg/(ind.∙h)逐渐下降,到第30天左右逐渐稳定在0.8 mg/(ind.∙h) (图 1),软组织干重由(5.21±0.89) g降低至(3.84±0.22) g(图 2),并基本保持恒定。软组织干重和呼吸耗氧率较初始值下降26.3%和70%,皱纹盘鲍软组织有机物含量从80%降到58% (表 1)。
|
图 1 皱纹盘鲍耗氧率随饥饿时间的变化情况 Fig.1 The change of oxygen consumption rate of H. discus hannai with the starvation time |
|
图 2 皱纹盘鲍软组织干重(A)和存储物质(B)随饥饿时间变化情况 Fig.2 Changes in dry flesh weight (A) and storage of reserves (B) in H. discus hannai during the starvation experiment |
|
|
表 1 饥饿实验相关参数计算值 Tab.1 Parameter calculation value related to the starvation experiment |
皱纹盘鲍在饥饿后耗氧率基本维持稳定,根据公式(1)计算得出单位体积维持耗能率
在饥饿实验25 d内,软组织干重下降明显,在35 d之后基本趋于稳定,根据公式(2),将软组织干重转化为单位体积结构物质所需的能量值
根据公式(3),将鲍饥饿实验初始时的能量值与饥饿后剩余能量的差值转化为单位体积最大存储能量
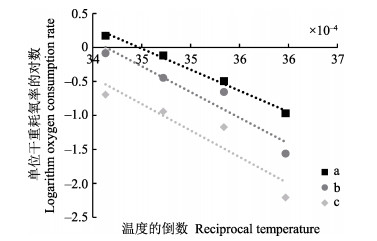
在实验条件下,3组皱纹盘鲍(表 1)单位干重耗氧率随个体大小的增加而减小(图 3)。耗氧率随温度呈先上升后下降的趋势,在5℃~20℃时,单位干重耗氧率随温度的升高而增大,在20℃达最高值;之后,随温度升高,单位干重耗氧率降低。在20℃转折点之前,依据温度对皱纹盘鲍单位干重耗氧率的关系,得出a、b、c组鲍耗氧率的ln值与温度(热力学温度)倒数的线性关系分别为lnR = –6201.1T–1+21.377 (R2 = 0.9914)、lnR = –7578.7T–1+25.87(R2 = 0.9126)、lnR = –7807.6T–1+ 26.104(R2 = 0.8656) (图 4)。3组方程斜率的绝对值的平均值为7196 K,即皱纹盘鲍的Arrhenius温度
|
|
表 2 3组皱纹盘鲍生物学特征 Tab.2 Biological characteristics of three groups of H. discus hannai |

|
图 3 不同大小的皱纹盘鲍在不同温度下的单位干重耗氧率 Fig.3 Oxygen consumption rate per unit dry weight of abalone at different sizes |
|
图 4 皱纹盘鲍单位干重耗氧率的ln值与温度的倒数线性关系 Fig.4 Linear relationship between the logarithm value of the oxygen consumption rate per unit dry weight and the reciprocal temperature |
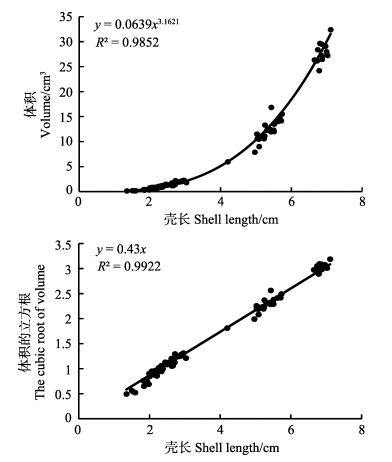
通过拟合回归,皱纹盘鲍壳长与体积符合三次函数(图 5):V = 0.0639 L3.1621(R2 = 0.9852),根据公式(6)壳长与软组织湿重的立方根线性回归的斜率(图 5)即为形状系数δm的值为0.43。
|
图 5 皱纹盘鲍壳长与软组织湿重的关系 Fig.5 The relationship between wet flesh weight and shell length for H. discus hannai |
体积是模型输出状态变量的关键因素,形状系数δm是表征体积和表面积函数的重要参数,因此,δm值的获得对模型构建十分重要。因贝类的体积和表面积较难测量,通常使用间接法测定。一种方法是只有贝壳的情况下测定贝壳的重量,用密度为1 g/cm3物质(如马铃薯渣)填满贝壳再次称重(van der Veer et al, 2001、2006),质量差为贝的物理体积,然后再通过公式
几乎所有贝类的生长都受温度的影响(王有基等, 2014),因Arrhenius温度
目前已有多种双壳贝类DEB模型参数的报道,其中,形状系数主要在0.17~0.39范围内,如太平洋牡蛎(Crassostrea gigas)的δm值为0.175,紫贻贝(Mytilus edulis)为0.287,虾夷扇贝为0.32等(van der Veer et al, 2006)。本研究测得的皱纹盘鲍形状系数是0.43,比已报道的双壳贝类数值要大,这也许与皱纹盘鲍是单壳贝类,其软组织湿重与壳长的比值要高于双壳贝类。
贝类Arrhenius温度
不同贝类饥饿实验相关参数值
DEB模型中其他的参数,如温度函数中温度的上下限可根据鲍生长温度确定,结构物质体积根据鲍性腺发育成熟的壳长计算,吸收效率可根据已有研究得出。
DEB模型已广泛应用于双壳贝类,但对于鲍等单壳贝类研究较少。本研究通过实验计算了6个参数值,为进一步构建皱纹盘鲍DEB模型提供了必需的参数值,也为进一步研究其他单壳贝类提供了理论依据。
Bourlès Y, Alunno-Bruscia M, Pouvreau S, et al. Modelling growth and reproduction of the Pacific oyster Crassostrea gigas: Advances in the oyster-DEB model through application to a coastal pond. Journal of Sea Research, 2009, 62(2-3): 62-71 DOI:10.1016/j.seares.2009.03.002 |
Brey T, Rumohr H, Ankar S. Energy content of macrobenthic invertebrates: General conversion factors from weight to energy. Journal of Experimental Marine Biology and Ecology, 1988, 117(3): 271-278 DOI:10.1016/0022-0981(88)90062-7 |
Cai BY, Zhu CB, Liu H, et al. Model simulated growth of kelp Saccharina japonica in Sanggou Bay. Progress in Fishery Sciences, 2019, 40(3): 31-41 [蔡碧莹, 朱长波, 刘慧, 等. 桑沟湾养殖海带生长的模型预测. 渔业科学进展, 2019, 40(3): 31-41] |
Chang YQ, Wang ZC. An energy budget for individual pacific abalone (Haliotis discus hannai Ino). Chinese Journal of Applied Ecology, 1998, 9(5): 511-516 [常亚青, 王子臣. 皱纹盘鲍的个体能量收支. 应用生态学报, 1998, 9(5): 511-516] |
Chang YQ. Mollusc culture. Beijing: China Agriculture Press, 2007 [常亚青. 贝类增养殖学. 北京: 中国农业出版社, 2007]
|
Fang JH, Zhang P, Fang JG, et al. The growth and carbon allocation of abalone (Haliotis discus hannai Ino) of different sizes at different temperatures based on the abalone-kelp integrated multitrophic aquaculture model. Aquaculture Research, 2018, 49(8): 2676-2683 DOI:10.1111/are.13769 |
He MX, Yuan T, Huang LM. Preliminary study on compensatory growth in pearl oyster Pinctada martensi Dunker, following starvation. Journal of Tropical Oceanography, 2010, 29(6): 143-146 [何毛贤, 袁涛, 黄良民. 马氏珠母贝饥饿补偿生长的初步研究. 热带海洋学报, 2010, 29(6): 143-146] |
Koizumi Y, Tsuji Y. Abalone Haliotis spp. Application of Recirculating Aquaculture, 2017, 12(30): 175-211 |
Kooijman SALM. Population dynamics on basis of budgets. Dynamics of Physiologically Structured Populations, 1986, 266-297 |
Kooijman SALM. Dynamic energy and mass budgets in biological systems. 2nd ed. Cambridge: Cambridge University Press, 2000
|
Kooijman SALM. Dynamic energy budget theory for metabolic organization. Cambridge: Cambridge University Press, 2010
|
Leighton D, Boolootian RA. Diet and growth in the black abalone, Haliotis cracerodii. Ecology, 1963, 44(2): 227 DOI:10.2307/1932170 |
Li TW, Su XR, Ding MJ. The determination of some nutritional in abalone Haliotis discus hannai Ino. Chinese Journal of Marine Drugs, 1995(1): 47-48 [李太武, 苏秀榕, 丁明进. 皱纹盘鲍中几种营养成分的测定. 中国海洋药物, 1995(1): 47-48] |
Liu H, Cai BY. Advance in research and application on aquaculture carrying capacity. Progress in Fishery Sciences, 2018, 39(3): 158-166 [刘慧, 蔡碧莹. 水产养殖容量研究进展及应用. 渔业科学进展, 2018, 39(3): 158-166] |
Mehner T, Wieser W. Energetics and metabolic correlates of starvation in juvenile perch (Perca fluviatilis). Journal of Fish Biology, 2010, 45(2): 325-333 |
Orestis SZ, Nikos P, Konstadia L. A DEB model for European sea bass (Dicentrarchus labrax): Parameterisation and application in aquaculture. Journal of Sea Research, 2019, 143: 262-271 |
Ren JS, Ross AH. Environmental influence on mussel growth: A dynamic energy budget model and its application to the greenshell mussel Perna canaliculus. Ecological Modelling, 2005, 189(3-4): 347-362 DOI:10.1016/j.ecolmodel.2005.04.005 |
Ren JS, Ross AH. A dynamic energy budget model of the Pacific oyster Crassostrea gigas. Ecological Modelling, 2001, 142(1-2): 105-120 DOI:10.1016/S0304-3800(01)00282-4 |
Ren JS, Schiel DR. A dynamic energy budget model: Parameterisation and application to the Pacific oyster Crassostrea gigas in New Zealand waters. Journal of Experimental Marine Biology and Ecology, 2008, 361(1): 42-48 DOI:10.1016/j.jembe.2008.04.012 |
Ren JS, Stenton-Dozey J, Zhang J. Parameterisation and application of dynamic energy budget model to the sea cucumber Apostichopus japonicus. Aquaculture Environment Interactions, 2016, 9(1): 1-8 |
Rico-Villa B, Bernard I, Robert R, et al. A dynamic energy budget (DEB) growth model for Pacific oyster larvae, Crassostrea gigas. Aquaculture, 2010, 305(1-4): 84-94 DOI:10.1016/j.aquaculture.2010.04.018 |
Sablani SS, Kasapis S, Rahman MS, et al. Sorption isotherms and the state diagram for evaluating stability criteria of abalone. Food Research International, 2004, 37(10): 915-924 DOI:10.1016/j.foodres.2004.05.006 |
Saraiva S, van der Meer J, Kooijman SALM, et al. Validation of a dynamic energy budget (DEB) model for the blue mussel. Marine Ecology Progress, 2012, 463(3): 141-158 |
Sousa T, Domingos T, Poggiale JC, et al. Dynamic energy budget theory restores coherence in biology. Philosophical Transactions of the Royal Society B: Biological Sciences, 2010, 365(1557): 3413-3428 DOI:10.1098/rstb.2010.0166 |
Sousa T, Mota R, Domingos T, et al. Thermodynamics of organisms in the context of dynamic energy budget theory. Physics Review E, Statistical, Nonlinear, and Soft Matter Physics, 2006, 74(5 Pt 1): 051901 |
van der Veer H, Cardoso JFMF, van der Meer J. The estimation of DEB parameters for various Northeast Atlantic bivalve species. Journal of Sea Research, 2006, 56(2): 107-124 |
van der Veer H, Kooijman SALM, van der Meer J. Intra- and interspecies comparison of energy flow in North Atlantic flatfish species by means of dynamic energy budgets. Journal of Sea Research, 2001, 45(34): 303-320 |
van Haren RJF, Kooijman SALM. Application of a dynamic energy budget model to Mytilus edulis (L.). Netherlands Journal of Sea Research, 1993, 31(2): 119-133 DOI:10.1016/0077-7579(93)90002-A |
Wang YJ, Li LS, Li Q, et al. Research progress on eco-physiological responses of shellfish under ocean acidification and global warming. Acta Ecologica Sinica, 2014, 34(13): 3499-3508 [王有基, 李丽莎, 李琼, 等. 珍海洋酸化和全球变暖对贝类生理生态的影响研究进展. 生态学报, 2014, 34(13): 3499-3508] |
Yang Y, Jiang SH, Tang L, et al. Advancements in studies on energy budget of abalone. Science Paper Online, 2007, 2(2): 149-152 [杨义, 姜森颢, 唐玲, 等. 鲍能量学研究进展. 中国科技论文, 2007, 2(2): 149-152] |
Zhang JH, Wu WG, Liu Y, et al. A dynamic energy budget (DEB) growth model for Japanese scallop Patinopecten yessoensis cultured in China. Journal of Fishery Sciences of China, 2017, 24(3): 497-506 [张继红, 吴文广, 刘毅, 等. 虾夷扇贝动态能量收支生长模型. 中国水产科学, 2017, 24(3): 497-506] |
Zhang JH, Wu WG, Xu D, et al. The estimation of dynamic energy budget (DEB) model parameters for scallop Patinopecten yessoensis. Journal of Fisheries of China, 2016, 40(5): 703-710 [张继红, 吴文广, 徐东, 等. 虾夷扇贝动态能量收支模型参数的测定. 水产学报, 2016, 40(5): 703-710] |
Zhang XM, Wang CL, Li LG, et al. Oxygen consumption rate and effect of hypoxia stress on enzyme activity of Octopus variabilis. Journal of Hydroecology, 2010, 3(2): 72-79 [张晓梅, 王春琳, 李来国, 等. 耗氧率及溶氧胁迫对长蛸体内酶活力的影响. 水生态学杂志, 2010, 3(2): 72-79] |



