2. 四川农业大学生命科学学院 雅安 625014;
3. 成都市农林科学院水产研究所 成都 611130
2. College of Life Science, Sichuan Agricultural University, Ya'an 625014;
3. Fisheries Research Institute, Chengdu Academy of Agricultural and Forestry Sciences, Chengdu 611130
温度是鱼类生长发育过程中重要的环境因子,鱼类作为变温水生脊椎动物,温度对其生长、代谢以及其他生理活动都具有重要影响(Elliott, 1995)。应激反应是鱼类受到一个或多个外界环境因素的不良刺激作用所产生的非特异性反应(王国强等, 2009)。温度应激会对鱼类生长(杨健等, 2007; 张雅芝等, 2009)、行为(陈松波, 2004; Goyer et al, 2014)、生殖(张亚晨, 2015)、免疫(Morvan et al, 1996; 何福林等, 2007)等造成影响,从而引起鱼类一系列生理生化指标的改变,如虹鳟(Oncorhynchus mykiss)在水温14℃~23℃下,红细胞数量随温度的升高而减少(向建国, 2008);22℃下急性温度胁迫银鲳(Pampus argenteus)幼鱼48 h,其胃蛋白酶和胰蛋白酶的活力无显著变化(P > 0.05),而二者在32℃下的活力显著上升(P < 0.05) (施兆鸿等, 2016)。热休克蛋白70 (Heat Shock Protein 70, HSP70)是鱼类温度应激中最重要的生理生化指标之一。
HSP70是热休克蛋白(Heat Shock Proteins, HSPs)家族中最为重要的一员,分子量约为70 kDa。遗传学家Ritossa首次在果蝇(Drosophila)唾液腺中发现热休克蛋白(Ritossa, 1962);除热休克外,细胞在低温、缺氧、重金属、营养缺乏等其他应激条件下,也有HSPs生成,因此,又被称为应激蛋白(Stress Protein, SP) (钟文英等, 2005)。HSP70是目前鱼类中研究最广泛的一类热休克蛋白,许多鱼类的hsp70基因序列已报道,如罗非鱼(Oreochromis mossambicus) (Molina et al, 2000)、草鱼(Ctenopharyngodon idella) (林亚秋等, 2009)、团头鲂(Megalobrama amblycephala) (明建华等, 2009)、达氏鳇(Huso dauricus)(Peng et al, 2016)等。HSP70具有重要的生物学功能,如分子伴侣功能、保护遗传物质DNA、增强细胞耐受能力等。作为分子伴侣,在高温下,HSP70能协助变性蛋白复性(Heredia, 2008)、保护生物体免受损伤(Deane et al, 2006; Rosic et al, 2011)。
杂交黄颡鱼(黄颡鱼Pelteobagrus fulvidraco ♀ ×瓦氏黄颡鱼Pelteobagrus vachelli ♂)“黄优1号”是由华中农业大学等多家育种单位共同研发、经全国水产原种和良种审定委员会审定通过的我国淡水养殖鱼类新品种(品种登记号GS-02-001-2018),其在相同养殖条件下,与母本黄颡鱼相比,1龄鱼生长速度平均提高143.4%;与父本瓦氏黄颡鱼相比,品质和市场接受度提高。目前,尽管在国内已开展关于杂交黄颡鱼杂交育种及杂种鉴定等初步研究工作(王卫民, 2003; 唐忠林等, 2016; 巩高瑞等, 2017; 张佳佳等, 2017),但在抗逆方面的研究相对较少。本研究对杂交黄颡鱼hsp70基因进行克隆、生物信息学分析、组织表达的同时,探究了温度应激对hsp70基因组织表达的影响,为其抗逆、抗病选育奠定理论基础,也为其健康高效养殖提供一定的理论指导。
1 材料与方法 1.1 实验鱼选取健康无病、规格整齐的杂交黄颡鱼30尾,体长为(13.88±1.03) cm,采集于四川省眉山市东坡区缘通特种水产养殖场。
30尾鱼随机分为4组,每组6尾,4组鱼均暂养于48 cm×34 cm×25 cm的养殖箱中,水深20 cm。设置4个温度梯度,分别为20℃(常温组)、25℃、28℃和31℃,采用控温器控温(±0.5℃),处理3 h后麻醉,迅速取各组的肝脏、鳃、脑和肌肉,液氮速冻,–80℃超低温冰箱保存。
1.2 hsp70基因核心序列的克隆参照Total RNA Kit Ⅱ(Omega)提取杂交黄颡鱼总RNA。1%琼脂糖凝胶电泳和NanoDrop 2000 (Thermo)检测RNA的完整性、浓度和纯度。参照PrimeScript™ RT reagent Kit with gDNA Eraser (TaKaRa)的步骤进行cDNA的合成。
根据GenBank中黄颡鱼的hsp70 cDNA序列(登录号:KR673401.1),设计引物(表 1)扩增杂交黄颡鱼hsp70基因核心序列。以杂交黄颡鱼cDNA为模板进行PCR扩增,PCR体系参照2×TSINGKE® Master Mix (TSINGKE)。回收与纯化、测序,获得杂交黄颡鱼hsp70基因核心序列。
|
|
表 1 本实验所用的引物序列 Tab.1 The primers used in the experiment |
根据杂交黄颡鱼hsp70的核心序列,设计qPCR引物(表 1)。参照黄颡鱼组织表达相关研究(冯美惠等, 2017; 张娟等, 2009),获取内参基因β-actin和18S rRNA序列设计内参引物(表 1)。提取杂交黄颡鱼肝脏、鳃、脑、肌肉的总RNA,反转录,采用实时荧光定量PCR(Quantitative Real-time PCR, qPCR)方法检测hsp70基因mRNA在肝脏、鳃、脑、肌肉中的相对表达量,计算方法为2–ΔΔCt (Livak et al, 2001)。
采用SPSS 22.0进行单因素方差分析(One-way ANOVA),不同处理间进行Duncan’s多重比较检验,显著水平取0.05。
2 结果 2.1 hsp70基因核心序列分析测序结果表明,从杂交黄颡鱼肝脏组织分离鉴定得到的hsp70基因片段大小为735 bp(图 1),通过NCBI上的ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)确定开放阅读框(Open Reading Frame, ORF),ORF为729 bp,翻译得到编码243个氨基酸的蛋白质;于ExPASy-Protparam tool (https://web.expasy.org/cgi-bin/protparam/protparam)进行蛋白序列基本特征分析:氨基酸组成中,Leu(L)、Ala(A)和Ser(S)含量较高,分别为8.6%、8.6%和7.8%;酸性氨基酸(Asp +Glu) 27个,占11.1%;碱性氨基酸(Arg+Lys) 32个,占13.2%;其理论pI/MW为9.06/27251.28。

|
图 1 杂交黄颡鱼hsp70基因核心序列及推测的氨基酸序列 Fig.1 Core cDNA and deduced amino acid sequences of hsp70 in the hybrid of P. fulvidraco ♀ × P. vachelli ♂ |
将克隆得到的杂交黄颡鱼hsp70基因核苷酸与氨基酸序列分别于NCBI上的BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行Nucleotide BLAST和Protein BLAST。运用MegAlign 7.0进行核苷酸与氨基酸同源性分析。结果显示(表 2),杂交黄颡鱼与6种鱼类的hsp70基因核苷酸同源性为80.2%~ 99.7%,氨基酸同源性为87.6%~99.6%,表明hsp70基因有较高同源性,该区段在进化中高度保守。图 2详细列出了杂交黄颡鱼与以上6种鱼类的hsp70基因氨基酸序列的差异。
|
|
表 2 杂交黄颡鱼hsp70基因核苷酸与氨基酸同源性分析 Tab.2 Homology analysis of nucleotide and amino acid sequences of hsp70 gene in the hybrid of P. fulvidraco ♀ × P. vachelli ♂(%) |

|
图 2 hsp70基因氨基酸序列比对 Fig.2 Alignment of amino acid sequences of hsp70 gene |
以β-actin和18S rRNA为双内参基因,qPCR分析hsp70基因在20℃(常温组)杂交黄颡鱼不同组织中的相对表达量。结果显示(图 3),hsp70基因在杂交黄颡鱼肝脏、鳃、脑、肌肉4个组织均有表达,其表达量由高到低依次为肝脏、脑、鳃、肌肉。肝脏与脑、鳃、肌肉的表达量均差异显著(P < 0.05),脑与鳃、肌肉的表达量差异显著(P < 0.05),鳃与肌肉的表达量差异不显著(P > 0.05)。

|
图 3 杂交黄颡鱼hsp70基因在不同组织中的相对表达量 Fig.3 Relative expression of hsp70 gene in different tissues of the hybrid of P. fulvidraco ♀ × P. vachelli ♂ 图中不同字母表示在不同组织间的表达差异(P < 0.05) Different letters in the figure represent differences in expression between different tissues (P < 0.05) |
温度应激实验qPCR结果显示(图 4),25℃、28℃和31℃下,hsp70基因的表达量由高到低依次均为鳃、肝脏、脑、肌肉,且28℃、31℃下hsp70基因于鳃中的表达量与肝脏、脑、肌肉中的表达量差异显著(P < 0.05);而25℃下,hsp70基因于鳃中的表达量与肝脏中的表达量差异不显著(P>0.05),但与脑、肌肉中的表达量差异显著(P < 0.05)。
肝脏中hsp70基因的表达量随温度的升高先上升后下降,28℃时达到最大值,表达量显著高于20℃、25℃和31℃下的表达量(P < 0.05);鳃中,hsp70基因的表达量随温度的升高而不断上升,31℃时达到最大值,28℃和31℃下的表达量显著高于20℃和25℃下的表达量(P < 0.05),说明温度应激对杂交黄颡鱼hsp70基因在鳃中的表达量影响大;脑中,hsp70基因的表达量随温度的升高先上升后下降,28℃时达到最大值,且28℃下的表达量与20℃、25℃和31℃下的表达量差异显著(P < 0.05);肌肉组织中,hsp70基因的表达量随温度的升高逐渐上升,31℃时达到最大值,31℃下的表达量与20℃、25℃和28℃下的表达量差异显著(P < 0.05)。
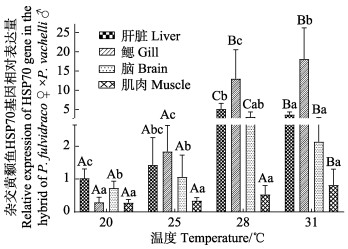
|
图 4 不同温度下杂交黄颡鱼hsp70基因在不同组织中的相对表达量
Fig.4 Relative expression of hsp70 gene in different tissues of the hybrid of P. fulvidraco ♀ × P. vachelli ♂ at different temperatures
不同小写字母代表同一温度不同组织间的表达差异(P < 0.05),不同大写字母代表同一组织不同温度下的 表达差异(P < 0.05) Different lowercase letters in the figure represent differences in expression between different tissues at the same temperature (P < 0.05), and different uppercase letters represent differences in expression at different temperatures of the same tissue (P < 0.05) |
鱼类是变温脊椎动物,温度的日变化和季节变化对鱼的生命过程有重要影响,水环境的其他因素(如重金属、缺氧、细菌感染等)也影响着鱼类的分布和生理状态,而这些因素与它们体内热休克蛋白的数量和表达程度息息相关。HSPs在生物界普遍存在,在同一生物体的不同组织内均有表达(曲凌云等, 2004)。本研究通过qPCR的方法检测了hsp70在杂交黄颡鱼不同组织中的相对表达量,结果表明(图 3),hsp70基因在肝脏、鳃、脑、肌肉具有明显的组织特异性,肝脏中的表达量显著高于脑、鳃、肌肉中的表达量,这可能与肝脏在动物消化、代谢、免疫、内环境的调节等方面都具有十分重要的作用有关。hsp70的组织特异性表达在草鱼(林亚秋等, 2009)、淞江鲈(Trachidermus fasciatus) (刘庆全, 2013)、达氏鳇(Peng et al, 2016)中均有报道,但相对表达量和组织间表达水平存在差异:如草鱼的各组织间的表达量由高到低依次为脑、肝胰脏、鳃、肌肉,且脑与肝胰脏、鳃、肌肉的表达量差异显著(P < 0.05) (林亚秋等, 2009);淞江鲈hsp70基因在鳃、脑、肌肉、肝脏中的表达量依次递减(刘庆全, 2013)。可能原因有物种的差异性及实验温度设置的不同,温度变化对hsp70在不同的组织中会产生不同的响应(Peng et al, 2016; 王云彪, 2008; 万文菊, 2006)。
温度应激实验研究不同温度下杂交黄颡鱼hsp70基因在不同组织中的表达水平。20℃~31℃,随着温度的升高,hsp70基因在不同组织中均呈先上升趋势,表明hsp70基因在保护机体免受损害中发挥作用,其中,鳃和肌肉中的表达量呈持续上升的趋势;而在肝脏和脑中的表达量呈先上升后下降的趋势,28℃到达峰值。鳃、肌肉和肝脏中的变化趋势与草鱼hsp70对温度响应的变化(周鑫等, 2013)趋势一致。脑中的变化趋势与鲤鱼(Cyprinus carpio)的应激实验中10℃~28℃的变化趋势(王云彪, 2008)一致,均呈不断上升的趋势。此外,西伯利亚鲟(Acipenser baerii)进行急性热应激,鱼体从17.5℃迅速转至27.5℃后,hsp70于鳃和脑中的表达量均呈上升趋势(田照辉等, 2013),这也与本研究结果相符。
hsp70具有广泛的运用前景,可作为生物指标诊断鱼类的生理状态(Dunlap et al, 1997; Vijayan et al, 1997)、生物标记物与水环境监测(De, 1996; 沈骅等, 2004),而作为生物标志物在生理学上的合理性即是基于HSP70家族的诱导模式,即细胞内HSP70表达水平可作为机体“温度计”的功能(Ge et al, 2002)。HSP70对温度极为敏感,已被用作分子标记分析生物对温度等环境变化的响应(Mukhopadhyay et al, 2010)。研究表明,急性温度应激会显著改变尼罗罗非鱼(Oreochromis niloticus)幼鱼肝脏HSP70的表达,其表达量基本呈先上升后下降的趋势(强俊等, 2012);而银鲫(Carassius auratus gibelio)热应激2 h后,肝脏中hsp70表达量达到最高(P < 0.01) (周朝伟, 2018)。hsp70在不同组织对温度应激的响应不同,本研究中,杂交黄颡鱼的鳃组织对温度的响应最为敏感,鳃为杂交黄颡鱼温度应激的敏感组织,可能是鳃作为鱼类呼吸代谢的重要器官,hsp70表达量升高是鱼类在温度急剧变化情况下的一种机体保护策略。hsp70基因家族存在亚型hsc70基因,目前国内有开展黄颡鱼HSC70表达(张娟, 2009)的相关研究,25℃下HSC70在所检测的组织中均有表达,且表达量在鳃中最高,在肌肉中最低,这与杂交黄颡鱼在25℃下HSP70的组织表达结果一致,进一步表明HSP70基因家族对黄颡鱼的鳃在温度应激下产生的免疫应答对机体保护具有重要作用。
研究表明,氧限制的热耐受性理论(Oxygen- and capacity-limited thermal tolerance, OCLTT) (Pörtner et al, 2001、2008)可适用于淡水广温性鱼类(周鑫等, 2013),根据该理论:当环境温度超过生物体最适温度时,有氧代谢会下降,随着温度进一步上升,将导致有氧代谢丧失,转变为无氧代谢,氧自由基和变性蛋白相应增加,影响免疫应答及诱导热休克蛋白的表达。由于热休克蛋白的表达需要消耗能量,其只能提供短期保护(Pörtner et al, 2001、2007)。基于hsp70的表达量,后期可开展杂交黄颡鱼耗氧率和半致死温度的实验,以确定杂交黄颡鱼的生理临界温度。这将为杂交黄颡鱼抗逆、抗病选育奠定理论基础,也为其健康高效养殖提供理论指导。
致谢: 感谢四川农业大学生命科学学院杜小刚副教授和李云坤博士研究生,感谢四川农业大学动物科技学院银龙硕士、张月硕士、张松培硕士和苗懿硕士研究生,感谢四川大学生命科学学院黎树博士研究生及眉山伟继水产种业科技有限公司张继业总经理等在实验过程中给予的指导和帮助!
Chen SB. Study on feeding rhythm and respiratory metabolism of common carp at different temperature. Masterxs Thesis of Northeast Agricultural University, 2004, 1-70 [陈松波. 不同温度条件下鲤鱼摄食节律与呼吸代谢的研究. 东北农业大学硕士研究生学位论文, 2004, 1-70] |
De PD. Heat-shock proteins as biomarkers of pollution. Human and Experimental Toxicology, 1996, 15(4): 279-285 DOI:10.1177/096032719601500401 |
Deane EE, Woo NY. Impact of heavy metals and organochlorines on hsp70 and hsc70 gene expression in black sea bream fibroblasts. Aquatic Toxicology, 2006, 79(1): 9-15 DOI:10.1016/j.aquatox.2006.04.009 |
Dunlap DY, Matsumura F. Development of broad spectrum antibodies to heat shock protein 70s as biomarkers for detection of multiple stress by pollutants and environmental factors. Ecotoxicology and Environmental Safety, 1997, 37(3): 238-244 DOI:10.1006/eesa.1997.1544 |
Elliott JA. A comparison of thermal polygons for British freshwater teleosts. Freshwater Forum, 1995, 5(3): 178-184 |
Feng MH, Chen P, Lei W, et al. Full-length cDNA cloning and the effect of dietary Vitamin D3 on tissue expression of major histocompatibility complex-Ⅱ in yellow catfish (Pelteobagrus fulvidraco). Acta Hydrobiologica Sinica, 2017, 41(5): 992-999 [冯美惠, 陈沛, 雷文, 等. 黄颡鱼MHC class Ⅱ基因全长的克隆及饲料维生素D3对其组织表达的影响. 水生生物学报, 2017, 41(5): 992-999] |
Ge H, Ba B. Thermal acclimation changes DNA-binding activity of heat shock factor 1 (HSF1) in the goby Gillichthys mirabilis: Implications for plasticity in the heat-shock response in natural populations. Journal of Experimental Biology, 2002, 205(20): 3231-3240 |
Gong GR, Zhang J, Dan C, et al. Identification of Pelteobagrus fulvidraco, Pelteobagrus vachelli and their interspecific hybrid by DNA markers. Acta Hydrobiologica Sinica, 2017, 41(2): 321-325 [巩高瑞, 张晋, 丹成, 等. 应用DNA分子标记鉴定黄颡鱼、瓦氏黄颡鱼及其杂交种的研究. 水生生物学报, 2017, 41(2): 321-325] |
Goyer K, Bertolo A, Pépino M, et al. Effects of lake warming on behavioural thermoregulatory tactics in a cold-water stenothermic fish. PLoS One, 2014, 9(3): e92514 DOI:10.1371/journal.pone.0092514 |
He FL, Xiang JG, Li CJ, et al. Preliminary study on the effect of water temperature on hematology indices of rainbow trout. Acta Hydrobiologica Sinica, 2007, 31(3): 363-369 [何福林, 向建国, 李常健, 等. 水温对虹鳟血液学指标影响的初步研究. 水生生物学报, 2007, 31(3): 363-369 DOI:10.3321/j.issn:1000-3207.2007.03.010] |
Heredia P. Heat shock protein (HSP70) RNA expression differs among rainbow trout (Oncorhynchus mykiss) clonal lines. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 2008, 149(4): 552-556 DOI:10.1016/j.cbpb.2007.05.012 |
Lin YQ, Zheng YC, Ji H. Cloning of HSP70 partial cDNA sequence and its tissue differential expression in grass carp (Ctenopharyngodon idella). Freshwater Fisheries, 2009, 39(4): 67-71 [林亚秋, 郑玉才, 吉红. 草鱼HSP70基因cDNA部分序列克隆及其组织表达差异. 淡水渔业, 2009, 39(4): 67-71 DOI:10.3969/j.issn.1000-6907.2009.04.013] |
Liu QQ. A preliminary study of roughskin sculpin (Trachidermus fasciatus Heckel) HSP70 sequence cloning and expression. Masterxs Thesis of Fudan University, 2013, 25-27 [刘庆全. 淞江鲈(Trachidermus fasciatus Heckel)HSP70全序列的克隆及其表达的初步研究. 复旦大学硕士研究生学位论文, 2013, 25-27] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods, 2001, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
Ming JH, Xie J, Liu B, et al. Cloning, sequence analysis of HSP70 cDNA and effects of heat stress on its mRNA expression in Megalobrama amblycephala. Journal of Fishery Sciences of China, 2009, 16(5): 635-648 [明建华, 谢骏, 刘波, 等. 团头鲂Hsp70 cDNA的克隆、序列分析以及热应激对其mRNA表达的影响. 中国水产科学, 2009, 16(5): 635-648 DOI:10.3321/j.issn:1005-8737.2009.05.001] |
Molina A, Biemar F, Muller F, et al. Cloning and expression analysis of an inducible HSP70 gene from tilapia fish. Federation of European Biochemical Societies Letters, 2000, 474(1): 5-10 DOI:10.1016/S0014-5793(00)01538-6 |
Morvan CL, Deschaux P, Troutaud D. Effects and mechanisms of environmental temperature on carp (Cyprinus carpio) anti-DNP antibody response and non-specific cytotoxic cell activity: A kinetic study. Developmental and Comparative Immunology, 1996, 20(5): 331-340 DOI:10.1016/S0145-305X(96)00027-4 |
Mukhopadhyay I, Nazir A, Saxena D, et al. Heat shock response: Hsp70 in environmental monitoring. Journal of Biochemical and Molecular Toxicology, 2010, 17(5): 249-254 |
Peng G, Zhao W, Shi Z, et al. Cloning HSP70 and HSP90 genes of kaluga (Huso dauricus) and the effects of temperature and salinity stress on their gene expression. Cell Stress and Chaperones, 2016, 21(2): 349-359 DOI:10.1007/s12192-015-0665-1 |
Pörtner HO, Berdal B, Blust R, et al. Climate effects on growth performance, fecundity and recruitment in marine fish: Developing a hypothesis for cause and effect relationships in Atlantic cod (Gadus morhua) and common eelpout (Zoarces viviparus). Continental Shelf Research, 2001, 21(18-19): 1975-1997 DOI:10.1016/S0278-4343(01)00038-3 |
Pörtner HO, Farrell AP. Physiology and climate change. Science, 2008, 322(5902): 690-692 DOI:10.1126/science.1163156 |
Pörtner HO, Knust R. Climate change affects marine fishes through the oxygen limitation of thermal tolerance. Science, 2007, 315(5808): 95-97 DOI:10.1126/science.1135471 |
Qiang J, Yang H, Wang H, et al. The effect of acute temperature stress on biochemical indices and expression of liver HSP70 mRNA in Gift Nile Tilapia juvenniles (Oreochromis niloticus). Oceanologia et Limnologia Sinica, 2012, 11061106(5): 943-953 [强俊, 杨弘, 王辉, 等. 急性温度应激对吉富品系尼罗罗非鱼(Oreochromis niloticus)幼鱼生化指标和肝脏HSP70 mRNA表达的影响. 海洋与湖沼, 2012, 11061106(5): 943-953] |
Qu LY, Sun XQ, Xiang JH, et al. Advances in study on heat shock protein. Advances in Marine Science, 2004, 22(3): 385-391 [曲凌云, 孙修勤, 相建海, 等. 热休克蛋白研究进展. 海洋科学进展, 2004, 22(3): 385-391 DOI:10.3969/j.issn.1671-6647.2004.03.019] |
Ritossa F. A new puffing pattern induced by temperature shock and DNP in Drosophila. Experientia, 1962, 18(12): 571-573 DOI:10.1007/BF02172188 |
Rosic NN, Pernice M, Dove S, et al. Gene expression profiles of cytosolic heat shock proteins Hsp70 and Hsp90 from symbiotic dinoflagellates in response to thermal stress: Possible implications for coral bleaching. Cell Stress and Chaperones, 2011, 16(1): 69-80 DOI:10.1007/s12192-010-0222-x |
Shen H, Wang XR, Zhang JF, et al. Application of the stress protein (HSP70) as the biomarker in studying zinc and copper, and the joint toxicity to fish liver. Acta Scientiae Circumstantiae, 2004, 24(5): 895-899 [沈骅, 王晓蓉, 张景飞. 应用应激蛋白HSP70作为生物标志物研究锌、铜及其联合毒性对鲫鱼肝脏的影响. 环境科学学报, 2004, 24(5): 895-899] |
Shi ZH, Xie MM, Peng SM, et al. Effects of temperature stress on activities of digestive enzymes and serum biochemical indices of Pampus argenteus juveniles. Progress in Fishery Sciences, 2016, 37(5): 30-37 [施兆鸿, 谢明媚, 彭士明, 等. 温度胁迫对银鲳(Pampus argenteus)幼鱼消化酶活性及血清生化指标的影响. 渔业科学进展, 2016, 37(5): 30-37] |
Tang ZL, Zhou GQ, Mao JQ, et al. Large-scale hybridization of Pelteobagrus fulvidraco and Pelteobagrus vachelli. Jiangsu Agricultural Science, 2016, 44(10): 303-305 [唐忠林, 周国勤, 茆健强, 等. 黄颡鱼与瓦氏黄颡鱼的规模化杂交繁殖. 江苏农业科学, 2016, 44(10): 303-305] |
Tian ZH, Xu SG, Wang W, et al. Effects of acute thermal stress on HSP70 mRNA, physiology and nonspecific immunity in Siberian sturgeon (Acipenser baerii). Acta Hydrobiologica Sinica, 2013, 37(2): 344-350 [田照辉, 徐绍刚, 王巍, 等. 急性热应激对西伯利亚鲟HSP70 mRNA表达、血清皮质醇和非特异性免疫的影响. 水生生物学报, 2013, 37(2): 344-350] |
Vijayan M, Kennedy C, Forsyth R, et al. Handling stress does not affect the expression of hepatic heat shock protein 70 and conjugation enzymes in rainbow trout treated with β-naphthoflavone. Life Sciences, 1997, 61(2): 117-127 DOI:10.1016/S0024-3205(97)00366-4 |
Wang GQ, Wang W. Research progress in the effect of the stress response on fish. Journal of Anhui Agricultural Sciences, 2009, 37(24): 11579-11580 [王国强, 王雯. 应激反应对鱼类影响的研究进展. 安徽农业科学, 2009, 37(24): 11579-11580 DOI:10.3969/j.issn.0517-6611.2009.24.099] |
Wang WJ. Molecular cloning of two members of HSP70 and their transcriptional regulation responding to Vibrio alginolyticus infection and immunization in Xiphophorus helleri. Doctoral Dissertation of Shandong Agricultural University, 2006, 48-54 [万文菊. 剑尾鱼HSP70家族两成员的分子克隆及溶藻弧菌感染与免疫对其基因的诱导表达. 山东农业大学博士研究生学位论文, 2006, 48-54] |
Wang WM. Preliminary studies in crossbreeding of Pelteobagrus fulvidraco and P. vachelli. Doctoral Dissertation of Huazhong Agricultural University, 2003, 1-25 [王卫民. 黄颡鱼与瓦氏黄颡鱼杂交育种初步研究. 华中农业大学博士研究生学位论文, 2003, 1-25] |
Wang YB. Tissue-specific expression and response of Hsp70 in Cyprinus carpio under heat stress. Doctoral Dissertation of Northeast Normal University, 2008, 52-62 [王云彪. 热影响下鲤鱼Hsp70组织特异性表达和应激反应. 东北师范大学博士研究生学位论文, 2008, 52-62] |
Xiang JG. Physiological responses of rainbow trout (Oncorhynchus mykiss) to increased water temperature: A preliminary study. Masterxs Thesis of Hunan Agricultural University, 2008, 20-24 [向建国. 虹鳟对水温应激反应的初步研究. 湖南农业大学硕士研究生学位论文, 2008, 20-24] |
Yang J, Chen G, Huang JS, et al. Effects of temperature and salinity on the growth and activities of antioxidant enzymes of Cobia (Rachycentron canadum) juveniles. Journal of Guangdong Ocean University, 2007, 27(4): 25-29 [杨健, 陈刚, 黄建盛, 等. 温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响. 广东海洋大学学报, 2007, 27(4): 25-29 DOI:10.3969/j.issn.1673-9159.2007.04.006] |
Zhang J, Zhang QZ, Zhang ZH, et al. HSC70 gene and its tissue expression analysis in yellow catfish. Acta Hydrobiologica Sinica, 2009, 33(3): 426-434 [张娟, 张其中, 张占会, 等. 黄颡鱼HSC70基因及其组织表达分析. 水生生物学报, 2009, 33(3): 426-434] |
Zhang JJ, Zhang GS, Zhang HY, et al. Analysis of karyotype and nutrient composition of parents and their hybrid progeny of Pelteobagrus fulvidraco (♀)×Pelteobagrus vachelli (♂). Marine Fisheries, 2017, 39(2): 149-161 [张佳佳, 张国松, 张宏叶, 等. 黄颡鱼(♀)×瓦氏黄颡鱼(♂)双亲及其杂交子代核型和营养成分分析. 海洋渔业, 2017, 39(2): 149-161 DOI:10.3969/j.issn.1004-2490.2017.02.004] |
Zhang YC. Effect of acute temperature stress on hematological physiology and reproductive endocrine functions of gestational ovoviviparous black rockfish, Sebastes schlegelii. Masterxs Thesis of Ocean University of China, 2015, 37-60 [张亚晨. 急性温度胁迫对妊娠期许氏平鲉血液生理和生殖内分泌机能的影响. 中国海洋大学硕士研究生学位论文, 2015, 37-60] |
Zhang YZ, Liu DE, Fang QS, et al. Effects of temperature and salinity on growth and survival rate of young Epinephelus coioides. Journal of Jimei University (Natural Science), 2009, 14(1): 8-13 [张雅芝, 刘冬娥, 方琼珊, 等. 温度和盐度对斜带石斑鱼幼鱼生长与存活的影响. 集美大学学报(自然科学版), 2009, 14(1): 8-13 DOI:10.3969/j.issn.1007-7405.2009.01.002] |
Zhong WY, Pu XM. Advances in molecular biology research of heat shock proteins. Medical Recapitulate, 2005, 11(2): 148-150 [钟文英, 普雄明. 热休克蛋白的分子生物学研究进展. 医学综述, 2005, 11(2): 148-150 DOI:10.3969/j.issn.1006-2084.2005.02.027] |
Zhou CW, Hu XW, Lei L, et al. Effects of heat stress on biochemical indices and HSP70 mRNA expression in gibel carp (Carassius auratus gibelio). Progress in Fishery Sciences, 2018, 39(6): 65-71 [周朝伟, 胡续雯, 雷骆, 等. 热应激对银鲫生化指标和HSP70 mRNA表达的影响. 渔业科学进展, 2018, 39(6): 65-71] |
Zhou X, Dong YW, Wang F, et al. Effect of rapid temperature change on expression of hsp70 and hsp90 in grass carp (Ctenopharyngodon idella). Journal of Fisheries of China, 2013, 37(2): 216-221 [周鑫, 董云伟, 王芳, 等. 草鱼hsp70和hsp90对温度急性变化的响应. 水产学报, 2013, 37(2): 216-221] |



