2. 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Drugs and Bioproducts, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071)
虾在我国渔业经济中占有重要地位,鲜销是其主要的产品形态,然而,鲜虾在流通和储藏过程中有一最为突出的问题––黑变。虾的黑变是其体内的酪氨酸或其衍生物等色原物质在酶的作用下经过一系列生化反应最终形成黑色素的过程,这一过程与酚氧化酶(Phenoloxidase, PO)密切相关(Begoña et al, 2010)。PO可以催化虾体中的无色单酚化合物向双酚及双酚化合物转化,进而转化为醌类物质,醌类物质进一步与氨基酸或蛋白质结合生成黑色素,产生黑变,从而严重影响虾的外观,制约其商业价值(Friedman, 1996)。
PO是虾类黑色素生成反应的限速酶,研究其生化性质对于探究虾的黑变机理及防控方法具有重要的现实意义。目前,已有国内外学者对斑节对虾(Penaeus monodon) (Rolle et al, 1991)、桃红对虾(Penaeus duorarum) (Simpson et al, 1998)、中国对虾(Penaeus chinensis) (汪小锋等, 2003)、日本对虾(Penaeus japonicus) (Soottawat et al, 2005)、长额拟对虾(Parapenaeus longirostris) (José-Pablo et al, 2009) 和凡纳滨对虾(Litopenaeus vannamei) (鲍俊旺等, 2019)等的PO进行了分离纯化和生化性质研究,发现不同种类虾的PO在分子量、等电点、最适pH值、热稳定性以及动力学参数等方面均有很大差异。对于虾黑变的控制目前主要采用化学法,如亚硫酸盐类(李小蕾等,2012)、4-己基间苯二酚(周宇芳等, 2019)以及一些天然提取物(Jang et al, 2003; Nilesh et al, 2009; Nalan et al, 2008)等,均表现出了很好的防黑变效果,但对于酚酶活性的影响研究尚不够全面。
南极磷虾(Euphausia superba)富含8种人体必需氨基酸且比例适宜,具有很高的营养价值(聂玉晨等, 2016; 曹荣等, 2018b),广泛分布于环南极大陆架水域,资源量极为丰富。在世界近海渔业资源普遍衰退的情况下,南极磷虾已成为世界渔业发达国家竞相开发利用的海洋新资源(曹荣等, 2018a)。在其运输过程中,大部分采用船上冷冻保藏到陆地上解冻二次加工的方法,在此过程中很容易发生自溶、黑变等变化,影响南极磷虾品质(陈怡炫等, 2018)。我国从2009年开始对南极磷虾进行大规模的商业化捕捞和加工(黄洪亮等, 2015),但在船载加工技术和设备方面还比较落后,在南极磷虾贮运与利用方面的研究也比较薄弱(谌志新等, 2019)。鹰爪糙对虾(Trachypenaeus curvirostris)又称立虾、红虾,体型较小,体长与南极磷虾相似,是我国黄、渤海产量较高的一种海捕虾类,味道鲜美,是加工“金钩海米”的原材料(张树德等,1992)。目前,已有较多关于大宗虾类品种黑变方面的研究报道,但对南极磷虾黑变以及PO性质的相关研究较少,南极磷虾与普通海捕虾在黑变进程和机制方面是否存在差异也尚未可知。
本文选取南极磷虾及鲜活鹰爪糙对虾作为研究对象,观察2种虾在(2±1)℃贮藏过程中的黑变进程,从头胸部提取到PO粗酶并进行了纯化,对2种虾PO的生化性质进行了对比分析,旨在为南极磷虾冷链物流过程中的品质控制和死后黑变机理研究等提供参考。
1 材料与方法 1.1 实验原料与试剂南极磷虾由辽宁省大连海洋渔业集团南极磷虾作业船于2018年11月在南极海域捕捞,捕后包被冰衣,–30℃冻藏,2019年5月运抵实验室后,迅速用流动水解冻,选取完整的南极磷虾进行后续实验。
鲜活鹰爪糙对虾购于青岛市埠东水产品批发市场,充氧条件下30 min内运送至实验室,剔除死亡个体,选取体长均一个体(4~5 cm),流水冲洗后加冰猝死,进行后续实验。
L-3, 4-二羟基苯丙氨酸、硫酸铵、焦亚硫酸钠、亚硫酸氢钠、植酸钠、L-半胱氨酸、4-己基间苯二酚(4-HR)、抗坏血酸、苯甲酸、柠檬酸和乳酸等均为分析纯,购于美国Sigma公司。
1.2 实验方法 1.2.1 黑变进程观察将解冻后的南极磷虾与猝死后的鹰爪糙对虾分别放置于(2±1)℃冰箱中,定期取样观察其黑变情况。
1.2.2 PO粗酶液的制备与部分纯化参照汪小锋等(2003)的方法,略有改动。取虾的头胸部按1∶5 (w/v)比例加入预先冷却的磷酸盐缓冲溶液(0.1 mol/L, pH 7.2),剪碎、均质30 min后离心(4℃, 8000 r/min, 20 min),取上清液,测定蛋白质含量及酶活力。
在上清液中缓慢加入固体硫酸铵粉末,并不断搅拌,分别收集0~40%、40%~75%和75%~100%部分的沉淀。将3组沉淀分散于磷酸盐缓冲液(0.1 mol/L,pH 7.2)中,透析24 h,离心(4℃, 8000 r/min, 20 min)后取上清液,分别测定蛋白质含量及酶活力。
Sephadex G-100凝胶过滤柱(1.8 cm×75.0 cm)经磷酸缓冲液(0.1 mol/L, pH 7.2)预平衡后,取40%~75%硫酸铵沉淀对应的组分上柱,以0.5 ml/min的流速进行洗脱,检测280 nm下的吸光度值,收集蛋白峰对应的组分,检测酶活力,收集酶活较高的管数,超滤浓缩后–80℃保存,留待后续实验测定。
1.2.3 PO比活力测定参照Zamorano等(2009)的方法,略有改动。以L-3, 4-二羟基苯丙氨酸为底物,将2.0 ml磷酸盐缓冲液(0.1 mol/L,pH 7.2)与2.0 ml L-3, 4-二羟基苯丙氨酸溶液(20.0 mmol/L)混合,30℃水浴中孵育,加入待测酶液0.2 ml混匀,反应5 min后,在波长为475 nm处测定吸光度值。每分钟吸光度值增加0.001定义为1个酶活力单位(U)。
采用双缩脲法测蛋白质含量,计算比活力(U/mg)。
1.2.4 温度对酚氧化酶活力的影响将底物与待测酶液分别在5℃、10℃、20℃、30℃、40℃、50℃和60℃条件下孵育后混合,反应5 min后测定酶活力。
1.2.5 pH对酚PO活力的影响将底物与不同pH的缓冲溶液混合,使反应体系的最终pH分别为3.0、4.0、5.0、6.0、7.0、8.0和9.0,30℃水浴中孵育,加入待测酶液0.2 ml混匀,反应5 min后测定酶活力。
1.2.6 化学试剂对PO活力的影响分别配制0.1%(w/v)的焦亚硫酸钠、亚硫酸氢钠、植酸钠、L-半胱氨酸、4-己基间苯二酚、抗坏血酸、苯甲酸、柠檬酸和乳酸水溶液。将底物溶液与上述溶液1∶1(v/v)混合,30℃水浴中孵育,加入待测酶液0.2 ml混匀,反应5 min后,在波长为475 nm处测定吸光度值,计算酶活力。以磷酸盐缓冲溶液为对照,计算相对酶活力。
1.3 数据处理采用SPSS 17.0软件对数据进行处理,结果以平均值±标准差(Mean±SD)表示,P < 0.01为极显著,P < 0.05为显著,P > 0.05为不显著。
2 结果与分析 2.1 南极磷虾与鹰爪糙对虾冷藏过程黑变进程由表 1可以看出,南极磷虾的黑变进程与鹰爪糙对虾相比更为迅速。冷藏条件下24 h时,南极磷虾的黑变已经非常明显,黑变部位集中在头胸部、腹部甲壳以及尾节部分,这与长额拟对虾(José-Pablo et al, 2009)发生黑变的规律类似。鹰爪糙对虾在72 h时可以观察到头胸部、尾节部分有轻微的黑变,之后逐渐扩散到躯干。鹰爪糙对虾不同个体间的黑变进程略有差别,这可能与其死前的生理状态有关,虾个体在底物水平、酶激活因子等方面的差异也会影响黑变的进程。
|
|
表 1 南极磷虾与鹰爪糙对虾冷藏过程中黑变情况 Tab.1 Melanosis progress of Euphausia superba and Trachypenaeus curvirostris during refrigerated storage |
对2种虾PO的纯化结果见表 2。南极磷虾PO粗酶液的比活力为1.58 U/mg,经硫酸铵沉淀后,得到初步纯化酶,其中,40%~75%硫酸铵沉淀组分的蛋白回收率为40.67%,酶活回收率高达67.11%,比活力提高至2.61 U/mg,该组分经Sephadex G-100凝胶过滤后,比活力达27.25 U/mg,纯化倍数提高至17.22。
|
|
表 2 南极磷虾与鹰爪糙对虾酚氧化酶纯化结果 Tab.2 Results of PO purification of E. superba and T. curvirostris |
鹰爪糙对虾PO粗酶液的比活力为1.28 U/mg,略低于南极磷虾,且PO活性主要集中在0~40%硫酸铵沉淀部分,酶活回收率达59.55%,这与赵娇等(1997)发现日本对虾PO活性主要存在于0~40%硫酸铵沉淀组分中一致。该组分经Sephadex G-100凝胶过滤后,比活力提高至25.21 U/mg,酶的纯化倍数达到19.67。
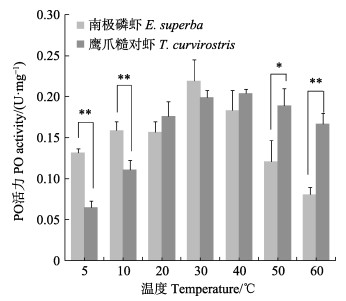
2.3 温度对PO活力的影响温度对2种虾PO活力的影响如图 1。南极磷虾PO在5℃和10℃条件下,活力极显著高于鹰爪糙对虾(P < 0.01),这与其在低温储藏时黑变发生更为迅速的现象一致,最适温度在30℃左右,50℃以上活力迅速下降,这可能与南极磷虾生长的环境温度较低,南极海域海水温度范围在–1.3℃~3.0℃(李莹春等, 2012)有关。
|
图 1 温度对南极磷虾与鹰爪糙对虾PO活力影响 Fig.1 Effects of temperature on the PO activity of E. superba and T. curvirostris *表示差异显著(P < 0.05);**表示差异极显著(P < 0.01) *: The difference is significant (P < 0.05); **: The difference is highly significant (P < 0.01) |
鹰爪糙对虾PO在低温条件下活力较低,而50℃和60℃下的活力显著高于南极磷虾。鹰爪糙对虾PO的最适温度在40℃左右,这与凡纳滨对虾(鲍俊旺等, 2019; Nilesh et al, 2011)、中国对虾(樊廷俊等, 2002)等PO的最适温度接近。
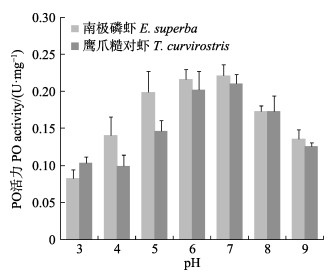
2.4 pH对PO活力的影响南极磷虾和鹰爪糙对虾PO随pH的变化规律较为一致,如图 2所示,最适pH均在6.0~7.0范围内,酸性或碱性条件对酶活力都有一定的抑制作用,因此,南极磷虾在运输过程中提供一个酸性冷冻环境对其保鲜期延长效果会有帮助。
|
图 2 pH对南极磷虾与鹰爪糙对虾PO活力影响
Fig.2 Effects of pH on the PO activity of E. superba and T. curvirostris
|
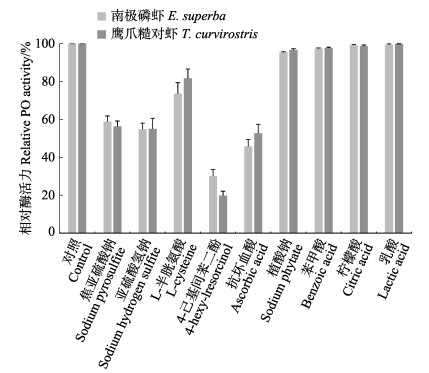
化学法是抑制虾类黑变最为常见的方法。几种化学试剂对2种虾PO活力的影响见图 3。植酸钠、苯甲酸、柠檬酸和乳酸未表现出明显的PO抑制效果。焦亚硫酸钠和亚硫酸氢钠对南极磷虾和鹰爪糙对虾PO均有较好的抑制作用,相对酶活都低于60%。亚硫酸盐类在控制虾类黑变中应用广泛(李小蕾等, 2012; Ferrer et al, 1989),其分解后释放的SO2可有效抑制PO活性,同时,可与黑变的中间产物–醌类化合物发生反应从而阻断黑变发生,但亚硫酸盐类在使用过程中往往存在过量使用、残留超标的问题,存在一定的安全隐患。
|
图 3 化学试剂对南极磷虾与鹰爪糙对虾PO活力的影响
Fig.3 Effects of chemical reagents on the PO activity of E. superba and T. curvirostris
|
4-HR表现出很好的PO抑制效果,南极磷虾和鹰爪糙对虾PO经4-HR处理后,相对酶活力仅有30.16%和19.75%。4-HR可竞争性抑制PO,有效防止黑色素的形成(周宇芳等, 2019)。我国曾在20世纪90年代引进了美国瑞辉公司的“虾鲜宝”产品(殷邦忠等, 1994),该产品的主要有效成份即4-HR,但4-HR成本相对较高,限制了其大范围应用推广。
L-半胱氨酸和抗坏血酸也表现出较好的PO活力抑制效果。抗坏血酸是一种强还原剂,可阻止底物被氧化成醌类以及醌类进一步聚合成黑色素,从而抑制黑变。L-半胱氨酸则直接与酶促反应的中间产物–醌类化合物结合生成无色的硫氢化合物(Soottawat et al, 2006),从而阻断黑变的发生。这2种化合物均对人体无毒副作用,在食品安全方面更符合要求。
3 结论冷藏条件下南极磷虾与鹰爪糙对虾黑变情况差异较大,南极磷虾黑变更为迅速,这可能与其生存环境有关,经过长期的自然选择,南极磷虾更能适应低温环境,所以其PO在低温条件下仍保持较高的活力。南极磷虾和鹰爪糙对虾PO的最适温度分别为30℃、40℃,最适pH均在6.0~7.0范围内,酸性环境能较好地抑制其酶活,因此,在2种虾的运输、保存过程中,可选择添加一些酸性物质来达到延长其保鲜期的目的。焦亚硫酸钠、亚硫酸氢钠、4-HR、L-半胱氨酸和抗坏血酸均表现出较好的PO活力抑制效果,适宜用来配制虾类防黑变保鲜剂。
Bao JW, Li Y, Weng L, et al. Purification and characterization of polyphenol oxidase from Pacific white shrimp (Litopenaeus vannamei). Journal of Jimei University (Natural Science), 2019, 24(2): 100-109 [鲍俊旺, 李越, 翁凌, 等. 凡纳滨对虾多酚氧化酶的纯化及性质分析. 集美大学学报(自然科学版), 2019, 24(2): 100-109] |
Begoña G, Óscar MA, Pilar M, et al. Characterization of phenoloxidase activity of carapace and viscera from cephalothorax of Norway lobster (Nephrops norvegicus). LWT-Food Science and Technology, 2010, 43(8): 1240-1245 DOI:10.1016/j.lwt.2010.02.017 |
Cao R, Yu YK, Zhao L, et al. Study on the protein autolysis process of Antarctic krill (Euphausia superba) and its influencing factors. Progress in Fishery Sciences, 2018a, 39(6): 114-118 [曹荣, 余弈珂, 赵玲, 等. 南极磷虾(Euphausia superba)起捕后蛋白自溶进程及其影响因素. 渔业科学进展, 2018a, 39(6): 114-118] |
Cao R, Zhao L, Sun HH, et al. Nutritional characteristics and umami assessment of Euphausia superba and Exopalaemon carinicauda. Food Science, 2018b, 39(4): 149-153 [曹荣, 赵玲, 孙慧慧, 等. 南极磷虾(Euphausia superba)与脊尾白虾(Exopalaemon carinicauda)营养学特征分析及鲜味评价. 食品科学, 2018b, 39(4): 149-153] |
Chen YX, Chen X, Wang F, et al. Study on the basic enzymatic properties of protease in crude enzyme of Antarctic krill and the development of inhibitors. Progress in Fishery Sciences, 2018, 39(5): 152-157 [陈怡炫, 陈昕, 王芳, 等. 南极磷虾粗酶液中蛋白酶的基础酶学性质研究及抑制剂的开发. 渔业科学进展, 2018, 39(5): 152-157] |
Chen ZX, Wang ZY, Ouyang J. Development of technology for Antarctic krill fishing and processing equipment in China. Strategic Study of CAE, 2019, 21(6): 48-52 [谌志新, 王志勇, 欧阳杰. 我国南极磷虾捕捞与加工装备科技发展研究. 中国工程科学, 2019, 21(6): 48-52] |
Fan TJ, Wang XF. Purification and partial biochemical characterization of phenoloxidase from Penaeus chinensis. Acta Biochimica et Biophysica Sinica, 2002, 34(5): 589-594 [樊廷俊, 汪小锋. 中国对虾(Penaeus chinensis)酚氧化酶的分离纯化及其部分生物化学性质. 生物化学与生物物理学报(英文版), 2002, 34(5): 589-594] |
Ferrer OJ, Otwell WS, Marshall MR. Effect of bisulfite on lobster shell phenoloxidase. Journal of Food Science, 1989, 54(2): 478-480 DOI:10.1111/j.1365-2621.1989.tb03111.x |
Friedman M. Food browing and its prevention: An overview. Journal of Agricultural and Food Chemistry, 1996, 44: 631-653 DOI:10.1021/jf950394r |
Huang HL, Chen XZ, Liu J, et al. Analysis of the status and trend of the Antarctic krill fishery. Chinese Journal of Polar Research, 2015(1): 25-30 [黄洪亮, 陈雪忠, 刘健, 等. 南极磷虾渔业近况与趋势分析. 极地研究, 2015(1): 25-30] |
Jang MS, Sanada A, Ushio H, et al. Inhibitory effect of enokitake extract on melanosis of shrimp. Fisheries Science, 2003, 69(2): 379-384 DOI:10.1046/j.1444-2906.2003.00632.x |
José-Pablo Z, Oscar M, Pilar M, et al. Characterization and tissue distribution of polyphenol oxidase of deepwater pink shrimp (Parapenaeus longirostris). Food Chemistry, , 2009, 112: 104-111 DOI:10.1016/j.foodchem.2008.05.061 |
Li XL, Cai YQ, Qian BL, et al. Investigation on standard of sulfite used in crabs and shrimps. Chinese Fishery Quality and Standards, 2012, 2(1): 29-35 [李小蕾, 蔡友琼, 钱蓓蕾, 等. 亚硫酸盐用于虾蟹类保鲜剂的限量探讨. 中国渔业质量与标准, 2012, 2(1): 29-35] |
Li YC, Zhu GP, Meng T, et al. Observation on the temperature tolerance of Antarctic krill under artificial conditions. Jiangsu Agricultural Sciences, 2012(9): 216-218 [李莹春, 朱国平, 孟涛, 等. 人工条件下南极磷虾的温度耐受性试验观察. 江苏农业科学, 2012(9): 216-218] |
Nalan G, Pinar Y. Inhibition effects of grape seed extracts on melanosis formation in shrimp (Parapenaeus longirostris). International Journal of Food Science and Technology, 2008, 43(6): 1004-1008 DOI:10.1111/j.1365-2621.2007.01553.x |
Nie YC, Zhang B, Zhao XY, et al. Seasonal variation in lipids and protein content of Antarctic krill (Euphausia superba). Progress in Fishery Sciences, 2016, 37(3): 1-7 [聂玉晨, 张波, 赵宪勇, 等. 南极磷虾(Euphausia superba)脂肪与蛋白含量的季节变化. 渔业科学进展, 2016, 37(3): 1-7] |
Nilesh PN, Soottawat B. Melanosis and quality changes of Pacific white shrimp (Litopenaeus vannamei) treated with catechin during iced storage. Journal of Agricultural and Food Chemistry, 2009, 57(9): 3578-3586 DOI:10.1021/jf900051e |
Nilesh PN, Soottawat B. Use of tea extracts for inhibition of polyphenoloxidase and retardation of quality loss of Pacific white shrimp during iced storage. LWT-Food Science and Technology, 2011, 44(4): 924-932 DOI:10.1016/j.lwt.2010.12.007 |
Rolle RS, Guizani N, Chen JS, et al. Purification and characterization of phenoloxidase isoforms from Taiwanese black tiger shrimp (Penaeus monodon). Journal of Food Biochemistry, 1991, 15: 17-32 DOI:10.1111/j.1745-4514.1991.tb00141.x |
Simpson BK, Marshall MR, Otwell WS. Phenoloxidase from pink and white shrimp: Kinetic and other properties. Journal of Food Biochemistry, 1998, 12(3): 205-217 |
Soottawat B, Wonnop V, Munehiko T. Properties of phenoloxidase isolated from the cephalothorax of kuruma prawn (Penaeus japonicus). Journal of Food Biochemistry, 2005, 29(5): 470-485 DOI:10.1111/j.1745-4514.2005.00042.x |
Soottawat B, Wonnop V, Tanaka M. Inhibitory effect of cysteine and glutathione on phenoloxidase from kuruma prawn (Penaeus japonicus). Food Chemistry, 2006, 98(1): 158-163 DOI:10.1016/j.foodchem.2005.05.056 |
Wang XF, Fan TJ. Some biochemical specificity studies of phenoloxidase from Penaeus chinensis. Marine Sciences, 2003, 27(4): 71-75 [汪小锋, 樊廷俊. 中国对虾酚氧化酶的部分生物化学特性的初步研究. 海洋科学, 2003, 27(4): 71-75 DOI:10.3969/j.issn.1000-3096.2003.04.017] |
Yin BZ, Yao J, Xu MQ. On using everfresh to prevent occurrence of blackspots on the shell of Trachypenaeus curvirostis. Shandong Fisheries, 1994, 11(6): 33-34 [殷邦忠, 姚建, 徐明起. "虾鲜宝"对鹰爪虾的防黑变试验. 齐鲁渔业, 1994, 11(6): 33-34] |
Zhang SD, Song AQ. Talons shrimp and its fishery. Bulletin of Biology, 1992, 11: 12-14 [张树德, 宋爱勤. 鹰爪虾及其渔业. 生物学通报, 1992, 11: 12-14] |
Zhao J, Qi XY, You YM, et al. Study on some characteristics of phenoloxidase from Japanese prawn, Penaeus japonicus. Journal of Shanghai Fisheries University, 1997, 6(3): 157-165 [赵娇, 戚晓玉, 尤瑜敏, 等. 日本对虾的酚氧化酶特性研究. 上海水产大学学报, 1997, 6(3): 157-165] |
Zhou YF, Hu JK, Hao YB, et al. Kinetic analysis of the inhibitory effect of 4-hexylresorcinol and ascorbic acid on polyphenoloxidase from Solenocera crassicornis. Food Science, 2019, 40(4): 69-74 [周宇芳, 胡建坤, 郝云彬, 等. 4-HR与抗坏血酸对中华管鞭虾多酚氧化酶的抑制动力学模拟分析. 食品科学, 2019, 40(4): 69-74] |




