2. 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 青岛瑞滋集团有限公司 青岛 266409
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. Qingdao Ruizi Group Co., Ltd., Qingdao 266409
发酵饲料技术是在2006年欧盟全面禁止在畜禽饲料中添加抗生素后发展起来的一项新技术,发酵饲料作为一种新型饲料,从制作过程和功能上有别于传统饲料,经过微生物发酵可降解饲料中的毒素,分解或转化抗营养因子,将大分子物质分解为小分子物质,使饲料更容易被动物吸收利用(吴业阳等, 2018)。同时,发酵饲料可以改善饲料的适口性、风味,并产生促营养因子,改善饲料的营养组成、提高饲料营养价值;此外,发酵饲料中的微生物可以改善动物肠道微生态平衡,增强其免疫力。目前,发酵饲料已广泛应用到畜禽养殖(陶蕾等, 2015),在仔猪、泌乳奶牛和蛋鸡的养殖应用中都取得了良好的效果(胡新旭等, 2013; 吴小燕等, 2014; 孙汝江等, 2012);在水产动物养殖方面,发酵饲料在虾、蟹、鱼的养殖应用中已有诸多报道,对提高养殖对象的饲料利用率和肠道健康有显著效果(钟小群等, 2018; 袁春营等, 2018; Refstie et al, 2005)。
刺参饲料以大型海藻粉为主要成分。目前,对刺参饲料的研究主要集中于饲料组成对刺参生长发育的影响(王晓艳等, 2019; 谭杰等, 2020),对刺参发酵饲料的研究尚处于探索阶段。养殖实验中发现,投喂发酵饲料可促进刺参生长(姜燕, 2014; 李利华, 2013; 王世英, 2015),而关于发酵饲料对刺参养殖效果的综合性评价较少。本研究以刺参发酵饲料为切入点,从刺参能量收支、生长、酶活性以及对养殖池水水质影响等角度,综合性探究刺参养殖过程中发酵饲料的应用效果,以期为刺参养殖提供理论数据和参考。
1 材料与方法 1.1 刺参苗种来源本研究所用刺参来源于青岛瑞滋集团有限公司养殖场,选取生长良好、肉刺坚挺、附着力强的健康苗种,苗种规格为(1.79±0.22) g/头,在养殖车间内暂养5 d后进行相关实验。
1.2 饲料的来源与制作本研究所用饲料来源于青岛瑞滋集团有限公司,未发酵饲料的组分比例为海带(Laminaria japonica)粉: 马尾藻(Scagassum)粉: 扇贝边粉=3:6:1。在未发酵饲料基础上添加5%的葡萄糖和10%的布氏乳杆菌(Lactobacillus buchneri)发酵菌液,30℃恒温发酵2 d制成发酵饲料。饲料与海泥按1:4的比例混合,加入适量海水搅拌均匀,经过80目筛绢过滤后投喂。
1.3 投喂发酵饲料对刺参特定生长率和存活率的影响本研究选取6个容积为12 m3的刺参育苗池,育苗池中摆放波纹板附着基,每个育苗池投放刺参苗种30 kg。实验分为2组,一组投喂未发酵饲料(未发酵饲料组,CG),一组投喂发酵饲料(发酵饲料组,FG),每组3个平行。实验周期为50 d,每日饲料投喂量为刺参体重的2%,根据摄食情况微调投喂量,每天投喂2次,08:00投喂其总量的40%,15:00投喂其总量的60%。每天换水1/2,每7 d倒池1次。实验结束后,将实验刺参全部捞出,称取刺参总重,并随机取样,计算刺参的平均体重,计算特定生长率(Specific growth rate, SGR);根据总重和平均体重计算总头数,进而计算其存活率(Survival rate, SR)。
刺参SGR和SR计算公式如下:
| $ \begin{array}{*{20}{c}} {{\rm{SGR}}\left({\% \cdot {{\rm{d}}^{ - 1}}} \right) = \left({\ln {W_t} - \ln {W_\mathit{0}}} \right)/t \times 100\% }\\ {{\rm{SR}}(\%) = \left({{N_\mathit{0}} - {N_t}} \right)/{N_\mathit{0}} \times 100\% } \end{array} $ |
式中,W0、Wt分别表示实验刺参的初始体重和终末体重;t表示养殖周期;N0、Nt分别表示实验刺参的初始个体数和终末个体数。
1.4 投喂发酵饲料对刺参非特异性免疫酶和消化酶的影响分别在实验开始和结束时自6个育苗池中随机抽取10头刺参,用无菌注射器抽取体腔液。抽取体腔液后解剖刺参,用3%灭菌NaCl溶液反复冲洗肠道,收集肠道。体腔液和肠道于-20℃冰箱内保存,分别检测刺参的非特异性免疫酶活性和消化酶活性。
选取酸性磷酸酶(Acid phosphatase, ACP)、碱性磷酸酶(Alkaline phosphatase, AKP)、超氧化物歧化酶(Superoxide dismutase, SOD)和溶菌酶(Lysozyme, LZM) 4个非特异性免疫酶指标,以及淀粉酶(Amylase, AMS)和胰蛋白酶(Trypsin) 2个消化酶指标,利用酶活性检测试剂盒(南京建成生物工程研究所)进行测定,测定方法参照试剂盒说明书。
1.5 投喂发酵饲料对养殖池水水质的影响本研究选取1个倒池周期(7 d),采集养殖池水样,测定水体中的氨氮、亚硝酸盐及pH值。利用靛酚蓝分光光度法测定水体中的氨氮,利用萘乙二胺分光光度法测定水体中的亚硝酸盐,详细操作方法参照国标GB 17378.4,利用pH计法测定水体的pH值。
1.6 投喂发酵饲料对刺参能量收支的影响刺参能量收支测定实验在同一个实验车间选取1个空的养殖池,池内放置6个容量为40 L的塑料水槽,每个水槽投放刺参苗种20头。实验分为2组,一组投喂未发酵饲料,另一组投喂发酵饲料,每组设3个平行。实验周期为20 d,实验开始和结束时分别称重,计算刺参的增重率,并随机采集10头刺参进行能值测算。每日饲料投喂量为刺参体重的2%,每天投喂等量的未发酵饲料和发酵饲料,收集残饵和粪便。
刺参饲料为粉末状饲料,投喂后有溶失现象。经实验测算饲料溶失率后,换算得到摄食饲料总量(汪洋等, 2012)。
0 d和20 d时,随机采集10头刺参烘干,同时将收集到的所有粪便和残饵烘干,用氧弹仪测定0 d和20 d刺参、粪便和残饵的能值。
刺参能量收支方程式:
| $ C = G + F + U + R $ |
式中,C表示摄食能;G表示生长能;F表示排粪能;U表示排泄能;R表示代谢能。
摄食能(C)的计算公式为:
| $ C = {C^\prime } \times {E_{{C^\prime }}} $ |
式中,C'表示实验中刺参消耗的饲料干重总量;EC'为饲料的能值(J/g)。
生长能(G)的计算公式为:
| $ G = {W_\mathit{1}} \times {E_\mathit{1}} - {W_\mathit{0}} \times {E_\mathit{0}} $ |
式中,W0、W1分别表示实验刺参的初始和终末干物质重量;E0、E1分别表示实验刺参的初始能值和终末能值(J/g)。
排粪能(F)的计算公式为:
| $ F = {F^\prime } \times {E_{{F^\prime }}} $ |
式中,F'表示实验中刺参产生的粪便干重总量;EF'为粪便的能值(J/g)。
排泄能(U)的计算公式为:
| $ U = \left({{C_N} - {F_N} - {G_N}} \right) \times 24830 $ |
式中,CN表示摄食氮(g);FN表示排粪氮(g);GN表示生长氮(g);24830表示刺参排泄每克氨氮的能值为24830 J/g。
代谢能(R)的计算公式为:
| $ R = C - G - F - U $ |
利用SPSS 17.0软件对实验数据进行单因素方差统计分析(One-way ANOVA),采用Tukey检验进行多重比较,以P < 0.05作为差异显著水平。
2 结果分析 2.1 投喂发酵饲料对刺参特定生长率和存活率的影响由表 1可以看出,投喂发酵饲料苗种的SGR为(1.83±0.01)%/d,略低于未发酵饲料组,但2组间无显著差异(P > 0.05);但从SR来看,发酵饲料组(91.51±0.74)%,显著高于未发酵饲料组(82.35±2.22)%] (P < 0.05)。
|
|
表 1 投喂不同饲料刺参的特定生长率和存活率(平均值±标准差,n=3) Tab.1 Specific growth rate and survival rate of sea cucumbers fed with different feeds (Mean±SD, n=3) |
由表 2可以看出,实验开始时发酵饲料和未发酵饲料组的ACP、SOD、AKP和LZM酶活性差异不显著(P > 0.05)。经过50 d的投喂实验,2个实验组刺参苗种的ACP、SOD、AKP LZM酶活性变化呈现出一定的差异。其中,未发酵
|
|
表 2 投喂不同饲料刺参的非特异性免疫酶活性变化(平均值±标准差,n=3) Tab.2 Changes in non-specific immunoenzyme activity of sea cucumbers fed with different feeds (Mean±SD, n=3) |
饲料组的ACP和SOD酶活性变化较小,发酵饲料组的ACP和SOD酶活性出现增高的趋势,但与未发酵饲料组差异不显著(P > 0.05);刺参的AKP酶活性发酵饲料组和未发酵饲料组均出现降低的趋势,投喂50 d后发酵饲料组酶活性为(0.74±0.04) king U/100 ml,显著高于未发酵饲料组(P < 0.05);发酵饲料组和未发酵饲料组刺参的LZM酶活性均出现增高趋势,投喂50 d后发酵饲料组的LZM酶活性为(95.52±14.80) U/ml,显著高于未发酵饲料组(P < 0.05)。
2.2.2 消化酶活性由表 3可以看出,在50 d的实验周期内,发酵饲料组和未发酵饲料组刺参的淀粉酶活性均有提高。虽然发酵饲料组的酶活性高于未发酵饲料组,但2组间差异不显著(P > 0.05)。而投喂发酵饲料组50 d后的刺参胰蛋白酶活性为(335.89± 13.01) U/mg prot,显著高于未发酵饲料组[(268.99± 2.99) U/mg prot] (P < 0.05)。
|
|
表 3 投喂不同饲料刺参的消化酶活性变化(平均值±标准差,n=3) Tab.3 Changes in digestive enzyme activity of sea cucumbers fed with different feeds (Mean±SD, n=3) |
由图 1可以看出,在7 d的倒池周期内,未发酵饲料组和发酵饲料组水体中的氨氮均呈上升趋势,且未发酵饲料组的上升趋势明显高于发酵饲料组。投喂1~3 d,未发酵饲料组水体中的氨氮略高于发酵饲料组(P > 0.05);在投喂4~7 d,未发酵饲料组水体中的氨氮显著高于发酵饲料组(P < 0.05);7 d时,发酵饲料组的水体氨氮浓度为(263.27±32.57) μg/L,未发酵饲料组的水体氨氮浓度高达(462.86±14.69) μg/L。
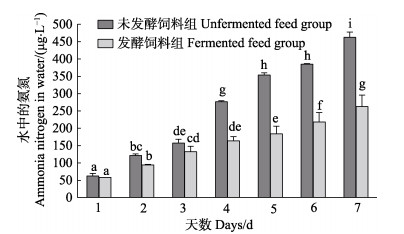
|
图 1 1个倒池周期(7 d)内养殖池水氨氮含量的变化 Fig.1 Concentation of ammonia nitrogen in the culture water during the substrate change period 不同的字母标注表示二者间有显著差异(P < 0.05) (平均值±标准差,n=3)。下同 Different letters indicate significant difference between the two groups (P < 0.05) (Mean±SD, n=3). The same as below |
由图 2可以看出,在7 d的倒池周期内,未发酵饲料组和发酵饲料组水体中的亚硝酸盐均呈上升趋势,且未发酵饲料组的上升趋势明显高于发酵饲料组。投喂1~2 d时,未发酵饲料组水体中的亚硝酸盐略高于发酵饲料组(P > 0.05);投喂3~7 d时,未发酵饲料组水体中的亚硝酸盐显著高于发酵饲料组(P < 0.05);7 d时,发酵饲料组的水体亚硝酸盐浓度为(315.15±61.41) μg/L,未发酵饲料组的水体亚硝酸盐浓度高达(572.87±25.75) μg/L。
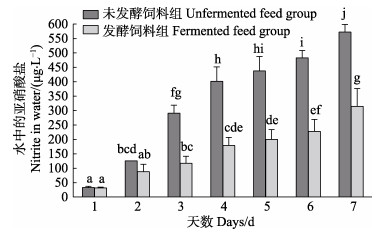
|
图 2 一个倒池周期(7 d)内养殖池水亚硝酸盐含量的变化 Fig.2 Concentration of nitrite in the culture water during the substrate change period |
由图 3可以看出,在7 d的倒池周期内,未发酵饲料组和发酵饲料组水体的pH均呈下降趋势,发酵饲料组和未发酵饲料组差异不显著(P > 0.05)。0 d时发酵饲料组pH为7.24±0.06,未发酵饲料组pH为7.25±0.08,7 d时发酵饲料组pH为6.97±0.08,未发酵饲料组pH为7.02±0.01。

|
图 3 一个倒池(7 d)周期内养殖池水pH的变化 Fig.3 Changes of pH in the culture water during the substrate change period |
通过氧弹仪测定,0 d时刺参的能值为39.34 J/g,发酵饲料组饲料、残饵、粪便及20 d时的刺参能值分别为34.79、5.35、1.77和42.45 J/g,未发酵饲料组饲料、残饵、粪便及20 d时的刺参能值分别为45.61、6.71、1.50和41.25 J/g。根据以上能值计算出发酵饲料组刺参的生长能、排粪能、排泄能以及代谢能的能量分配分别为(13.25±1.01)%、(44.78±0.80)%、(9.65±0.88)%和(32.32±2.00)%,发酵饲料组刺参生长能占比为(13.25±1.01)%,略高于未发酵饲料组(11.38±1.05)%;发酵饲料组的代谢能占比为(32.32± 2.00)%,显著低于未发酵饲料组[(44.12±0.54)%] (P < 0.05) (表 4)。
|
|
表 4 投喂不同饲料刺参的能量分配(平均值±标准差,n=3) Tab.4 Energy distribution of sea cucumbers fed with different feeds (Mean±SD, n=3) |
发酵饲料通过微生物的新陈代谢和菌体繁殖,将饲料中的大分子物质和抗营养因子分解或转化,产生更利于动物采食和利用的富含高活性益生菌及其代谢产物的饲料或原料,促进养殖生物的生长(刘艳新等, 2017)。通过对比投喂发酵饲料和未发酵饲料对刺参特定生长率和存活率的影响看出,投喂发酵饲料和未发酵饲料刺参的特定生长率无显著差异,但发酵饲料组的刺参存活率显著高于未发酵饲料组。李利华(2013)和姜燕等(2012)比较发酵饲料和普通饲料对刺参生长的影响,研究表明,投喂发酵饲料可以提高刺参的特定生长率和存活率。本研究中,发酵饲料对刺参存活率的影响与以上研究结果基本一致,但在特定生长率方面的结果与其存在差别,这可能与2个实验过程中所用苗种的规格以及投放密度存在差异有关。本研究采用了与养殖生产一致的高密度养殖,在发酵饲料组刺参存活率显著提高,相同投喂实验期内,后期养殖水体中苗种密度较大,影响了刺参特定生长率的增长。
3.2 投喂发酵饲料对刺参非特异性免疫酶和消化酶的影响棘皮动物主要依靠细胞免疫和体液免疫来抵抗外界的侵害(Kudriavtsev et al, 2004),非特异性免疫酶在刺参的免疫防御中占据重要地位(王淑娴等, 2012; 孙永欣等, 2007)。发酵饲料可以改善动物肠道微生态平衡,增强其免疫力,发酵饲料中的小分子物质更有利于刺参的肠道吸收,有助于提高刺参的非特异性免疫酶活性,同时,饲料在发酵过程中,益生菌含量不断增加。本研究在投喂50 d后,发酵饲料组刺参的ACP、AKP、SOD和LZM酶活性均高于未发酵饲料组,2组间ACP和SOD酶活性无显著差异,AKP和LZM酶活性存在显著差异。王世英等(2016)在刺参的配合饲料中添加30%的发酵海带,刺参LZM、SOD、ACP酶活性都有显著提高。以上研究均表明,发酵饲料可显著提高刺参的免疫酶活性,这也可以解释投喂发酵饲料组存活率显著高于未发酵饲料组。
本研究中发酵饲料对刺参消化酶活性的影响表明,发酵饲料可以显著提高刺参胰蛋白酶活性,对淀粉酶活性影响较小。王天神(2012)发现,饲喂发酵饲料后,克氏原螯虾(Procambarus clarkii)的胰蛋白酶活性和淀粉酶活性都显著升高;孙兴(2015)发现,发酵饲料可以不同程度的提高刺参的蛋白酶、淀粉酶和纤维素酶活性,其研究结果在胰蛋白酶活性上与本研究结果相似,这可能是由于发酵过程可以提高饲料中酵母菌等益生菌,进而会促进刺参肠道中蛋白酶活性的提升。而本研究中,发酵饲料对刺参淀粉酶活性影响较小,可能与养殖动物饲料的组成有关,本研究所用的刺参饲料主要为海带和马尾藻,饲料的淀粉含量较低(李来好等, 1997),发酵饲料对刺参肠道淀粉酶活性影响较小。
3.3 投喂发酵饲料对养殖水体水质的影响刺参工厂化养殖过程中,残饵和粪便不断沉积,并通过微生物降解产生大量的氨氮和亚硝酸盐等有害物质,且会影响水体的pH值,这些有害物质和pH的变化会对刺参的摄食、消化和生长产生不利影响(胡炜等, 2018; 韩莎等, 2018)。本研究通过对比投喂未发酵饲料和发酵饲料对养殖单元池水水质的影响发现,在7 d的倒池周期内,未发酵饲料组水体的氨氮和亚硝酸盐浓度升高较快,在第3天或第4天后显著高于发酵饲料组。王永杰等(2019)发现,投喂发酵饲料水体的氨氮、亚硝酸盐、pH和硫化氢的浓度均低于对照组,本研究与其结果较为相似。总结分析认为,发酵饲料诱食性好、饲料利用率高,并且发酵饲料中含有大量的益生菌,促进了水体的氮循环,从而改善了养殖水体的水质。
3.4 投喂发酵饲料对刺参能量收支的影响能量收支作为一种能量流动与分配的评估手段,可以用来分析生物体对能量的分配利用情况。通过对比投喂未发酵饲料和发酵饲料刺参的能量分配可以看出,发酵饲料组刺参的生长能、排粪能和排泄能占比均高于未发酵饲料组,两组间无显著差异,发酵饲料组的代谢能占比低于未发酵饲料组,且两组间存在显著差异。郭娜(2011)研究发现,投喂不同饲料刺参的能量分配有所差异,投喂鼠尾藻(Sargassum thunbergii)粉的刺参代谢能高于投喂海带粉和浒苔(Enteromorpha prolifera)粉刺参的代谢能,刺参的排粪能低于投喂海带粉和浒苔粉刺参的排粪能。本研究所用马尾藻与鼠尾藻同属马尾藻科,据此推断,摄食马尾藻粉刺参会分配更多的能量用于代谢活动,而马尾藻经发酵后大分子物质降解为小分子物质,利于刺参的消化吸收,因此,摄食发酵饲料刺参分配的代谢能减少;而发酵饲料增加刺参摄食量,排粪能和排泄能增加。本研究中未发酵饲料组刺参的生长能占比为(11.38±1.05)%,发酵饲料组刺参的生长能占比为(13.25±1.01)%。虽然两组的特定生长率测定结果无显著差异,但发酵组刺参的生长能占比略高,这可能是由于进行能量收支实验时,投喂等质量的发酵饲料和未发酵饲料,但是发酵过程饲料中的部分能量被发酵菌利用,因此,发酵饲料组刺参摄入的总能(摄食能)低于未发酵饲料组导致。姜燕(2014)研究发现,投喂发酵饲料的刺参用于生长的能量高于未发酵饲料与本研究结果一致,可能是发酵过程将饲料中的大分子物质转化为小分子物质(Jiang et al, 2015),更有利于刺参消化吸收,刺参分配更多能量用于生长,提高了饲料的有效利用率。
为充分验证发酵饲料在工厂化大规格苗种培育中的养殖效果,本研究采用工厂化养殖模式,在50 d的实验周期中,投喂发酵饲料和未发酵饲料,检测刺参的能量收支、生长、酶活性及养殖水质等指标。研究表明,投喂发酵饲料可以显著提高刺参的存活率,并使刺参分配更多的能量用于生长;同时,投喂发酵饲料可以提高刺参的碱性磷酸酶、溶菌酶和胰蛋白酶活性,减缓养殖池水氨氮和亚硝酸盐浓度的增长。综上所述,在刺参工厂化保苗中,发酵饲料的养殖效果要优于未发酵饲料。本研究结果将对发酵饲料在刺参养殖中的应用提供参考。
Guo N. Studies on the effects of different diets on growth, digestive physiology and energy budget of Apostichopus japonicus. Master's Thesis of China Ocean University, 2011 [郭娜. 不同饲料对刺参(Apostichopus japonicus)生长、消化生理和能量收支的影响. 中国海洋大学硕士研究生学位论文, 2011]
|
Han S, Hu W, Li CL, et al. Effects of pH stress on survival rate, growth and antioxidant enzyme activities of the sea cucumber, Apostichopus japonicus Selenka. Progress in Fishery Sciences, 2018, 39(5): 91-98 [韩莎, 胡炜, 李成林, 等. pH胁迫对刺参存活、生长及抗氧化酶活性的影响. 渔业科学进展, 2018, 39(5): 91-98] |
Hu W, Zhao B, Li CL, et al. Effects of chronic ammonia nitrogen stress on the feeding and digestive enzyme activities of sea cucumber (Apostichopus japonicus Selenka). Journal of Fishery Sciences of China, 2018, 25(1): 137-146 [胡炜, 赵斌, 李成林, 等. 慢性氨氮胁迫对刺参摄食与消化酶活性的影响. 中国水产科学, 2018, 25(1): 137-146] |
Hu XX, Zhou YH, Liu HZ, et al. Effects of fermented feed without antibiotic on growth performance, intestinal flora, blood biochemical parameters and immune function of weaner piglets. Chinese Journal of Animal Nutrition, 2013, 25(12): 2989-2997 [胡新旭, 周映华, 刘惠知, 等. 无抗发酵饲料对断奶仔猪生长性能、肠道菌群、血液生化指标和免疫性能的影响. 动物营养学报, 2013, 25(12): 2989-2997 DOI:10.3969/j.issn.1006-267x.2013.12.028] |
Jiang Y. Study on the processing technology and application of fermentation feed for sea cucumber Apostichopus japonicus. Doctoral Dissertation of Ocean University of China, 2014 [姜燕. 刺参(Apostichopus japonicus)发酵饲料的制作工艺与应用效果研究. 中国海洋大学博士研究生学位论文, 2014]
|
Jiang Y, Wang YG, Xue TS, et al. The production and feeding experiment of fermented feed in pond culture system of sea cucumber, Apostichopus japonicus. Progress in Fishery Sciences, 2012, 33(1): 66-71 [姜燕, 王印庚, 薛太山, 等. 刺参池塘养殖系统中发酵饲料的制作与投喂. 渔业科学进展, 2012, 33(1): 66-71 DOI:10.3969/j.issn.1000-7075.2012.01.010] |
Jiang Y, Wang YG, Mai KS, et al. Effects of different microbes on fermenting feed for sea cucumber (Apostichopus japonicus). Journal of Ocean University of China, 2015, 14(5): 873-880 DOI:10.1007/s11802-015-2591-3 |
Kudriavtsev IV, Polevshchikov AV. Comparative immunological analysis of echinoderm cellular and humoral defense factors. Zhurnal Obshcheĭ Biologii, 2004, 65(3): 218 |
Li LH, Yang XQ, Wu YY, et al. Analysis of nutritive composition in Sargassum and its evaluation in nutriology. Journal of Ocean University of Qingdao, 1997(3): 53-59 [李来好, 杨贤庆, 吴燕燕, 等. 马尾藻的营养成分分析和营养学评价. 青岛海洋大学学报, 1997(3): 53-59] |
Li LH. Process optimization of cucumbers fermented food and application in the breeding trials. Master's Thesis of Harbin Institute of Technology, 2013 [李利华. 刺参发酵饵料工艺条件优化及养殖试验中的应用. 哈尔滨工业大学硕士研究生学位论文, 2013]
|
Liu YX, Liu ZY, Ni HJ, et al. The research progress and prospect of microbial fermentation feed. Feed Review, 2017(2): 15-22 [刘艳新, 刘占英, 倪慧娟, 等. 微生物发酵饲料的研究进展与前景展望. 饲料博览, 2017(2): 15-22 DOI:10.3969/j.issn.1001-0084.2017.02.005] |
Refstie S, Sahlström S, Bråthen E, et al. Lactic acid fermentation eliminates indigestible carbohydrates and antinutritional factors in soybean meal for Atlantic salmon (Salmo salar). Aquaculture, 2005, 246(1-4): 331-345 DOI:10.1016/j.aquaculture.2005.01.001 |
Sun RJ, Lu YQ, Gao MF, et al. Study on application of microorganism fermentation feed in laying hens. China Feed, 2012(15): 12-14, 26 [孙汝江, 吕月琴, 高明芳, 等. 微生物发酵饲料在蛋鸡生产中的应用研究. 中国饲料, 2012(15): 12-14, 26 DOI:10.3969/j.issn.1004-3314.2012.15.005] |
Sun X. Production of solid state fermentation feed and its application in Apostichopus japonicas cultivation. Master's Thesis of Dalian Polytechnic University, 2015 [孙兴. 刺参固态发酵饲料的制备及应用. 大连工业大学硕士研究生学位论文, 2015]
|
Sun YX, Wang JQ, Wang TT, et al. A review: Defense mechanism in sea cucumber. Fisheries Science, 2007(6): 358-361 [孙永欣, 王吉桥, 汪婷婷, 等. 海参防御机制的研究进展. 水产科学, 2007(6): 358-361 DOI:10.3969/j.issn.1003-1111.2007.06.013] |
Tan J, Li FH, Chen SQ, et al. Effect of temperature and diet on the reproductive condition of sea cucumber Apostichopus japonicus broodstock. Progress in Fishery Sciences, 2020, 41(1): 1-9 [谭杰, 李凤辉, 陈四清, 等. 不同培育水温和饲料对刺参人工促熟效果的影响. 渔业科学进展, 2020, 41(1): 1-9] |
Tao L, Zhou YY, Zhao FW, et al. Development status and application of microbial fermentation feed in livestock and poultry breeding. Journal of Anhui Agricultural Sciences, 2015, 43(13): 167-169 [陶蕾, 周玉岩, 赵凤舞, 等. 微生物发酵饲料在畜禽养殖中的发展现状及应用. 安徽农业科学, 2015, 43(13): 167-169 DOI:10.3969/j.issn.0517-6611.2015.13.058] |
Wang SY, Chen ZQ. The effect of fermented seaweed Laminaria japonica on growth, immunity and digestion physiology of sea cucumber Apostichopus japonicus. Journal of Jimei University (Natural Science), 2016, 21(6): 410-419 [王世英, 陈政强. 发酵海带对刺参生长和免疫及消化生理的影响. 集美大学学报(自然科学版), 2016, 21(6): 410-419 DOI:10.3969/j.issn.1007-7405.2016.06.002] |
Wang SY. The application of microbial fermented feed in cultivation of sea cucumber Apostichopus japonicus. Master's Thesis of Jimei University, 2015 [王世英. 微生物发酵饲料在刺参养殖中的应用. 集美大学硕士研究生学位论文, 2015]
|
Wang SX, Ye HB, Yu XQ, et al. Analysis of sea cucumber immune mechanism. Journal of Anhui Agricultural Sciences, 2012, 40(25): 12553-12555 [王淑娴, 叶海斌, 于晓清, 等. 海参的免疫机制研究. 安徽农业科学, 2012, 40(25): 12553-12555 DOI:10.3969/j.issn.0517-6611.2012.25.080] |
Wang TS. Effect of fermented biological feed on growth, nutritional components in muscle, digestive enzyme and non-specific immunity of Procambarus clarkii. Master's Thesis of Shanghai Ocean University, 2012 [王天神. 生物发酵饲料对克氏原螯虾生长、营养成分、消化酶和免疫酶的影响. 上海海洋大学硕士研究生学位论文, 2012]
|
Wang XY, Qiao HJ, Huang BS, et al. Application research of five seaweeds in juvenile sea cucumber Apostichopus japonicus (Selenka). Progress in Fishery Sciences, 2019, 40(3): 160-167 [王晓艳, 乔洪金, 黄炳山, 等. 5种海藻在刺参幼参饲料中的应用研究. 渔业科学进展, 2019, 40(3): 160-167] |
Wang Y, Zheng ZM, Zhou CS, et al. Comparison of growth, energy budget of Southern-China-cultured Stichopus japonicus fed with three types of sediment-feeds. Ecological Sciences, 2012, 31(6): 613-618 [汪洋, 郑忠明, 周朝生, 等. 南移刺参摄食三种沉积物饵料下的生长和能量收支比较. 生态科学, 2012, 31(6): 613-618 DOI:10.3969/j.issn.1008-8873.2012.06.003] |
Wang YJ, Gan XS, Xu SG, et al. Effects of fermented feed on the growth performance, physiological and biochemical indices and aquaculture water quality of black bream×Culter hybrid cultivar "Wanjiang No.1". Journal of Anhui Agricultural Sciences, 2019, 47(16): 110-112, 118 [王永杰, 甘小顺, 徐双贵, 等. 发酵饲料对杂交鲂鲌"皖江1号"生长性能、生理生化指标及养殖水质的影响. 安徽农业科学, 2019, 47(16): 110-112, 118 DOI:10.3969/j.issn.0517-6611.2019.16.032] |
Wu XY, Guo CH, Wang ZS, et al. Microbiology fermented feed: Effects on performance and nutrient apparent digestibility of lactating dairy cows. Chinese Journal of Animal Nutrition, 2014, 26(8): 2296-2302 [吴小燕, 郭春华, 王之盛, 等. 微生物发酵饲料对泌乳奶牛生产性能和饲粮养分表观消化率的影响. 动物营养学报, 2014, 26(8): 2296-2302 DOI:10.3969/j.issn.1006-267x.2014.08.034] |
Wu YY, Sun RJ, Mi HF, et al. The current situation and application of biological fermentation feed in aquaculture. China Feed, 2018(13): 60-63 [吴业阳, 孙瑞健, 米海峰, 等. 生物发酵饲料现状及在水产养殖上应用. 中国饲料, 2018(13): 60-63] |
Yuan CY, Meng Y, Bi JC, et al. Effects of fermented feed on digestive enzyme activities and intestinal microflora of Penaeus vannamei. Feed Industry, 2018, 39(24): 24-28 [袁春营, 孟阳, 毕建才, 等. 发酵饲料对南美白对虾消化酶活性与肠道菌群的影响. 饲料工业, 2018, 39(24): 24-28] |
Zhong XQ, Li XF, Cai WC, et al. Effects of fermented feed on growth performance, digestive enzyme activity, fillet quality and immunity of juvenile carp (Cyprinus carpio). Journal of Nanjing Agricultural University, 2018, 41(1): 154-162 [钟小群, 李向飞, 蔡万存, 等. 发酵饲料对鲤鱼幼鱼生长性能、消化酶活性、肌肉品质和免疫机能的影响. 南京农业大学学报, 2018, 41(1): 154-162] |



