2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 威海市文登区海洋发展局 威海 264400;
4. 山东省乳山市海洋发展局 威海 264500;
5. 烟台市海洋经济研究院 烟台 264006;
6. 五洲丰农业科技有限公司 烟台 264000
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
3. Wendeng Marine Development Bureau, Weihai 264400;
4. Rushan Marine Development Bureau, Rushan 264500;
5. Yantai Marine Economic Research Institute, Yantai 264006;
6. Wuzhoufeng Agricultural Science and Technology Co. LTD, Yantai 264000
20世纪80年代,我国初步建立刺参(Apostichopus japonicus)苗种人工繁育技术,进入21世纪以来,刺参养殖规模的持续扩大,拉动了刺参苗种生产的快速发展。21世纪初,用于刺参人工繁育的亲参主要来源于养殖池塘或者海区自然成熟的刺参。采用养殖池塘或自然海区的亲参,往往因为天气原因,错过亲参的采捕时机,而且自然成熟的亲参成熟时间晚,苗种上市规格小,放养后成活率低。为解决这一问题,刺参亲参人工促熟技术逐步建立,通过控制亲参培育的水温和营养条件,来获得性腺发育成熟的亲参。人工促熟获得的亲参,仍然存在成熟不同步、比自然成熟的亲参怀卵量低等问题,为获得足够的卵子,通常需要培育大量的亲参。
海洋无脊椎动物的中枢神经系统通过释放神经递质来控制繁殖行为(Nagaraju, 2011; Tanabe et al, 2010)。利用此原理,可通过向甲壳动物体内注入外源激素来促进其性腺发育。研究表明,5-羟色胺即血清素能促进斑节对虾(Penaeus monodon)的卵巢组织发育(Wongprasert et al, 2006; 温为庚等, 2009)。Meeratana等(2006)证实,血清素能刺激罗氏沼虾(Macrobrachium rosenbergii)的性腺发育和排放。本研究以刺参为实验对象,研究向人工促熟的刺参体内注射血清素对刺参繁育效果的影响,为进一步完善刺参人工促熟技术提供参考。
1 材料与方法 1.1 实验刺参实验刺参于2018年11月取自山东省乳山市海渊水产养殖公司养殖池塘。挑选2000头体格健壮、活力好的刺参作为亲参进行培育。亲参平均体重为(247.6±52.6) g,暂养于12 m3水泥池,水深为1 m。初始时,以自然水温培育,当水温降至2℃~3℃,保持此水温2~3 d,此后以1℃/d的速率升温至6℃,恒温培育6~8 d,再以0.5℃/d的速率升温至10℃,恒温培育6~8 d后,继续以0.5℃/d的速率升温至15℃后,恒温待产。亲参培育密度为15~20头/m3,培育池内的溶氧浓度≥5 mg/L,培育过程中,每日上午换水1次,每次换水量为池水的50%,所换海水经过砂滤处理,每3~5 d倒池1次,清洗池底残饵及粪便。
培育过程中,投喂粉状饲料和海泥的混合物,其重量比为饲料∶海泥=1∶6~8,每日饲料投喂量为池中亲参重量的3%~5%,根据摄食情况适当调整。及时将死亡的亲参移出培育池,并记录每个实验组刺参的死亡头数。
1.2 血清素配制及注射血清素购于Sigma公司。以生理盐水(NaCl为0.85%)溶解血清素,配成浓度为100 mg/ml的工作液。当亲参培育水温升至15℃后,将血清素按照20、50、100和200 μg/g亲参体重的剂量从刺参背部注入体腔,每种注射剂量之后各按每5、10、15和20 d再注射1次,以注射生理盐水的亲参为对照组,以不做处理的为空白组。注射生理盐水的亲参每10 d注射1次,每次注射0.2 ml,实验设置见表 1。每个培育池设置2个实验组,每组为111头或112头亲参,同一培育池的不同实验组之间用网隔隔开。
|
|
表 1 实验设置 Tab.1 Experiment design |
当夜间观察到大量亲参集中在培育池的池角,部分亲参在水体表层沿池壁活动频繁,躯体上半部离开池壁不停地摇摆或已出现少量雄参排精时,每日升高亲参培育水温0.5℃,升至18℃后待产。在2019年3月下旬,采用阴干流水升温的方法刺激亲参排放精液和卵子。每个实验组设置3个平行,每个平行30头亲参在0.5 m3塑料水槽中排放。观察到有雄参排精后,即将排精的雄参移出水槽,统计每个水槽中产卵的雌参数,计算雌参排放率。待所有雌参停止排卵后,计算雌参平均产卵量。每个实验组随机测量30个卵子的卵径。2 h后,计算受精率。
根据雌参排放率和平均产卵量,挑选F组和空白组测定孵化率、幼体体长和附着变态率。F组和空白组的受精卵分别在21℃水温孵化,孵化密度为3个/ml。受精48 h后,统计孵化率。在统计受精率和孵化率时取样3次,每次统计的个体数为100个。
雌参排放率=(排卵雌参数/催产亲参总数)×100%;
受精率=发生卵裂的受精卵数/总卵子数×100%;
孵化率=小耳幼体数/受精卵数×100%。
受精卵发育到小耳幼体后进行布池,培育密度为0.15个/ml。幼体培育时期,投喂由角毛藻(Chaetoceros muelleri)、小新月菱形藻(Nitzschia closterium)和海洋红酵母(Rhodotorula benthica)组成的混合饵料,日投饵4次,小耳幼体、中耳幼体和大耳幼体的日投饵量分别为25000~30000、35000和35000~40000 cells/ml。幼体培育期间不换水,每天加入部分新水,至受精后第9天池内水深达到1 m,每组随机抽样30个耳状幼体,在显微镜下用目微尺测定其体长。
在小耳幼体进行布池的同时,对F组和空白组进行附着变态实验。实验容器是体积为10 L的消毒处理的塑料桶。实验采用透明塑料薄膜作为附着基。使用前,塑料薄膜先浸泡于海水中,经20×10–6 mol/L高锰酸钾消毒30 min,清水冲洗晾干后使用,塑料薄膜置于桶底。2个组各设置3个平行。幼体培育密度为0.15个/ml,充气培育。实验开始时,桶中加满海水,以后每天换水1次,每次换水1/2。耳状幼体期间,每日投喂饵料量和培育池中相同。授精后第10天,开始投喂由海带(Laminaria)粉和马尾藻(Sargassum)粉混合制成的配合饵料。授精后第20天,观察统计幼体附着变态的情况,计算幼体附着变态率。
1.4 数据分析实验结果用平均值±标准误(Mean±SE)表示,采用SPSS20.0软件进行单因素方差分析(One-way ANOVA),P < 0.05表示差异显著。
2 结果 2.1 亲参成活率各实验组、对照组和空白组的亲参成活率见图 1。从图 1可以看出,各组亲参成活率介于(84.7±6.2)%和(90.1±1.6)%之间,各组之间无显著差异。
|
图 1 注射血清素对亲参成活率的影响 Fig.1 Effects of serotonin on survival rate of sea cucumbers |
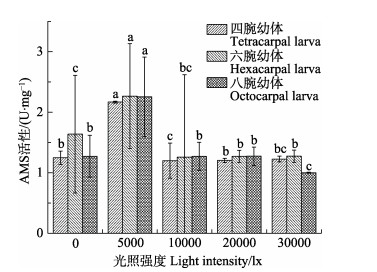
不同实验组雌参排放率和产卵量见图 2和图 3。由图 2和图 3可知,对照组雌参排放率最低,为(14.4± 1.1)%,空白组为(15.6±2.2)%。注射血清素的所有实验组雌参排放率均高于对照组和空白组,其中,F、J和M组显著高于对照组和空白组,分别为(33.3± 1.9)%、(32.2±2.9)%和(31.1±1.1)%。对照组和空白组雌参排卵量最低,分别为(302.0±73.3)万粒和(304.0± 62.7)万粒。E、F、I、J、K、L、M、N、O和P组显著高于对照组和空白组(P < 0.05),其中F组最高,平均排卵量为(637.0±64.2)万粒。

|
图 2 注射血清素对雌参排放率的影响 Fig.2 Effects of serotonin on spawning rate of female sea cucumbers 不同字母表示差异显著(P < 0.5),下同 Different letters indicated significant different (P < 0.5). The same as below |
|
图 3 注射血清素对雌参平均排卵量的影响 Fig.3 Effects of serotonin on fecundity of female sea cucumber |
按血清素为20 μg/g亲参体重进行注射的4个实验组的雌参排放率和平均排卵量2项指标没有显著差异。注射剂量为50 μg/g的实验组中,每20 d注射1次的实验组的2项繁殖力指标显著低于每10 d注射1次的实验组。注射剂量为100 μg/g的实验组中,每20 d注射1次的实验组的雌参排放率显著低于每10 d注射1次的实验组。注射剂量为200 μg/g的实验组中,每20 d注射1次的实验组的雌参排放率显著低于每5 d注射1次的实验组。
2.3 血清素对卵子和幼体质量的影响F组和空白组卵径、受精率、孵化率、幼体体长和附着变态率见表 2。由表 2可知,F组卵子卵径为(165.0±3.5) μm,大于空白组[(161.7±2.6) μm]。F组的卵子受精率、受精卵孵化率、9日龄幼体体长和幼体附着变态率分别为(93.0±1.5)%、(82.7±1.2)%、(856.0±24.8) μm和(24.0±1.9)%,均低于空白组[分别为(96.3±1.8)%、(85.3±1.8)、(951.3±40.3) μm和(26.4±1.0)%],但2组的上述指标无显著差异。
|
|
表 2 血清素对刺参卵子与幼体质量的影响 Tab.2 Effects of serotonin on offspring quality of sea cucumber |
刺参亲参在人工促熟过程中能多次产卵,然而每次是由不同的亲参产卵或者同一头亲参多次产卵,目前尚不明确。Liu等(2015)研究表明,人工促熟的亲参经过升温刺激,50%~80%的亲参会排放精卵。谭杰等(2020)的研究表明,人工促熟的亲参,雌参排放率为6%~16%,结合生产实践的经验,人工催产中排放的亲参大部分为雄参,排放的雌参所占比例较小,说明雌参性腺发育同步性较差。通过注射外源激素促进刺参性腺发育,提高雌参性腺发育同步性,可减少亲参培育数量,降低生产成本;另一方面,雌参排放率提高,可增加繁殖的有效群体数量,降低近交衰退的风险。
血清素是一种重要的神经传递素和神经调节物质,动物通过血清素受体控制着一系列的感觉和运动功能(Wang et al, 2017)。在甲壳动物中,血清素具有促进卵黄发生和卵母细胞成熟的双重作用(Tomy et al, 2016)。Tinikul等(2009)发现,注射血清素可缩短罗氏沼虾卵巢成熟和胚胎发育的时间,同时增加性腺指数和卵子卵径。在贝类中,血清素可诱导贝类卵细胞成熟和排放(刘洪军等, 1994; Hamida et al, 2004),体外诱导卵子的生发泡破裂,重启减数分裂(王琦等, 2015),使生发泡破裂的卵母细胞进一步成熟(邸炜鹏等, 2011)。刺参和栉孔扇贝(Chlamys farreri)的卵母细胞相似,在排出体外前处于第1次减数分裂中期。Gianasi等(2019)研究表明,血清素不能诱导冰岛刺参(Cucumaria frondosa)产卵。本研究表明,血清素可有效促进刺参性腺的发育。Gianasi等(2019)研究通过向性成熟的冰岛刺参注射血清素诱导产卵,本研究是通过注射血清素促进刺参性腺发育成熟,然后通过阴干流水升温刺激诱导刺参产卵。可见,血清素对不同动物繁殖行为的调控效果不同。
在甲壳动物中,血清素可能通过抑制性腺抑制激素的合成和分泌,或者刺激神经系统合成和分泌促性腺激素来促进性腺发育(Wongprasert et al, 2006)。Soonthornsumrith等(2018)认为,罗氏沼虾脑和卵巢中的血清素能诱导雌性类固醇的分泌,这些类固醇促进卵黄发生,进而引起卵母细胞生长和成熟。血清素在贝类中的作用是通过结合卵母细胞膜表面的G蛋白偶联受体,在细胞内生成第二信使,将细胞外的信号传递到细胞内,诱发细胞行为(王琦等, 2015)。Wang等(2017)从刺参呼吸树、消化道和肌肉组织中分离出血清素受体的cDNA,启示刺参体内可能存在血清素结合及作用现象。但目前,对于血清素受体是否存在于刺参神经系统或性腺中尚无相关报道。因此,后期需要对血清素促进刺参性腺发育的机理开展进一步研究。
本研究中,按血清素为20 μg/g亲参体重进行注射的4个实验组,雌参排放率和平均排卵量2项指标与对照组和空白组相比没有显著差异,可能是因为注射剂量较小。而在剩余3个剂量中,每20 d注射1次的实验组中,雌参排放率与对照组和空白组没有显著差异,说明注射间隔时间太长时,血清素不能提高刺参繁殖力。注射血清素的实验组刺参的卵子卵径、受精率、受精卵孵化率、浮游幼体体长和浮游幼体附着变态率与对照组相比无显著差异,说明注射血清素可促进刺参性腺发育,同时对卵子质量并无不良影响。以上结果表明,在亲参培育过程中,当培育水温稳定在15℃以后,按照50 μg/g亲参体重的剂量,每10 d注射1次血清素可显著提高刺参排卵率和产卵量,且不会影响后期受精孵化过程。本研究为优化刺参亲本促熟工艺、建立刺参高效制种技术提供了科学依据。
Di WP, Wang ZP, Yu RH, et al. Effect of ammonia seawater and 5-HT on maturation of oocyte stripped from scallop, Chlamys farreri (Jones et Preston). Periodical of Ocean University of China, 2011, 41(4): 46-50 [邸炜鹏, 王昭萍, 于瑞海, 等. 氨海水与5-羟色胺对栉孔扇贝解剖卵的体外促熟作用. 中国海洋大学学报, 2011, 41(4): 46-50] |
Gianasi B, Hamel J, Mercier A. Triggers of spawning and oocyte maturation in the commercial sea cucumber Cucumaria frondosa. Aquaculture, 2019, 498: 50-60 DOI:10.1016/j.aquaculture.2018.08.030 |
Hamida L, Medhioub M, Cochard J, et al. Evaluation of the effects of serotonin (5-HT) on oocyte competence in Ruditapes decussatus (Bivalvia, Veneridae). Aquaculture, 2004, 239(1-4): 413-420 DOI:10.1016/j.aquaculture.2004.05.010 |
Liu HJ, Xiang JH. Studies on induction of spawning by biochemical signal molecules in several bivalves. Marine Sciences, 1994, 6: 35-38 [刘洪军, 相建海. 几种生化信号物质对双壳类催产效应的研究. 海洋科学, 1994, 6: 35-38] |
Liu SL, Sun JC, Ru XS, et al. Broodstock conditioning and spawning. In: Yang H, Hamel JF, Mercier A. The sea cucumber Apostichopus japonicus: History, biology and aquaculture. Cambridge: Academic Press, 2015, 101-110
|
Meeratana P, Withyachumnarnkul B, Damrongphol P, et al. Serotonin induces ovarian maturation in giant freshwater prawn broodstock, Macrobrachium rosenbergii de Man. Aquaculture, 2006, 260(1-4): 315-325 DOI:10.1016/j.aquaculture.2006.06.010 |
Nagaraju GP. Reproductive regulators in decapod crustaceans: An overview. Journal of Experimental Biology, 2011, 214: 3-16 DOI:10.1242/jeb.047183 |
Soonthornsumrith B, Saetan J, Kruangkum T, et al. Three- dimensional organization of the brain and distribution of serotonin in the brain and ovary, and its effects on ovarian steroidogenesis in the giant freshwater prawn, Macrobrachium rosenbergii. Invertebrate Neuroscience, 2018, 18(2): 5 DOI:10.1007/s10158-018-0209-3 |
Tan J, Li FH, Chen SQ, et al. Effect of temperature and diet on the reproductive condition of sea cucumber Apostichopus japonicus broodstock. Progress in Fishery Sciences, 2020, 41(1): 96-103 [谭杰, 李凤辉, 陈四清, 等. 不同培育水温和饲料对刺参人工促熟效果的影响. 渔业科学进展, 2020, 41(1): 96-103] |
Tanabe T, Yuan Y, Nakamura S, et al. The role in spawning of a putative serotonin receptor isolated from the germ and ciliary cells of the gonoduct in the gonad of the Japanese scallop, Patinopecten yessoensis. General and Comparative Endocrinology, 2010, 166: 620-627 DOI:10.1016/j.ygcen.2010.01.014 |
Tinikul Y, Soonthornsumrith B, Phoungpetchara I, et al. Effects of serotonin, dopamine, octopamine, and spiperone on ovarian maturation and embryonic development in the giant freshwater prawn, Macrobrachium rosenbergii (De Man, 1879). Crustaceana, 2009, 82(8): 1007-1022 DOI:10.1163/156854009X448844 |
Tomy S, Saikrithi P, James N, et al. Serotonin induced changes in the expression of ovarian gene network in the Indian white shrimp, Penaeus indicus. Aquaculture, 2016, 452: 239-246 DOI:10.1016/j.aquaculture.2015.11.003 |
Wang Q, He MX. Effect of 5-HT on maturation of oocyte stripped from the pearl oyster Pinctada fucata and cellular localization of 5-HT receptor. Marine Science Bulletin, 2015, 34(1): 89-94, 101 [王琦, 何毛贤. 5-HT对马氏珠母贝卵体外促熟的影响及5-HT受体的细胞学定位. 海洋通报, 2015, 34(1): 89-94, 101] |
Wang TM, Yang Z, Zhou NM, et al. Identification and functional characterisation of 5-HT4 receptor in sea cucumber Apostichopus japonicus (Selenka). Scientific Reports, 2017, 7: 1-12 DOI:10.1038/s41598-016-0028-x |
Wen WG, Huang JH, Yang QB, et al. Effect of serotonin on ovarian maturation in Penaeus mondon. South China Fisheries Science, 2009, 5(1): 59-63 [温为庚, 黄建华, 杨其彬, 等. 血清素在斑节对虾催熟过程中的作用. 南方水产, 2009, 5(1): 59-63 DOI:10.3969/j.issn.1673-2227.2009.01.010] |
Wongprasert K, Asuvapongpatana S, Poltana P, et al. Serotonin stimulates ovarian maturation and spawning in the black tiger shrimp Penaeus monodon. Aquaculture, 2006, 261(4): 1447-1454 DOI:10.1016/j.aquaculture.2006.08.044 |



