2. 中国科学院大学 北京 100049;
3. 中国科学院种子创新研究院 武汉 430072
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Innovation of Seed Design, Chinese Academy of Sciences, Wuhan 430072
棘皮动物(Echinodermata)是一类古老、特殊的海洋生物,在5亿多年以前的古生代寒武纪即已出现,是无脊椎动物中进化地位最高等的类群。世界范围内现存棘皮动物7000余种,化石种类接近13000种,几乎全营底栖生活,分布范围广泛,从热带海域到寒带海域,从潮间带到数千米的深海都有分布(廖玉麟等, 2011; Pawson, 2007)。现存的棘皮动物普遍认为可分为5个纲,包括海百合纲(Crinoidea)、海星纲(Asteroidea)、蛇尾纲(Ophiuroidea)、海胆纲(Echinoidea)和海参纲(Holothurioidea)。棘皮动物门为海洋生境所特有,其幼虫两侧对称而成体多五辐射对称,体壁中有CaCO3为主要成分的内骨骼向外突出成棘刺,有特殊的水管系统辅助摄食、运动和其他功能,在海洋生态系统的结构和功能中发挥着重要作用(廖玉麟等, 2011)。棘皮动物中,海参纲和海胆纲的一些种类具有很高的经济、营养和药用价值,逐渐被人们采捕和养殖。但由于近几年来采捕过度、养殖规模急剧扩大和近亲交配严重等原因,一些棘皮动物种质退化问题非常明显,良种缺乏、病害发生日趋严重、对病害和环境胁迫的抵抗能力显著降低。以刺参(Apostichopus japonicus)为例,在20世纪80年代,人们突破了刺参苗种规模化繁育技术。21世纪以来,养殖产业迅猛发展,刺参成为引领我国第5次海水养殖浪潮的主要品种。然而,从2004年开始,养殖刺参陆续出现大规模死亡现象,并出现种质退化现象,在近几年尤为明显,主要表现出生长速度慢、病害频发、存活率低等问题,导致每年数10亿的经济损失(王印庚等, 2014)。野生刺参的资源量和种质质量亦急剧下降,已被世界自然保护联盟纳入濒危物种红色名录(IUCN Red List of Threatened Species, IUCN红色名录)。群体选育往往被用来解决经济品种种质退化及良种缺乏等问题,但此方法周期较长,且容易存在雌、雄性腺成熟不同步、亲本运输不方便以及配子利用率低等问题。而超低温冷冻保存技术是生物材料进行长期保存的一种有效手段,能有效解决群体选育中的上述问题。对种质资源(包括精子、卵子和胚胎)进行超低温冷冻保存,能够提供不受季节限制的种质资源、提高配子的利用率;扩大杂交育种范围,克服长期近亲交配造成的种质资源衰退;使种质资源运输更加便利,节约遗传育种的资金;拯救珍稀、濒临灭绝的具有优良性状的物种,并可长期不间断的为遗传育种和现代生物技术的研究提供生物材料,为种质资源的保存和生物多样性的保护开辟了新途径。本文对海胆、海参和海星3种主要棘皮动物的精子超低温冷冻保存研究进行了系统归纳和整理,并展开描述了精子冷冻保存过程的各个步骤,以期为棘皮动物种质资源保存的进一步研究及产业化应用提供参考。
1 精子超低温冷冻保存 1.1 超低温冷冻保存技术原理超低温冷冻保存技术能够长期、有效保存生物材料,它是指通过向细胞、胚胎和组织器官等添加适当的抗冻液,使其在冷冻过程中免受或降低一系列低温损伤(冰晶损伤、渗透损伤和溶质损伤等)的影响,并通过一定的降温速率,使之快速越过危险区(-15℃~ -60℃),最后,投入液氮中(-196℃)进行长期保存的过程(刘清华, 2005)。理论上认为,在液氮中保存的生物样品细胞内的一切生化反应处于“暂停”状态,甚至完全停止,可以长时间保存。在需要的时候,以适当的方法可重新解冻、激活液氮中的生物样品,恢复其内部正常的生化反应,使其具有正常的生物学功能(齐文山等, 2014; Liu et al, 2015)。
1.2 精子进行超低温冷冻保存的优点相对于卵子和胚胎等种质资源,精子的超低温冷冻保存具有其独特的优势。精子体积小,具有单层膜等相对简单的结构,表面积与体积比相对较大,有利于水分和抗冻剂的渗透;而卵子和胚胎体积较大,表面积与体积比减小,并且具有丰富的卵黄、脂肪滴和多隔室生物系统,导致膜通透效率降低,双层半透性膜系统和高的低温敏感性又进一步限制了水分和抗冻剂在膜两边的渗透性(Tsai et al, 2012)。
1.3 精子超低温冷冻保存技术的应用到目前为止,精子的超低温冷冻保存技术已在人类辅助生殖和牲畜育种中得到广泛应用(Anger et al, 2003; Mocé et al, 2009; Sharma et al, 2015; Rozati et al, 2017)。例如,冷冻保存已常规应用于协助马(Janett et al, 2003)和牛(Bhakat et al, 2011)的育种计划。在水生物种中,为突破地理隔离,扩大杂交组合范围,提供不受季节限制的精子库,达到提高遗传育种效率和濒危物种保护的目的,人们亦对一些水生经济物种开展了精子超低温冷冻保存研究。据统计,已有约200种鱼类的精子被冷冻保存(田永胜等, 2009; 齐文山等, 2014; Liu et al, 2015),针对软体动物(牡蛎和鲍鱼)、甲壳类(虾和蟹)和棘皮动物(海胆)等水生经济物种的精子也有相应的冷冻保存研究(Dunn et al, 1973; Bhavanishankar et al, 1997; Dong et al, 2007)。但棘皮动物精子冷冻保存研究开展得较晚,且研究内容不够系统全面,没有形成产业化应用的发展模式(田永胜等, 2019)。棘皮动物中,海参纲和海胆纲的一些种类自古以来即被作为滋补佳品,常被用来预防和治疗一些疾病,具有重要的经济价值和营养价值(廖玉麟等, 2011; Bordbar et al, 2011)。因此,棘皮动物主要的精子冷冻保存研究也集中于这2个纲的物种。
2 棘皮动物精子超低温冷冻保存基本步骤通常精子超低温冷冻保存过程主要包括精子的收集与质量评估、稀释剂制备、冷冻保护剂制备、精子与冷冻保护剂混合、冷却、储存、解冻和解冻后精子质量评价(图 1)。其中,抗冻剂的种类和浓度、稀释液种类、精子与冷冻保护剂混合比例、降温程序和解冻程序等因素均会对解冻后的精子质量产生极大的影响。解冻后评价精子质量的指标包括运动活力、形态变化、受精率、孵化率、细胞器完整性和代谢机能(Liu et al, 2015)。
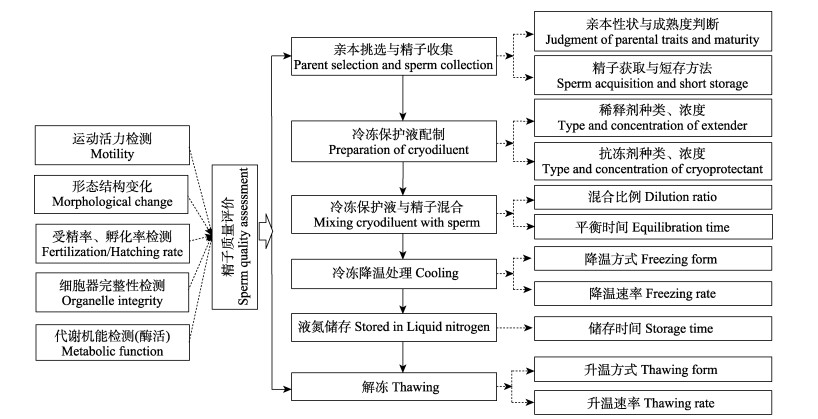
|
图 1 精子超低温冷冻保存技术流程 Fig.1 Basic process for sperm cryopreservation technology |
海胆和海参等棘皮动物不能根据体型和外表分辨性别,因此,精子和卵子通常是一起收集。一般采用自然排精和获取性腺2种方法收集棘皮动物的精子。自然排精是指通过升高海水温度、阴干或注射KCl溶液等方式诱导棘皮动物排出成熟的精子,但此方法收集精子的质量容易受到粘液、海水或粪便的污染,而且收集的精子难于浓缩(Gwo et al, 2002)。获取性腺是收集棘皮动物精子最常使用的方式,广泛应用于海参、海星和海胆等动物的精子收集过程中。Shao等(2006)获取新鲜刺参精液的操作为:当发现白色精液从位于刺参背部的生殖孔中释放出来时,立即挑出雄性刺参,解剖获得成熟雄性性腺并剪碎,用0.5 mm的筛网滤掉性腺管壁碎片,滤出新鲜精液,于4℃保存至使用。用此方法,每只雄性海参可收集约5 ml新鲜精子。
在获取新鲜精液后,立即检测精子活力,以判断是否能用于后续的超低温冷冻。精子的活力可通过光学显微镜统计样本中运动精子的百分比来直接测量(Lyons et al, 2005; Vitiello et al, 2011; Mizuno et al, 2019)。Mizuno等(2019)采用含0.5%胎牛血清的人工海水激活稀释500倍的刺参精子,认为只有活力高于70%的精子才适用于超低温冷冻保存。此外,还可通过计算机辅助精子分析系统(Computer-aided sperm analysis, CASA)来测量精子的运动能力,该系统能客观评估精子的多种运动参数,比主观观察具有更高的准确性和测量效率(Acosta-Salmón et al, 2007)。Adams等(2003)研究表明,同种海胆不同个体的新鲜精子虽然起初的运动活力无显著差异,但经过超低温冷冻保存,解冻的精子质量却存在显著差异。因此,在进行超低温冷冻实验时,将3个雄性个体的精子合并在一起以减少雄性个体精子之间的差异,此方法还解决了从棘皮动物(海胆)单只个体中只能收集到少量精子的问题,这一现象在牡蛎中也有报道(Paniagua-Chavez et al, 2001; Dong et al, 2007)。新鲜精子的质量是影响精子超低温冷冻保存成功与否的重要因素,冷冻后精子的质量与新鲜精子的质量有着密切的关系(Coloma et al, 2011; Orgal et al, 2012)。如何选取性腺质量好、精子活力高、精子抗冻能力强的亲本对棘皮动物精子超低温冷冻保存非常重要,如何评价和获取高质量的棘皮动物新鲜精子仍需进一步深入研究。
2.2 稀释剂的选择普遍认为,精液超低温保存所需稀释液必须具备的性质是抑制精子的活力、维持细胞电解质和渗透压的平衡(Graham et al, 1990; 刘清华, 2005)。在海洋鱼类和软体动物精子冷冻保存中,常使用无Ca2+的Hank's平衡盐溶液作为稀释剂,其具有抑制精子活化和优化精子渗透压的能力,有利于在冷冻前节省精子中的能量从而保持精子的质量(Dong et al, 2005a)。Ca2+被认为能够诱导精子的顶体反应,并能导致精子凝集(Paniagua-Chavez et al, 1998),但在棘皮动物精子冷冻保存研究中,人工海水或过滤自然海水作为稀释剂已被广泛应用(表 1),而其他成分的稀释剂研究鲜有发表。棘皮动物的精子是能被自然海水激活的,这显然违反了稀释液需满足抑制精子活力的性质。Gallego等(2014)分析了2种游泳者(河豚和欧洲鳗鱼)和2种无柄者(海胆和海鞘)海洋物种的精子运动参数和形态特征。结果显示,海胆等无柄者海洋物种的精子被激活后,精子活力能保持更长的时间(约45 min);Fabbrocini等(2017)研究表明,海胆精子在激活后可保持1 h的高活力,并保持相对运动活力达24 h。实验时,海水用量较少和精子激活后能维持较长时间的活力,可能是过滤自然海水或人工海水能够作为棘皮动物精子冷冻保存稀释剂的原因。但随着棘皮动物精子在稀释液中时间的延长,其质量会下降,在今后研究中,应继续了解棘皮动物精子的激活机制,发掘具有更好冷冻保存效果的稀释剂,从而延长精子的运动能力,提高冷冻保存后的精子质量。
|
|
表 1 海洋棘皮动物精子冷冻保存研究内容及结果总结 Tab.1 Summary of research contents and results in marine echinoderms sperm cryopreservation |
抗冻剂在精子超低温冷冻保存中非常重要,如果精子在冷冻保存中没有抗冻剂的保护,解冻后的精子质量极差,并可能呈粘稠状,无应用价值。抗冻剂按其穿透细胞膜的能力可分为渗透性抗冻剂(CPA)和非渗透性抗冻剂(co-CPA)(Dong et al, 2005b)。
2.3.1 渗透性抗冻剂渗透性抗冻剂能够快速穿透细胞膜,渗入细胞内部并与水和电解质结合,在细胞内产生一定的摩尔浓度,能够降低细胞内外未结冰电解质溶液的浓度、降低冰点、减少冰晶的形成,同时,能避免细胞内水分过分渗出造成细胞皱缩,从而导致容积损伤(刘清华, 2005; 杨培民等, 2008)。常用的渗透性抗冻剂包括二甲基亚砜(DMSO)、甲醇(METH)、乙二醇(EG)、丙二醇(PG)、二甲基乙酰胺(DMA)和甘油(GLY)等,其中,DMSO被极广泛应用于海洋鱼类和无脊椎动物精液超低温冷冻保存,这与DMSO对精子的冷冻保护效果好且适用于大多数物种的精子有关(Liu et al, 2015; Shao et al, 2006)。同时,DMSO也在棘皮动物精子冷冻保存中提供了良好的冷冻保护作用。DMSO作用的最适浓度范围一般是5%~20%,但Dunn等(1973)研究发现,DMSO在海星精子冷冻保存中的有效浓度范围是20%~30%,这可能是由于海星新鲜精液中精子浓度比较低,需要更多DMSO来起作用(表 1)。不同浓度的EG、PG、METH、DMA和二甲基甲酰胺(DMF)被用于棘皮动物精子冷冻保存研究,但其冷冻保护效果均不如DMSO (Shao et al, 2006; 表 1)。不同物种的精子具有特定的最适抗冻剂种类和浓度范围,这与其物种特异性有关。例如,Behlmer等(1984)研究发现,GLY比DMSO对鲎(Limulus polyphermus L.)的精液的保护效果更好;浓度为10%的GLY也为罗氏沼虾(Macrobrachium rosenbergii)精子提供了更成功的冷冻保存结果(Akarasanon et al, 2004)。GLY已更成功地应用于虾、蟹精子的冷冻保存,可能是由于GLY是虾、蟹动物脂代谢中的天然中间产物(Jeyalectumie et al, 1989)。但是,GLY却对海星、海胆、鲍鱼、牡蛎的精子具有毒害作用,浓度为5%~40%的GLY能够导致上述物种的精子活力在冷冻前急剧降低(Dunn et al, 1973)。PG能有效保护牡蛎和海胆精子,但其效果不及DMSO (Asahina et al, 1978)。
2.3.2 非渗透性抗冻剂(co-CPA)葡萄糖(GLU)、海藻糖(TRE)、蔗糖(SUC)、蛋黄(Yolk)、甘氨酸(Gly)、聚乙二醇(PEG)和胎牛血清(FBS)等co-CPA在精液超低温冷冻保存中也发挥着重要的作用。co-CPA的添加被发现可显著改善精子冷冻保存后的存活率,如胎牛血清的添加能够促进日本珍珠贝(Pincetada fucata martensii)精子解冻后的运动活力,可能与胎牛血清能减少冷冻过程中精子所受的渗透效应和离子效应以及增强精子抵抗冷冻损伤的能力有关(Kawamoto et al, 2007)。Acosta-Salmón等(2007)研究表明,单独使用海藻糖可达到与DMSO组合使用时相似的解冻后的精子活力。添加1%或2%的葡萄糖显著改善了解冻后澳洲绿边鲍鱼(Haliotis laevigata)精子的受精率(Liu et al, 2014b)。此外,Liu等(2014a、2014b)研究表明,甘氨酸在海洋软体动物的精子冷冻保存中起着积极的作用,已被优先选择作为冷冻保护介质。Dong等(2006)认为,co-CPA具有冷冻保护效果,与其能在冷冻保存过程中控制溶质的流入和流出来稳定精子膜有关,鸡蛋黄的作用主要是与精子膜相互作用,在冷冻过程中可以防止膜上脂类相态的变化以保护精子免受冷休克损伤;单糖的作用主要是与膜上磷脂相互作用,可维持膜的稳定性,促进细胞脱水,还能为精子的运动提供能量。
2.3.3 抗冻剂之间的组合为达到更好的精子冷冻保存效果,通常会将CPA与co-CPA组合搭配使用。Jeyalectumie等(1989)研究表明,海藻糖单独用于锯缘青蟹(Scylla serrata)精子冷冻保存时效果较差,而海藻糖与DMSO组合使用时,解冻后精子的活力显著增加。在虹鳟(Oncorhynchus mykiss)、细须石首鱼(Icropogonias undulatus)精液的低温保存中发现,DMSO与蔗糖或葡萄糖组合使用时,具有正协同保护效应(Gwo et al, 1991)。在棘皮动物精子超低温冷冻保存中,关于co-CPA以及CPA与co-CPA结合使用的研究相对较少(表 1)。不同物种有其最适种类或浓度的CPA和co-CPA,这一差别可能因为亲本来源的地理位置不同,从而产生了精子相关特征的遗传变异(Thurston et al, 2002; Dong et al, 2005b)。
2.4 精液稀释比例和平衡时间适宜的稀释比例和平衡时间对精子冷冻保存至关重要,在精子冷冻保存操作过程中,通常将冷冻保护液和精子按一定比例稀释混合并平衡一段时间,以达到用最适数量的冷冻精子实现最优冷冻保存结果的目的(Liu et al, 2015)。
2.4.1 稀释比例稀释比例是指精子和冷冻保护液在冷冻容器中的混合比例。稀释对精子冷冻保存非常重要,精子稀释程度低可能会导致解冻后精子发生有害凝集,而精子稀释程度高可能会导致精子能量的快速消耗、生理学改变以及精液中保护性成分减少,稀释程度的不当均可导致精子冻存后生存能力的下降(Paniagua-Chavez et al, 1998; Dong et al, 2005a)。Liu等(2015)研究指出,通过自然排精收集的精子浓度较小,其在超低温冷冻保存过程中的稀释倍数也较小,最大稀释倍数为1∶10。棘皮动物精子获取方式多为解剖收取性腺,获取精液的精子密度高,在超低温冷冻保存过程中的稀释倍数也较高。研究表明,棘皮动物精子冷冻保存最适的稀释比例范围是1∶3~ 1∶20 (Dunn et al, 1973; Asahina et al, 1978; Adams et al, 2004; Fabbrocini et al, 2014; Shao et al, 2006; Mizuno et al, 2019)。从不同个体性腺中取出新鲜精液的精子密度不同,若按照统一的稀释比例进行实验存在一定弊端,将精子稀释至特定浓度更能优化实验方案。Dong等(2006、2007)将太平洋牡蛎(Crassostrea gigas)精子稀释至1×109个/ml,Liu等(2014b)将绿边鲍鱼精子浓度稀释至1.6×108个/ml,更有效地开展、比较并优化了精子冷冻保存的相关实验方案。
2.4.2 平衡时间平衡时间是指精子与冷冻保护液接触混合至开始降温的时间段,平衡时间过短导致抗冻剂不能充分的进入精子细胞膜或与细胞膜结合,不能发挥其抗冻保护的作用;平衡时间过长,抗冻剂的毒害作用会对细胞造成不可逆转的损伤。在以往棘皮动物精子冷冻保存研究中,并没有考虑平衡时间这一因素对冷冻后保存效果的影响,在实验过程中,只设立了单一的平衡时间,没有设置对比,Mizuno等(2019)研究表明,平衡时间必须少于3 min,有的研究设置平衡时间为6~10 min(Shao et al, 2006; Fabbrocini et al, 2014),甚至为30 min (Dunn et al, 1973)。Zheng等(2018)选取珠母贝(Pinctada fucata martensii)为研究对象,研究了新鲜珠母贝精子在5种不同抗冻剂、5种浓度经历不同平衡时间作用后精子存活率的变化,并利用模型模拟提出了不同种类抗冻剂和不同抗冻剂浓度条件下应有的最大平衡时间,从而判定不同抗冻剂的毒性大小,并初步筛选排除出毒性大且不适用于精子冷冻保存的抗冻剂。
2.5 降温速率和解冻速率降温速率和解冻速率亦对精子冷冻保存至关重要。降温速率太慢、冷冻效率低,抗冻剂对细胞的毒性作用会加剧,细胞膜上的脂质分子在高浓度电解质溶液中时间太长也会遭受损伤;降温速率太快,细胞膜外的结冰速率会高于细胞内的结冰速率,造成细胞膜外的溶质浓度和渗透压比膜内越来越高,可能造成渗透休克和冰晶损伤、并对细胞产生不可逆影响。解冻速率太慢,重结晶现象会加剧冰晶对细胞膜和细胞器的机械损伤;解冻速率太快,对解冻操作要求高,需要在很短的时间内结束解冻,并且高温可能会对细胞产生热应激,造成不可逆影响(Liu et al, 2015)。因此,适宜的降温速率和解冻速率可以最低限度的降低冷冻保存过程对细胞造成的损伤。
2.5.1 降温速率在精子超低温冷冻保存研究中,控制降温速率的方法可分为非程序两步降温法和程序降温法。非程序两步降温法通常使用带架子的泡沫聚苯乙烯盒子等工具。首先将样品快速降到距液氮面某一高度处,停留一段时间,使细胞充分脱水以减少胞内冰晶的形成,然后,投入到液氮中长期保存。该方法通过调节样品距液氮面的高度来控制冷冻速率,并通过热电偶测其冷冻速率,具有设备成本低且易于现场操作的优点。目前,棘皮动物精子超低温冷冻保存相关研究均采用非程序两步降温法。例如,在对刺参精液的超低温冷冻保存研究中,Shao等(2006)通过控制样品距液氮液面的高度(2、4、6和8 cm)来调整降温速率为-77、-52、-35和-19℃/min,放置15 min后,立即投入液氮保存,发现当降温速率为-35℃/min时,精子解冻后的受精率最高(70%)。同样,Mizuno等(2019)控制样品距液氮液面的高度为(5~17.5 cm)来调整降温速率为-5.2~-65℃/min,将样品冷却至-50℃后,立即投入液氮保存,发现当降温速率为-10.4℃/min (距液氮液面高度15 cm)时,精子解冻后获得最高的受精率为(89.8±1.7)%,与新鲜精子的受精率[(92.7±1.8)%]无显著差异。对比不同的棘皮动物精子冷冻保存的研究发现,同样运用非程序两步降温法,不同研究得出的最适降温速率差异较大,如-5、-20和-50℃/min。Dunn等(1973)和Asahina等(1978)的研究均表明,适合海胆精子的降温速率约为-5℃/min,而Adams等(2004)通过实验对比却发现,降温速率-50℃/min对海胆精子的冷冻效果明显比-5℃/min效果好,其中的原因有物种及其生存环境的差异,也有研究所使用的降温装置及冷冻容器的不同。
程序降温法指通过程序降温仪等仪器预先设计的冷冻程序来控制样品的冷冻速率,然后将样品投入液氮中保存。此种方法操作简单、能精确控制并灵活改变降温速率及平衡时间,有利于深入研究降温速率对精子冷冻保存的影响,但仪器较为昂贵,方法不易普及。程序降温法在海洋鱼类和软体动物精子冷冻保存研究中有使用,但在棘皮动物中并未使用。作者认为应将程序降温法和非程序两步降温法结合使用,通过程序降温法找到合适的降温速率及降温终点温度,并以此设计适合的装置,通过非程序两步降温法在实验室或养殖场验证与应用。
2.5.2 解冻速率Liu等(2015)在海洋软体动物精子冷冻保存的解冻温度分为3个范围:低温(< 29℃)、中温(30℃~49℃)和高温(> 50℃)。按照此标准,以往棘皮动物精子冷冻保存研究的解冻温度属于中低温度,解冻温度从室温、15℃~45℃水浴不等(Dunn et al, 1973; Asahina et al, 1978; Adams et al, 2004; Fabbrocini et al, 2014; Shao et al, 2006; Mizuno et al, 2019)。解冻操作的一般步骤为将样品从液氮中取出,置于特定温度水浴解冻,轻轻摇动使温度均匀,待只剩少量固体时立即取出,在空气中继续摇动使其完全融化。作者认为适合某一物种精子冷冻保存的解冻温度应模拟其自然排精、受精时的温度,既保证了有合适的解冻速率,又能保证解冻温度不会对精子产生温度应激。本团队实验结果显示,解冻温度为20℃、37℃和50℃对刺参冷冻保存精子解冻后的活力影响不显著(P > 0.05,未发表数据),这与Anchordoguy等(1988)研究中不同解冻温度对海虾(Sicyonia ingentis)冷冻保存精子活力影响的结果相似。但利用受精温度作为解冻温度可能会影响解冻的速率,从而造成解冻时的反玻璃化和重结晶等冷冻损伤。目前,仍缺乏能够为棘皮动物乃至整个水生物种精子的冷冻保存选择合适解冻温度的理论,解冻过程应当成为以后研究的重点。
2.6 精子质量评价冷冻精子经解冻后应对其质量进行评价,评价精子质量的参数包括运动活力、形态变化、受精率、孵化率、细胞器完整性及代谢机能(图 1)。对冷冻精子进行全面系统的质量评价,并对比新鲜精子的相关参数,有利于进一步研究冷冻保存对精子的损伤机制。
2.6.1 运动活力和形态变化冷冻精子运动能力测试与前述新鲜精子的运动能力测试相一致,一般有使用光学显微镜统计样本中运动精子的百分比来直接测量和通过CASA系统测量2种方式,近几年,CASA系统由于其较高的准确性和效率而被广泛应用(van der Horst et al, 2018)。众多棘皮动物精子冷冻保存研究中并未使用CASA系统对冷冻保存后的精子进行活力检测,但Fabbrocini等(2017)利用CASA系统的特定分析模型对海胆(Paracentrotus lividus)的新鲜精子激活后不同时间的运动参数进行了详细评估,评估的精子运动参数包括精子存活率(TM,活动精子数占总精子数的百分比)、活力(RAP,快速前向运动精子占总精子数的百分比)、密度、存活时间、平均曲线运动速度(VCL, μm/s)、平均直线运动速度(VSL, μm/s)、平均路径速度(VAP, μm/s)、鞭打频率(BCF)、头部的侧摆幅度(ALH)等,并提出使用浓度为0.05%的胎牛血清(BSA)作为抗粘剂。该研究表明,海胆精子在激活后可保持1 h的高活力,并保持相对运动活力达24 h,比大多数鱼类精液稀释激活后保持高活力的时间更长,不需要抑制活力的过程。Fabbrocini等(2017)的研究为CASA系统在棘皮动物精子冷冻保存研究中的使用奠定基础,为棘皮动物激活后的精子在实验室研究中的应用提供数据支持。
对冷冻精子进行精子形态评估时,传统上是通过扫描或透射电子显微镜观察精子头部、中段、尾巴、顶体、线粒体和细胞核的变化。观察结果为了解冷冻保存对精子结构上的损伤提供了有效信息(Espinoza et al, 2010)。此外,CASA系统中的辅助形态分析模块还可协助区分精子的形态测量特性,进而提供有关精子冷冻保存后形态学变化及冷冻耐受能力的信息。目前,该技术已应用于山羊(Gravance et al, 1995),欧洲鳗鱼(Asturiano et al, 2007)和鹿(Esteso et al, 2009)等物种,但不适用于海洋软体动物,其对棘皮动物是否适用有待研究。
2.6.2 受精率和孵化率受精率和孵化率的检测,指测量精子与成熟卵子结合产生受精卵并正常发育的能力,是精子冷冻保存技术的关键步骤。冷冻精子的浓度以及精子与卵子的比率对于成功受精至关重要,较低或较高的浓度和精卵比都会影响受精率。冷冻保存后,大多数精子的顶体和质膜已经受损,受精能力显著降低(Kurokura et al, 1990; Bury et al, 1993)。Kurokura等(1989)研究表明,冷冻后的海胆精子只有5%~12%在形态上是正常的。Kurokura等(1990)研究表明,经冷冻后的牡蛎精子由于顶体被破坏,丧失了进入卵子的能力,精子聚集,导致受精率下降。冷冻保存精子的受精能力低于新鲜精子的受精能力,因此,受精实验中需要增加冷冻精子的数量。Adams等(2004)对海胆新鲜精子和冷冻精子的研究表明,为获得最大的受精率,所需新鲜精子浓度约为105/ml (卵子与精子的比例为1∶1000),而冷冻精子则至少需要106/ml的浓度(卵子与精子的比例为1∶10000)。Shao等(2006)也得到了同样的结果,其研究结果显示,刺参卵子与冷冻精子的比例为1∶10000时的受精率显著高于二者比例为1∶1000时的受精率(P < 0.05)。
2.6.3 流式细胞术与细胞器完整性电镜观察精子形态和受精率、检查精子活力等评估步骤执行较缓慢,相比较而言,流式细胞术具有在短时间内评估多个精子参数的优点。通过流式细胞仪和荧光显微镜,可对冷冻前后精子的质膜(SYB/PI染色,PMI)、线粒体膜电位[罗丹明123/碘化丙锭(PI)染色,MMP]、顶体(DND/PI染色,AI)和DNA(AO染色)等的完整性或损伤比例进行测定。如PI不能通过活细胞膜,只可透过受损的细胞膜对细胞核染色(呈红色),罗丹明123只可使线粒体功能完整的精子细胞着色(呈绿色),因此,通过罗丹明123/PI 2种染料进行荧光双染色及流式细胞仪观察,可检测冷冻解冻后精子膜和线粒体结构及功能的损伤状况(Adams et al, 2003)。Adams等(2004)利用流式细胞术比较了海胆精子在冻前冻后的细胞膜完整性和线粒体功能的变化情况,研究表明,较高浓度的DMSO在保留精子线粒体功能和膜完整性方面更为有效,但精子的线粒体功能和膜完整性对冻前冻后不同海胆个体精子间的受精能力基本无影响。
2.6.4 代谢机能精液经超低温保存后,由于膜的损伤会导致精子内的酶渗漏到细胞外,而导致胞内酶的活性降低,精浆中酶的活性却大大提高。超低温保存还会导致细胞内ATP水平的变化。冷冻前后精液中酶活性及水平的分析测定,不仅是评价低温保存成功与否的重要指标,也是用来确定细胞损伤部位、研究损伤机理的有效途径(Chauhan et al, 1994)。如果参与三羧酸循环的有关的酶活性降低并伴有水平的下降,则说明为精子提供能量的场所——线粒体受到损伤。常检测的酶主要有琥珀酸脱氢酶(SDH)、乳酸脱氧酶(LDH)、Na+/K+-ATP酶、超氧化物歧化酶(SOD)、过氧化氧酶(CAT)与谷胱甘肽还原酶(GR)等。现有的棘皮动物精子冷冻保存研究中尚未提及冷冻前后精子代谢机能的变化情况,下一步应借鉴鱼类精子冷冻保存方面的类似研究,将该指标纳入棘皮动物精子冷冻前后质量评价体系。
3 总结与展望综上所述,精子超低温冷冻保存技术已广泛应用于人类辅助生殖、畜牧和水生经济动物育种中。棘皮动物精子冷冻保存的研究内容相对滞后,此类研究中精子收集常用的方法是解剖获取性腺法;常用的稀释剂和抗冻剂分别为海水和DMSO;平衡时间、稀释比例、降温速率和解冻温度等因素在筛选过程中因实验条件不同而呈现多种结果。应继续借鉴鱼类、软体动物精子的超低温冷冻保存技术,不断丰富人们对超低温冷冻保存技术作用原理的认识,同时,根据棘皮动物精子自身的特点,重点研究稀释剂的选择、解冻过程和产业化应用等内容。基于上述棘皮动物精子冷冻保存研究进展,提出以下待解决的问题和建议。
3.1 获取高质量的新鲜精子高质量的新鲜精子是冷冻保存成功的先决条件,在进行超低温冷冻保存前,应保证所用新鲜精子具有低温冷冻价值。为解决这个问题,应建立一系列评价指标,在精子冷冻保存前,统计不同亲本个体的性腺指数、体重和年龄等参数,并检测新鲜精子的各项运动参数;用相同的冷冻保存技术流程对上述来自同物种不同个体的精子进行冷冻保存,并对冷冻保存的精子进行质量评价;将冷冻前亲本的性状参数及精子的运动参数与其相对应的冷冻保存精子质量评价结果相关联,筛选影响精子冷冻后质量的关键参数,做到从表型数据或新鲜精子的运动参数就能选择出高质量的精子。
3.2 开发新型抗冻剂抗冻剂在冷冻保存技术中发挥着至关重要的作用,相对来说,DMSO是目前最符合“低毒、高效”标准的抗冻剂,即使在低浓度下也能提高膜对ATP的渗透能力(Gironi et al, 2020)。应不断深入研究各种抗冻剂的保护机制,根据抗冻剂的保护原理及抗冻剂具备的生化特性,开发具备低毒、高效特点的新型抗冻剂,为规范化超低温冷冻保存提供更多的选择。
3.3 优化超低温冷冻保存技术流程超低温冷冻保存技术中每一种参数的筛选是相对繁琐的工作,如果对每一物种都进行重复的工作,费时费力。应不断加强相关的理论研究,如超低温冷冻对精子的损伤机制、抗冻剂对精子的保护机制、稀释剂抑制精子活力原理和精子激活机制等,在此基础上针对每一物种精子的特性,直接选择最适的稀释剂、渗透性抗冻剂、非渗透性抗冻剂,并设计最适的降温程序及解冻程序。
3.4 精子超低温冷冻保存技术原理的拓展和应用种质资源不仅只有精子,还包含卵子和胚胎等。应将精子冷冻保存技术的原理和经验与卵子和胚胎相关方面的原理和经验相结合,不断丰富超低温冷冻保存原理,并应用于生产实践,建立种质资源库。棘皮动物的卵子和胚胎能否有效冷冻?冷冻精子和冷冻卵子受精后,受精率和孵化率如何?通过冷冻整个性腺得到冷冻的精(卵)母细胞解冻后能否培养为成熟精(卵)子并有效应用?这一系列问题均有待解决。相信随着科学技术的发展,研究方法和手段的不断更新,超低温冷冻保存技术会越来越成熟,棘皮动物种质资源会得到有效的保护,可持续地为全人类提供更多优质蛋白质和皂苷等营养物质。
Acosta-Salmón H, Jerry DR, Southgate PC. Effects of cryoprotectant agents and freezing protocol on motility of black-lip pearl oyster (Pinctada margaritifera L.) spermatozoa. Cryobiology, 2007, 54(1): 13-18 DOI:10.1016/j.cryobiol.2006.10.189 |
Adams SL, Hessian PA, Mladenov PV. Cryopreservation of sea urchin (Evechinus chloroticus) sperm. CryoLetters, 2004, 25(4): 287-299 |
Adams SL, Hessian PA, Mladenov PV. Flow cytometric evaluation of mitochondrial function and membrane integrity of marine invertebrate sperm. Invertebrate Reproduction and Development, 2003, 44(1): 45-51 DOI:10.1080/07924259.2003.9652552 |
Akarasanon K, Damrongphol P, Poolsanguan W. Long-term cryopreservation of spermatophore of the giant freshwater prawn, Macrobrachium rosenbergii (de Man). Aquaculture Research, 2004, 35(15): 1415-1420 DOI:10.1111/j.1365-2109.2004.01163.x |
Anchordoguy T, Crowe JH, Griffin FJ, et al. Cryopreservation of sperm from the marine shrimp sicyonia ingentis. Cryobiology, 1988, 25(3): 238-243 DOI:10.1016/0011-2240(88)90031-4 |
Anger JT, Gilbert BR, Goldstein M. Cryopreservation of sperm: Indications, methods and results. Journal of Urology, 2003, 170(4): 1079-1084 |
Asahina E, Takahashi T. Freezing tolerance in embryos and spermatozoa of sea urchin. Cryobiology, 1978, 15(1): 122-127 DOI:10.1016/0011-2240(78)90016-0 |
Asturiano JF, Marco-Jiménez F, Peñaranda DS, et al. Effect of sperm cryopreservation on the European eel sperm viability and spermatozoa morphology. Reproduction in Domestic Animals, 2007, 42(2): 162-166 DOI:10.1111/j.1439-0531.2006.00746.x |
Behlmer SD, Brown G. Viability of cryopreserved spermatozoa of the horseshoe crab, Limulus polyphermus L. International Journal of Invertebrate Reproduction and Development, 1984, 7: 193-199 DOI:10.1080/01688170.1984.10510089 |
Bhakat M, Mohanty TK, Raina VS, et al. Frozen semen production performance of murrah buffalo bulls. Buffalo Bulletin, 2011, 30(2): 157-162 |
Bhavanishankar S, Subramoniam T. Cryopreservation of spermatozoa of the edible mud crab Scylla serrata (Forskal). Journal of Experimental Zoology, 1997, 277(4): 326-336 DOI:10.1002/(SICI)1097-010X(19970301)277:4<326::AID-JEZ6>3.0.CO;2-R |
Bordbar S, Anwar F, Saari N. High-value components and bioactives from sea cucumbers for functional foods-A review. Marine Drugs, 2011, 9(10): 1761-1805 DOI:10.3390/md9101761 |
Bury NR, Olive PJW. Ultrastructural observations on membrane changes associated with cryopreserved spermatozoa of 2 polychaete species and subsequent mobility induced by quinacine. Invertebrate Reproduction and Development, 1993, 23(2-3): 139-150 DOI:10.1080/07924259.1993.9672305 |
Chauhan MS, Kapila R, Gandhi KK, et al. Acrosome damage and enzyme leakage of goat spermatozoa during dilution, cooling and freezing. Andrologia, 1994, 26(1): 21-26 |
Coloma MA, Toledano-Diaz A, Castano C, et al. Seasonal variation in reproductive physiological status in the Iberian ibex (Capra pyrenaica) and its relationship with sperm freezability. Theriogenology, 2011, 76(9): 1695-1705 DOI:10.1016/j.theriogenology.2011.07.001 |
Dong QX, Eudeline B, Huang CJ, et al. Commercial-scale sperm cryopreservation of diploid and tetraploid Pacific oysters, Crassostrea gigas. Cryobiology, 2005a, 50(1): 1-16 DOI:10.1016/j.cryobiol.2004.09.003 |
Dong QX, Huang CJ, Eudeline B, et al. Cryoprotectant optimization for sperm of diploid Pacific oysters by use of commercial dairy sperm freezing facilities. Aquaculture, 2007, 271(1-4): 537-545 DOI:10.1016/j.aquaculture.2007.07.005 |
Dong QX, Huang CJ, Eudeline B, et al. Systematic factor optimization for sperm cryopreservation of tetraploid Pacific oysters, Crassostrea gigas. Theriogenology, 2006, 66(2): 387-403 DOI:10.1016/j.theriogenology.2005.12.004 |
Dong QX, Huang CJ, Eudeline B, et al. Systematic factor optimization for cryopreservation of shipped sperm samples of diploid Pacific oysters, Crassostrea gigas. Cryobiology, 2005b, 51(2): 176-197 DOI:10.1016/j.cryobiol.2005.06.007 |
Dunn RS, McLachlan J. Cryopreservation of echinoderm sperm. Canadian Journal of Zoology, 1973, 51(6): 666-669 DOI:10.1139/z73-100 |
Espinoza C, Valdivia M, Dupré E. Morphological alterations in cryopreserved spermatozoa of scallop Argopecten purpuratus. Latin American Journal of Aquatic Research, 2010, 38(1): 121-127 DOI:10.3856/vol38-issue1-fulltext-11 |
Esteso MC, Fernandez-Santos MR, Soler AJ, et al. Identification of sperm-head morphometric subpopulations in Iberian red deer epididymal sperm samples. Reproduction in Domestic Animals, 2009, 44(2): 206-211 DOI:10.1111/j.1439-0531.2007.01029.x |
Fabbrocini A, D'Adamo R, Pelosi S, et al. Gamete cryobanks for laboratory research: Developing a rapid and easy-to-perform protocol for the cryopreservation of the sea urchin Paracentrotus lividus (Lmk, 1816) spermatozoa. Cryobiology, 2014, 69(1): 149-156 DOI:10.1016/j.cryobiol.2014.06.009 |
Fabbrocini A, D'Adamo R. Motility of sea urchin Paracentrotus lividus spermatozoa in the post-activation phase. Aquaculture Research, 2017, 48(11): 5526-5532 DOI:10.1111/are.13373 |
Gallego V, Peréz L, Asturiano JF, et al. Sperm motility parameters and spermatozoa morphometric characterization in marine species: A study of swimmer and sessile species. Theriogenology, 2014, 82(5): 668-676 DOI:10.1016/j.theriogenology.2014.05.026 |
Gironi B, Kahveci Z, McGill B, et al. Effect of DMSO on the mechanical and structural properties of model and biological membranes. Biophysical Journal, 2020, 119(2): 274-286 DOI:10.1016/j.bpj.2020.05.037 |
Graham JK, Kunze E, Hammerstedt RH. Analysis of sperm cell viability, acrosomal integrity, and mitochondrial-function using flow-cytometry. Biology of Reproduction, 1990, 43(1): 55-64 DOI:10.1095/biolreprod43.1.55 |
Gravance CG, Lewis KM, Casey PJ. Computer automated sperm head morphometry analysis (ASMA) of goat spermatozoa. Theriogenology, 1995, 44(7): 989-1002 DOI:10.1016/0093-691X(95)00286-H |
Gwo JC, Chen CW, Cheng HY. Semen cryopreservation of small abalone (Haliotis diversicolor supertexa). Theriogenology, 2002, 58(8): 1563-1578 DOI:10.1016/S0093-691X(02)01055-5 |
Gwo JC, Strawn K, Longnecker MT, et al. Cryopreservation of Atlantic croaker spermatozoa. Aquaculture, 1991, 94(4): 355-375 DOI:10.1016/0044-8486(91)90179-B |
Jalali A, Crawford B. A freezing technique that maintains viability of sperm from the starfish Pisaster ochraceus. Invertebrate Reproduction and Development, 2012, 56(3): 242-248 DOI:10.1080/07924259.2011.601125 |
Janett F, Thun R, Bettschen S, et al. Seasonal changes of semen quality and freezability in Franches-Montagnes stallions. Animal Reproduction Science, 2003, 77(3-4): 213-221 DOI:10.1016/S0378-4320(03)00039-3 |
Jeyalectumie C, Subramoniam T. Cryopreservation of spermatophores and seminal plasma of the edible crab Scylla serrata. Biological Bulletin, 1989, 177(2): 247-253 DOI:10.2307/1541940 |
Kawamoto T, Narita T, Isowa K, et al. Effects of cryopreservation methods on post-thaw motility of spermatozoa from the Japanese pearl oyster, Pinctada fucata martensii. Cryobiology, 2007, 54(1): 19-26 DOI:10.1016/j.cryobiol.2006.10.190 |
Kurokura H, Namba K, Ishikawa T. Lesions of spermatozoa by cryopreservation in oyster Crassostrea gigas. Nippon Suisan Gakkaishi, 1990, 56(11): 1803-1806 DOI:10.2331/suisan.56.1803 |
Kurokura H, Yagi N, Hirano R. Studies on cryopreservation of sea urchin sperm. Aquaculture Science, 1989, 37(3): 215-219 |
Liao YL, Xiao N. Species composition and faunal characteristics of echinoderms in China seas. Biodiversity Science, 2011, 19(6): 729-736 [廖玉麟, 肖宁. 中国海棘皮动物的种类组成及区系特点. 生物多样性, 2011, 19(6): 729-736] |
Liu QH. Study on spermatozoa cuyopreservation and cryodamage in Red Seabream (Pagrosomus major). Masterxs Thesis of Ocean University of China, 2005 [刘清华. 真鲷(Pagrosomus major)精液超低温保存及其低温损伤研究. 中国海洋大学硕士研究生学位论文, 2005]
|
Liu YB, Li XX, Robinson N, et al. Sperm cryopreservation in marine mollusk: A review. Aquaculture International, 2015, 23(6): 1505-1524 DOI:10.1007/s10499-015-9900-0 |
Liu YB, Li XX, Xu T, et al. Improvement in non-programmable sperm cryopreservation technique in farmed greenlip abalone Haliotis laevigata. Aquaculture, 2014a, 434: 362-366 DOI:10.1016/j.aquaculture.2014.08.033 |
Liu YB, Xu T, Robinson N, et al. Cryopreservation of sperm in farmed Australian greenlip abalone Haliotis laevigata. Cryobiology, 2014b, 68(2): 185-193 DOI:10.1016/j.cryobiol.2014.01.002 |
Lyons L, Jerry DR, Southgate PC. Cryopreservation of black-lip pearl oyster (Pinctada margaritifera, L. ) spermatozoa: Effects of cryoprotectants on spermatozoa motility. Journal of Shellfish Research, 2005, 24(4): 1187-1190 |
Mizuno Y, Fujiwara A, Yamano K, et al. Motility and fertility of cryopreserved spermatozoa of the Japanese sea cucumber Apostichopus japonicus. Aquaculture Research, 2019, 50(1): 106-115 DOI:10.1111/are.13872 |
Mocé E, Vicente JS. Rabbit sperm cryopreservation: A review. Animal Reproduction Science, 2009, 110(1-2): 1-24 DOI:10.1016/j.anireprosci.2008.08.015 |
Orgal S, Zeron Y, Elior N, et al. Season-induced changes in bovine sperm motility following a freeze-thaw procedure. Journal of Reproduction and Development, 2012, 58(2): 212-218 DOI:10.1262/jrd.10-149N |
Paniagua-Chavez CG, Buchanan JT, Tiersch TR. Effect of extender solutions and dilution on motility and fertilizing ability of eastern oyster sperm. Journal of Shellfish Research, 1998, 17(1): 231-237 |
Paniagua-Chavez CG, Tiersch TR. Laboratory studies of cryopreservation of sperm and trochophore larvae of the eastern oyster. Cryobiology, 2001, 43(3): 211-223 DOI:10.1006/cryo.2001.2346 |
Pawson DL. 2007. Phylum Echinodermata. Zootaxa, 1668, 749-764 |
Qi WS, Jiang J, Tian YS, et al. Sperm cryopreservation of kelp grouper Epinephelus moara. Progress in Fishery Sciences, 2014, 35(1): 26-33 [齐文山, 姜静, 田永胜, 等. 云纹石斑鱼精子冷冻保存. 渔业科学进展, 2014, 35(1): 26-33 DOI:10.3969/j.issn.1000-7075.2014.01.004] |
Rozati H, Handley T, Jayasena C. Process and pitfalls of sperm cryopreservation. Journal of Clinical Medicine, 2017, 6(9): 1-13 |
Shao MY, Zhang ZF, Yu L, et al. Cryopreservation of sea cucumber Apostichopus japonicus (Selenka) sperm. Aquaculture Research, 2006, 37(14): 1450-1457 DOI:10.1111/j.1365-2109.2006.01581.x |
Sharma R, Kattoor AJ, Ghulmiyyah J, et al. Effect of sperm storage and selection techniques on sperm parameters. Systems Biology in Reproductive Medicine, 2015, 61(1): 1-12 DOI:10.3109/19396368.2014.976720 |
Thurston LM, Watson PF, Holt WV. Semen cryopreservation: A genetic explanation for species and individual variation?. CryoLetters, 2002, 23(4): 255-262 |
Tian YS, Chen SL, Ji XS, et al. Cryopreservation of tongue sole Cynoglossus semilaevis sperm. Progress in Fishery Sciences, 2009, 30(6): 97-102 [田永胜, 陈松林, 季相山, 等. 半滑舌鳎精子冷冻保存. 渔业科学进展, 2009, 30(6): 97-102] |
Tian YS, Tang J, Ma WH, et al. Development and growth of hybrid offspring of brown grouper Epinephelus fuscoguttatus (♀)×blue speckled grouper Epinephelus tulcula (♂) using cryopreserved sperm. Progress in Fishery Sciences, 2019, 40(6): 36-47 [田永胜, 唐江, 马文辉, 等. 蓝身大斑石斑鱼冷冻精子(♂)与棕点石斑鱼(♀)杂交后代发育及生长特征分析. 渔业科学进展, 2019, 40(6): 36-47] |
Tsai S, Lin C. Advantages and applications of cryopreservation in fisheries science. Brazilian Archives of Biology and Technology, 2012, 55(3): 425-433 DOI:10.1590/S1516-89132012000300014 |
van der Horst G, Bennett M, Bishop JDD. CASA in invertebrates. Reproduction Fertility and Development, 2018, 30(6): 907-918 DOI:10.1071/RD17470 |
Vitiello V, Carlino PA, Del Prete F, et al. Effects of cooling and freezing on the motility of Ostrea edulis (L., 1758) spermatozoa after thawing. Cryobiology, 2011, 63(2): 118-124 DOI:10.1016/j.cryobiol.2011.07.004 |
Wang YG, Rong XJ, Liao MJ, et al. Technical monograph for health culture and disease control of sea cucumber. Beijing: China Agriculture Press, 2014 [王印庚, 荣小军, 廖梅杰, 等. 刺参健康养殖与病害防控技术丛解. 北京: 中国农业出版社, 2014]
|
Yang PM, Yang AG, Liu ZH, et al. Ultrastructure and cryodamage studies of Patinopecten yessoensis sperm by electron microscopy. Marine Fisheries Research, 2008, 29(1): 98-102 [杨培民, 杨爱国, 刘志鸿, 等. 虾夷扇贝精子形态结构和超低温冷冻损伤的电镜观察. 海洋水产研究, 2008, 29(1): 98-102] |
Zheng X, Gu ZF, Huang ZW, et al. The effects of cryoprotectants on sperm motility of the Chinese pearl oyster, Pinctada fucata martensii. Cryobiology, 2018, 82: 64-69 DOI:10.1016/j.cryobiol.2018.04.007 |




