多氯联苯(polychlorinated biphenyls, PCBs)是国际上广泛存在的一大类人为污染物,共有209种具有不同理化和毒理学性质的同系物(Grilo et al, 2014),对生物内分泌、神经、免疫和生殖系统等均能产生生理毒性。多氯联苯可以通过废弃的工业设备以及建筑材料等释放到环境中,广泛存在于大气、土壤和水环境中,从而对环境造成了潜在的威胁(Kohler et al, 2005; Hassan, 2018)。尽管自20世纪70年代,国际上普遍禁止多氯联苯的使用,但由于其理化性质稳定、不易降解的特点,在大多数工业化国家,多氯联苯不仅仍然存在于环境中,而且还可以通过食物网迁移、积累和生物放大(Freitag et al, 1982; Ulbrich et al, 2004)。由于多氯联苯的疏水性和低降解性,相对于水环境中的浓度,多氯联苯可在生物群中累积数千或数万倍的浓度,从而对从浮游植物到海洋哺乳动物等多种物种产生毒理学影响(Song et al, 2012; Filipkowska, 2013)。PCB153(2, 2ʹ, 4, 4ʹ, 5, 5ʹ-六氯联苯)属于非二噁英类(非共面)同类物(胡芳等, 2012; 陈曦, 2014),是人体脂肪组织中含量最多的PCBs之一,与人类关系密切(Duartedavidson et al, 1994; Kimbrogh, 1995; Ghosh et al, 2003)。六氯联苯是常见的环境内分泌干扰物之一,能够使生物体多巴胺、雌激素等代谢异常,扰乱免疫系统。六氯联苯在我国东海岸水体中污染程度较高(徐添翼等, 2016)。梅婕(2014)通过探究Cd-PCB153对海水青鳉(Oryzias melastigma)仔鱼的影响时发现,随着水中Cd-PCB153浓度的增大,鱼体中Cd-PCB153浓度增大,RNA/DNA和Shh基因相对表达量降低。韩现芹等(2019)探究PCB153对半滑舌鳎(Cynoglossus semilaevis)抗氧化酶影响时发现,暴露24 h和48 h时,半滑舌鳎体内超氧化物歧化酶(SOD)活性呈先诱导后抑制的趋势。李娜(2012)研究PCBs在水生食物链中生物毒性及富集效应,发现大型蚤(Daphnia magna)、斑马鱼(Brachydanio rerio var)体内的PCBs主要来源于摄食食物藻类等,在探究PCB153对蛋白核小球藻(Chlorella pyrenoidosa)、斜生栅藻(Scenedesmus obliquus)的影响时发现,PCB153对藻细胞内的叶绿素a、b等均有抑制作用,低浓度PCB153可提高2种微藻的SOD活性,高浓度PCB153抑制2种微藻的SOD活性。
微藻是一种指示生物,常用指标有生长速率、细胞密度和叶绿素含量等,这些指标具有可靠、快速和重复性好等优点,常被用于评价水体中重金属和其他新型污染物的毒性,是进行环境风险评价和确定水环境中有毒化学物质释放限值的重要依据(Monteiro et al, 2011; Stauber et al, 2011; Ebenezer et al, 2013)。目前,常用的淡水微藻主要有淡水小球藻(Chlorella vulgaris)、羊角月牙藻(Pseudokirchneriella subcapitata)和四尾栅藻(Scenedesmus quadricauda)等。海洋微藻是海洋生物食物链(网)的基础,微藻细胞所吸附或积累的PCB153可通过海洋食物链在高营养级生物体内富集,最终进入人体产生危害(迟潇等, 2019)。目前,关于多氯联苯对海洋微藻的研究相对较少。
本研究选择我国海域常见的海洋微藻——湛江叉鞭金藻(Dicrateria zhanjiangensis)为研究对象,进行PCB153胁迫实验,通过分析其生长、光合色素含量、抗氧化、解毒相关指标及藻细胞超微结构的变化规律,探究湛江叉鞭金藻对六氯联苯的生理生态响应规律,为评估多氯联苯对海洋生态系统造成的生态风险的基础研究提供依据,为探究多氯联苯对水生食物链中的影响积累数据,同时,为微藻在海洋环境风险评估和有机污染物生物防治中的应用提供科学参考。
1 材料与方法 1.1 实验材料实验所用湛江叉鞭金藻由天津市水产生态及养殖重点实验室提供。PCB153购自德国Dr. Ehrenstorfer GmbH公司,使用90%丙酮助溶,超纯水稀释,配制成100 mg/L储备液待用。SOD、谷胱甘肽S-转移酶(GST)活性试剂盒、丙二醛(MDA)含量试剂盒均购自北京索莱宝科技有限公司。
1.2 实验方法 1.2.1 湛江叉鞭金藻的培养方法湛江叉鞭金藻培养用水为正常海水,盐度为30,培养基为f/2培养基,光照培养箱中培养,培养温度为(26±1)℃,光暗周期12 h∶12 h,光照强度为2500 lx。每天摇动锥形瓶3次,并随机更换位置保证其受光照均匀。
1.2.2 毒性实验根据预实验结果,正式实验设置空白对照组(CK)、丙酮对照组(AT)及PCB153浓度分别为1、5、25、50、125和250 μg/L的胁迫组,丙酮对照组的丙酮浓度与最高浓度实验组丙酮浓度一致,为0.125 μL/mL。每组3个平行,所用容器为500 mL三角烧瓶,藻液体积为300 mL,实验藻初始密度为1.28×106 cell/mL,实验共进行7 d,每天取5 mL藻液测定其生物量;并在胁迫初期(3 d),测定其叶绿素a、叶绿素c和类胡萝卜素的含量,并分别取空白对照组、5 μg/L和250 μg/L处理组藻液20 mL进行电镜观察;在实验结束时(7 d),取剩余藻液,测定其SOD、GST活性和MDA含量。
1.2.3 测定方法藻细胞密度的测定方法采用血球计数板法(张士璀等, 1997),每天17:00每组取5 mL藻液,用血球计数板在显微镜下计数,每个样品计数3次,取平均值。
相对生长速率(relative growth rate)公式:
| $\mu ({\rm{ln}}N - {\rm{ln}}{N_0})/(t - {t_0}) $ |
式中,N和N0分别为t时刻和初始(t0时刻)藻密度。
实验结束时(7 d),采用Jeffrey分光光度法(帕森斯, 1989)测定藻液色素含量。公式如下:
| $叶绿素a({C_a}):{\rm{ \mathsf{ ρ} Chl}}{\rm{.}}a = 11.85{E_{664}} - 1.54{E_{647}} - 0.08{E_{630}} $ |
| $叶绿素a({C_c}):{\rm{ \mathsf{ ρ} Chl}}{\rm{.}}c = 24.52{E_{630}} - 1.677{E_{664}} - 7.6{E_{647}} $ |
| $类胡萝卜素:{\rm{ \mathsf{ ρ} Cp = 7}}{\rm{.6(}}{E_{480}} - 1.49{E_{510}}) $ |
式中,E是上述不同波长下所测的消光值(以750 nm读数校正后)(朱永梅等, 2017)。
SOD活性单位定义为在黄嘌呤氧化酶藕联反应体系中抑制百分50%时,反应体系中的SOD活力定义为1个酶活力单位。GST活性单位定义为在25℃中,每104个细胞每分钟催化1 μmol CDNB与GSH结合为1个酶活单位。
1.2.4 数据分析实验数据采用平均值±标准差(Mean±SD)表示,使用SigmaPlot 12.0绘图,并使用SPSS 19.0软件进行单因素方差分析(one-way ANOVA)和Duncanxs多重比较,P < 0.05表示差异显著。
2 结果 2.1 PCB153对湛江叉鞭金藻生长的影响PCB153对湛江叉鞭金藻生长的影响如图 1所示。实验期间,空白对照组与丙酮对照组之间细胞密度变化趋势基本一致,二者无显著差异(P > 0.05)。PCB153胁迫1 d,各处理组细胞密度均呈升高趋势,胁迫2 d,250 μg/L处理组藻密度开始下降,且随着胁迫时间的延长细胞密度下降程度增加,至5 d时,细胞密度降为零,藻细胞全部死亡。在相同的时间点,除1 μg/L组以外,其余各胁迫组细胞密度均低于空白对照组,并随着PCB153浓度的增大,密度差增加。实验期间,1 μg/L PCB153胁迫组的相对增长率略高于空白对照组和丙酮对照组,但三者之间差异不显著(P > 0.05)。其余各胁迫组(5~125 μg/L)的相对增长率随着PCB153浓度的增加呈明显递减趋势,其相对生长率均显著低于空白对照组(P < 0.05)。
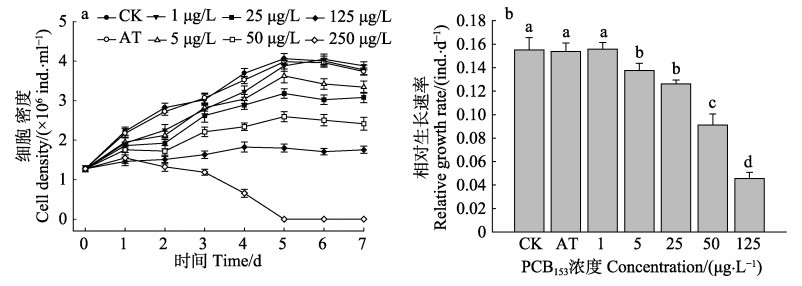
|
图 1 PCB153对湛江叉鞭金藻生长(a)和相对生长率(b)的影响 Fig.1 Effect of PCB153 on growth (a) and relative growth rate (b) of D. zhanjiangensis CK:空白对照组;AT:丙酮对照组。图中不同字母表示差异显著(P < 0.05) CK: Control check; AT: Acetone test. Different letters indicate significant difference (P < 0.05) |
PCB153对湛江叉鞭金藻光合色素含量的影响如图 2所示。实验期间,空白对照组与丙酮对照组之间的叶绿素a、叶绿素c、类胡萝卜素和总光合色素含量无显著差异(P > 0.05)。在实验浓度范围内,叶绿素a、叶绿素c、类胡萝卜素和总光合色素含量均随着PCB153胁迫浓度的增加而显著降低。与空白对照组相比,PCB153胁迫组(1~125 μg/L)叶绿素a分别下降了31.07%、47.72%、44.96%、45.03%和57.70%。与空白对照组相比,PCB153胁迫组(1~125 μg/L)叶绿素c分别下降了15.70%、13.36%、35.61%、35.00%和44.81%,均显著低于空白对照组(P < 0.05)。叉鞭金藻类胡萝卜素含量随PCB153胁迫浓度增加而降低,与空白对照组相比,PCB153胁迫组(1~125 μg/L)类胡萝卜素分别下降了8.38%、16.89%、32.00%、44.10%和46.68%。低浓度组(1~5 μg/L)的类胡萝卜素含量降低趋势较缓,与空白对照组相比,无显著差异(P > 0.05)。在5~50 μg/L范围内,类胡萝卜素含量随胁迫浓度升高而显著降低(P < 0.05),当浓度高于50 μg/L时,类胡萝卜素含量降低趋势变缓。与空白对照组相比,PCB153胁迫组(1~125 μg/L)总光合色素含量分别下降22.60%、33.42%、40.00%、46.78%和52.49%。低浓度PCB153(1~5 μg/L)胁迫组的总光合色素含量随PCB153浓度的升高而显著降低(P < 0.05);当浓度高于5 μg/L时,总光合色素含量虽然随PCB153浓度升高而降低,但各组之间差异不显著(P > 0.05)。

|
图 2 PCB153对湛江叉鞭金藻光合色素含量的影响 Fig.2 Effect of PCB153 on the content of photosynthetic pigment in D. zhanjiangensis |
PCB153对湛江叉鞭金藻SOD、GST活性和MDA含量的影响如图 3所示。不同浓度PCB153胁迫对湛江叉鞭金藻SOD活性和MDA含量均有显著影响(P < 0.05)。实验期间,空白对照组与丙酮对照组的SOD活性和MDA含量均无显著差异(P > 0.05)。在1~25 μg/L胁迫组中,SOD活性随PCB153浓度的升高而显著升高,25 μg/L胁迫组的SOD活性为空白对照组的2倍,显著高于其他处理组(P < 0.05)。当PCB153浓度升高至50 μg/L和125 μg/L时,SOD活性则显著下降,分别降低至空白对照组的65.19%和59.04%,显著低于其他处理组(P < 0.05)。PCB153胁迫后,湛江叉鞭金藻的MDA含量显著升高(P < 0.05),且随着胁迫浓度的升高而升高,各胁迫组(1~125 μg/L)的MDA含量分别升高29.89%、41.35%、66.43%、102.91%和124.72%。

|
图 3 PCB153对湛江叉鞭金藻抗氧化和解毒相关指标的影响 Fig.3 Effect of PCB153 on indexes related to antioxidation and detoxification of D. zhanjiangensis |
丙酮对照组与空白对照组的GST活性无显著差异(P > 0.05)。低浓度PCB153(1~25 μg/L)胁迫下,GST活性显著升高(P < 0.05),而高浓度PCB153(50~125 μg/L)胁迫下,GST活性显著降低(P < 0.05)。
2.4 PCB153对湛江叉鞭金藻超微结构的影响PCB153对湛江叉鞭金藻超微结构的影响如图 4所示。对照组藻细胞的细胞膜完整,细胞器结构完整,细胞质基质分布较为均匀(图 4a)。PCB153胁迫3 d后,5 μg/L胁迫组藻细胞形态略有变化,其细胞膜变形,但未见明显缺损,“杯形”色素体聚缩,细胞质基质较为松散、不均匀(图 4b);250 μg/L胁迫组藻细胞形态有明显的变化,细胞膜破裂、缺损,“杯形”色素体等解体,甚至已经与细胞质基质融为一体,并随细胞质基质流出细胞(图 4c)。随PCB153的浓度增大,细胞膜变化越来越明显,最终由于细胞膜的不完整性导致细胞自溶死亡。
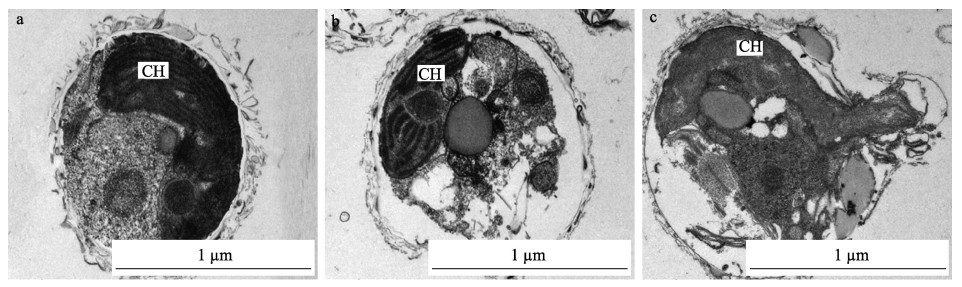
|
图 4 PCB153对湛江叉鞭金藻超微结构的影响 Fig.4 Effect of PCB153 on the ultrastructure of D. zhanjiangensis a:对照组;b:5 μg/L;c:250 μg/L。CH:“杯形”色素体 a: Control group; b: 5 μg/L; c: 250 μg/L. CH: Cup-shaped plastid |
藻类生长指标可以客观反映藻细胞的生长状况,同时,也间接反映了水质的状况,可以通过检测水体中藻类的生长指标来监测该区域该段时间的水质状况。吴越等(2017)研究发现,PCB138对牟氏角毛藻(Chaetoceros muelleri)和亚心形扁藻(Platymonas subcordiformis)有明显的抑制作用,0.01 mg/L PCB138胁迫24 h后,牟氏角毛藻开始出现显著生长抑制(P < 0.05),0.1 mg/L PCB138胁迫下,亚心形扁藻细胞密度显著低于对照组(P < 0.05)。聂湘平等(2002)研究发现,PCB1254浓度高于10 ng/mL时,蛋白核小球藻和斜生栅藻生长缓慢,甚至呈负增长。本研究中,PCB153对湛江叉鞭金藻生长有明显的抑制作用,在浓度较低(< 5 μg/L)时,PCB153对湛江叉鞭金藻生长的抑制作用相对较小;浓度较高(> 5 μg/L)时,PCB153对湛江叉鞭金藻的抑制作用较为明显,且随着浓度增大和胁迫时间的延长,PCB153对湛江叉鞭金藻生长的抑制作用明显增强,甚至出现负增长。王向艺(2012)研究表明,叉鞭金藻的生长随原油浓度的增大而抑制作用明显增大,可能是因为叉鞭金藻没有细胞壁包被,抵抗外界有毒物质的能力较弱。细胞膜脂质过氧化引起的膜损伤是环境污染物抑制微藻生长的重要原因(岳文洁等, 2009; Fu et al, 2013)。本研究中,PCB153对湛江叉鞭金藻生长有显著的抑制作用(P < 0.05),可能与湛江叉鞭金藻没有细胞壁保护、细胞膜脂质过氧化有关。
3.2 PCB153对湛江叉鞭金藻光合色素的影响光合色素是藻类光合作用进行吸收、传递、转化光能的物质基础,光合色素质量浓度可以较好地反映植物光合生理能力、各阶段的生长发育状况,同时,也是反映环境胁迫状况的重要指标(张锦华等, 2016; Geoffroy et al, 2003; 刘碧云等, 2006)。藻类体内的光合色素按化学结构分为叶绿素、类胡萝卜素和藻胆蛋白(方小丹, 2012)。其中,湛江叉鞭金藻内主要含有叶绿素a、叶绿素c、类胡萝卜素等(Jeffrey et al, 1997)。光合反应中心主要成分为叶绿素a,大部分的叶绿素a吸收和传递光能(Taiz et al, 2006; Ston et al, 2000)。叶绿素a是捕光色素复合体的重要组成部分,可以作为光合电子传递链的电子供体参与光合作用系统的反应(Rontani et al, 1994、2001; 张丽, 2015)。类胡萝卜素是光系统中的辅助捕光色素,是光合色素的一部分;同时,也是内源抗氧化剂,具有抗氧化的作用,是细胞内活性氧清除系统中非酶促系列的重要组成部分,具有保护叶绿素和光合机能的作用(胡单等, 2011; 黄彬城等, 2006; 秦天才等, 2000; 张锦华等, 2016; 张浩等, 2019)。叶绿素c具有吸收传递太阳能的作用,由于湛江叉鞭金藻无叶绿素b,叶绿素c替代叶绿素b主要捕获水中蓝光和绿光(Katoh et al, 1989)。总光合色素体现出来的是金藻细胞进行最优光合作用所有色素的动态平衡,可以直接反应出光合作用的状态(张丽, 2015)。李娜(2012)研究发现,在PCB153胁迫下,蛋白核小球藻和斜生栅藻细胞中叶绿素a是最先受到显著抑制的。本研究中,湛江叉鞭金藻受PCB153胁迫后,叶绿素a最先产生显著下降,随后,叶绿素c、类胡萝卜素出现显著下降(P < 0.05)。相比叶绿素c和类胡萝卜素,湛江叉鞭金藻叶绿素a对PCB153胁迫更为敏感。这可能是由于PCB153对湛江叉鞭金藻光合作用的抑制是先通过抑制叶绿素a的合成,从而抑制藻细胞正常的生长,促进了藻细胞的衰老、死亡(牧辉等, 2009; 聂湘平等, 2007)。随着PCB153浓度的增大,类胡萝卜素含量下降,藻细胞色素的捕光能力减弱,抗氧化能力和光合作用机能下降。随着PCB153浓度的增大,叶绿素c含量不断减少,藻细胞光合作用过程中捕获蓝光、绿光能力下降,吸收传递太阳能的能力也不断下降,光合作用受到严重影响。随着PCB153浓度的增大,总光合色素的含量不断下降,表明PCB153对湛江叉鞭金藻的胁迫作用不断增大,导致藻细胞体内总光合色素的含量不断减少,光合作用机能遭到严重破坏,几乎无法正常地进行光合作用,由光能转化为化学能的能力减弱,间接影响了藻细胞的呼吸作用以及其他代谢作用,抑制藻细胞生存、生长,促使藻细胞凋亡。
3.3 PCB153对湛江叉鞭金藻抗氧化和解毒相关指标的影响SOD是生物体内重要的抗氧化酶,在生物体的自我保护系统中起着极为重要的作用,是反映生物应对各种胁迫的重要指标(韩莎等, 2018; 郝水, 1983)。SOD作为酶类抗氧化剂,在生物体内广泛存在,当机体受到活性氧物质刺激时,SOD会迅速产生应答,清除活性氧物质,从而保护机体(Sheng et al, 2014; Kong et al, 2018; 唐洁等, 2019)。MDA是脂质过氧化的重要产物,可以反映生物体受ROS攻击的程度,是脂质过氧化和氧化应激的重要生物标志物(Lawal et al, 2011; 井维鑫等, 2019)。MDA含量是反映机体抗氧化潜在能力的重要参数,间接反映组织过氧化损伤程度。聂湘平等(2002)进行了多氯联苯对蛋白核小球藻和斜生栅藻生长影响的研究,在PCB1254作用下,蛋白核小球藻和斜生栅藻体内的SOD活性有较明显的变化,低浓度作用下,SOD活性均略有升高;高质量浓度时,明显受到抑制,活性逐渐下降。方浩等(2011)研究发现,低浓度多氯联苯(PCB1254)对锥状斯氏藻(Scrippsiella trochoidea)的SOD活性有诱导作用,当多氯联苯浓度超过一定阈值,酶活性下降。Cd2+等可引起背角无齿蚌(Anodonta woodiana)等双壳类体内MDA含量的上升,指示脂质过氧化以及氧化胁迫的存在(井维鑫等, 2019; Nardi et al, 2017; Almeida et al, 2018)。由于ROS攻击引发的膜脂质过氧化严重影响了生物膜的功能及完整性并对细胞造成不可逆的损伤(Aravind et al, 2005)。本研究发现,较低浓度PCB153对湛江叉鞭金藻体内的SOD有诱导作用,SOD活性的升高增强了机体消除各种代谢产生的活性氧自由基的能力,使生物体内的活性氧自由基的产生和消除处于动态的平衡状态,也增强了藻细胞自我保护机制,提高藻细胞抗氧化能力和抗损伤能力;较高浓度PCB153对湛江叉鞭金藻体内的SOD有破坏作用,其自我保护机制、代谢作用已遭到严重损坏,藻细胞的生长受到抑制。MDA含量随着PCB153浓度的增大而增大,表明了藻细胞受ROS攻击程度不断增大,膜脂质过氧化程度也不断加深,而且MDA含量的增大,表明藻细胞膜的损伤、细胞的衰老等加剧,PCB153胁迫对藻细胞造成不可逆的损伤,抑制了藻细胞的生长,促进了细胞的凋亡。
GST是一种Ⅱ相解毒酶,也是一种重要的抗氧化酶(Shenai-Tirodkar et al, 2017; 杨惠珍等, 2015)。GST可保护植物体免受污染物及ROS的损伤(Nemat Alla, 1995),GST既具有过氧化物酶的活性,同时,可以直接清除分子结构里带有亲电基团的化合物(刘滨扬, 2011; Nemat Alla, 1995; Nemat Alla et al, 2006)。姜爽(2011)在研究多溴联苯醚对米氏凯伦藻(Karenia mikimotoi) GST活性影响时发现,GST活性随时间的延长先增加后降低的趋势。前5 d,GST活性随时间的延长而增大;后5 d,GST活性随时间的延长而减小。朱佩佩等(2019)在研究不同浓度铅胁迫对椭圆食粉螨(Aleuroglyphus ovatus) GST活性影响的研究中发现,随着铅浓度的增加,GST活性呈先增大后减小的趋势,当铅的浓度超过25 mg/kg时,GST活性不断减小。本研究中,当PCB153浓度低于25 μg/L时,GST活性随浓度升高而提高;当PCB153浓度高于25 μg/L时,GST活性随着PCB153浓度升高而降低。本研究发现,较低浓度PCB153对湛江叉鞭金藻体内的GST有诱导作用,可以刺激藻细胞的自我保护机制,提高藻细胞的抗氧化能力和抗损伤能力;较高浓度PCB153对湛江叉鞭金藻体内的GST有破坏作用,其GST活性降低,清除结构里带亲电基团化合物的能力降低,自我保护机制、代谢作用已遭到严重损坏。
3.4 PCB153对湛江叉鞭金藻超微结构的影响PCB153通过对湛江叉鞭金藻细胞膜的破坏,导致部分细胞器流出细胞,同时,细胞膜的不完整导致细胞自溶死亡(陈必链等, 2000)。“杯”形色素体是湛江叉鞭金藻细胞进行光合作用、将光能转化为化学能的主要场所,从进化角度看,由较原始的单层类囊体组成,且仅有1个色素体(时沁峰等, 2009; 毛连菊等, 1999)。250 μg/L组“杯”形色素体的形态发生变化,表明了类囊体受损,光合作用场所受到破坏,光能转化为化学能的过程受到抑制,光合作用较为微弱,严重影响了藻细胞自身的正常生长以及代谢活动,从而促使细胞无法正常生长繁殖,甚至凋亡。湛江叉鞭金藻没有细胞壁,细胞膜是它与外界进行物质交换等的具有选择透过性的结构,它对藻细胞起着一定的保护功能。PCB153胁迫破坏了湛江叉鞭金藻的细胞膜,藻细胞内的细胞器暴露于溶液中,加速了其被氧化进程,藻细胞的正常生理活动遭受严重破坏。3 d后,250 μg/L胁迫组的湛江叉鞭金藻细胞出现胞内基础结构解体(万莉等, 2014)。Moharikar等(2006)用“类凋亡”来描述藻类的这种类似细胞死亡方式。本研究表明,湛江叉鞭金藻受PCB153胁迫后,出现“类凋亡”现象。高浓度PCB153使膜系统脂质氧化因而破坏细胞和叶绿体等的结构,造成光合色素合成受到阻碍,藻细胞生长受抑制。高浓度PCB153胁迫的藻细胞内基础结构解体,可能与SOD、GST等抗氧化物酶的活性降低有关,SOD、GST活性降低意味藻细胞体内自我保护机制、代谢作用已遭到严重损坏,藻细胞内的各个细胞器无法正常工作。随着PCB153浓度的增加,细胞膜开始变形,逐渐解体,可能是由于藻细胞受ROS攻击程度不断增大,膜脂质过氧化程度也不断加深,最终导致藻细胞膜缺损破裂,藻细胞死亡。
综上所述,PCB153胁迫对湛江叉鞭金藻的生长和光合色素的合成有明显的抑制作用,且随着胁迫浓度的增加,抑制作用增大。随着PCB153浓度的增大,MDA含量逐渐增大。低浓度PCB153激活藻细胞的SOD活性和GST活性,提高其自我保护水平,而高浓度PCB153胁迫则显著抑制这2种酶的活性。短期低浓度PCB153胁迫会改变金藻细胞超微结构,使细胞器形态改变、聚缩;高浓度PCB153胁迫则会直接破坏细胞膜的完整性,使细胞破裂,导致细胞自溶死亡。
ALMEIDA Ã, CALISTO V, ESTEVES V I, et al. Effects of single and combined exposure of pharmaceutical drugs (carbamazepine and cetirizine) and a metal (cadmium) on the biochemical responses of, R. philippinarum. Aquatic Toxicology, 2018, 198(5): 10-19 |
ARAVIND P, PRASAD M N V. Modulation of cadmium-induced oxidative stress in Ceratophyllum demersum by zine involves ascorbate-glutathione cycle and glutathione metabolism. Plant Physiology and Biochemistry, 2005, 43(2): 107-116 DOI:10.1016/j.plaphy.2005.01.002 |
CHEN B L, ZHUANG H R, CHEN W L, et al. Effect of Co on the ultrastructure of Pavlova viridis. Marine Environmental Science, 2000, 19(2): 22-29 [陈必链, 庄惠如, 陈文列, 等. Co对绿色巴夫藻超微结构的影响. 海洋环境科学, 2000, 19(2): 22-29 DOI:10.3969/j.issn.1007-6336.2000.02.006] |
CHEN X. Remediation of polychlorinated biphenyls contaminated soil by nanoscale zerovalent iron or nZVI-microorganism integrated treatment. Masterxs Thesis of Zhejiang University, 2014 [陈曦. 纳米零价铁及其与微生物联合修复多氯联苯污染土壤. 浙江大学硕士研究生学位论文, 2014]
|
CHI X, XIA B, ZHU L, et al. Acute toxicity of four polybrominated diphenyl ether congeners to marine organisms: Chlorella pyrenoidosa, Daphnia magna, and Scophthalmus maximus. Progress in Fishery Sciences, 2019, 40(6): 88-97 [迟潇, 夏斌, 朱琳, 等. BDE-47、BDE-99、BDE-153和BDE-209对蛋白核小球藻、大型溞和大菱鲆的急性毒性效应. 渔业科学进展, 2019, 40(6): 88-97] |
DUARTEDAVIDSON R, WILSON S C, JONES K C. PCBs and other organochlorines in human tissue samples from the Welsh population. Adipose Environmental Pollution, 1994, 84(1): 69-77 DOI:10.1016/0269-7491(94)90072-8 |
EBENEZER V, KI J S. Quantification of toxic effects of the herbicide metolachlor on marine microalgae Ditylum brightwellii (Bacillariophyceae), Prorocentrum minimum (Dinophyceae), and Tetraselmis suecica (Chlorophyceae). Journal of Microbiology, 2013, 51(1): 136-139 DOI:10.1007/s12275-013-2114-0 |
FANG H, LÜ S H, MA F F, et al. Study on the acute toxicity of PCBs to two species of microalgae. Anhui Agricultural Science, 2011, 39(15): 9147-9150 [方浩, 吕颂辉, 马方方, 等. 多氯联苯对2种微藻的急性毒性研究. 安徽农业科学, 2011, 39(15): 9147-9150 DOI:10.3969/j.issn.0517-6611.2011.15.120] |
FANG X D. HPLC-MS/MS analysis and application on photosynthetic pigments of marine environment. Masterxs Thesis of Dalian Polytechnic University, 2012 [方小丹. 海洋环境中光合色素的HPLC-MS/MS分析技术研究与应用. 大连工业大学硕士研究生学位论文, 2012]
|
FILIPKOWSKA A. Determining PCBs in fish and sediment samples related to intercomparison studies. Polish Journal of Environmental Studies, 2013, 22(5): 1341-1347 |
FREITAG D, GEYER H, KRAUS A, et al. Ecotoxicological profile analysis. VII. Screening chemicals for their environmental behavior by comparative evaluation. Ecotoxicology and Environmental Safety, 1982, 6(1): 60-81 DOI:10.1016/0147-6513(82)90081-1 |
FU M, SONG X X, YU Z M, et al. Responses of activity of antioxidant enzyme in Thalassiosira. Marine Environmental SCIENCE, 2013, 32(6): 809-813 |
GEOFFROY L, DEWEZ D, VERNET G, et al. Oxyfluorfen toxic effect on S. obliquus evaluated by different, photosynthetic and enzymatic biomarkers. Archives of Environmental Contamination and Toxicology, 2003, 45(4): 445-452 DOI:10.1007/s00244-003-2217-4 |
GHOSH U, ZIMMERMAN J R, LUTHY R G. PCB and PAH speciation among particle types in contaminated harbor sediments and effects on PAH bioavailability. Environmental Science and Technology, 2003, 37(10): 2209-2217 DOI:10.1021/es020833k |
GRILO T F, CARDOSO P G, PATO P, et al. Uptake and depuration of PCB153 in edible shrimp Palaemonetes varians and human health risk assessment. Ecotoxicology and Environmental Safety, 2014, 101(1): 97-102 |
HAN S, HU W, LI C L, et al. Effects of pH stress on survival rate, growth and antioxidant enzyme activities of the sea cucumber, Apostichopus japonicus Selenka. Progress in Fishery Sciences, 2018, 39(5): 91-98 [韩莎, 胡炜, 李成林, 等. pH胁迫对刺参存活、生长及抗氧化酶活性的影响. 渔业科学进展, 2018, 39(5): 91-98] |
HAN X Q, CHEN Y P, GUO H Y, et al. Effect of PCB153 on acute toxicity and antioxidant enzyme activity of Cynoglossus semilaevis. Jiangsu Agricultural Sciences, 2019, 47(24): 153-157 [韩现芹, 陈永平, 郭华阳, 等. PCB153对半滑舌鳎的急性毒性及抗氧化酶活性的影响. 江苏农业科学, 2019, 47(24): 153-157] |
HAO S. Course of cell biology. Beijing: Higher Education Press, 1983: 142-147 [郝水. 细胞生物学教程. 北京: 高等教育出版社, 1983: 142-147]
|
HASSAN H M. Effects of pollution on marine crustaceans in Qatari waters: A baseline survey and a case study on genotoxicity indicators in an endemic shrimp. Doctoral Dissertation of University of Salford, 2018
|
HU D, YANG Y H. Effect of different application rate of nitrogen on photosynthetic pigment, biomass and yield of winter highland barley seedlings. Journal of Anhui Agricultural Sciences, 2011, 39(24): 14561-14563, 14585 [胡单, 杨永红. 不同施氮对冬青稞幼苗光合色素·生物量及产量的影响. 安徽农业科学, 2011, 39(24): 14561-14563, 14585 DOI:10.3969/j.issn.0517-6611.2011.24.017] |
HU F, XU Z C. Pollution of PCBs in environment media in China. Guangdong Chemical Industry, 2012, 39(1): 87-88 [胡芳, 许振成. 多氯联苯(PCBs)污染现状分析. 广东化工, 2012, 39(1): 87-88 DOI:10.3969/j.issn.1007-1865.2012.01.046] |
HUANG B C, JI J, WANG G, et al. Advances of carotenoid in plants. Tianjin Agricultural Sciences, 2006, 12(2): 13-17 [黄彬城, 季静, 王罡, 等. 植物类胡萝卜素的研究进展. 天津农业科学, 2006, 12(2): 13-17 DOI:10.3969/j.issn.1006-6500.2006.02.005] |
JEFFREY S W, MANTOURAR F C, WRIGHT S W. Phytoplankton pigments in oceanography: Guidelines to modern methods. Paris: UNESCO Publishing, 1997
|
JIANG S. The toxic effects of two kinds of polybrominated diphenyl ethers (PBDEs) on four species of marine microalgae. Masterxs Thesis of Ocean University of China, 2011 [姜爽. 两种多溴联苯醚对四种海洋微藻的毒性效应研究. 中国海洋大学硕士研究生学位论文, 2011]
|
JING W X, LIN Z G, LANG L, et al. Oxidative stress in the gills and digestive gland of Anodonta woodiana exposed to cadmium. Journal of Shanxi Agricultural Sciences, 2019, 47(8): 1334-1340 [井维鑫, 林子根, 朗朗, 等. 镉暴露对背角无齿蚌鳃和消化腺的氧化应激. 山西农业科学, 2019, 47(8): 1334-1340 DOI:10.3969/j.issn.1002-2481.2019.08.10] |
KATOH T, MIMURO M, TAKAICHI S. Light-harvesting panicles isolated from a brown alga, Dictyota dichotoma: A supramolecular assembly of fucoxanthinchlomphyll-protein complexes. Biochimica et Biophysica Acta, 1989, 976(2): 233-240 |
KIMBROGH R D. Poly chlorinated biphenyls (PCBs) and human health: An update. Critical Reviews in Toxicology, 1995, 25(2): 133-163 DOI:10.3109/10408449509021611 |
KOHLER M, TREMP J, ZENNEGG M, et al. Joint sealants: An overlooked diffuse source of polychlorinated biphenyls in buildings. Environmental Science and Technology, 2005, 39(7): 1967-1973 DOI:10.1021/es048632z |
KONG H, CHANDEL N. To claim growth turf, mTOR says SOD off. Molecular Cell, 2018, 70(3): 383-384 DOI:10.1016/j.molcel.2018.04.015 |
LAWAL A O, LAWAL A F, OLOGUNDUDU A, et al. Antioxidant effects of heated garlic juice on cadmium- induced liver damage in rats as compared to ascorbic acid. Journal of Toxicological Sciences, 2011, 36(5): 549-557 DOI:10.2131/jts.36.549 |
LI N. Toxicity effects and enrichment effect of PCBs in the aquatic food chain. Masterxs Thesis of Jinan University, 2012 [李娜. 多氯联苯在水生食物链中的生物毒性及富集效应研究. 暨南大学硕士研究生学位论文, 2012]
|
LIU B Y, ZHOU P J, LI J J, et al. Effect of γ-HCH on the growth, photosynthetic and lipid peroxidation of Scenedesmus obliquus kütz. Journal of Agro-Environmental Science, 2006, 25(1): 204-207 [刘碧云, 周培疆, 李佳洁, 等. 丙体六六六对斜生栅藻生长及光合色素和膜脂过氧化影响的研究. 农业环境科学学报, 2006, 25(1): 204-207 DOI:10.3321/j.issn:1672-2043.2006.01.043] |
LIU B Y. Toxic effect and mechanism of erythromycin, ciprofloxacin and sulfamethoxazole on Pseudokirchneriella subcapitata. Masterxs Thesis of Jinan University, 2011 [刘滨扬. 红霉素、环丙沙星和磺胺甲噁唑对羊角月牙藻的毒性效应及其作用机理. 暨南大学硕士研究生学位论文, 2011]
|
MAO L J, ZHANG C Y, YOU X C. Studies on ultrastructural of Isochrysis zhanjiangensis. Journal of Dalian Fisheries University, 1999, 14(4): 7-12 [毛连菊, 张从尧, 由学策. 湛江等鞭金藻的超微结构研究. 大连水产学院学报, 1999, 14(4): 7-12 DOI:10.3969/j.issn.1000-9957.1999.04.002] |
MEI J. Effect of Cd-PCB153, humic acid and Cd-PCB153 on RNA/DNA and expression of sonic hedgehog gene of marine medaka larva. Masterxs Thesis of Guangxi University, 2014 [梅婕. 镉、多氯联苯153、黄腐酸和镉-多氯联苯153对海水青鳉仔鱼RNA/DNA和Shh基因表达的影响. 广西大学硕士研究生学位论文, 2014]
|
MOHARIKAR S, D'SOUZA J S, KULKARNI A B, et al. Apoptotic-like cell death pathway is induced in unicellular Chlorophyte Chlamydomonas reinhardtii (Chlorophyceae) cells following UV irradiation: Detection and functional analyses. Journal of Phycology, 2006, 42(2): 423-433 DOI:10.1111/j.1529-8817.2006.00207.x |
MONTEIRO C M, FONSECA S C, CASTRO P M L, et al. Toxicity of cadmium and zinc on two microalgae, Scenedesmus obliquus and Desmodesmus pleiomorphus, from Northern Portugal. Journal of Applied Phycology, 2011, 23(1): 97-103 DOI:10.1007/s10811-010-9542-6 |
MU H, PENG X J, DAI N, et al. Toxicity of [C8mim] PF6 to aquatic organisms. China Environmental Science, 2009, 29(11): 1196-1201 [牧辉, 彭新晶, 戴宁, 等. 离子液体[C8mim] PF6对水生生物的毒性作用. 中国环境科学, 2009, 29(11): 1196-1201 DOI:10.3321/j.issn:1000-6923.2009.11.014] |
NARDI A, MINCARELLI L F, BENEDETTI M, et al. Indirect effects of climate changes on cadmium bioavailability and biological effects in the Mediterranean mussel Mytilus galloprovincialis. Chemosphere, 2017, 169(5): 493-502 |
NEMAT ALLA M M, HASSAN N M. Changes of antioxidants levels in two maize lines following atrazine treatments. Plant Physiology and Biochemistry, 2006, 44(4): 202-210 DOI:10.1016/j.plaphy.2006.05.004 |
NEMAT ALLA M M. Glutathione regulation of glutathione S-transferase and peroxidase activity in herbicide treated Zea mays. Plant Physiology and Biochemistry, 1995, 33(2): 185-192 |
NIE X P, LAN C Y, LIN L, et al. The effect of Aroclor 1254 on the growth of Chlorella pyrenoidosa and Scenedesmus obliquus. Acta Scientiarum Naturalium University Sunyatseni, 2002, 41(1): 68-71 [聂湘平, 蓝崇钰, 林里, 等. 多氯联苯对蛋白核小球藻和斜生栅藻生长影响的研究. 中山大学学报, 2002, 41(1): 68-71 DOI:10.3321/j.issn:0529-6579.2002.01.019] |
NIE X P, WANG X, CHEN J F, et al. Toxic effects of trichloroisocyanuric acid and ciprofloxacin hydrochloride on a freshwater alga, Chlorella pyrenoidosa. Acta Scientiae Circumstantiae, 2007, 27(10): 1694-1701 [聂湘平, 王翔, 陈菊芳, 等. 三氯异氰尿酸与盐酸环丙沙星对蛋白核小球藻的毒性效应. 环境科学学报, 2007, 27(10): 1694-1701 DOI:10.3321/j.issn:0253-2468.2007.10.018] |
PARSONS. Handbook of analytical chemistry and biological methods of seawater. Beijing: Ocean Press, 1989: 104-108 [帕森斯. 海水分析化学和生物学方法手册. 北京: 海洋出版社, 1989: 104-108]
|
QIN T C, RUAN J, WANG L J. Effect of Cd on the plant photosynthesis. Environmental Science and Technology, 2000, 23(1): 33-35 [秦天才, 阮捷, 王腊娇. 镉对植物光合作用的影响. 环境科学与技术, 2000, 23(1): 33-35] |
RONTANI J F, AUBERT C. Effect of oxy-free radicals upon the phytyl chain during chlorophyll a photodegradation. Journal of Photochemistry and Photobiology A: Chemistry, 1994, 79(3): 167-172 DOI:10.1016/1010-6030(93)03762-6 |
RONTANI J F. Visible light-dependent degradation of lipidic phytoplanktonic components during senescence: A review. Photochemistry, 2001, 58(2): 187-202 DOI:10.1016/S0031-9422(01)00202-3 |
SHENAI-TIRODKAR P S, GAUNS M U, MUJAWAR M W A, et al. Antioxidant responses in gills and digestive gland of oyster Crassostrea madrasensis (Preston) under lead exposure. Ecotoxicology and Environmental Safety, 2017, 142: 87-94 DOI:10.1016/j.ecoenv.2017.03.056 |
SHENG Y, ABREU I A, CABELLI D E, et al. Superoxide dismutases and superoxide reductases. Chemical Reviews, 2014, 114(7): 3854-3918 DOI:10.1021/cr4005296 |
SHI Q F, CAO W R. Research overview of superoxide dismutase (SOD). Livestock and Poultry Industry, 2009(4): 66-68 [时沁峰, 曹威荣. 超氧化物歧化酶(SOD)的研究概况. 畜禽业, 2009(4): 66-68 DOI:10.3969/j.issn.1008-0414.2009.04.036] |
SONG X, LI J, CHEN L, et al. Determination of polychlorinated biphenyls in seawater using headspace solid-phase microextraction coupled with gas chromatography-mass spectrometry with the aid of experimental design. Journal of the Brazilian Chemical Society, 2012, 23(1): 132-141 DOI:10.1590/S0103-50532012000100019 |
STAUBER J L, DAVIES C M. Use and limitations of microbial bioassays for assessing copper bioavailability in the aquatic environment. Environmental Reviews, 2011, 8(4): 255-301 |
STON J, KOSAKOWSKA A. Qualitative and quantitative analysis of Baltic phytoplankton pigments. Oceanologia, 2000, 42(4): 449-471 |
TAIZ L, ZEIGER E. Plant physiology. Sunderland: Sinauer Associate Inc, 2006: 128-138
|
TANG J, YANG H Y, LI L, et al. Repair effects on SOD enzyme and anti-inflammatory activity of the Platycladus orientalis extract. China Surfactant Detergent and Cosmetics, 2019, 49(9): 585-589 [唐洁, 杨海延, 李利, 等. 侧柏叶提取物对SOD酶活力修复作用及抗炎功效. 日用化学工业, 2019, 49(9): 585-589 DOI:10.3969/j.issn.1001-1803.2019.09.005] |
ULBRICH B, STAHLMANN R. Developmental toxicity of polychlorinated biphenyls (PCBs): A systematic review of experimental data. Archives of Toxicology, 2004, 78(5): 252-268 |
WAN L, SHAO L L, LU K H, et al. Effect of ultrasound on the ultrastructure and physiological characteristics of blue-green algae (Microcystis aeruginosa). Acta Hydrobiologica Sinica, 2014, 38(3): 516-524 [万莉, 邵路路, 陆开宏, 等. 超声波对铜绿微囊藻超微结构和生理特性的影响. 水生生物学报, 2014, 38(3): 516-524] |
WANG X Y. Acute toxic effects of crude oil and oil dispersant on three algae. Masterxs Thesis of Dalian Maritime University, 2012 [王向艺. 原油和消油剂对三种藻的急性毒性效应. 大连海事大学硕士研究生学位论文, 2012]
|
WU Y, CHEN X X, PAN Q C, et al. A study of toxicity and bioacculation of PCBs in two species of marine microalgae. Marine Sciences, 2017, 41(3): 61-67 [吴越, 陈星星, 潘齐存, 等. 多氯联苯在两种海洋微藻中毒性效应及富集效应的研究. 海洋科学, 2017, 41(3): 61-67] |
XU T Y, TANG W Q. Comparative analysis on isomer-specific of polychlorinated biphenyls in the dead bodies of two finless porpoise subspecies in Yangtze estuary. Chinese Journal of Zoology, 2016, 51(3): 337-346 [徐添翼, 唐文乔. 长江口两种江豚亚种体脂内多氯联苯同分异构体含量的比较分析. 动物学杂志, 2016, 51(3): 337-346] |
YANG H Z, LIU N, LI Y Q, et al. Effect of cadmium on glutathione content and related enzyme activity in main tissues of Anodonta woodiana. Journal of Agro-Environmental Science, 2015, 34(1): 15-21 [杨惠珍, 刘娜, 李涌泉, 等. 镉对背角无齿蚌主要组织谷胱甘肽含量和相关酶活性的影响. 农业环境科学学报, 2015, 34(1): 15-21] |
YUE W J, WANG Z H, WANG Q J, et al. Toxic effect of cypermethrin on Chattonella marina. Asian Journal of Ecotoxicology, 2009, 39(15): 251-257 [岳文洁, 王朝晖, 王桥军, 等. 氯氰菊酯对海洋卡盾藻的毒性效应. 生态毒理学报, 2009, 39(15): 251-257] |
ZHANG H, ZHAO Y X, DAI C J, et al. Effect of vermicomposte on seedling growth and photosynthetic pigment content of Zea mays L. under salt stress. Jiangsu Agricultural Sciences, 2019, 47(20): 122-125 [张浩, 赵雨欣, 戴川景, 等. 蚓粪添加对盐胁迫下玉米幼苗生长和光合色素含量的影响. 江苏农业科学, 2019, 47(20): 122-125] |
ZHANG J H, FENG J, LÜ J P, et al. Toxic effects of 1, 4-dichlorobenzene on the growth and photosynthetic pigment of Scenedesmus quadricauda. Journal of Shanxi Agricultural Sciences, 2016, 44(3): 333-336 [张锦华, 冯佳, 吕俊平, 等. 1, 4-二氯苯对四尾栅藻生长和光合色素的毒性效应. 山西农业科学, 2016, 44(3): 333-336 DOI:10.3969/j.issn.1002-2481.2016.03.15] |
ZHANG L. Toxic effects of 2, 2', 4, 4'-tetrabromodiphenyl ether (BDE-47) on two marine microalgae. Masterxs Thesis of the First Institute of Oceanography, 2015 [张丽. 2, 2', 4, 4'-四溴联苯醚(BDE-47)对两种海洋微藻的毒性效应. 国家海洋局第一海洋研究所硕士研究生学位论文, 2015]
|
ZHANG S C, MA J Y, FAN X. Principles and applications of marine biotechnology. Beijing: Ocean Press, 1997: 97-98 [张士璀, 马军英, 范晓. 海洋生物技术原理和应用. 北京: 海洋出版社, 1997: 97-98]
|
ZHU P P, WANG D, MO W F, et al. Effects of heavy metal lead on the morphology and SOD, GST activity of Aleuroglyphus ovatus. Chinese Journal of Applied Entomology, 2019, 56(4): 702-709 [朱佩佩, 汪丁, 莫维芬, 等. 重金属铅对椭圆食粉螨形态及SOD、GST活性的影响. 应用昆虫学报, 2019, 56(4): 702-709] |
ZHU Y M, LIU Z G. Effects of different photosynthetic light intensity of blue LED light on the growth and pigment concentration of Isochrysis zhanjiangensis. Journal of Guangdong Ocean University, 2017, 37(1): 35-40 [朱永梅, 刘志刚. 不同光合光子照度LED蓝光对湛江等鞭金藻生长及色素含量的影响. 广东海洋大学学报, 2017, 37(1): 35-40 DOI:10.3969/j.issn.1673-9159.2017.01.006] |



